Introducción
La replicación del virus de la inmunodeficiencia humana tipo 1 (VIH-1) está regulada por múltiples eventos que ocurren en las diferentes fases de su ciclo vital. Tras la entrada del virus en la célula huésped, tiene lugar la transcripción en reverso del ARN genómico viral y el paso al núcleo del complejo de preintegración (proteínas del virus más el material genético en forma de ADN complementario). Una vez dentro del núcleo, el ADN viral es integrado dentro del genoma de la célula hospedadora como provirus. Posteriormente se expresan los genes virales, proceso regulado por factores virales y celulares que activan o reprimen la transcripción del VIH-1. Los sitios de unión para los factores celulares implicados en la regulación transcripcional del VIH, denominados también "secuencias consenso", están presentes en las secuencias terminales repetidas largas (LTR) en ambos extremos del provirus integrado.
La región LTR del VIH-1 está implicada en la retrotranscripción, integración y regulación de la expresión génica. El material genético del VIH-1, al integrarse en el genoma de la célula hospedadora, se comporta como un gen celular inducible (estado de latencia/reactivación) dependiente de la inducción de señales de activación celular. La región LTR es similar a un promotor eucariótico complejo y presenta diferentes niveles de regulación. Un primer nivel se produce por la interacción entre la TATA box clásica situada en el LTR del VIH-1 y la maquinaria transcripcional basal o inicial de la célula hospedadora, la cual está constituida por proteínas celulares de unión al promotor necesarias para el inicio de la transcripción. Este proceso implica, por una parte, modificar la estructura del nucleosoma (complejo histonas-ADN) para permitir el acceso al ADN viral y, por otra, la unión de la caja TATA con una serie de factores activadores y adaptadores (Tata Binding Protein, p300, TAFs, etc.) que permitirán el reclutamiento de la ARN polimerasa II al sitio de inicio de la transcripción.
En un segundo nivel actúan los factores de transcripción que se unen a las secuencias facilitadoras (enhancer) y reguladoras, que activan la transcripción mediante la "transactivación" del LTR viral. Distintas señales intracelulares e intercelulares activan una serie de vías metabólicas que movilizan distintos factores de transcripción o los translocan al núcleo celular donde se unen a sus consensos en el LTR, induciendo así la transactivación de éste. Se produce de esa manera el "inicio de la transcripción" mediante la acción de factores que actúan sobre la región reguladora y las proteínas de la maquinaria transcripcional basal que se unen a la caja TATA. Sin embargo, en el caso del VIH-1 la potencia transcripcional de estos factores es limitada y no se consigue una elongación completa de ARN mensajero (ARNm) viral.
Para ello es necesario un tercer nivel de regulación en el que la proteína viral Tat se une al ARN "naciente" de la región TAR del LTR y recluta el complejo ciclina T1 y la quinasas Cdk9 al complejo transcripcional1. Estos factores permiten la fosforilación de la ARN polimerasa II, aumentando su actividad y procesividad, lo que permite la elongación completa del genoma del VIH y el mantenimiento de altos niveles de expresión génica viral. Estos tres procesos no deben considerarse compartimentos estancos, ya que los distintos factores interaccionan entre sí. Así, Sp1 interacciona con la proteína p300 del complejo transcripcional primario y la proteína viral Tat con los factores Sp1 y NF-kB2. La acción de los distintos factores debe contemplarse como un proceso sinérgico que permite finalmente la transcripción del genoma viral.
Estructura y función de la región LTR
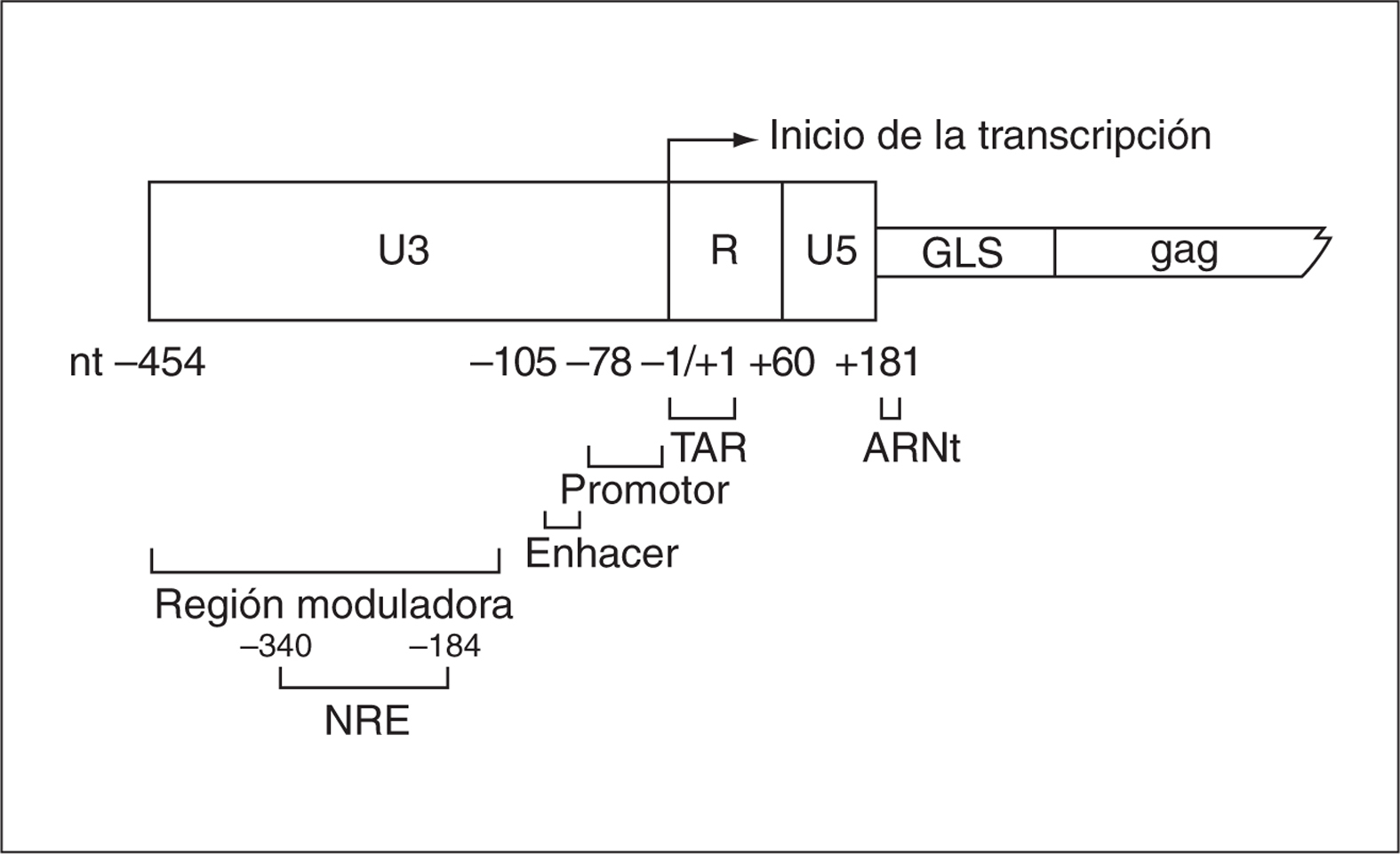
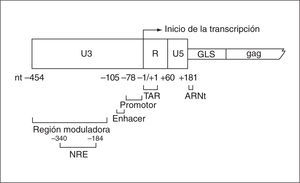
La estructura de las LTR es distinta en el ARN viral y ADN proviral. El LTR del ARN viral presenta exclusivamente la región R-U5 en el extremo 5' y U3-R en el extremo 3'. Por el contrario, la duplicación de las secuencias que se produce en el proceso de retrotranscripción hace que los dos LTR en el ADN proviral sean idénticos. El LTR se encuentra dividido en tres regiones funcionales (U3, R y U5), que están presentes en ambos extremos del genoma del provirus (fig. 1).
Figura 1. Estructura del LTR en el VIH-1 y secuencia leader gag (GLS). Se indican los pares de bases y posiciones que comprende cada región y el inicio de la transcripción.
La región U3 situada en el extremo 5' de la forma proviral del VIH (posiciones 454 a 1) no es una región codificante sino estrictamente reguladora que dirigirá la transcripción viral. Se subdivide, a su vez, en tres regiones: promotor, potenciador (enhancer) y moduladora. La región promotora es imprescindible para la transcripción basal de los genes virales. Contiene la secuencia de iniciación de la transcripción (TATAA) y los sitios consenso Sp1, a los cuales se une la proteína Sp1 para ayudar a la activación de la transcripción viral. Adyacente a esta zona, se encuentra la región del enhancer, cuya función es la transcripción inducible de los genes virales. Ésta presenta el sitio de unión para NF-kB, el cual actúa en respuesta a señales celulares y a estímulos inmunológicos. Por último, la región moduladora se encarga de incrementar o inhibir la transcripción. Para ello, esta región contiene múltiples secuencias que sirven como sitios de unión de diversas proteínas celulares y de receptores de hormonas nucleares3. Además, dicha región contiene el elemento de regulación negativa NRE, aunque no está claro que ésta sea su función.
La región R (posiciones +1 a +100) se transcribe y contiene la secuencia de transactivación TAR. El ARN de TAR conforma una estructura terciaria a la que se une la proteína viral Tat, la cual estabiliza los complejos de iniciación y de elongación transcripcional. Además, dicha región presenta sitios de unión para factores celulares (p. ej., Ap-1) que modulan la transcripción3.
Las regiones U5 (+100 a +181) y GLS (gag leader sequence) ocupan las posiciones +181 a +296. Aunque esta región se encuentra distal al sitio de iniciación de la transcripción, se ha descrito en la misma la presencia de secuencias consenso para diferentes factores de transcripción que parecen jugar un papel en la regulación de la transcripción del VIH-1, como Ap-1, Ap3-L/NF-AT, DBF/ IRF y Sp-14-6.
Variabilidad genética de las LTR en diferentes subtipos del VIH-1
El VIH ha sido agrupado en dos tipos: VIH-1 y VIH-2. Dentro del VIH-1 se han diferenciado, por orden cronológico, tres grandes grupos: M, O y N. Las variantes englobadas en el grupo M, a su vez, se han dividido en base a su homología genética en 9 subtipos (A, B, C, D, F, G, H, J y K) y en 15 formas recombinantes (CRF, circulant recombinant forms). Las variantes que se englobaban hace unos años como subtipo E han resultado ser recombinantes entre los subtipos A y E, incluyéndose actualmente en la forma recombinante CRF01-AE. Las diferencias observadas en la secuencia genética del LTR en los diferentes subtipos del grupo M del VIH-1 pueden afectar a los niveles de replicación viral y, por tanto, influir en la patogénesis de la infección por distintos subtipos7-15.
Variabilidad intersubtipo de la región U3
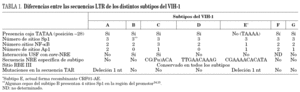
En la región del promotor de U3, la caja TATAA de la posición 28 está implicada en la iniciación de la transcripción. Está presente en todos los subtipos, excepto en el recombinante CRF01-AE, que presenta una variante de la caja TATA (secuencia TAAAA) que es funcional. Todos los subtipos presentan en U3 tres sitios Sp-1 (I, II y III) con alta heterogeneidad genética, siendo el sitio Sp-1 III el más variable7-9,11-13.
Algunos aislados del subtipo B muestran una duplicación perfecta de un cuarto sitio Sp-1 (IV) en U3, entre Sp-1 I y Sp-1 II14,15. Su presencia no se ha reconocido hasta ahora en subtipos no B. Asimismo, existen variaciones en el número de sitios NF-kB en la región enhancer de U3 al comparar distintos subtipos, hecho que se correlaciona con la capacidad de inducción del LTR viral por factores inflamatorios como el factor de necrosis tumoral (TNF-a) (tabla 1)7-9,11-13.
Se han descrito secuencias específicas de subtipo en ciertos sitios de unión a factores celulares en la región moduladora de U3 de la LTR. Es el caso de la secuencia core-NRE (posiciones 174 a 163 de la región moduladora), que es específica en los subtipos C, D y CRF01-AE (tabla 1)9. Por otro lado, a esta región se une el factor USF en los subtipos B y C10. También el número de sitios de unión de Ap-1 varía en los diferentes subtipos (tabla 1)13.
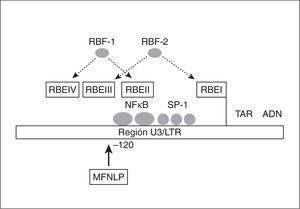
Justo antes del sitio NF-kB en la posición 120 de U3, hay una región denominada MFNLP, que presenta inserciones de longitud variable (de 15 a 34 pb) consideradas polimórficas. En un principio, esas inserciones se denominaron "motivos CTG"14. Con posterioridad se ha sugerido que corresponden a una duplicación parcial o total del sitio de unión al factor de crecimiento tumoral (TCF-1a)16. Más recientemente, se ha postulado que este polimorfismo natural representa un sitio RBE III de unión para el factor celular RBF-217. Para algunos, la región MFNLP constituiría un nuevo sitio de unión para el factor Ap-118.
Variabilidad intersubtipo de la región R
En la región R, la secuencia TAR (a cuyo ARN se une la proteína viral activadora Tat) también presenta diferencias específicas de subtipo. Así, el subtipo A y el CRF01-AE presentan una secuencia TAR con un nucleótido delecionado, lo que modifica la estructura secundaria del ARN viral. Además, algunas variantes CRF01-AE presentan dos sustituciones adicionales (A22G y T31C) en dicha región7,8. Por otro lado, en el subtipo C se han observado cambios de aminoácidos Arg57Ser y Gln36Glu en la proteína viral Tat en posiciones implicadas en la unión a TAR, que pueden afectar a la unión de Tat al LTR y a su actividad activadora de la transcripción viral19.
Variabilidad intersubtipo de la región U5
La variabilidad genética de la región U5 del LTR viral no se ha estudiado aún en los distintos subtipos del VIH-1, a pesar de incluir sitios de unión a factores celulares relacionados con la transcripción viral.
Proteínas de unión a la región LTR del VIH-1
La importancia del estudio de la estructura y función de las proteínas de unión a la región LTR radica en que modulan la regulación de la transcripción del VIH-1. De esa manera, pueden modificar la producción viral en un individuo infectado. En los últimos años, algunos de estos factores se han propuesto como dianas en el diseño de nuevas estrategias antirretrovirales.
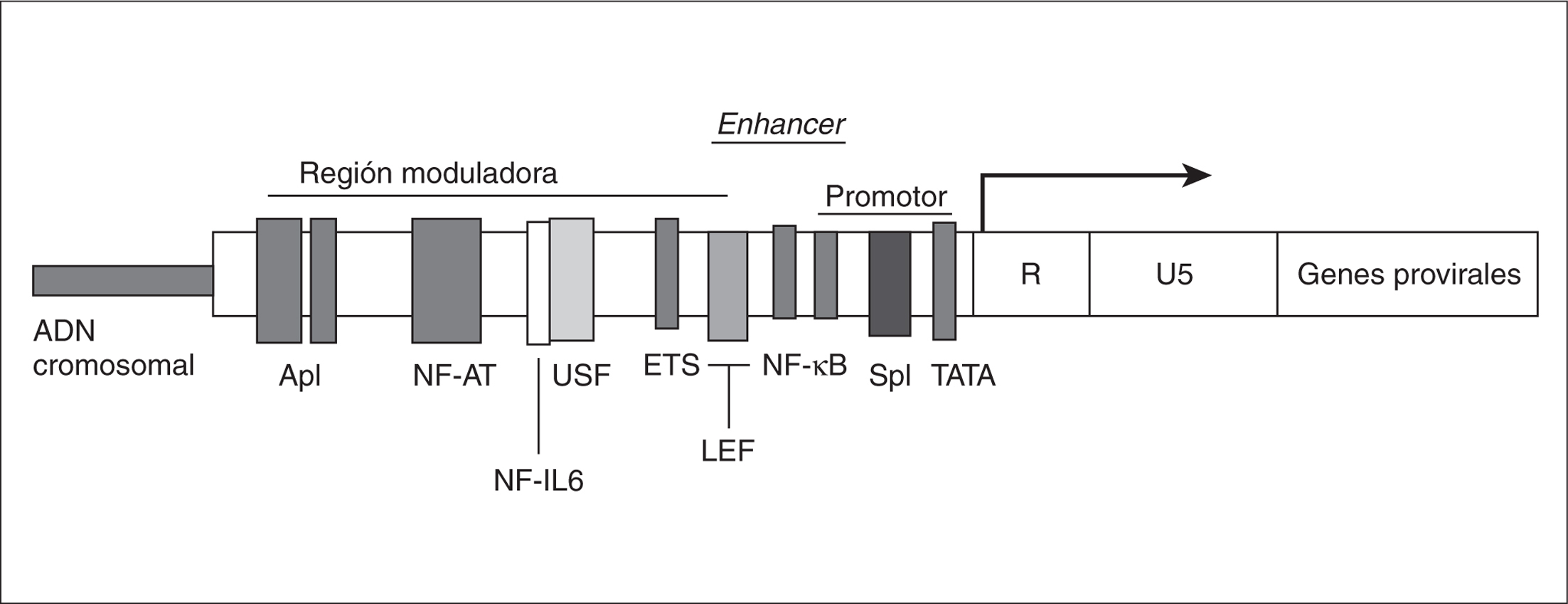
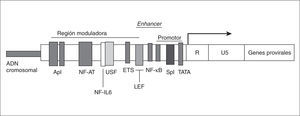
Las proteínas moduladoras más estudiadas que se unen a la región LTR, regulando la expresión génica del VIH-1, se resumen en la figura 2 y se analizan a continuación.
Figura 2. Lugar de unión de distintos factores de transcripción a la región U3 del LTR en el genoma proviral del VIH-1 integrado en el genoma celular.
Factores celulares
Factor NF-kB (factor nuclear kappa B). Pertenece a una familia de proteínas que participan en la transcripción viral en respuesta a mitógenos, citoquinas y estímulos inmunológicos. Nabel y Baltimore demostraron mediante ensayos in vitro que mutaciones en el motivo NF-kB del LTR disminuyen la expresión génica viral. Este factor actúa como activador de la transcripción en asociación con otros20,21, pudiendo incrementar la producción viral en los individuos infectados. Se conoce que NF-kB es un activador de genes implicados en inflamación y apoptosis. Por ello, actualmente se están diseñado compuestos antiinflamatorios e inmunosupresores que inhiban su actividad22. Por el contrario, otros compuestos como la prostratina son capaces de activar NF-kB, pudiendo favorecer de esa manera la activación de los reservorios latentes y disminuyendo así, la carga proviral en el individuo.
Factor Sp1 (proteína específica 1). Pertenece a la familia de proteínas ubicuas de unión a cajas GC (ricas en guaninas y citosinas) mediante dominios en forma de dedos de cinc presentes en muchos promotores celulares y virales. Están implicados en la activación de la transcripción viral, tanto basal como dependiente de Tat. Para actuar necesita interaccionar con otros factores celulares20. Otras proteínas (Sp3 y Sp4) de la misma familia también pueden reprimir y activar, respectivamente, la expresión del promotor del VIH23.
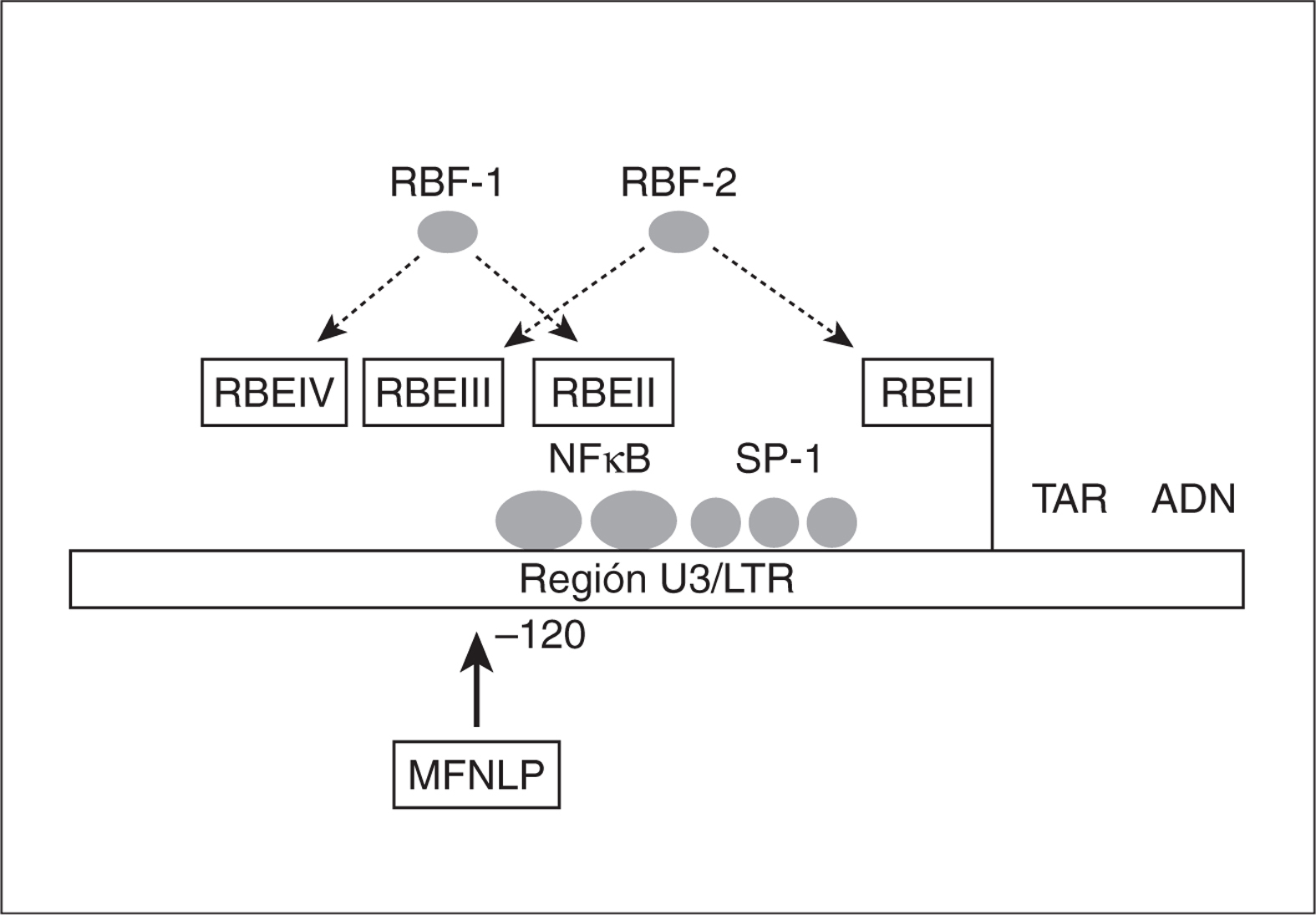
Factores RBF-1 y RBF-2 (factores de unión de respuesta a Ras). Son factores celulares de respuesta a Ras, proteína anclada a la superficie interna de la membrana con actividad GTPasa y que produce la propagación de señales celulares mediante la activación de una cascada de quinasas. Se unen a los elementos de respuesta a Ras (RBE I, II, III y IV), presentes en la LTR (fig. 3), que están muy conservados en la LTR de los diferentes subtipos. Mutaciones en las regiones RBE impiden la estimulación de la LTR en respuesta a Ras24. Algunos autores defienden que el factor RBF-2 se une a la región polimórfica MFNLP de U3 del LTR, reprimiendo la transcripción del VIH-1 en células T y monocitos17.
Figura 3. Región U3 del LTR donde se sitúa la región polimórfica MFNLP y los sitios de unión de los factores celulares RBF-1 y 2 (modificado de Estable et al17).
NF-AT (factor nuclear de células T activadas). Es un miembro de la familia de factores nucleares de activación de células T entre los que se encuentran NF-AT1 y NF-AT2. Estos factores se encuentran en estado inactivo en el citoplasma y se activan en el núcleo, donde realiza su función al unirse a su sitio específico del LTR. En cuanto a la función de ambas, parece que ejercen efectos contrarios. Se ha visto que NF-AT2 produce la activación de la transcripción en células T y que existe una cooperación entre dicho factor y NF-kB para transactivar la LTR25. Sin embargo, ensayos in vitro con células T Jurkat han demostrado que el factor NF-AT1 puede competir por el sitio de unión de NF-kB en la región LTR, produciendo un efecto inhibitorio sobre la transcripción26.
Ets (erythroblastoma twenty-six). Es una familia multigénica de proteínas (Ets-1, Ets-2 y Elf-1) que tienen un papel importante en la regulación de la expresión del VIH-1 y VIH-2 en células T. Así, se han identificado dos sitios de unión para Ets en las regiones enhancer y moduladora del LTR. Estudios in vitro con células T demostraron que la interacción entre múltiples proteínas Ets y miembros de la familia NF-kB/NF-AT era necesaria para la expresión de múltiples genes virales21. Además, la unión cooperativa entre Ets y el factor USF-1 activa sinérgicamente la transcripción del VIH-127.
USF (factor estimulador uptreams). Es un miembro de la familia de factores de transcripción que se expresa de manera constitutiva en algunos tejidos. Fue caracterizado como un activador positivo del promotor en adenovirus. Sin embargo, su función en la infección por VIH-1 no está clara. USF activa la transcripción en células T, pero la reprime en células epiteliales, con independencia del subtipo genético viral. El sitio de unión de USF es un motivo llamado E-box (CAC(A/G)TG), situado dentro de la región del core-NRE de la LTR, presente en los subtipos B y C pero no en los subtipos A, D, E o G. Sin embargo, esta interacción afecta a la transcripción de todos los subtipos, sugiriendo que USF actuaría independientemente del core-NRE de la LTR10.
Factor NF-IL6 (factor nuclear IL-6). Pertenece a la familia de factores de transcripción C/EBP (CCAAT/enhancer binding proteins). Tiene un papel importante en el control de la expresión de genes en respuestas celulares mediadas por citoquinas y lipopolisacáridos. La LTR incluye varios de los sitios de unión para NF-IL6. Uno de los sitios solapa con el sitio de unión de USF y el otro está situado inmediatamente después de la secuencia de unión para NF-kB. El mecanismo de regulación de la LTR por este factor no está claro, aunque parece que regula la transcripción del VIH-1 a través de la unión compleja con otros factores celulares, como USF28.
Receptores de hormonas tiroideas
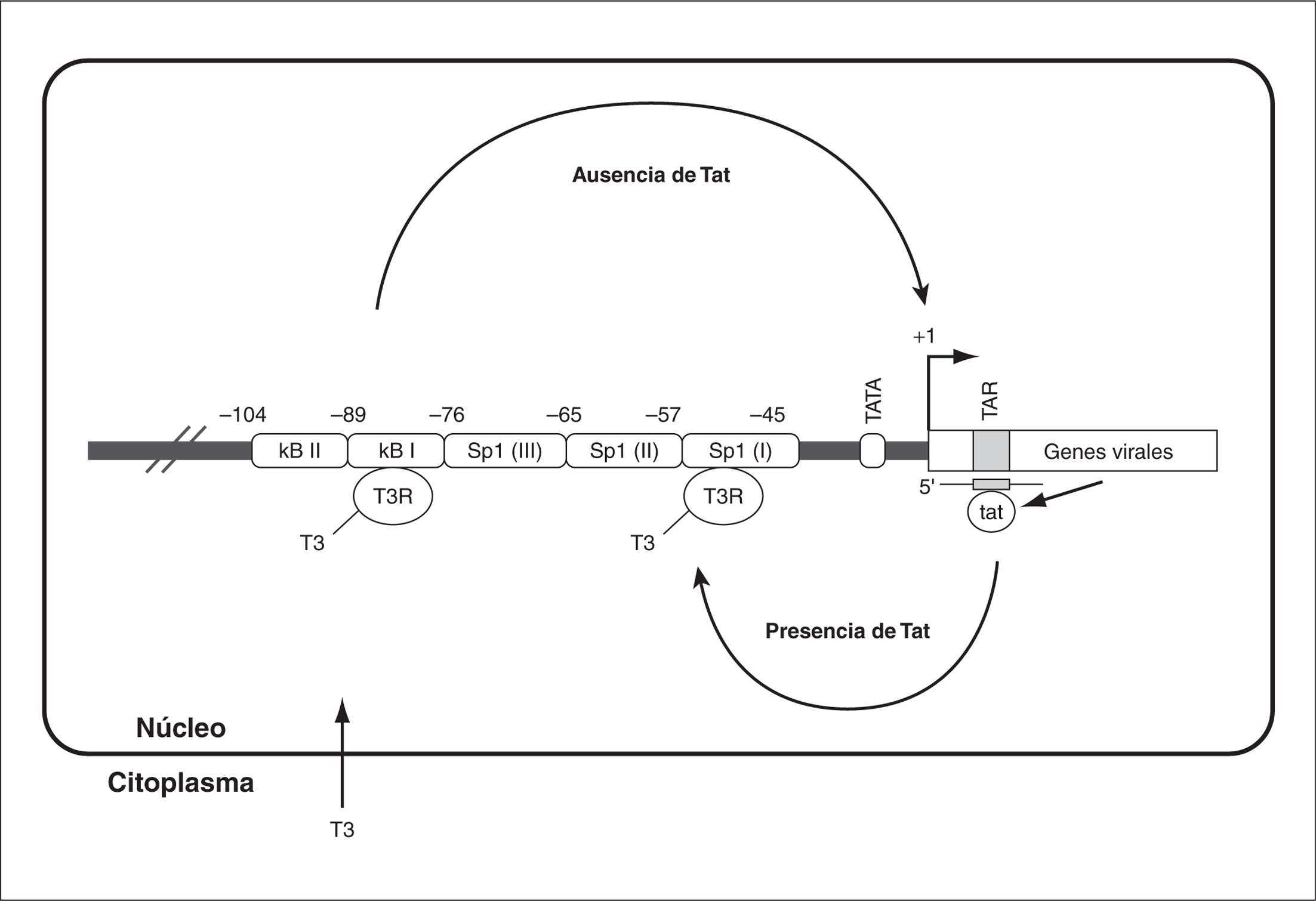
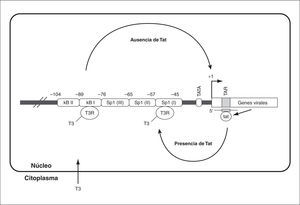
Algunos receptores nucleares, como TR3 (receptor de la familia de hormonas tiroideas T3) pueden interaccionar con la región LTR y regular la transcripción del VIH. Así, la hormona T3 en asociación con su receptor T3R en el núcleo pueden estimular la transcripción del VIH-1 por unión y activación de los elementos de respuesta a hormonas tiroideas (TRE). Éstos están situados en los motivos de unión a NF-kB y a Sp1 de la LTR. Los TRE situados en el primer motivo median la estimulación de la transcripción en ausencia de Tat, mientras que los situados en el motivo Sp1 funcionan como TRE sólo en presencia de la proteína viral Tat (fig. 4)29,30.
Figura 4. Regulación de la transcripción del VIH-1 mediante el receptor nuclear T3R por mecanismos dependiente e independiente de la proteína viral Tat (modificado de Desai-Yajnik et al30).
Proteínas virales
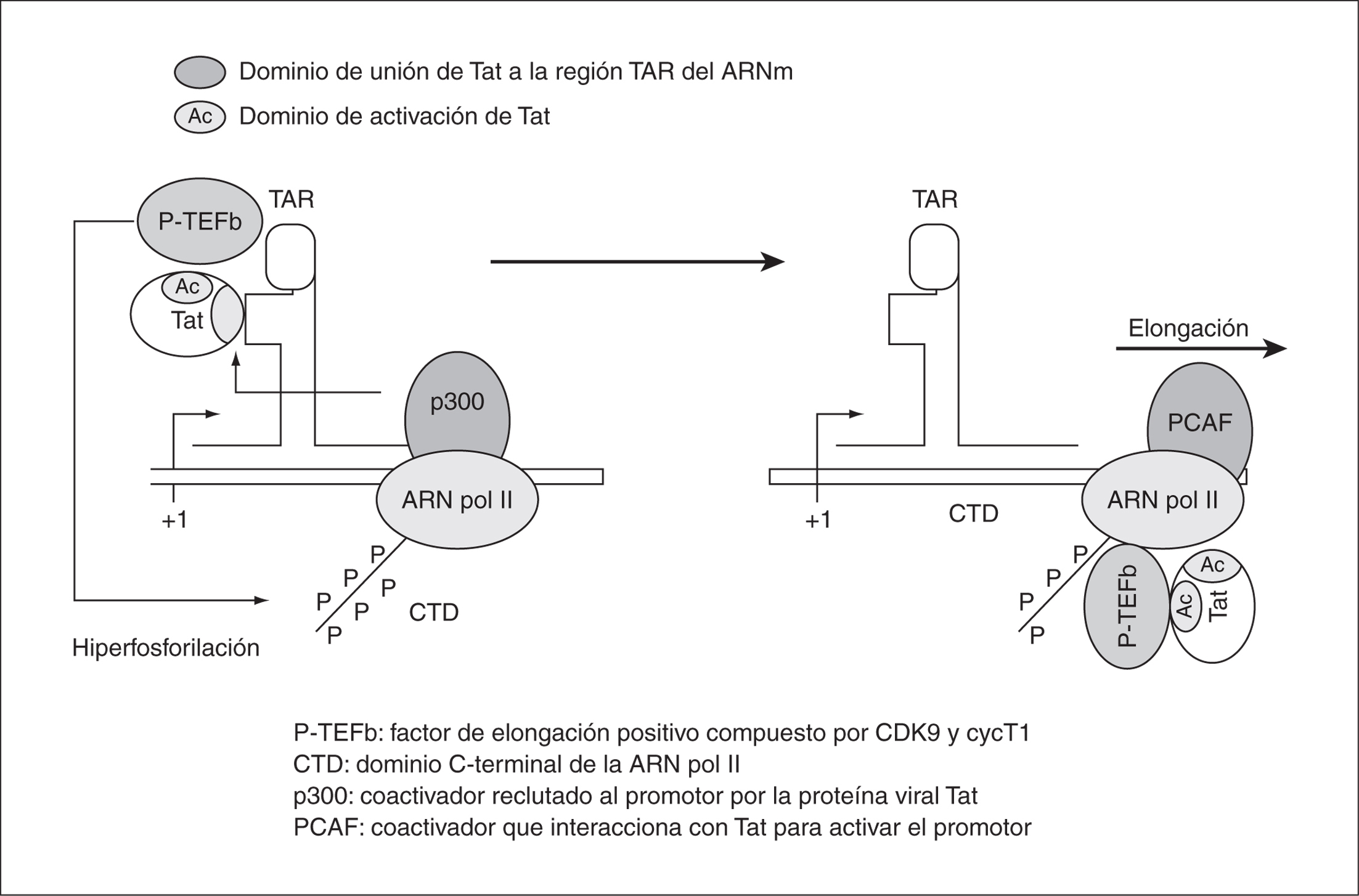
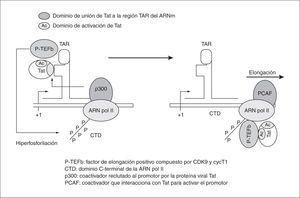
La proteína Tat (transcription trans-activator) es una proteína que se expresa en la fase temprana de la transcripción del VIH-1. El gen TAT está compuesto por dos exones, que darán lugar a una proteína de 86 aminoácidos. El exón 1 presenta el sitio de unión a la región TAR de la LTR y una región rica en Arginina necesaria para su entrada al núcleo, que es donde Tat actúa. Esta proteína viral es un activador muy potente de la expresión del VIH-1 y aumenta la procesividad de la ARN polimerasa II. Ello favorece la elongación completa del ARN viral y la consecuente expresión de los genes de la fase tardía, manteniendo así altos niveles de producción viral. Tat actúa estimulando las quinasas celulares que, a su vez, estimulan la eficiencia de la ARN polimerasa II celular en los pasos iniciales de la elongación de la transcripción31 (fig. 5). Para ello se requiere la presencia de los factores celulares Sp1 y NF-kB y la asociación con varios coactivadores32.
Figura 5. Unión de Tat a la región TAR del LTR en el proceso de elongación transcripcional del ARNm.
Diferencias en los niveles de transcripción en distintos subtipos del VIH-1
Diversos estudios in vitro han demostrado diferencias en los niveles de transcripción de distintos subtipos del VIH-1. Ello se debe a mutaciones presentes en la secuencia de la región promotor, enhancer, moduladora y TAR del LTR. Estos cambios genéticos afectarían a la unión de factores celulares y proteínas virales que regulan la expresión génica del virus7-11,13,19. Recientemente, se ha demostrado que las diferencias en el grado de replicación viral de los distintos subtipos del VIH-1 dependen tanto del tipo celular utilizado en el ensayo como del estado de activación celular33.
La actividad transcripcional basal del VIH-1 (en ausencia de Tat) es significativamente mayor en la mayoría de los subtipos no B respecto a variantes B en determinadas líneas celulares (C33A, y Cos), pero es similar en todos los subtipos en otras células, como los astrocitos13.
Ensayos in vitro demuestran que todos los subtipos del VIH-1 en presencia de la proteína viral Tat presentan mayor actividad transcripcional respecto al nivel basal cuando Tat está ausente13. Sin embargo, el nivel de transactivación inducido por Tat y la actividad basal varían entre subtipos y dependen de la línea celular donde se realicen los ensayos. Así, en un estudio realizado con células T Jurkat, se observó que las variantes CRF01-AE presentaban mayor capacidad de transactivación respecto al subtipo B y C11. Por el contrario, en líneas celulares T humanas, el nivel de transactivación del subtipo C es mayor que en las variantes B y CRF01-AE19.
Ensayos in vitro con células T (SupT1 y Jurkat T) han mostrado el efecto del factor TNF-a sobre la actividad transcripcional de las LTR de distintos subtipos del VIH-1. Existe una correlación entre el número de sitios NF-kB y su estimulación con TNF-a. El subtipo C tiene 3 sitios NF-kB y presenta mayor actividad transcripcional basal tras la adición de TNF-a que los subtipos A, B, D, F y G, que tienen sólo dos sitios NF-kB. Además, el recombinante CRF01-AE presenta menor inducción por TNF-a, ya que tiene un solo sitio NF-kB funcional8,13. Debido a una mutación puntual en el otro sitio NF-kB presente en todas las variantes de este recombinante, la nueva secuencia se convierte en un sitio de unión para el factor GABP, una proteína de la familia de factores transcripcionales Ets. Ello potenciaría la activación de la transcripción mediada por Tat y la replicación viral en las variantes CRF01-AE, según se ha demostrado en algunas líneas celulares como SupT134.
Asimismo, variantes del subtipo B con cuatro sitios de unión al factor Sp1 en la región del promotor del LTR presentan una ligera mayor actividad basal transcripcional respecto a aquellas con tres sitios. Sin embargo, cuando además de los cuatro sitios Sp1 existen repeticiones de la secuencia de unión a TCF-1a en posiciones cercanas, la actividad transcripcional es menor que cuando existen tres sitios Sp1 únicamente. Ello sugiere que la presencia de repeticiones TCF-1a disminuye la ventaja selectiva ofrecida por los 4 sitios Sp114,15. No hay estudios que hayan examinado diferencias en la actividad transcripcional debidos a estos cambios de secuencia en los subtipos no-B.
El efecto de la presencia de polimorfismos naturales en la región MFNLP de la LTR en variantes del subtipo B es controvertido. Algunos autores proponen que estimulan la actividad transcripcional18,35, otros que la inhiben14,15,17,36 y otros que no producen ningún efecto sobre ella37. Esta disparidad se ha interpretado como resultado del uso de distintas líneas celulares y estímulos en los experimentos in vitro35. No existen estudios todavía al respecto para subtipos no-B.
La secuencia TAAAA en la posición 28 del LTR, presente sólo en el recombinante CRF01-AE es esencial para el inicio de la transcripción, mientras que la caja TATAA observada en la posición 136 no contribuye a la actividad del promotor13. Este cambio de secuencia TAAAA en la posición 28 también se ha descrito en un paciente con subtipo G9.
Conclusión
La región LTR del VIH-1 regula la transcripción viral por la unión de distintos factores en sitios específicos, lo cual puede estimular o reprimir la transcripción viral. Este es un proceso complejo, ya que los distintos factores pueden interaccionar entre sí produciendo un efecto sinérgico. La variabilidad genética observada en el LTR de distintos subtipos podría reflejar una diferente actividad transcripcional, pudiendo repercutir en la patogenicidad de esas variantes. Sin embargo, no todos los cambios tendrían la misma repercusión biológica, al ser una proporción de ellos reflejo de una tolerancia estructural. Sin embargo, otros cambios podrían modificar la interacción con los factores de transcripción. Por tanto, se requieren estudios de variabilidad genética del LTR en los distintos subtipos del VIH-1 para poder aportar nuevos datos. A la vez, una mejor caracterización de la función de las diferentes zonas del LTR podría tener interés terapéutico, mediante el diseño de nuevos inhibidores específicos.
Agradecimientos
Este trabajo ha sido realizado con la ayuda de la Asociación Investigación y Educación en Sida (AIES) y la Red de Investigación en Sida (RIS). Queremos expresar nuestro agradecimiento al Dr. José Alcamí por la lectura y revisión del manuscrito original.
NOTA
Los artículos publicados en la sección "Formación Médica Continuada" forman parte de grupos temáticos específicos (antibiograma, antimicrobianos, etc.). Una vez finalizada la publicación de cada tema, se irán presentando al Sistema Español de Acreditación de la Formación Médica Continuada (SEAFORMEC) para la obtención de créditos.
Una vez concedida la acreditación, ésta se anunciará oportunamente en la Revista y se abrirá un período de inscripción gratuito para los socios de la SEIMC y suscriptores de la Revista, al cabo del cual se iniciará la evaluación, durante 1 mes, que se realizará a través de la web de Ediciones Doyma.
RELACIÓN DE SERIES ACREDITADAS:
"Puesta al día en Métodos Microbiológicos para el Diagnóstico Clínico"
Disponible en http://www.doyma.es/eimc/formacion
17 enero / 31 marzo 2005