Introducción
A lo largo de los últimos años, se han publicado varias revisiones sobre el tratamiento antirretroviral (TAR) en adultos y niños, tema que por su enorme trascendencia y rápida evolución requiere revisiones continuas1,2. Existe una actualización periódica de las recomendaciones del TAR en niños, editada por un panel de expertos americanos3 y europeos4.
Este documento de consenso se ha elaborado basándose en las evidencias de la imposibilidad de que el TAR actual sea capaz de erradicar el virus5, aun pudiendo preservar o restaurar el sistema inmunológico, y la toxicidad asociada al TAR de consecuencias futuras inciertas6.
Los niños tienen una historia natural de la enfermedad, respuesta inmunológica y evolución de la carga viral diferentes a las del adulto. Por tanto, algunos de los eventos de progresión considerados en adultos no son extrapolables al niño, y siempre es necesario considerar la edad en la valoración del riesgo de progresión en un paciente determinado7.
El niño presenta peculiaridades farmacocinéticas que es necesario conocer en el TAR, que pueden modificarse en las distintas etapas madurativas y requiere preparaciones pediátricas específicas, sencillas de administrar y de fácil dosificación. Además, las interacciones medicamentosas son frecuentes en el abordaje terapéutico de los niños con infección por el virus de la inmunodeficiencia humana (VIH), siendo un campo en continua evolución y del que se dispone de pocos datos en la edad pediátrica.
Es preciso recordar que la información sobre TAR cambia constantemente, por lo que los lectores deberán consultar con regularidad diferentes fuentes. Por ello, este documento debería revisarse y actualizarse periódicamente.
Objetivos de las guías
Realizar una revisión de la evidencia actual disponible sobre las bases y modos de actuación respecto al TAR en el niño infectado por el VIH.
Debido a la complejidad creciente en la tratamiento de la infección VIH pediátrica, es aconsejable que pediatras especialistas en la atención de estos niños participen directa o indirectamente en el cuidado y la toma de decisiones importantes en la práctica clínica. Este comité considera primordial que los niños infectados sean tratados en estrecha colaboración con un centro de referencia especializado en la infección VIH pediátrica.
Este documento no pretende repetir las excelentes guías disponibles, sino más bien proporcionar una interpretación de la evidencia disponible en pediatría, y refleja en muchos aspectos la opinión del comité encargado de su elaboración.
Recomendaciones basadas en la evidencia
Se han revisado los datos científicos y trabajos pediátricos publicados o comunicados en los últimos 5 años. Se analizaron resultados de ensayos clínicos finalizados, estudios de metaanálisis, guías pediátricas de tratamiento de VIH en la red, revisiones de series pediátricas y estudios de cohortes. Se utilizaron las bases de datos: Medscape Medline Search, Entrez-Pub-Med, Grateful Med V26.3, Med Web Plus Subjects, empleando palabras de búsqueda: "children", "infants", "HIV", "AIDS", "antiretrovirals", "guidelines", "CD4", "viral load".
Metodología del diseño y análisis de ensayos clínicos
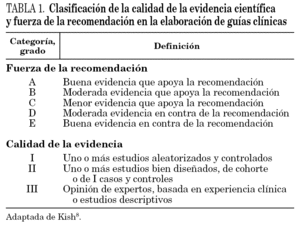
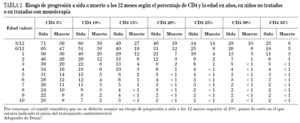
La metodología empleada ha consistido, fundamentalmente, en las recomendaciones de elaboración de guías basadas en la evidencia, con adaptación del modelo sugerido por la Infectious Disease Society of America (IDSA)8, y empleado en la elaboración de otras guías de TAR en pediatría4. Según el tipo de estudio se han clasificado los niveles de evidencia en tres grupos: nivel A, estudios aleatorizados y controlados; nivel B, estudios de cohortes o de casos y controles, y nivel C, estudios descriptivos y opinión de expertos (tabla 1).
Consideraciones generales. Peculiaridades de los niños
El TAR ha reducido la morbimortalidad en niños9-11, transformando la infección por el VIH en una enfermedad crónica, en la que se plantean nuevos retos y dificultades, que requieren un abordaje multidisciplinario. La identificación de la infección en la mujer embarazada y el empleo de TAR de manera apropiada permite disminuir la tasa de transmisión vertical a menos del 2%12. Es preciso descartar la infección por el VIH en pacientes procedentes de zonas con alta prevalencia de infección, tanto en las mujeres gestantes como en los niños.
Una de las mayores peculiaridades del TAR en niños es su farmacocinética específica. Los mayores obstáculos en el desarrollo y disponibilidad de fármacos en pediatría han sido la necesidad de preparados galénicos apropiados y de estudios de farmacocinética específicos para las diferentes edades. Muchos de los antirretrovirales nuevos no pueden administrarse en pediatría por carecer de datos de farmacocinética y farmacodinámica. Las dificultades para realizar ensayos clínicos hacen que la mayoría de pautas sean una adaptación de la experiencia previa en la edad adulta. La administración de dosis subóptimas, sobre todo cuando existe un alto grado de replicación viral, facilita el fracaso terapéutico y la selección precoz de resistencias.
Los potenciales beneficios inmunológicos y virológicos del TAR deben ponerse en la balanza con relación a los problemas de adherencia, resistencia y toxicidad. Estas limitaciones y dificultades asociadas al TAR están motivando una estrategia terapéutica más conservadora. Por otro lado, con la mayor supervivencia alcanzada, los niños infectados por transmisión vertical están llegando a la vida adulta, por lo que es necesario planificar la transición de los adolescentes controlados hasta ahora en unidades pediátricas a unidades de adultos de manera coordinada.
Pruebas de laboratorio para guiar el TAR
Riesgo de progresión en función de linfocitos CD4 y carga viral plasmática
Los niños infectados verticalmente tienen cargas virales más elevadas que los adultos, sobre todo en los primeros años de la vida, como reflejo de la inmadurez inmunológica para contener la replicación viral. La carga viral y los linfocitos CD4 son los dos marcadores predictivos de progresión de la infección VIH en niños y de respuesta al TAR utilizados y deben ser controlados cada 3 o 4 meses13,14. Aunque el porcentaje de linfocitos CD4 se utiliza preferentemente frente al valor absoluto de CD4, pues este varía más con la edad. El número total de linfocitos y el valor absoluto de CD4 son marcadores importantes de la progresión clínica y deberían utilizarse prioritariamente en los niños mayores de 7 años7. Además, es importante valorar de modo muy diferente el riesgo de progresión del VIH en niños no tratados, incluyendo el ligero deterioro cognitivo y afectación órgano-específica, en relación con el riesgo de progresión en niños tratados con las nuevas combinaciones de fármacos, que son mucho más efectivas11.
Linfocitos CD4 y carga viral en niños no tratados o tratados en monoterapia
En recién nacidos y niños infectados por VIH la mayor disminución del número de CD4 es un efecto combinado entre la progresión de la infección por el VIH y el descenso natural de CD4 por la edad13. Un valor bajo del porcentaje de CD4 es un marcador pronóstico de progresión de la enfermedad, aunque no hay un punto de corte de progresión a sida o muerte bien definido7,13,15. En la historia natural de la enfermedad, el mayor descenso de linfocitos CD4 ocurre en el primer año de vida, aproximadamente 250 cél./μl, disminuyendo posteriormente de manera gradual hasta los 6-8 años. En este grupo de edad se experimenta un descenso aproximado de unas 73 cél./μl al año15. A partir de los 6 años de edad, la disminución de linfocitos CD4 es similar a la de adultos asintomáticos (descenso de 60 cél./año)13.
La carga viral en niños suele ser baja al nacimiento (< 10.000 copias/ml), aumenta a los 2 meses de edad, con un rango variable, que puede alcanzar hasta 10 millones de copias/ml y disminuye lentamente en ausencia de tratamiento16,17. Esta disminución es mayor durante los primeros 12-24 meses de vida (0,6 log10/año) y más lenta posteriormente (0,3 log10/año)13. Una carga viral baja en el momento de la estabilización se asocia en adultos con progresión lenta y mejor supervivencia comparado con aquellos individuos con carga viral elevada18.
Existen dos formas de presentación de la infección VIH en niños, una con rápida progresión a sida19, y otra de progresión más lenta, más parecida a la de los adultos. Durante el primer año de vida es difícil interpretar valores de carga viral altos porque hay un solapamiento entre la carga viral de los niños que van a progresar rápidamente y los que no van a progresar a sida20. Los datos existentes indican que el valor basal del porcentaje de CD4 y la carga viral, así como los cambios en la evolución de estos parámetros, son marcadores más precisos en el pronóstico de la enfermedad7,15.
Actualmente, conociendo el porcentaje de CD4, los valores de carga viral y la edad del niño se puede estimar el riesgo probable de progresión clínica a sida o muerte a los 6 y 12 meses en niños infectados no tratados o en monoterapia7, disponible en la página www.pentatrials.org (tabla 2). Esta estimación del riesgo de progresión clínica procede de un metaanálisis de datos longitudinales de 3.941 niños seguidos en 8 estudios de cohorte y 9 estudios aleatorizados en Europa y Estados Unidos7. En este análisis, tanto el porcentaje de CD4 como la carga viral son predictores de progresión independientes, aunque el porcentaje de CD4 es un predictor más potente, y por ello es el principal marcador que se debe tener en cuenta en las decisiones terapéuticas. Si se utiliza este sistema se debe realizar una interpretación cuidadosa del metaanálisis en cada uno de los niños VIH ya que los resultados se han obtenido de la unión de análisis retrospectivos de cohortes longitudinales y ensayos en la etapa pre-TAR. Es muy probable que la progresión a sida sea mucho menor en los niños controlados actualmente que los que se analizaron 10-15 años antes.
Linfocitos CD4 y carga viral en niños en tratamiento antirretroviral
Con los nuevos antirretrovirales, que incluyen inhibidores de la proteasa (IP), se observa un incremento mantenido de CD421. Estos cambios cuantitativos están acompañados de cambios cualitativos en la respuesta inmunitaria y disminución del riesgo de infecciones oportunistas22. Sin embargo, el incremento del número de CD4 observado como respuesta temprana al TAR no explica completamente el beneficio clínico de cada fármaco individualmente.
El objetivo ideal del TAR es obtener una supresión completa de la replicación viral, por debajo de los límites de detección de los métodos actuales (habitualmente < 50 copias/ml de ARN plasmático). Un descenso de carga viral a concentraciones indetectables no significa supresión de replicación viral en tejido linfoide5. El VIH tiene una tasa alta de mutación y un recambio elevado por lo cual hay un porcentaje alto de viriones defectivos (no infectivos) que circulan en sangre periférica que se detectan al medir la carga viral. Por último, otras características biológicas del virus, que pueden ser importantes en la evolución (velocidad de replicación, tropismo, capacidad de inducción de sincitios y presencia de mutaciones) se escapan con la cuantificación de la carga viral.
La carga viral se expresa en logaritmo en base 10 (log10). Así, si un tratamiento produce una disminución de carga viral de 100 veces, es decir, del 99%, el resultado se expresa como una caída de 2 log10, considerándose significativa cualquier variación de la carga viral mayor de 0,5 log10, que es el mayor coeficiente de variación esperado por problemas de metodología y de fluctuaciones de la carga viral3.
RECOMENDACIONES. Los linfocitos CD4 y la carga viral son potentes predictores independientes de progresión y de respuesta al TAR, y por ello se deberían monitorizar periódicamente (nivel B).
Fármacos antirretrovirales en niños
El TAR habitualmente se basa en la combinación de tres o más fármacos antirretrovirales. Se emplea la combinación de dos inhibidores de transcriptasa inversa análogos de nucleósidos (ITIAN) asociados a un inhibidor de transcriptasa inversa no análogo de nucleósidos (ITINN) o a un IP.
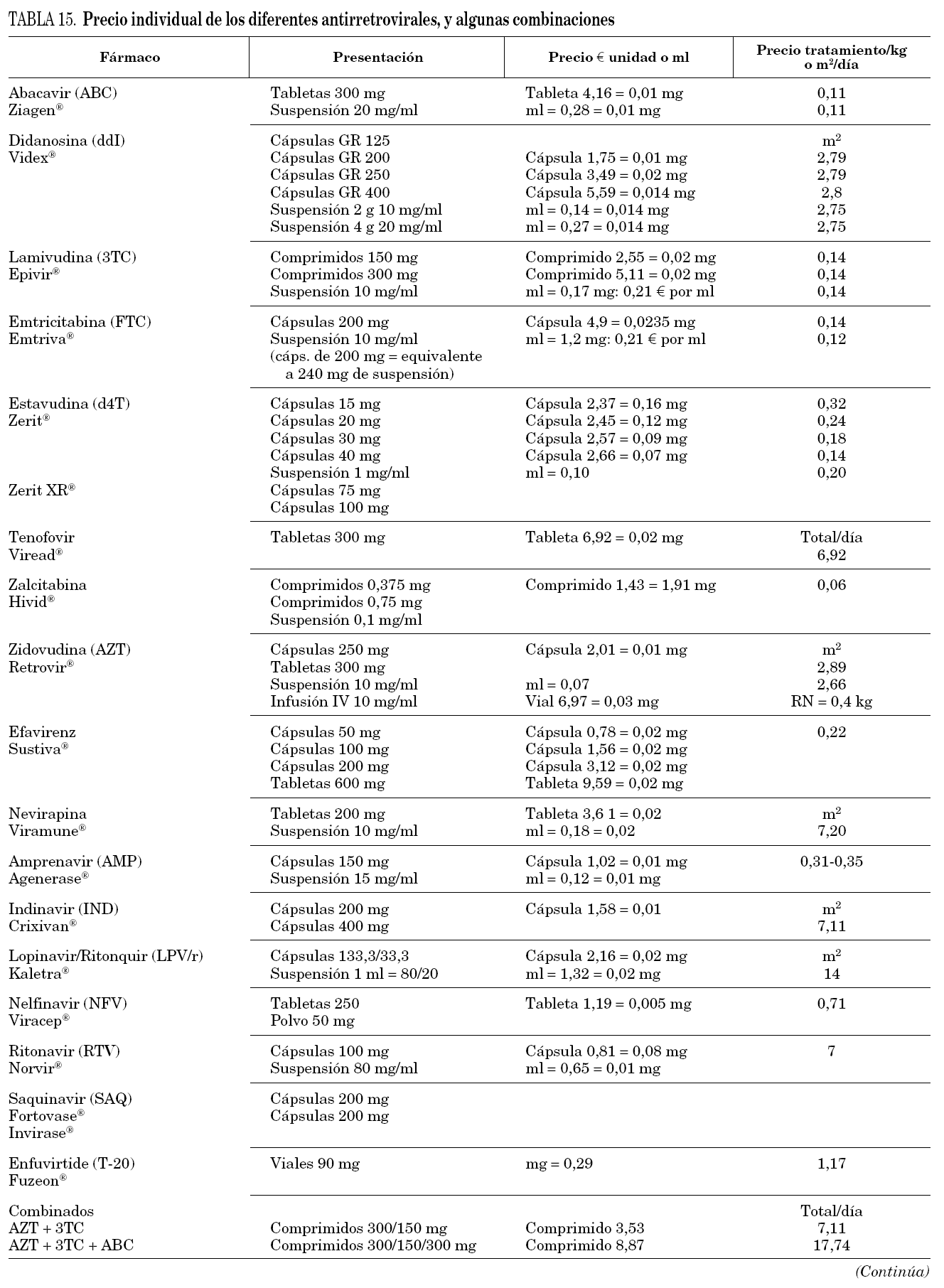
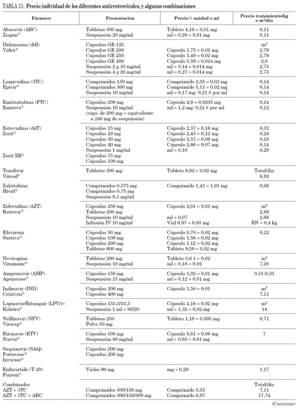
En la tabla 3 se muestran los fármacos disponibles en pediatría en nuestro país. En general, salvo en período neonatal, las dosis de los antirretrovirales son relativamente más elevadas que las de los adultos. En neonatos se requiere más información, sobre todo en prematuros.
En la adolescencia, la farmacocinética puede ser diferente a la del adulto. Es importante resaltar que la dosificación de los fármacos antirretrovirales viene determinada por el desarrollo puberal del niño. En los niños en estadios puberales precoces (estadios I y II de Tanner) se deben seguir los esquemas pediátricos, en los niños en estadios V se deben seguir las indicaciones terapéuticas de los adultos y en los niños en estadios III y IV se pueden seguir cualquiera de las dos recomendaciones3.
ITIAN
El ITIAN con el que se tiene mayor experiencia clínica en niños es zidovudina (AZT). La actividad del ITIAN depende fundamentalmente de los niveles intracelulares alcanzados tras sucesivas fosforilaciones; por ello, las concentraciones plasmáticas no parecen tener tanta relevancia clínica. Aun con una vida media plasmática relativamente corta en adultos, algunos ITIAN están aprobados una vez al día y en niños existen estudios en curso en este sentido con lamivudina (3TC) y abacavir (ABC)23. A excepción de zalcitabina (ddC), no aprobado en menores de 13 años, todos los ITIAN están aprobados y existen en preparación pediátrica en la actualidad.
El rango de dosis de didanosina (ddI) recomendado hasta ahora es muy amplio. Los últimos datos de farmacocinética recomiendan dosis de 120 mg/m2/día, 2 veces al día en mayores de 8 meses, y administrar dosis más bajas (100 mg/m2/día cada 12 h) en menores de 8 meses, debido a una menor eliminación renal del fármaco en este grupo de edad24. Los nuevos preparados de ddI de cubierta entérica permiten su administración una vez al día incluso en niños pequeños, pues existen comprimidos de 125, 200, 250 y 400 mg que podrían emplearse en niños con una superficie corporal mayor de 0,5 m2. La experiencia en pediatría aun es pequeña, aunque la larga vida media intracelular del fármaco permite una pauta de dosificación una vez al día con seguridad25.
No hay una dosis recomendada de ABC en menores de 3 meses3. Al ser un fármaco con probable menor toxicidad mitocondrial, su uso es cada vez mayor, tanto en terapias de inicio como en terapias de simplificación, a pesar de las reacciones de hipersensibilidad descritas, que ocurren entre el 2 y el 5% de los niños3,26. Es importante saber reconocer una reacción de hipersensibilidad, ya que puede comprometer la vida del paciente. La sintomatología consiste en la asociación de signos y síntomas inespecíficos entre los que se incluyen fiebre, exantema, mialgias, síntomas respiratorios o gastrointestinales. Ocurre precozmente (primeras 6 semanas), y requiere retirada del fármaco y no reintroducción34.
En la actualidad, la estavudina (d4T) tiende a utilizarse menos, por su mayor asociación a lipodistrofia27,28. Se ha sugerido que dosis algo más bajas podrían ser igual de eficaces y es posible que menos tóxicas. Sin embargo, no existe ningún estudio en el momento actual que avale esta sugerencia.
ITINN
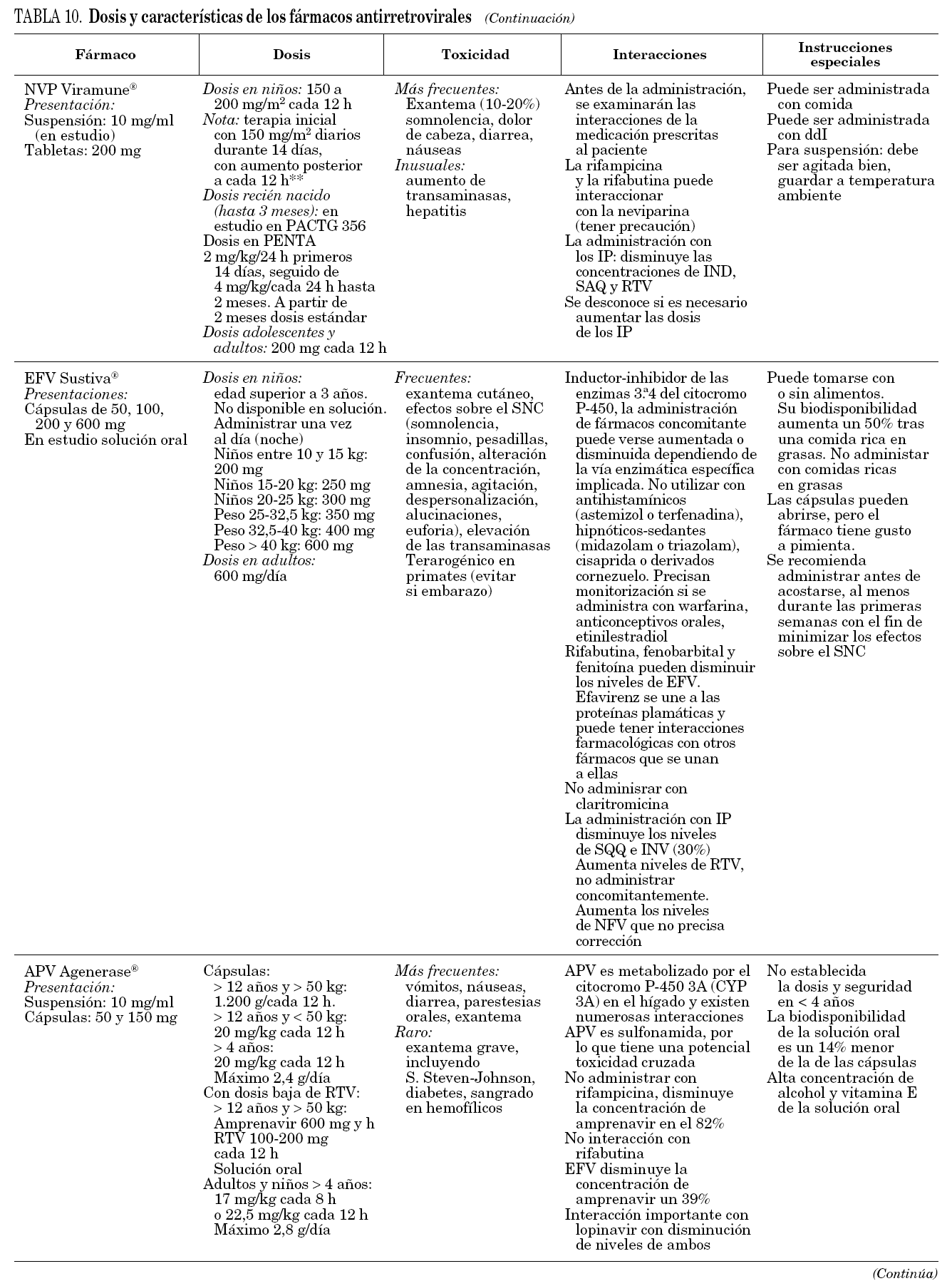
De los ITINN, tanto nevirapina (NVP) como efavirenz (EFV) existen en solución, pero este último preparado no está disponible en España, siendo necesaria su solicitud por medicación de uso compasivo. Además, la biodisponibilidad de la solución es menor que la de los comprimidos, por lo cual la dosis de la solución es más elevada, siendo necesario consultar la equivalencia. Las dosis de nevirapina y efavirenz son relativamente más elevadas en los niños que en los adultos29,30, pero se desconoce la dosis óptima de efavirenz en los primeros 3 años de vida, período en el que existe una gran variabilidad farmacocinética, y con frecuencia no se alcanzan concentraciones terapéuticas3.
Se han observado mejores resultados utilizando dosis altas de nevirapina (más de 300 mg/m2/día) que las recomendadas hasta ahora, siendo buena la tolerancia, por lo que se recomienda utilizar dosis altas en niños29.
IP
Para obtener la máxima supresión de la replicación viral, es necesario mantener unos niveles adecuados de IP en valle, varias veces superiores a la concentración del fármaco que reduce en un 50% el crecimiento del virus en cultivo (IC50). Como consecuencia del escaso rango terapéutico de la mayoría de los IP, es primordial administrar dosis adecuadas, y quizá la monitorización de las concentraciones, puesto que en adultos se ha puesto de manifiesto una asociación clara en las concentraciones de algunos IP en el valle con la respuesta virológica31, lo cual también parece ocurrir en niños con algunos fármacos como nelfinavir32 y los ITINN29,30.
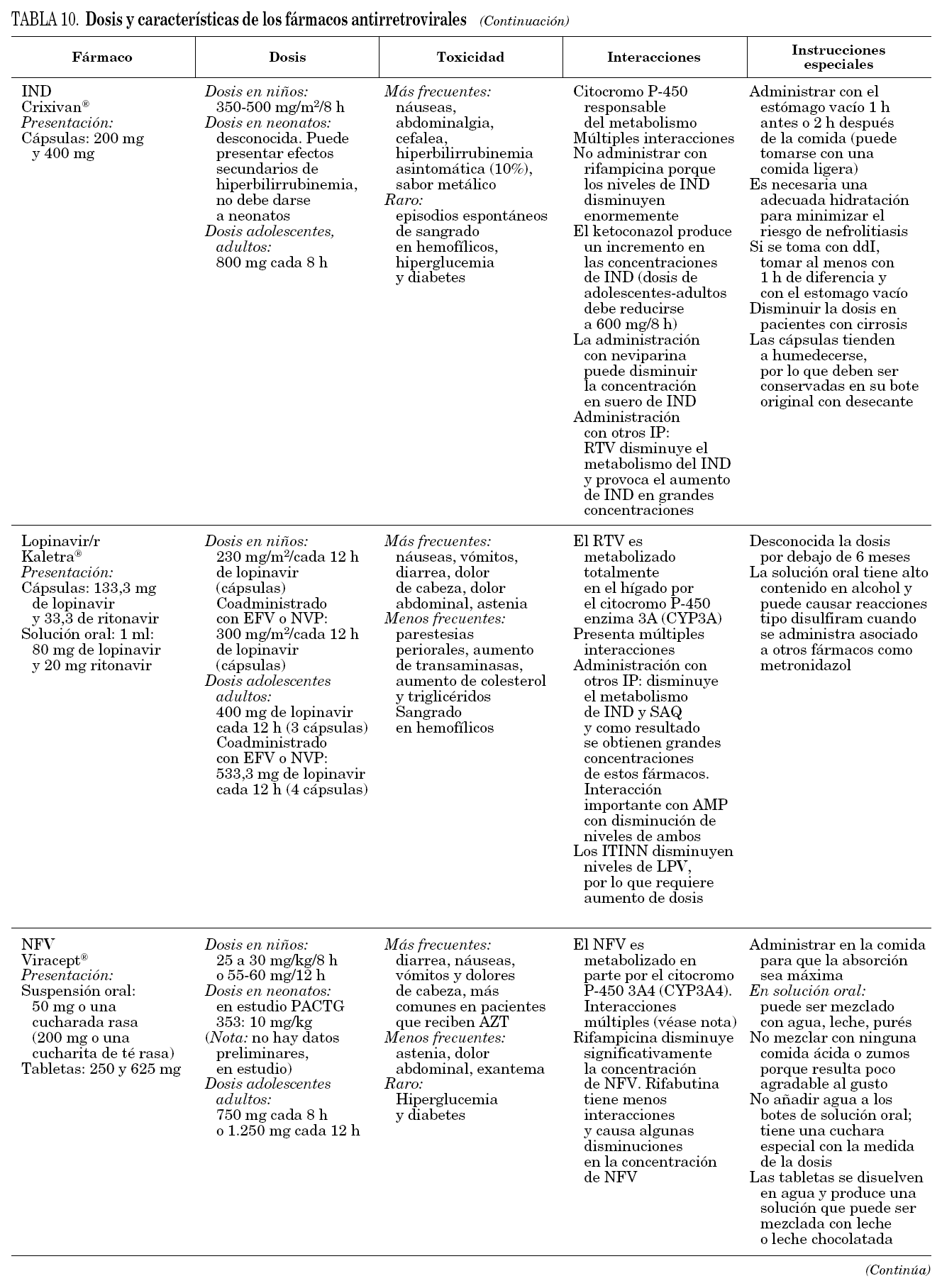
Los IP aprobados en niños son nelfinavir, ritonavir, amprenavir y la asociación de lopinavir con dosis bajas de ritonavir (lopinavir/r), puesto que son los únicos disponibles en preparación pediátrica, con datos de farmacocinética. Las dosis de IP, en general, también son relativamente más elevadas que en adultos. La biodisponibilidad de nelfinavir es muy variable en niños, sobre todo en lactantes, y se ve muy alterada por el tipo de ingesta. Por ello, las concentraciones obtenidas de nelfinavir en el valle son con frecuencia impredecibles en niños pequeños33, y de ahí que se requieran dosis mucho más altas en los 24 primeros meses de vida que en etapas posteriores. En menores de 6 meses, se han utilizado dosis de 75 mg/kg cada 12 h en el ensayo europeo PENTA 734. Aunque la dosis aprobada es de 30 mg/kg/dosis, 3 veces al día3, es habitualmente insuficiente. Si se utiliza nelfinavir, 3 veces al día en menores de 2 años, se debería aumentar la dosis al menos a 50 mg/kg/dosis pues hasta la mitad de los niños pueden tener concentraciones en el valle por debajo de los considerados terapéuticos con la dosis estándar. Las dosis habitualmente empleada es de 55-60 mg/kg/dosis cada 12 h, ya que existe experiencia en niños que muestra que es igual de efectivo 2 veces al día26. La dosis recomendada en adolescentes y adultos es de 1.250 mg cada 12 h, si bien en adolescentes se han utilizado dosis más elevadas que en adultos, de 1.500 mg/12 h, con buena tolerancia. En adultos se está investigando esta dosis3.
Todos los IP pueden ser potenciados con dosis bajas (booster) de ritonavir, menos el nelfinavir35. El IP que ha demostrado beneficiarse más en este sentido es lopinavir36. No hay datos de farmacocinética de lopinavir/r en menores de 6 meses, por lo que aún no se recomienda a esta edad3.
Las dosis bajas utilizadas con ritonavir como potenciador no conducen a selección de resistencias al mismo, ya que las concentraciones de ritonavir que se alcanzan nunca llegan a la zona de presión selectiva, con lo que no se desarrollan cepas mutantes33.
Nuevos fármacos antirretrovirales (próxima utilización en pediatría)
Tenofovir (TNF, Viread®). Es un análogo nucleótido de la transcriptasa inversa. A pesar de llevar varios años en el mercado, sólo está autorizado para mayores de 18 años y todavía es de uso compasivo en pediatría, ya que por el momento hay escasos datos de farmacocinética, eficacia y toxicidad en niños37,38. Presenta mejor perfil lipídico que la mayoría de ITIAN39, pero es fundamental vigilar su posible toxicidad ósea a medio y largo plazo3.
Emtricitabina (FTC, Emtriva®). Es un nuevo ITIAN con actividad contra el VIH y el virus de la hepatitis B (VHB), con vida media más larga que lamivudina, y puede administrarse una vez al día. No es eficaz cuando aparece la mutación 184, como ocurre con la lamivudina. Existe preparación en solución y hay datos en niños por encima de 3 meses40,41. Recientemente se ha aprobado en nuestro país, tanto en comprimidos como en solución, aceptándose su indicación en mayores de 4 meses. También en adultos se ha aprobado una presentación en comprimidos con la asociación emtricitabina y tenofovir (Truvada®).
Atazanavir (Reyataz®)3. Es un nuevo IP aprobado por la EMEA en adultos, que se administra una vez al día. Parece que produce menos alteraciones en el metabolismo lipídico que otros IP42. No existe una solución disponible, y no está recomendado por el momento en niños por falta de datos.
Tipranavir (Trizal®)3. Es un IP de potencia similar al lopinavir, con posible menor toxicidad. Potenciado con ritonavir, parece que podría ser eficaz frente a cepas virales con más de 20 mutaciones a IP43. Sólo está disponible en niños a través de ensayos clínicos, y en mayores de 13 años por uso compasivo.
Fosamprenavir (Telzir®)3. Es un IP, profármaco del amprenavir, aprobado en adultos. Hay ensayos pediátricos en curso en busca de dosis más óptima.
Enfuvirtide (T-20) (Fuzeon®)3. Es un fármaco perteneciente a una nueva familia de antirretrovirales, los inhibidores de fusión. Se administra mediante inyección subcutánea 2 veces al día. Está aprobado para niños mayores de 6 años, en quienes existen datos de farmacocinética, eficacia y seguridad44.
Indicaciones en la práctica clínica de la determinación de resistencias a fármacos antirretrovirales
La utilidad clínica de las pruebas de resistencia en situaciones concretas ha sido constatada por diferentes estudios prospectivos realizados en población adulta45-47. Actualmente distintas sociedades internacionales han difundido recomendaciones de consenso para la aplicación de las pruebas de resistencia en la práctica asistencial3,48-50. Las peculiaridades de la población pediátrica y la variabilidad geográfica del virus hacen necesaria una adaptación y actualización de estas recomendaciones de consenso para la práctica asistencial en nuestro país.
Para valorar la utilidad de un estudio de resistencias se consideran dos ámbitos sanitarios: el primero, el beneficio asistencial del paciente, y el segundo, el beneficio en salud pública debido a la optimización de la utilización de los antirretrovirales, que permite disminuir globalmente el desarrollo de variantes resistentes potencialmente transmisibles.
La resistencia del VIH al TAR es una de las principales causas de fallo terapéutico. La adecuada adherencia, interacciones medicamentosas, potencia de la droga, farmacocinética y posibilidad de resistencia preexistente o adquirida (por transmisión o por desarrollo debido a tratamientos anteriores) son factores que se asocian al desarrollo de resistencias y deben ser considerados para evaluar las indicaciones de los estudios de resistencia. Además, en el paciente pediátrico no son del todo extrapolables los datos de resistencias documentados en adultos. En los nuevos casos de infección en el recién nacido es frecuente la transmisión de cepas resistentes de sus madres previamente tratadas. Diferentes estudios demuestran que la prevalencia de variantes resistentes en los primeros meses de vida es elevada51.
Hay dos tipos de pruebas de resistencia, las genotípicas y las fenotípicas. Los ensayos genotípicos detectan mutaciones en el genoma del virus que confieren en mayor o menor grado resistencias. Se realizan aplicando técnicas de amplificación molecular siendo necesario una carga viral mínima de 1.000 copias/ml. La interpretación apropiada de estos estudios se desarrolla mediante algoritmos computarizados que requieren una actualización continuada. Las dos casas comerciales que disponen de ensayos genotípicos por secuenciación distribuyen sus propios algoritmos. En internet se puede acceder a excelentes bases de datos públicas para la interpretación de genotipo (http://hiv-web.lanl.gov o http://hivdb.stanford.edu) y listados de las mutaciones más relevantes asociadas a resistencia (www.iasusa.org/resistance.mutations). En la tabla 4 se muestra una lista de las mutaciones más comunes asociadas a resistencia a antirretrovirales.
Los ensayos fenotípicos determinan la concentración de fármaco que inhibe el crecimiento en cultivo del VIH. El resultado se expresa como la concentración del fármaco que reduce en el 50% el crecimiento del virus en cultivo (IC50). La principal ventaja del fenotipo es que informa del efecto de la suma de todas las mutaciones en la susceptibilidad del virus, pero los métodos fenotípicos clásicos son complejos, laboriosos, de elevado coste y están poco estandarizados. Actualmente hay pruebas comerciales basadas en la utilización de virus recombinantes que ofrecen mayor rapidez y estandarización.
Hay un tercer tipo de prueba de resistencia que predice el fenotipo a partir de los datos del genotipo. Este método es el "fenotipo virtual" y compara las mutaciones detectadas en la muestra del niño con una gran base de datos de muestras obtenidas por análisis de genotipado y fenotipado. No hay suficiente información para recomendar un tipo de prueba sobre otra y la decisión debe basarse en la disponibilidad real de las técnicas.
El seguimiento de un niño con infección por el VIH debe realizarse siempre con la misma técnica para evitar sesgos inherentes a las diferencias de las metodologías. En niños multitratados la aplicación de los dos tipos de técnicas (genotípicas y fenotípicas) podría añadir información complementaria para ayudar en la selección del nuevo tratamiento, aunque no existe consenso al respecto.
Indicaciones de las pruebas de resistencias en el paciente pediátrico
Distinguiremos diferentes situaciones ante el niño que no ha seguido previamente TAR según el tiempo de evolución a la infección.
Infección aguda
Niños diagnosticados en los 12 primeros meses tras la transmisión vertical de la infección por el VIH. Existe consenso en la recomendación de realizar un ensayo de resistencias. Actualmente la mayoría de niños diagnosticados con infección aguda han estado expuestos a virus maternos resistentes por tratamiento con antirretrovirales51. En el caso de la infección aguda el beneficio del estudio de resistencias es tanto para la asistencia individual del niño infectado, ya que en estos primeros meses es posible detectar la transmisión de variantes resistentes y adecuar la mejor pauta terapéutica, como en el ámbito de la salud pública. La vigilancia epidemiológica de las cepas transmisibles ofrecería información adicional sobre las diferencias en la transmisión de las variantes resistentes y de los regímenes terapéuticos en la embarazada con menor riesgo de transmisión.
Si por criterios clínicos, inmunológicos o virológicos se ha considerado el tratamiento precoz del niño, este no debe demorarse por la espera de los resultados de resistencia, sino que debe iniciarse empíricamente modificándose si fuera necesario tras la entrega del resultado.
Infección establecida
La posibilidad de que las mutaciones transmitidas por la madre se detecten en niños infectados sin tratamiento antirretroviral disminuye con el tiempo transcurrido, ya que las cepas wild-type tienen una capacidad replicativa superior a las cepas con mutaciones. Las pruebas de resistencia tienen una sensibilidad limitada para detectar estas poblaciones minoritarias, por lo que la no detección no significa ausencia de resistencia. Este hecho crea controversia sobre la utilidad de los ensayos de resistencia en el sujeto no tratado previamente pasada la infección aguda.
Una aplicación adicional de la técnica de secuenciación de los genes relacionados con resistencia a los antirretrovirales y que apoyaría la realización de un estudio basal en el paciente no tratado previamente es su utilidad filogenética, que permitiría identificar el subtipo viral y los polimorfismos. Por esta información adicional podría ser recomendable realizar un estudio basal de resistencias en el niño no tratado previamente en quien se desconoce el subtipo, con independencia del tiempo de evolución de la infección. La utilidad de la prueba sería tanto para la asistencia individual como para conocer globalmente los patrones específicos de resistencia en los distintos subtipos.
Paciente sin respuesta al tratamiento
Aunque en adultos hay suficiente información para recomendar la realización de un ensayo de resistencia cuando se constate fallo del tratamiento49,50, en niños no está definitivamente establecido, tras el primer fracaso virológico, el beneficio aportado. En pediatría existe un ensayo europeo en curso en niños con fracaso virológico en el que se aleatorizan en dos brazos: uno con terapia guiada por una prueba de resistencias, y otro a ciegas (ensayo PENTA 8 o PERA)4.
Si se decide una interrupción del TAR, la prueba de resistencias se debe realizar antes de la retirada del tratamiento para evitar que con el consiguiente rebrote de carga viral y predominio del virus wild-type se impida la detección de mutaciones existentes, que no serían detectables. En un paciente que recibe TAR con fracaso virológico, la no detección de mutaciones obedece mayoritariamente a falta de cumplimiento. Si se detectan mutaciones, hay que ser cauto ante la interpretación del genotipo resistente para diseñar el nuevo régimen.
La interpretación de la prueba de resistencias se debe realizar sin olvidar la historia previa de TAR, y con participación de un experto en infección por el VIH. Ante el niño multitratado se debe revisar las pruebas de resistencia previas debido al "archivo" de mutaciones del virus y puede ser de utilidad realizar dos tipos de técnicas diferentes (genotipo y fenotipo).
Finalmente, la prevalencia de la transmisión de resistencias a las drogas antirretrovirales en una población determinada puede variar en función del tipo de prueba empleada (genotipo, fenotipo), de los valores de corte de los estudios fenotípicos, de las mutaciones utilizadas como indicadoras de resistencia en las pruebas genotípicas, de las características epidemiológicas de la población estudiada y de la disponibilidad y las estrategias de implementación del tratamiento antirretroviral en un área o región determinada.
RECOMENDACIONES. Este comité recomienda la realización de una prueba de resistencias genotípicas a todos los niños menores de 12 meses con infección de transmisión vertical si han sido expuestos a antirretrovirales, y a partir del segundo fracaso virológico (nivel C).
Se debería considerar su realización en todo niño no expuesto a antirretrovirales antes de iniciar el TAR, y tras el primer fracaso virológico (nivel C).
Monitorización de concentraciones de antirretrovirales
La monitorización de las concentraciones plasmáticas de fármacos antirretrovirales sería en principio ideal para la optimización del tratamiento en niños infectados por el VIH, así como para conocer la adherencia real a la terapia. Existen múltiples factores que pueden influir en las concentraciones plasmáticas, que incluyen edad, hábitos nutricionales, interacciones farmacológicas o variaciones interindividuales. Su determinación no se encuentra al alcance de la mayoría de centros especializados en infección por el VIH.
Algunos estudios en adultos han mostrado la relación existente entre las concentraciones plasmáticas de algunos fármacos y la eficacia o el desarrollo de toxicidad relacionada con éstos. Las concentraciones plasmáticas excesivas se correlacionan bien con la toxicidad, lo que puede ayudar a corregir la dosificación e incluso podría ayudar a prevenirla. Por este motivo se ha sugerido que la monitorización de las concentraciones plasmáticas podría ser útil para aumentar su eficacia virológica o disminuir la toxicidad52, y debido a la mayor variabilidad farmacocinética en la edad pediátrica, el niño sería un candidato ideal para incluir la monitorización de concentraciones terapéuticas en la práctica clínica habitual, como se hace en algunos países europeos4,53. No obstante, en la interpretación hay que ser cautos, debido al desconocimiento parcial de la farmacocinética, y a la escasez de datos de los valores diana en el niño4. Los valores de los ITIAN no se correlacionan con la actividad antiviral53. Para ello sería necesaria la determinación de las concentraciones intracelulares de sus metabolitos trifosfatos, que sólo es posible realizar en laboratorios muy especializados. Debido a esto, la monitorización sólo estaría indicada para los ITINN y los IP51. De los diferentes parámetros farmacocinéticos, el área bajo la curva es el más útil, superando a los niveles pico y en valle, aunque es más complejo e invasivo53. Sería de gran utilidad la determinación de niveles ante el fallo terapéutico, la existencia de toxicidad, y ante la posible presencia de interacciones medicamentosas4.
La utilidad de la determinación de concentraciones terapéuticas no se ha establecido definitivamente en adultos, y los resultados de diferentes estudios prospectivos han sido dispares50. No obstante, se ha sugerido que existe una asociación entre concentraciones apropiadas y eficacia virológica, sobre todo para los ITINN e IP4,53. En niños la información existente es muy limitada. En un subestudio del ensayo PENTA 5 se observó cómo las concentraciones plasmáticas bajas de nelfinavir se correlacionaban con fallo virológico32. Próximamente comenzará un estudio pediátrico europeo, en el que se pretende dar respuesta al valor de la determinación de valores plasmáticos de fármacos en la práctica clínica (PENTA 14). Los niños se van a aleatorizar a diferente grado de monitorización frente a no determinación de niveles4.
RECOMENDACIONES. Este comité considera que las situaciones clínicas en las que podría ser útil la monitorización de las concentraciones plasmáticas de fármacos antirretrovirales serían el niño con fracaso terapéutico, la existencia de posible toxicidad por alguno de los fármacos monitorizados y las posibles interacciones medicamentosas con repercusión clínica (nivel C).
Terapia de inicio en niños
Uso racional del tratamiento antirretroviral en niños
Los dos marcadores fundamentales en la progresión de la enfermedad, los valores de linfocitos CD4 y la carga viral, constituyen la base para predecir la respuesta inmunológica y virológica a la terapia7,15,21,22.
La dificultad de conseguir cargas virales indetectables en niños54, junto con la evidencia de toxicidad de los fármacos antirretrovirales6, han hecho que las indicaciones de inicio y cambio de terapia antirretroviral en niños, tanto nacionales2, europeas4 como americanas3, sean hoy menos agresivas y actualmente se da más importancia a los marcadores inmunológicos, fundamentalmente al porcentaje de CD4, como indicadores de inicio y cambio del TAR4.
Premisas antes de iniciar el TAR en niños
1.El objetivo del TAR es mejorar la situación inmunológica, evitando así la progresión clínica. A pesar de no mantener máxima supresión viral, la mayoría de los niños tratados tienen una buena reconstitución inmunitaria, a expensas fundamentalmente de células vírgenes, lo que sugiere que el TAR se asocia a una mejor recuperación inmunológica55.
2.El objetivo del TAR en niños debe ser disminuir al máximo la replicación viral, consiguiendo niveles de carga viral por debajo de los límites de detección y evitando así la selección de cepas resistentes a fármacos. En muchos niños, especialmente en aquellos con carga viral inicial elevada, esto es difícil de conseguir56.
3.Existe la certeza de que la erradicación del virus no es posible con el TAR actual57 y comenzamos a conocer mejor la toxicidad de los fármacos, por lo que debemos intentar un equilibrio entre no retrasar demasiado el inicio del TAR, para evitar el deterioro inmunológico, y minimizar los efectos secundarios a largo plazo.
4.Los niños menores de 12 meses presentan una situación de "primoinfección", y por lo tanto tienen la posibilidad de conseguir una respuesta óptima y prolongada con la terapia precoz, evitando el deterioro tímico y la afectación del sistema nervioso central (SNC)58. Hasta que se pueda disponer de forma habitual en la práctica clínica de marcadores que identifiquen los niños con progresión lenta, los lactantes deberían ser candidatos a una terapia más precoz.
Momento de inicio del TAR
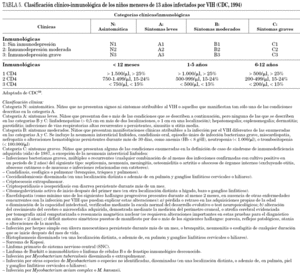
Las diferentes guías de TAR existentes2-4 proponen que el TAR se debe indicar basado en la edad y en el estadio clínico e inmunológico según la clasificación de los Centers for Disease Control and Prevention (CDC)59, como se expone en la tabla 5. La situación virológica también en algunos casos determinará el inicio terapéutico, pero no existe consenso en cuanto a puntos específicos de corte de carga viral en niños para inicio de terapia. Se diferencia la indicación de inicio de terapia según la edad de los niños (tabla 6), considerando a los niños menores de 12 meses un grupo de alto riesgo. A esta edad, la mayoría de los clínicos recomiendan iniciar el TAR por el elevado riesgo de progresión y encefalopatía, y la ausencia de buenos marcadores predictivos. No obstante, en casos seleccionados es posible no tratar y vigilar estrechamente. Los datos del metaanálisis muestran que el riesgo de progresión a sida en este grupo de edad asciende por encima del 10% cuando los CD4 disminuyen por debajo del 35%7. Por la misma razón se ha considerado una carga viral superior a 106 copias/ml. Si tras consenso con la familia se decide no tratar y esperar en niños asintomáticos, con CD4 por encima del 35% y carga viral inferior a 106 copias/ml, es necesario asegurar una monitorización clínica y analítica exhaustiva (cada 4-8 semanas)4.
A partir del primer año, se ha estimado un riesgo del 10% de progresión a sida en los 12 meses siguientes como indicación de terapia, y por ello se considera un porcentaje de CD4 < 15%, salvo en niños entre 1 y 3 años en que se considera el 20%, basado en los datos del metaanálisis. En mayores de un año la carga viral se ha considerado también un factor de riesgo de progresión, si bien menos robusto que el porcentaje de CD4, y por ello no se ha seleccionado un punto de carga viral a partir del cual exista una recomendación de iniciar la terapia, debiendo considerarse esta a partir de 250.000 copias/ml7. Por debajo de este nivel, en el niño asintomático o con pocos síntomas y CD4 elevados (> 20%) se podría diferir el TAR y vigilar estrechamente (tabla 6).
RECOMENDACIONES. Este comité considera que se debe iniciar o diferir el TAR basado en la práctica clínica, el porcentaje de CD4 y la carga viral (nivel B).
En menores de un año, la mayoría de expertos recomiendan iniciar el TAR, con independencia de la situación clínica, inmunológica y virológica (nivel C).
A partir del primer año está indicado el TAR en niños en categoría clínica C y CD4 menores del 15%, o menores del 20% para el grupo de niños entre 1 y 3 años (nivel B).
Se debe considerar iniciar el TAR en niños en clase B y/o carga viral elevada (> 250.000 copias/ml) (nivel B).
La mayoría de expertos aconsejan diferir el TAR y vigilancia estrecha en niños con situación clínica N o A y porcentaje de CD4 > 20% y carga viral menor de 250.000 copias/ml (nivel C).
Combinaciones de fármacos en terapia de inicio
Los tratamientos combinados con dos fármacos antirretrovirales han demostrado ser superiores a las monoterapias60, y las combinaciones con 2 ITIAN junto a 1 IP o a 1 ITINN, más potentes que las terapias dobles61. Las combinaciones ofrecen las siguientes ventajas respecto a la monoterapia: menor progresión de la enfermedad y mejoría de la supervivencia, supresión de la viremia mayor y más mantenida, y retraso en la selección de mutantes resistentes9-11.
Todavía se dispone de pocos datos sobre seguridad y toxicidad a largo plazo de la utilización de fármacos antirretrovirales en menores, por lo que se debe asegurar el máximo beneficio del tratamiento iniciado, con el fin de no agotar las posibilidades terapéuticas disponibles, manteniendo un estrecho control del paciente que permita garantizar una correcta adherencia.
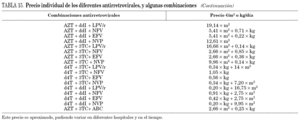
En la tabla 7 se muestran las diferentes combinaciones antirretrovirales, dando como preferentes aquellas con mayor nivel de evidencia.
Combinaciones de 2 ITIAN
En la tabla 8 se describen las combinaciones de ITIAN consideradas de elección y alternativas.
1.AZT + ddI. Es la combinación de 2 ITIAN de la que se dispone de mayor experiencia en niños, debido a que estos fueron los dos primeros antirretrovirales comercializados. Ofrece la ventaja de que están establecidas las dosis para los menores de 6 meses. Las presentaciones en solución de ambos fármacos permiten que puedan ajustarse al peso del niño, siendo su sabor y tolerancia adecuados. Ofrecen como inconveniente la toxicidad hematológica de zidovudina y la restricción con la alimentación de didanosina.
2.AZT + 3TC. Combinación que puede así mismo ser administrada en lactantes y cuya tolerancia es de las más altas. En hijos de madres que han recibido tratamiento antirretroviral durante el embarazo, deberá establecerse previamente la sensibilidad del aislado viral a estos fármacos (prueba de resistencias). En adolescentes permite la administración conjunta en un único comprimido, que puede facilitar la adherencia.
3.AZT + ABC. Combinación potente especialmente indicada en terapia de inicio de pacientes con encefalopatía asociada al VIH, debido que ambos fármacos consiguen concentraciones elevadas en LCR. Debido a la posibilidad de una reacción de hipersensibilidad, es necesaria una monitorización estrecha tras el inicio de abacavir, y según las guías americanas, este fármaco se utiliza más bien como segunda línea3. Ambos fármacos disponen de una solución oral de sabor aceptable.
4.3TC + ddI. Aunque la experiencia es extensa en adultos, existe mucha menos experiencia con esta combinación en niños, y por este motivo sería una combinación alternativa, aun cuando no hay contraindicaciones para que sea utilizada, y es atractiva por la posibilidad de administrarse en pautas una vez al día en niños mayores.
5.3TC + ABC. Los datos obtenidos del ensayo PENTA 526 determinaron que esta combinación fue superior a AZT + 3TC, o AZT + ABC, y por ello debe ser tenida en cuenta, y se incluye entre las combinaciones de primera elección en las guías europeas4, y en las recomendaciones actuales de adultos en nuestro país50. No obstante, la posibilidad de reacción de hipersensibilidad de abacavir puede ser un problema para algunas familias no habituadas a la utilización de antirretrovirales. En adultos se ha aprobado recientemente un comprimido que combina ambos antirretrovirales.
6.3TC + d4T. Menos experiencia en ensayos clínicos en niños, aunque son fármacos bien tolerados. Ha sido una combinación utilizada como tratamiento de inicio y de rescate con buenos resultados. La mayor toxicidad mitocondrial de estavudina exige cautela4,27,28.
7.ddI + d4T. Existe experiencia en lactantes de menos de 3 meses (PENTA 7)62, y también en niños mayores con situación estable63. Es bien tolerada a corto plazo. Puede estar indicada en casos de madres con resistencias a zidovudina y lamivudina. Tiene como principal problema el hecho de asociarse a mayor toxicidad mitocondrial27,28.
8.AZT + ddC. La zalcitabina no tiene presentación en solución, siendo este un inconveniente para su administración y ajuste de dosis en niños. Además debe ser administrado cada 8 h, y no está aprobado en menores de 13 años en nuestro país. En adultos ha demostrado ser menos eficaz que otras combinaciones y por este motivo debe considerarse sólo una alternativa3.
9.ddI + FTC. Cada vez es mayor la experiencia en adultos y niños con esta combinación en pautas una vez al día, incluso en niños pequeños, con elevada potencia y buen perfil de seguridad, por lo que debe considerarse una opción válida en terapia de inicio40,41, aunque se requieren aun más datos en niños.
Están contraindicadas las siguientes asociaciones: AZT + d4T, y ddI + ddC, y no recomendadas las asociaciones de ddC + d4T y ddC + 3TC por su posible potenciación de toxicidad. Tampoco se recomienda la asociación 3TC + FTC por su mecanismo de acción, diana y perfil de resistencias similares.
En la terapia de inicio se dispone de mayor información en pacientes pediátricos con la asociación de 2 ITIAN + 1 IP. Existen datos de farmacocinética y farmacodinámica de algunos de los IP (nelfinavir, ritonavir) incluidos niños pequeños y va acumulándose experiencia de lopinavir/r en menores de 6 meses. Están en curso ensayos con los nuevos IP, fosamprenavir y tipranavir. Asimismo se dispone de datos en niños de 2-4 meses con la combinación de nevirapina + ddI + AZT, aun cuando este último régimen podría no ser suficientemente potente en algunos niños58. Es posible que en este período, se requieran terapias más potentes, consistentes en 3 fármacos incluyendo lopinavir/r, o 4 fármacos con 2 ITIAN, nevirapina y nelfinavir58 o pautas de ahorro de IP. En este sentido, en el primer año de vida la combinación de 3 ITIAN incluyendo abacavir con nevirapina ha mostrado resultados muy esperanzadores64, si bien se requiere más experiencia, pues los datos son limitados y los resultados variables58,64. En la decisión en el primer año de vida es fundamental la historia previa de exposición a antirretrovirales y una prueba de resistencias.
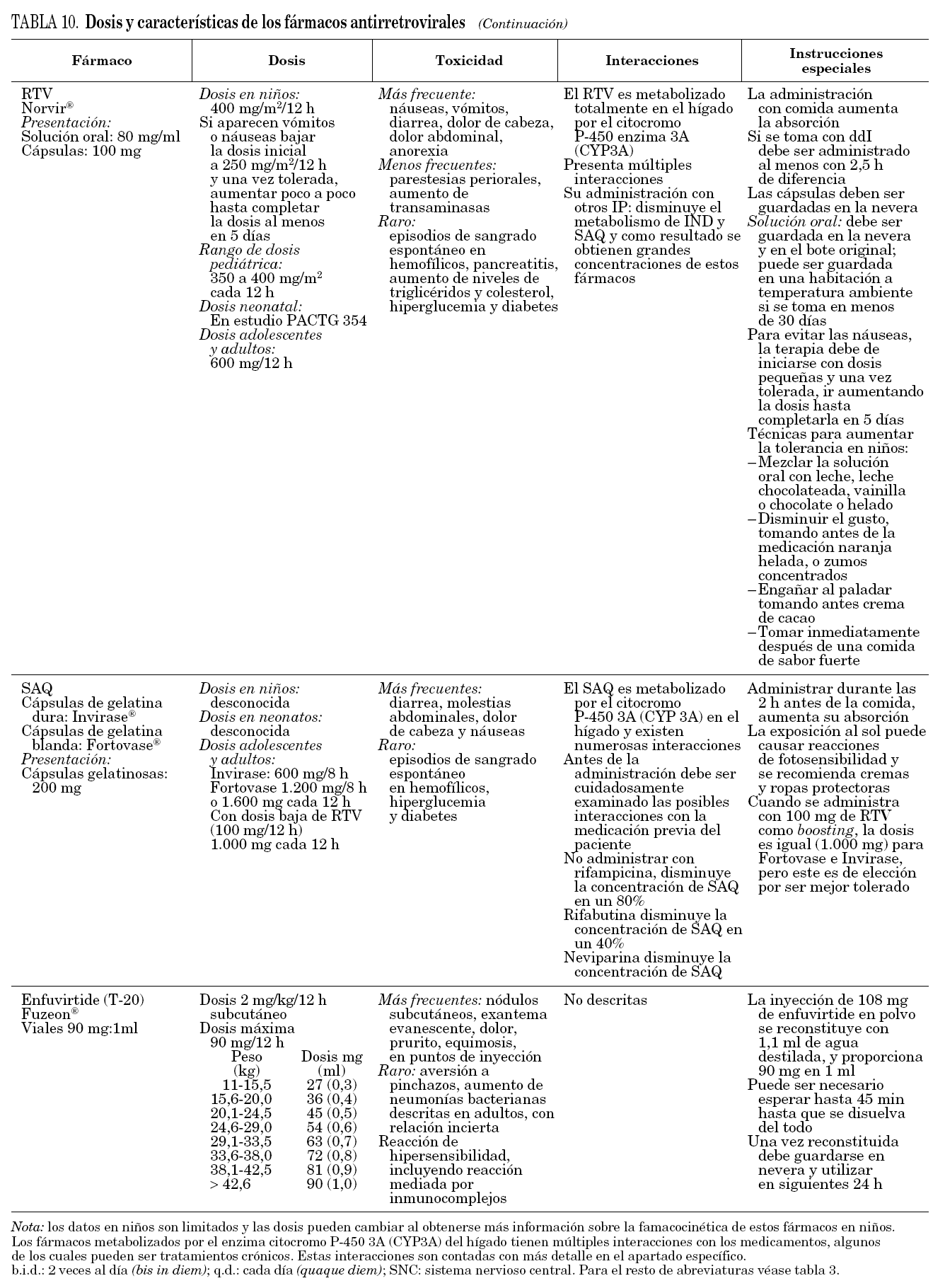
En la tabla 9 se describen algunas posibles ventajas y desventajas de los ITINN e IP más comunes. En la tabla 10 se describen algunas de las características fundamentales de los fármacos utilizados en pediatría.
Debido a los frecuentes efectos secundarios de los IP y teniendo en cuenta los problemas de cumplimiento que conllevan, también se incluye como primera opción de tratamiento en niños: efavirenz o nevirapina asociado a 2 ITIAN, aun cuando la experiencia es menor. No se dispone de datos que comparen en niños la efectividad de los ITINN con los IP, existiendo un ensayo en curso para responder a esta cuestión (PENPACTG 1)4. Ambos fármacos se emplean con éxito en terapias de inicio en niños29,65,66.
No existe evidencia de cuál sería el ITINN de elección. En las recomendaciones americanas se considera de elección efavirenz en mayores de 3 años3, mientras que en las guías europeas4 o en las de adultos en España50, ambos fármacos se consideran opciones igualmente válidas. En el ensayo 2 ITINN que compara directamente efavirenz con nevirapina no se detectaron diferencias en cuanto a eficacia, resultando nevirapina más hepatotóxica67. En niños no hay estudios comparativos, si bien un estudio abierto en Tailandia muestra que la efectividad de efavirenz es superior a la de la nevirapina en niños que pueden tragar comprimidos66. La decisión debe individualizarse, teniendo en cuenta el perfil de toxicidad, adherencia y el hecho de que efavirenz sólo puede ser utilizado en mayores de 3 años capaces de tomar cápsulas.
Como alternativa hay regímenes más conservadores que incluyen 3 ITIAN o 2 ITIAN con otros IP como saquinavir, o amprenavir, de los que hay menor información en niños. Estos regímenes constituyen opciones de segunda línea debido a que la posibilidad de conseguir una inhibición completa de la replicación viral es muy inferior a las combinaciones que incluyen los IP de primera línea o ITINN.
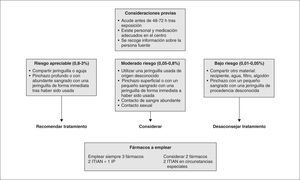
RECOMENDACIONES. Este comité considera que se debe individualizar la terapia de inicio. En menores de un año estarían indicados 3 o 4 fármacos, siendo fundamental en la elección la historia previa de exposición a antirretrovirales (nivel B).
En mayores de un año se recomienda iniciar el TAR con 3 fármacos, o 2 ITIAN y 1 IP, o bien 2 ITIAN + 1 ITINN (nivel B).
Entre los ITIAN existen varias opciones válidas, incluyendo pautas una vez al día, si bien combinaciones con abacavir pueden ser más potentes. Entre los ITINN se considera de elección nevirapina en menores de 3 años, y efavirenz o nevirapina a partir de esta edad. Entre los IP se considera preferente lopinavir/r o nelfinavir (nivel B).
Terapia de continuación
Generalidades sobre las terapias de rescate
Antes de cambiar el TAR es necesario poner en la balanza los pros y contras del cambio, entre los que se incluye las opciones de terapia existentes y futuras, posible adherencia al nuevo régimen y toxicidad.
Dada la elevada capacidad de replicación y mutación genética del virus, es indefectible la selección de cepas resistentes a los fármacos utilizados en una pauta no completamente supresora a lo largo del tiempo. La rapidez y el grado de resistencias va a depender del tipo de fármaco y la magnitud de la supresión viral. Es habitual que se produzca una acumulación secuencial de resistencias genotípicas, que van paralelas a las fenotípicas. Estas cepas resistentes pueden tener una disminución de la capacidad replicativa y, por tanto, una menor virulencia68, lo que explicaría en parte por qué se puede mantener elevado el recuento de CD4, a pesar del fracaso virológico.
Aunque, en teoría, cuanto antes se produzca el cambio mejor es la respuesta, se deben individualizar los riesgos y beneficios de un régimen más complejo y peor tolerado, frente al mantenimiento de una pauta a la cual se ha adaptado el paciente y, aunque no óptima, puede permitir continuar la monitorización en espera de estudios en curso, y de nuevos antirretrovirales mejor tolerados, más simples de administrar y más potentes.
No está claro el mejor momento del cambio cuando se produce un fracaso virológico. Si se decide un cambio terapéutico, debería sustituirse el mayor número de fármacos posible, con una terapia optimizada, para lo cual se aconseja un test de resistencias genotípicas, mientras se mantiene la terapia.
La elección del nuevo tratamiento debe basarse en un cuidadoso análisis de las causas del fallo terapéutico previo, y la historia de TAR. Si la causa del fallo radica en una pobre adherencia, en ausencia de resistencias demostrables, podría prescribirse el mismo régimen, siempre y cuando se analicen y resuelvan las causas de la mala adherencia, pudiendo optar por una pauta mejor tolerada y más fácil de cumplir.
El número de pacientes con fracasos múltiples va en aumento en pediatría. Alrededor de la tercera parte de los niños que reciben TAR en la cohorte de Madrid han fracasado previamente con al menos los dos primeros regímenes de TAR69. En los ensayos iniciales de rescate en niños con experiencia previa en IP, los resultados virológicos han sido pobres, incluso con combinación de 2 IP70. En la actualidad con las terapias disponibles, aun a pesar del fracaso virológico a las tres familias de fármacos, estos niños pueden responder a pautas con IP de mayor barrera genética en cerca de la mitad de los casos71.
El abordaje clínico del niño con múltiples fracasos es complejo, y requiere consulta en centro de referencia con experiencia2-4. En general:
1.Nunca se debería añadir un nuevo fármaco único a un régimen que falla, pues se anticipa el fracaso virológico y la anulación de la efectividad del fármaco introducido.
2.Es importante incluir al menos 2 fármacos nuevos para el paciente, para lo cual puede ser necesario esperar y cambiar sólo cuando exista un descenso de CD4 hasta niveles de riesgo. Una aproximación en la nueva combinación terapéutica tras un primer fracaso terapéutico podría ser la siguiente: en niños que fracasan a una terapia de inicio con 2 ITIAN y 1 ITINN, la opción más razonable sería un cambio a 2 ITIAN nuevos y 1 IP potenciado. En los niños que han fracasado a un régimen de 2 ITIAN y 1 IP se podría optar por una pauta de 2 ITIAN nuevos y 1 ITINN, o preferiblemente a un régimen con triple terapia que incluya 1 ITIAN nuevo, 1 ITINN y 1 IP potenciado.
3.En el paciente en que han fallado las tres familias de fármacos, la situación es compleja. En alguna ocasión podría ser útil reciclar fármacos, algunos mejorados en su presentación y seguridad, como es el caso con didanosina en cápsulas de cubierta entérica, que aun puede mostrar actividad en el paciente pretratado72. Puede estar justificada la solicitud de fármacos aun escasamente evaluados en niños como tipranavir, activo frente a cepas con múltiples mutaciones de resistencia a IP. Puesto que es común una disminución de susceptibilidad con aumento de la IC50, también puede plantearse un aumento de la dosis como se ha sugerido para lopinavir/ritonavir y existe alguna pequeña experiencia en pediatría73. Una aproximación podría ser la combinación de 2 o 3 ITIAN nuevos o reciclados, si aún están disponibles y presentan actividad teórica, y 1 IP potenciado. Debe plantearse la asociación de nuevos fármacos como el inhibidor de fusión enfuvirtide, aprobado en mayores de 6 años, que tiene una gran potencia antirretroviral pero requiere administración subcutánea 2 veces al día44,74.
4.Aunque son posibles combinaciones de cuatro o más fármacos (mega-TARGA), incluyendo asociación de varios IP, la adherencia puede ser difícil y existir importantes interacciones medicamentosas. En esta situación estaría indicada, si es posible, la monitorización de concentraciones terapéuticas4,31,75.
5.Se desconoce el valor de la interrupción de la terapia y por cuánto tiempo antes de la introducción de la nueva pauta, pero esta práctica se ha asociado en adultos de un elevado riesgo de progresión76 y, si se realiza, requiere monitorización muy estrecha.
Definición de fracaso terapéutico
Aunque la consideración de cambio terapéutico debería ser individualizada, en general se plantea un cambio de terapia cuando exista fracaso terapéutico, como se describe en la tabla 11. Se debe considerar un cambio de tratamiento cuando ocurre cualquiera de las siguientes circunstancias:
1.Evidencia de progresión de enfermedad, por parámetros clínicos, inmunológicos y virológicos.
2.Toxicidad, intolerancia o mala adherencia al tratamiento actual.
3.Aparición de nuevos datos o tratamientos menos tóxicos y más eficaces que el actual.
Cambios basados en consideraciones clínicas
La aparición de algunos cuadros clínicos durante el TAR indican mal pronóstico y progresión de la enfermedad:
1.Afectación neurológica progresiva. Es de mal pronóstico y traduce progresión de la enfermedad. Está indicado un cambio de tratamiento que incluya fármacos que penetren en el SNC, entre los que destacan los ITINN, zidovudina, abacavir, lamivudina y estavudina3.
2.Detención del crecimiento con afectación de percentiles de peso y talla sin otra justificación.
3.Progresión de la enfermedad con cambio a categoría clínica C. Si el niño pasa de de categoría A a B, no siempre es preciso un cambio aunque si una estrecha vigilancia.
Cambios basados en consideraciones inmunológicas
El recuento de células CD4 y su porcentaje en la edad pediátrica son predictores de progresión de enfermedad y mortalidad7. Antes de considerar el cambio basado en patrones inmunológicos debe confirmarse al menos con otra determinación obtenida unas semanas después de la prueba inicial.
Un tratamiento antirretroviral potente y eficaz se traduce habitualmente en un aumento progresivo de los valores CD4. Por ello debe considerarse un cambio de tratamiento en las siguientes situaciones:
1.Progresión de categoría en la clasificación inmunológica.
2.Cambio importante en el percentil de los CD4, con descenso superior al 5% en 6 meses.
3.Disminución rápida e importante del número absoluto de CD4 (> 30% en menos de 6 meses)3.
Es necesario individualizar, considerando tanto la evolución global de los CD4 como la rapidez de descenso. Así, puede ser más importante una caída sustancial de CD4 en la misma categoría que un descenso mínimo con cambio de categoría.
Cambios basados en consideraciones virológicas
Hay que tener en cuenta que la carga viral en niños infectados por vía perinatal es más alta que en el adulto, la respuesta al tratamiento más lenta y se consigue menos veces la supresión total de la viremia que en el adulto, a pesar de combinaciones potentes. La respuesta virológica puede ser más tardía y no alcanzarse hasta pasados 6 o más meses3. No obstante, en una elevada proporción de niños no se va a alcanzar máxima supresión de la replicación viral o va a existir un rebrote de carga viral. Aunque existe un riesgo de acumulación secuencial de resistencias, en general el fracaso virológico no debe ser constituir una indicación absoluta de cambio, incluso con carga viral alta.
Es imprescindible identificar la causa del fracaso virológico y en ocasiones plantear un cambio, y es necesario individualizar y valorar el riesgo de pérdida de actividad y su grado de la pauta antirretroviral empleada.
Combinaciones de fármacos en niños previamente tratados
La elección de un nuevo tratamiento va a depender, entre otros factores, de la adherencia, de la historia de antirretrovirales, de la toxicidad previa, de la disponibilidad de nuevos fármacos, y de los resultados de las pruebas de resistencias.
Antes de realizar un cambio de tratamiento en el niño, es conveniente la realización de resistencias genotípicas y fenotípicas siempre que tenga una carga viral superior a 1.000 copias/ml. La detección de resistencias implica que ese fármaco probablemente no sea apropiado para suprimir la replicación viral; sin embargo, la ausencia de resistencias no asegura que sea útil, debido a que puede haber resistencias cruzadas con fármacos previamente usados.
En caso de decidirse un cambio terapéutico, se debe monitorizar la respuesta al mes del cambio, con una periodicidad posterior de al menos una vez cada 3 meses3.
RECOMENDACIONES. Este comité considera que el cambio de terapia debe ser individualizado, y basado habitualmente en una prueba de resistencias (nivel C).
En niños que no responden a una terapia de inicio con 2 ITIAN y 1 ITINN, la opción más razonable sería un cambio a 2 ITIAN nuevos y 1 IP potenciado. En los niños que no han respondido a un primer régimen de 2 ITIAN y 1 IP, se podría optar por una pauta de 2 ITIAN nuevos y 1 ITINN, o preferiblemente a un régimen con 1 ITIAN nuevo, 1 ITINN y 1 IP potenciado. En los pocos niños existentes que han sido tratados de inicio con 3 ITIAN, se podría optar por 2 ITIAN nuevos y 1 ITINN, o por 2 ITIAN y 1 IP. En el niño con múltiples fracasos, el rescate es complejo y requiere consulta con centro de referencia (nivel C).
Simplificación
Se entiende como simplificación del TAR el cambio de una terapia con la que se ha llegado a la supresión virológica completa de manera prolongada (habitualmente más de 6 meses) por otra que mantenga dicha supresión y que permita reducir la complejidad del régimen, mejorando la adherencia, la calidad de vida del paciente, y en ocasiones disminuyendo la toxicidad. El TAR se puede simplificar reduciendo el número de fármacos, el número de comprimidos o el número de tomas, todo lo cual se ha demostrado en adultos que mejora la adherencia77, y disminuye el riesgo de abandonar la terapia78.
Los estudios de sustitución de fármacos antirretrovirales se han basado fundamentalmente en las premisas de que exista un control de la replicación viral y de que los fármacos alternativos sean equipotentes en términos de supresión viral. Hasta la fecha, los protocolos de simplificación realizados en adultos han observado una discreta disminución de las alteraciones analíticas, con descenso en las concentraciones plasmáticas de colesterol y triglicéridos, si bien las alteraciones morfológicas no se han visto modificadas de una manera evidente, en particular la lipoatrofia. Mientras se continúa investigando en un conocimiento más profundo en la patogenia y consecuencias de las alteraciones metabólicas asociadas al TAR actual, es fundamental disminuir factores de riesgo cardiovascular para lo cual puede ser necesario simplificar el tratamiento.
Con objeto de disminuir el número de comprimidos y/o de dosis se han realizado numerosos estudios en adultos50, y muy escasos en pediatría. En niños, efavirenz, didanosina, emtricitabina y tenofovir pueden administrarse una vez al día con seguridad, y probablemente en niños sin tratamiento antirretroviral previo, también lamivudina y nevirapina, como ya está aprobado en adultos, o abacavir23. Recientemente se ha comunicado la experiencia preliminar del ACTG 1021, en el que se utiliza emtricitabina, didanosina, y efavirenz en una sola dosis diaria en niños no tratados previamente, combinación que podría ser una opción como mantenimiento en un niño que ha respondido a la terapia previa. En análisis de intención de tratar hasta el 87% de los niños alcanzaron carga viral menor de 400 copias/ml a las 24 semanas, proporción que fue del 74% considerando el umbral de 50 copias/ml41.
En niños se han comunicado tres estudios de simplificación, con sustitución del IP en dos de ellos por un ITINN, y en un tercero por abacavir, tras más de 6 meses con carga viral indetectable. En el único estudio publicado, realizado en 17 niños, se sustituye el IP por efavirenz79, manteniendo carga viral indetectable a las 48 semanas 16 de ellos, documentándose un descenso moderado, aunque significativo, del colesterol total y de cociente aterogénico. En un estudio español en el que 7 niños cambiaron el IP por nevirapina, en seis se mantuvo la carga viral indetectable a las 48 semanas, apreciándose también un descenso moderado en la cifra de colesterol80. En el único estudio comunicado con abacavir se han incluido 19 niños tratados con IP en su primera pauta de TAR, la mitad en el primer año de vida, sustituyéndose este por abacavir, manteniéndose la carga viral por debajo de 50 copias/ml en todos ellos, tras una mediana de seguimiento de 28 semanas, con descenso significativo de colesterol total, el colesterol LDL y los triglicéridos, facilitando la adherencia y con mejoría en la calidad de vida81.
RECOMENDACIONES. Este comité considera que la sustitución de un IP por un ITINN es segura y efectiva como terapia de simplificación en el niño con carga viral indetectable durante un período prolongado. También es posible un cambio a abacavir en casos muy seleccionados. Ambas opciones podrían asociarse a una mejoría en el perfil lipídico (nivel C).
Interacciones farmacocinéticas
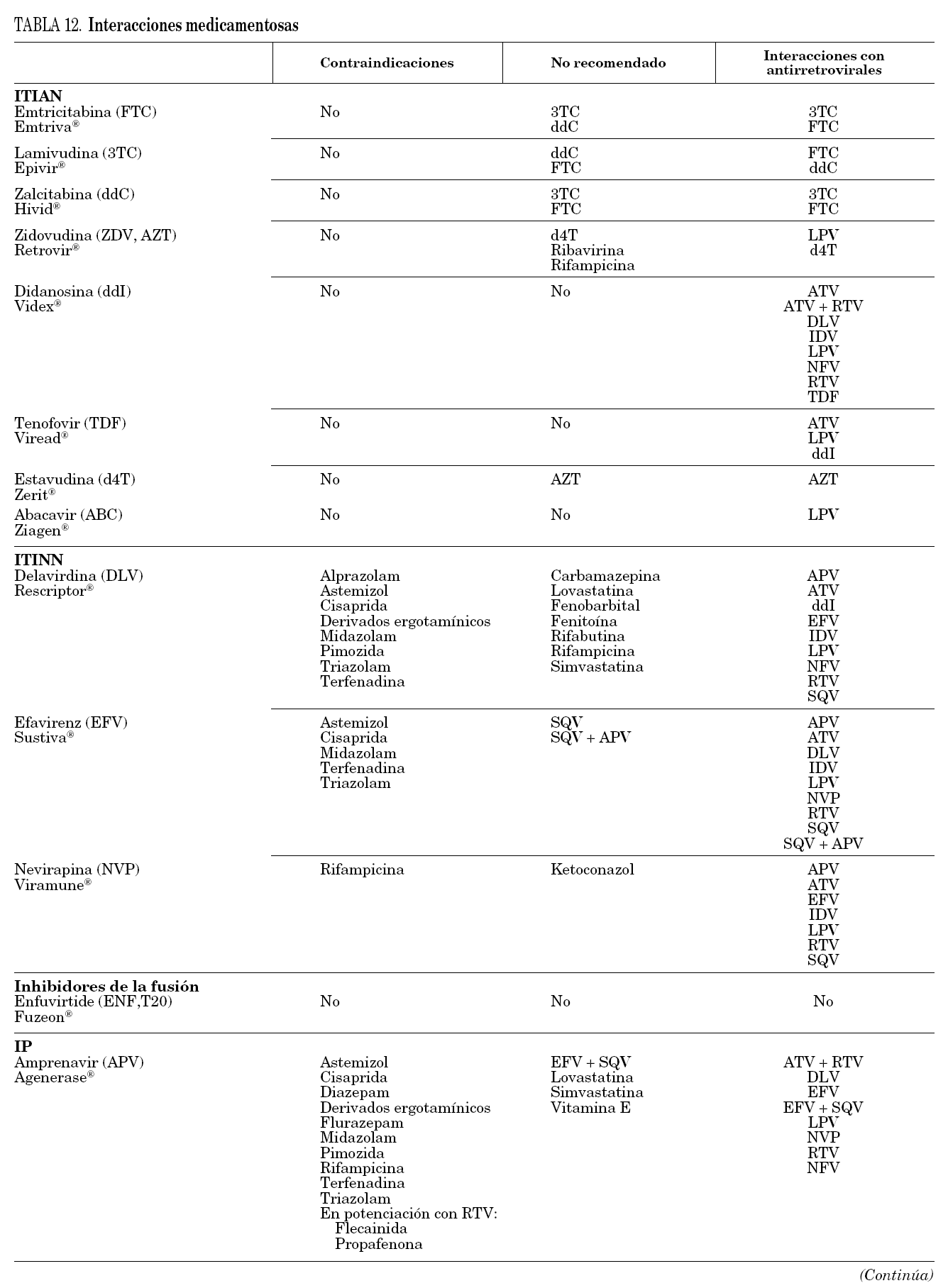
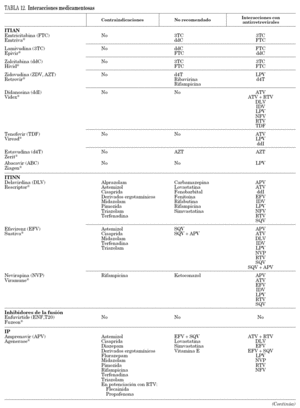
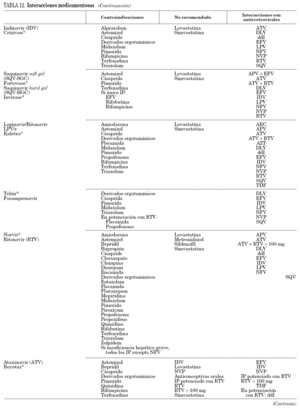
Gran parte de los antirretrovirales, en especial los ITINN y los IP, tienen gran número de interacciones medicamentosas por su carácter inhibidor o inductor enzimático, que en ocasiones tiene relevancia clínica. Las interacciones farmacocinéticas más importantes se deben a la interacción de algunos antirretrovirales con el citocromo P-450, por lo que pueden actuar como inductores o inhibidores de sus isoenzimas principales. Se recomienda consultar una guía de posibles interacciones medicamentosas antes de prescribir un fármaco nuevo a un paciente en tratamiento antirretroviral. También se recomienda consulta cuando se combinan diferentes antirretrovirales por su posible interacción.
Se incluye una tabla específica (tabla 12) que debe complementarse con otras fuentes. Esta información está disponible on line en www.hiv-druginteractions.org.
Cumplimiento del TAR
El TAR supone un reto para el niño, su familia y los médicos que los atienden. La administración de varios fármacos más de una vez al día es a menudo problemática. La eficacia del TAR depende no sólo de las diferencias individuales en la absorción y el metabolismo de las medicaciones, sino sobre todo de su correcto cumplimiento82. Si este no se realiza de forma estricta, no se va a contener la replicación viral y, por tanto, aumentan de manera considerable las posibilidades de aparición de cepas resistentes83, que no sólo anulan la eficacia de la medicación prescrita, sino que además pueden inutilizar otras alternativas terapéuticas por la existencia de resistencias cruzadas.
El correcto cumplimiento del TAR supone un desafío en el control adecuado de estos pacientes para evitar el fracaso terapéutico y la selección de resistencias84.
Definición del cumplimiento terapéutico
Se define como cumplimiento terapéutico el seguimiento estricto del tratamiento prescrito. Muchos autores utilizan el término adherencia (traducción del término inglés adherence) intentando expresar unión con el tratamiento; sin embargo, lo importante para mantener su eficacia es el cumplimiento estricto del tratamiento, sin que ello excluya que el tratamiento sea explicado, comprendido y aceptado por parte del la familia y el niño para que sea adecuadamente cumplido.
El cumplimiento incorrecto puede producirse por omitir alguna toma de una o varias medicaciones, no respetar el horario recomendado, disminuir o aumentar las dosis prescritas, no ajustarse a las recomendaciones en relación con las comidas o realizar abandonos periódicos.
En la infección por VIH se requiere un cumplimiento terapéutico superior al 95%85, para conseguir un adecuado y prolongado control de la replicación viral. En adultos se ha visto que el cumplimiento del TAR es con frecuencia incorrecto86. En niños se ha estudiado menos este problema87,88, si bien también se ha documentado que la mala adherencia es muy común, siendo la causa más frecuente de fracaso virológico en las series iniciales89.
En algunas series pediátricas el cumplimiento adecuado se aproxima al 80%88,90. En ensayos clínicos la adherencia suele ser mayor que en la práctica diaria que puede explicarse por la mayor preocupación de los padres o cuidadores sobre los niños y por el seguimiento individualizado que se realiza en este tipo de estudios90.
Existen diferentes métodos para controlar el cumplimiento, ninguno de ellos con una fiabilidad del 100%91, por lo que, para conseguir mayor exactitud es preferible utilizar varios92. Se puede medir el cumplimiento por métodos directos y/o indirectos, entre los que se incluyen la determinación de niveles del fármaco93, la entrevista estructurada o cuestionarios94,95, la monitorización electrónica96 y los registros de farmacia con recuento de la medicación96. La estimación del equipo asistencial puede tener un amplio margen de error, sobrestimándose el grado de adherencia87,95.
Factores relacionados con el cumplimiento terapéutico
Los factores relacionados con el cumplimiento dependen del tratamiento, la familia y el equipo sanitario que atiende al niño.
Algunos factores que hipotéticamente podrían dificultar el cumplimiento como número de tratamientos previos, antirretrovirales recibidos, IP en el tratamiento, frecuencia de las tomas de medicación, cantidad de tabletas/día y antecedente de efectos secundarios a antirretrovirales no se han correlacionado negativamente en algunas series pediátricas87. No obstante, la complejidad de la pauta de tratamiento, parece estar inversamente relacionada con el cumplimiento50. En los niños incluidos en PACTG 377 en el que se comparaban pautas de cuatro fármacos con tres, y esquemas de nelfinavir 2 o 3 veces al día, se observó una tendencia a mejor adherencia con pautas más simples de 2 veces al día y triple terapia97. En este estudio también se observó que el mal cumplimiento estaba asociado al mal sabor de algunos IP97.
En los niños, a diferencia de los adultos, un factor importante es la edad, pudiendo ser menor el cumplimiento en menores de un año por el rechazo o la dificultad en administrar la medicación, como se ha visto en la profilaxis de la infección diseminada por MAC, en niños infectados por el VIH98. En la adolescencia también puede haber dificultades con el cumplimiento del tratamiento, aun en niños buenos cumplidores previamente. Aunque es una población diferente a la nuestra, un estudio transversal reciente americano muestra que sólo el 28% de los adolescentes fueron completamente adherentes en el mes previo99. En la experiencia del hospital de La Paz no se han encontrado diferencias significativas con respecto a la edad probablemente por el escaso número de pacientes con menos de un año y mayores de 13, en los adolescentes analizados, el cumplimiento fue sólo del 50%88.
Estrategias para mejorar el cumplimiento
La evaluación de la adherencia debe formar parte de la rutina de seguimiento del niño infectado, y en ella debe colaborar todo el equipo multidisciplinario. Deben ponerse todos los medios y un equipo multidisciplinar (psicólogos, trabajadores sociales, farmacólogo, etc.) para ayudar a la familia y/o cuidadores a realizar de forma correcta el tratamiento pautado y asegurar un buen control de los pacientes. La familia y el niño, cuando sea posible, deberán participar en la decisión del tratamiento (cuándo y cómo), debido a que el seguimiento y cumplimiento del mismo determinan su eficacia.
Es necesario tener una información detallada de la dispensación y de la entrega de medicación, y los registros de farmacia deberían ser incluidos en la historia del paciente. Si es posible en casos seleccionados, se debería supervisar la toma de medicación con los miembros de la familia o grupos de apoyo social. En la tabla 13 se describen algunas posibles estrategias para mejorar el cumplimiento.
Efectos secundarios y alteraciones metabólicas
Efectos secundarios
El TAR puede producir en los niños las mismas alteraciones metabólicas descritas en los adultos: redistribución de la grasa corporal o síndrome de lipodistrofia, hiperlipemia, hiperglucemia, resistencia a la insulina, defecto de mineralización ósea, hiperlactatemia y acidosis láctica6,100-103. Es difícil atribuir a cada fármaco cada una de las implicaciones en las alteraciones metabólicas, pero podría resumirse de la siguiente manera104,105:
1.ITIAN: principales responsables de la atrofia grasa periférica y de la toxicidad mitocondrial.
2.ITINN: responsables del aumento de lípidos, sobre todo colesterol, aunque en menor grado que los IP.
3.IP: principales responsables de la hipertrofia grasa central, aumento de colesterol, LDL y triglicéridos, y de la resistencia periférica a la insulina.
4.IP + ITIAN: acción sinérgica en el desarrollo del síndrome de lipodistrofia27,28,106.
5.El TAR es un factor de riesgo asociado a la disminución de mineralización ósea6,107.
Otros factores que se han implicado en las alteraciones metabólicas no relacionados con el TAR son: el propio VIH, estadio clínico o inmunológico de la enfermedad, la edad del paciente y el estadio de maduración sexual, hipertrofia central previa e hiperinsulinismo secundario a déficit de hormona del crecimiento (GH)6,108.
Uno de los efectos más temibles a largo plazo, consecuencia de estas alteraciones metabólicas en los niños tratados con TAR, será el riesgo de padecer enfermedad cardiovascular en la edad adulta109.
Tratamiento de la lipodistrofia y las alteraciones metabólicas
1.Se debería escoger una combinación de bajo riesgo en cuanto al desarrollo de alteraciones metabólicas, al iniciar o cambiar el TAR. En este sentido se deberían tener en cuenta las siguientes consideraciones:
a)Los IP producen un mayor aumento de los lípidos que los ITINN y estos más que los ITIAN108.
b)Posiblemente nelfinavir sea el IP disponible en niños con menor efecto sobre los lípidos110.
c)Los ITINN y abacavir tienen un efecto sobre el colesterol no muy diferente.
d)Algunos ITIAN, como estavudina y posiblemente didanosina, se han asociado con lipoatrofia y toxicidad mitocondrial, y si existen otros ITIAN disponibles se debería evitar su asociación27,28,50.
e)En cuanto a la asociación de 2 ITIAN, se deben escoger los de menor riesgo para desarrollar complicaciones metabólicas108.
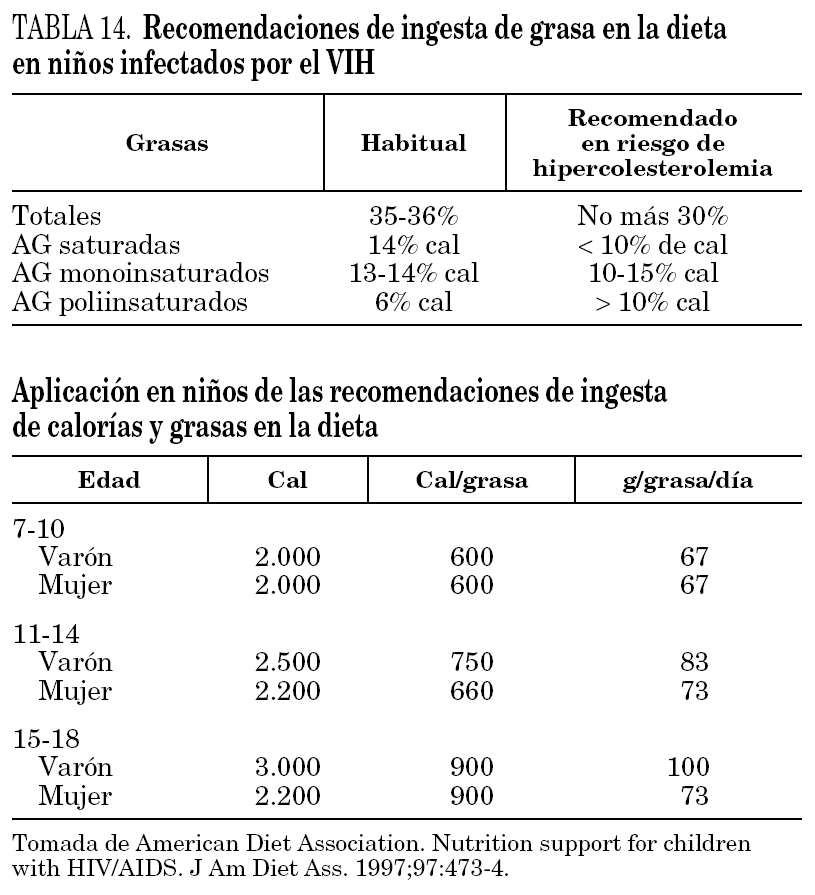
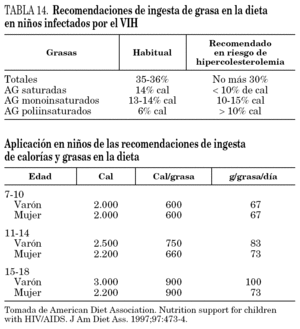
2.Se deben evitar factores de riesgo vascular como la obesidad con la elaboración de menús más saludables aumentando el consumo de alimentos pobres en colesterol y con un aporte de grasas en la dieta más racional111,112. En la tabla 14 se reflejan las necesidades calóricas y el aporte de grasa recomendado en niños, y cuando existe riesgo cardiovascular. Es importante evitar el sedentarismo fomentando el ejercicio físico controlado y diario, más un mínimo de 30 min de ejercicio vigoroso 3 veces a la semana. Son más recomendables ejercicios aeróbicos113. Asimismo, es necesario mantener un aporte adecuado de vitamina D y de calcio, que asegure una correcta mineralización ósea.
3.Cambio de TAR a un régimen que disminuya las alteraciones metabólicas. Cada una de las siguientes estrategias debe plantearse con suma cautela o bien basándose en datos con evidencia científica o en el contexto de ensayos clínicos. Entre las posibles medidas a seguir se incluye:
a)Cambio del IP por nevirapina o efavirenz, o cambio de IP por abacavir, como se describe en el apartado de simplificación.
b)Retirada de estavudina por su mayor riesgo de lipoatrofia y toxicidad mitocondrial, con sustitución por otros fármacos con menor toxicidad mitocondrial como abacavir114. En adultos con lipodistrofia moderada-grave, la sustitución de estavudina por abacavir se ha asociado con un aumento significativo de la grasa subcutánea medida por densitometría por rayos X (DEXA) de modo sostenido a los 2 años del cambio, a pesar de persistir los signos clínicos de lipodistrofia115. Estos datos sugieren que es posible revertir, al menos parcialmente, la pérdida de grasa subcutánea.
c)Sustitución por nuevos fármacos, que producen menos alteraciones lipídicas, como los IP: atazanavir y posiblemente tipranavir, así como el análogo de nucleótido tenofovir38,42,43,116.
d)Interrupción programada del TAR. En niños no recomendada, aunque puede plantearse en casos muy seleccionados, siendo la experiencia en pediatría muy escasa. En la actualidad hay un estudio europeo en curso, como PENTA 11, en el que se pretende valorar la seguridad de la retirada de la medicación a niños estables con carga viral indetectable, y el impacto en la evolución de las alteraciones metabólicas asociadas4. En adultos se ha documentado beneficio lipídico, aunque hay que sopesar el riesgo inmunológico/virológico asociado117. En adultos no existe evidencia de que la retirada de la medicación se acompañe de mejoría en los síndromes de redistribución grasa, al menos a corto plazo117.
e)Otras opciones terapéuticas, como el empleo de GH está en investigación, con resultados prometedores en adultos118.
Actitud frente a la acidosis láctica y toxicidad mitocondrial en niños
La acidosis láctica y toxicidad mitocondrial son poco frecuentes pero existen casos muy graves documentados en niños que obligan a retirar la medicación119,120. En la actualidad la tendencia es no hacer determinaciones de ácido láctico de rutina108. Si existe sospecha clínica o las transaminasas están elevadas, y se confirma un ácido láctico superior a 2 mmol/l, deberán realizarse determinaciones seriadas, y si persiste la sintomatología o el ácido láctico superior a 5 mmol/l se aconseja retirar los antirretrovirales, fundamentalmente los ITIAN. El cuadro suele revertir en 3 meses o más de la retirada de fármacos, y posteriormente puede reintroducirse el tratamiento, a ser posible sin ITIAN, sobre todo los de mayor potencial toxicidad mitocondrial108. En el momento agudo se han empleado vitaminas y coenzimas que han podido tener su utilidad, pero su uso no está estandarizado.
Actitud frente a las alteraciones óseas en niños
La osteonecrosis, fundamentalmente de cadera, se ha comunicado en adultos infectados por el VIH con una frecuencia más elevada que en la población general121, y en niños hay datos epidemiológicos que sugieren que también podría ser 9 veces más común que en la población general122. Al igual que en adultos, no hay datos que apoyen que el TAR sea un factor de riesgo independiente en el desarrollo de la necrosis avascular. En su patogenia más bien estarían implicados otros factores como lipodistrofia e hiperlipemia que el propio TAR108.
Por otro lado, tanto en adultos como niños existe una elevada prevalencia de osteopenia y osteoporosis123,124. Aunque la propia infección por el VIH puede tener un papel en la pérdida de masa ósea tanto en adultos125 como niños, existe una asociación entre la duración del TAR con la pérdida de mineralización ósea107. No existen guías ni normas de tratamiento para esta entidad. La administración de vitamina D y calcio no son suficientes para revertir la osteoporosis126, aunque algunos estudios en adultos demuestran que la asociación de calcio, vitamina D y bifosfonatos (alendronato y pamidronato) podrían ser útiles en algunos casos127. Otras posibilidades terapéuticas como la terapia con oxandrolona o GH no se han acompañado de la mejoría esperada, pero continúan en investigación108.
RECOMENDACIONES. La evidencia científica de la actitud a seguir ante la toxicidad del TAR es escasa no superando el nivel C.
Profilaxis postexposición
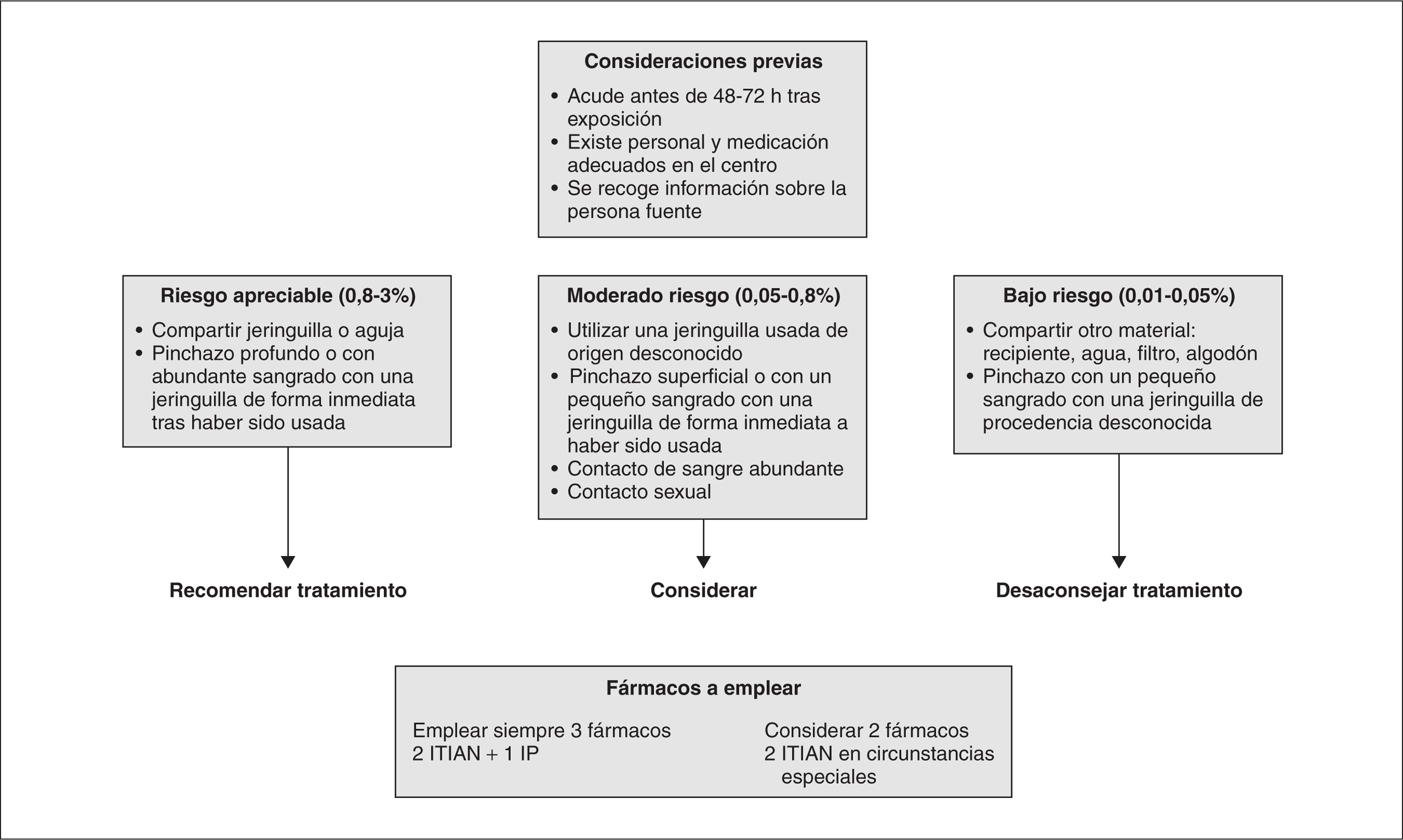
El pinchazo accidental con jeringa abandonada, supuestamente utilizada por un heroinómano es una situación que genera gran ansiedad en las familias. Las infecciones potencialmente transmisibles por esta vía incluyen el virus de la hepatitis B (VHB), hepatitis C (VHC), el VIH y el tétanos. Se calcula que en la población española usuaria de drogas por vía parenteral, la prevalencia de infección por VIH es del 50%, por VHB del 10% y por VHC del 70%128. Este apartado se limita a la actitud a tomar en relación con la infección VIH.
La infección por VIH tras abuso sexual en niños está bien documentada129, por lo cual en este apartado se describen los factores de riesgo asociados a esta situación y las posibilidades de profilaxis postexposición (PPE). Al igual que en el caso anterior las infecciones potencialmente transmisibles por esta vía incluyen otras infecciones de transmisión sexual, que no serán tratadas en este apartado.
Factores de riesgo de transmisión del VIH asociados al material contaminado
El riesgo de transmisión de VIH varía en función del fluido corporal con el que se tiene contacto, con el volumen del mismo y con la concentración de virus existente, directamente relacionado con la situación del enfermo VIH contagiante. El mayor riesgo de transmisión se establece con el contacto con sangre, seguido de semen y secreciones vaginales. El contacto con saliva, orina, heces y vómitos es muy poco probable que sea fuente de transmisión del VIH.
El VIH es lábil y al contacto con el aire pierde su capacidad infectiva. El mayor riesgo ocurre en las primeras 4 h del uso de la jeringa y hasta el 50% de su capacidad habrá desaparecido en 72 h en jeringas empleadas para extraer sangre de pacientes infectados por VIH130. No se han documentado casos de adquisición de infección por VIH por contactos con jeringas abandonadas (sí en contactos profesionales).
Con respecto a la transmisión sexual, las diferentes prácticas sexuales tienen distintos niveles de riesgo. El riesgo de infección en el contexto de un solo contacto sexual parece mayor en niños pequeños que en adultos y suponen también un alto riesgo para los adolescentes que podrían verse sometidos a encuentros repetidos131.
La transmisión de VIH por mordedura humana, aunque se ha descrito132, es muy poco probable, ya que la saliva inhibe la infectividad del VIH, que por otro lado se aísla raramente en este fluido131. No obstante, el riesgo es mayor si la saliva está contaminada con sangre.
Eficacia de la profilaxis postexposición
Modelos animales han demostrado que PPE es más efectiva dentro de las primeras 24-36 h del contagio y no tiene beneficios si se instaura pasadas 72 h del contacto133,134. La duración de la PPE que se ha mostrado más eficaz en animales es de 28 días135.
No existe evidencia de que la PPE evite la transmisión del VIH en contactos no ocupacionales. Por ello, hay que valorar cuidadosamente las indicaciones de PPE, ya que este tratamiento no está exento de efectos secundarios que pueden ser incluso letales, como se ha descrito con nevirapina en combinación136. Debe realizarse una cuidadosa evaluación de riesgos y beneficios en cada caso y discutirse con los padres antes de iniciarla, tomando una decisión conjunta.
Protocolo de actuación
La atención de urgencias de estos pacientes y el seguimiento posterior debe realizarse en un centro que disponga de personal preparado, de medios de laboratorio adecuados y que pueda dispensar tratamiento antirretroviral. La actitud terapéutica se basa fundamentalmente en las recomendaciones dadas por la American Academy of Pediatrics131, y por el Grupo de Consenso Español sobre Profilaxis Postexposición no ocupacional al VIH135.
Se debe hacer una valoración individual del riesgo de transmisión del VIH. Se han establecido tres niveles de riesgo, definidos por la vía o tipo de exposición, estado serológico de la fuente si es conocido, práctica de riesgo y factores de riesgo añadidos. Estos niveles se describen como riesgo apreciable, en cuyo caso la profilaxis está recomendada; moderado riesgo, donde la profilaxis se puede considerar y bajo riesgo, en cuyo caso la profilaxis se debe desaconsejar. En todos los casos se hará un seguimiento del paciente expuesto.
Se deben aplicar medidas locales, que incluyen lavado de la herida con agua y jabón y aplicar solución desinfectante y evitando soluciones irritantes. En la figura 1 se recoge un protocolo de actuación para prevención de la exposición por vía parenteral y por vía sexual, respectivamente.
Figura 1. Actitud a seguir tras exposición de riesgo de VIH.
Pautas recomendadas en la profilaxis postexposición al VIH
Siempre que se recomiende iniciar la PPE se deberán administrar las dosis diarias adecuadas, durante 4 semanas 2 ITIAN en caso de riesgo bajo o moderado y añadir 1 IP en caso de riesgo elevado. Es importante recordar que la profilaxis debe iniciarse idealmente a las 6 h del contacto y nunca después de las 72 h131. Uno de los ITIAN debería ser zidovudina puesto que es el único que ha demostrado su eficacia en un estudio de casos y controles137. La pauta más habitual es la combinación de zidovudina, lamivudina y nelfinavir. En caso de que exista evidencia de resistencia a zidovudina en la fuente, se podría optar por un ITIAN alternativo.
Seguimiento de los pacientes
En la primera visita en urgencias, se debe recabar, si existe, toda la información de la persona fuente. Es necesario realizar una analítica basal, que incluya perfil hepático, y a VIH, VHB y VHC. Es importante hacer una valoración del estado de vacunación de VHB y considerar la administración de gammaglobulina anti-VHB. En la exposición por vía parenteral, es necesario además confirmar el adecuado estado vacunal antitétanos, y vacunar si fuere necesario. En exposición por vía sexual además se debería realizar una adecuada evaluación de otras posibles enfermedades de transmisión sexual, y efectuar una consulta ginecológica, valorando la determinación de prueba de embarazo. En cualquier caso, se debe remitir a la unidad de seguimiento hospitalaria correspondiente. Se recomienda hacer controles periódicos en los 6 primeros meses de serología a VIH, VHB y VHC, así como analítica general en el primer mes en caso de haberse decidido realizar profilaxis con antirretrovirales. Debe valorarse el posible riesgo de embarazo y repetir la prueba.
Todas las exposiciones de riesgo de transmisión de VIH deben ser notificadas al servicio de medicina preventiva del centro. Sería deseable también notificarlo al registro europeo prospectivo de personas expuestas al VIH fuera del medio sanitario (proyecto 2000/SID/108 Comisión Europea DG SANCO F4) a través del GESIDA (Plan nacional sobre el Sida y Grupo de estudio de Sida).
RECOMENDACIONES. No hay ningún dato en el niño de la eficacia de la profilaxis postexposición y los datos disponibles proceden de adultos (nivel C).
Coinfección por VIH, VHC y VHB
La coinfección por VHC o VHB en el niño infectado por el VIH supone un problema añadido en cuanto al manejo de los pacientes. En niños, a diferencia del adulto, no existe experiencia en el tratamiento de las coinfecciones, sin embargo el aumento de la supervivencia con el TAR hace que nos planteemos esta posibilidad.
Coinfección por VIH y VHC
La tasa de transmisión vertical del VHC en madres coinfectadas por VIH/VHC se sitúa entre el 10 y el 14% frente al 2-6% en caso de madres monoinfectadas por el VHC. La transmisión vertical del VHC, no se modifica al realizar la profilaxis para el VIH y no hay evidencia del papel protector de la cesárea u otras intervenciones obstétricas. Actualmente no existe ninguna actitud preventiva conocida para disminuir la transmisión vertical del VHC138,139.
Los escasos estudios de infección por VHC en población infantil, demuestran que la fibrosis progresa con el tiempo transcurrido desde la primoinfección, con una mediana de desarrollar cirrosis de 28 años140. Durante la infancia parece existir un período de inmunotolerancia para el VHC y a partir de la adolescencia comienza un período de mayor agresividad hepática.
En el niño coinfectado por el VIH/VHC no hay estudios de historia natural, aunque cabe pensar que, como en el adulto, la toxicidad del TAR y el propio VIH interfieran en el curso natural de la infección VHC141. El objetivo del tratamiento del VHC es obtener una respuesta virológica sostenida que prevenga el daño hepático, evitando la cirrosis y en último término el hepatocarcinoma. En adultos monoinfectados por el VHC la combinación de ribavirina con interferón pegilado alfa-2a (IFNα2a-PEG), consigue una respuesta mantenida del 41-42% para el genotipo 1 y de hasta el 76-80% para los genotipos 2 y 3142,143. En adultos coinfectados por VIH/VHC la tasa de respuesta virológica sostenida es tan sólo del 25-29% en genotipos 1 y 4 y del 40-60% en genotipos 2 y 3144,145.
Experiencia de tratamiento de la infección por VHC en pediatría
En un estudio español, realizado en el Hospital Infantil La Paz, en 26 niños monoinfectados por VHC, con IFNα2a-PEG (1 μg/kg/semana) asociado a rivabirina (15 μg/kg/día), se demuestra una respuesta viral sostenida en el 70% para el genotipo 1 y en el 100% para el genotipo 3. Los efectos secundarios fueron frecuentes: fiebre, alucinaciones, anemia, neutropenia y alteración de hormonas tiroideas146. No existen estudios de tratamiento en niños coinfectados con VIH y VHC.
Seguimiento de niños coinfectados por VIH y VHC
No está indicado interrumpir o retrasar el TAR por la coinfección VIH/VHC. Se debe evitar el uso de nevirapina y estavudina, que son hepatotóxicos y debe inmunizarse frente al VHA. Es necesario cuantificar la viremia por VHC y monitorizar la función hepática. Se considerará la indicación de biopsia hepática en casos graves, e incluso podría valorarse un tratamiento por uso compasivo con IFN-PEG y ribavirina. En esta situación es conveniente determinar el genotipo del VHC y la carga viral basal, ya que ambos son predictores de la respuesta al tratamiento combinado. En la actualidad no hay evidencia para contraindicar ningún antirretroviral en niños coinfectados, pero si existe hepatotoxicidad grave, se debería suspender el TAR y priorizar un tratamiento alternativo con menor toxicidad hepática.
Coinfección por VIH y VHB
Actualmente los casos pediátricos de coinfección VIH y VHB son secundarios a embarazos no controlados, en los que no se realizó profilaxis frente a la transmisión vertical del VHB con gammaglobulina y vacuna. Esta situación es más común en población inmigrante. La carga viral del VHB es más elevada en sujetos coinfectados con VIH, aunque el VIH no parece acelerar el daño histológico del VHB. Tampoco la infección crónica por VHB parece modificar el curso de la infección por VIH147.
El TAR puede repercutir sobre la infección por VHB, y puede ser hepatotóxico; pero también el TAR al inducir una reconstitución inmunitaria puede ser beneficioso para la infección por VHB y producir un aclaración del ADN de este148. Si coexisten infecciones por VHB y VHC, la infección por VHC parece ser la predominante.
Los objetivos del tratamiento del VHB son erradicar la infección, previniendo la cirrosis y el hepatocarcinoma147. Tanto IFNα2b como lamivudina se han mostrado eficaces en el tratamiento de la monoinfección por VHB. Hay al menos 5 fármacos antirretrovirales con actividad frente al VHB: lamivudina, emtricitabina famciclovir, adefovir y tenofovir150,151, pudiendo estos últimos ser activos incluso frente a cepas resistentes a lamivudina o emtricitabina149. Cuando está indicado el TAR en un paciente pediátrico coinfectado por VIH/VHB, debería considerarse el uso prioritario de lamivudina y emtricitabina y/o tenofovir en la combinación seleccionada.
RECOMENDACIONES. No hay datos en niños infectados por VIH de la evolución ni de la eficacia del tratamiento en las coinfecciones con VHC y VHB. No está indicado interrumpir o retrasar el TAR por la coinfección VIH/VHC. Este comité no puede realizar, por el momento, ninguna recomendación terapéutica específica (nivel C).
Perspectivas
Nuevas perspectivas con dianas actuales
El conjunto de fármacos disponible actualmente así como las preparaciones en solución, ha aumentado de manera considerable. Asimismo, se está investigando utilizar fármacos ya aprobados con mejoría en la aplicación de sus propiedades farmacocinéticas y menor toxicidad, como lamivudina y abacavir en dosis única diaria, como ya está aprobado en adultos23, o estavudina a dosis más bajas. Cuando se disponga de más información es posible que se puedan combinar fármacos una vez al día, lo cual sería importante para el cumplimiento y calidad de vida del niño. En este sentido, efavirenz, didanosina, emtricitabina y tenofovir pueden administrarse una vez al día, y probablemente en niños sin tratamiento antirretroviral previo, también lamivudina y nevirapina, o abacavir. Hay estudios en curso con otros fármacos como los nuevos IP, atazanavir y fosamprenavir151, ambos potenciados con una pequeña dosis de ritonavir, que podrían utilizarse una vez al día, aunque fosamprenavir podría requerir una pauta de 2 veces al día en niños. Existe una gran variedad de fármacos en desarrollo con muy buenas perspectivas y resultados preliminares esperanzadores en cuanto a actividad frente a cepas de VIH multirresistentes a IP, como tipranavir. En el ensayo inicial de adultos, el número de mutaciones en el gen de la proteasa no influyó en la buena respuesta al tipranavir/ritonavir. Tras más de un año de tratamiento, únicamente el 12% de los pacientes presentaban una reducción en la susceptibilidad a tipranavir (cambios de entre 4 y 10 veces la IC50)152. En España, en niños, se está utilizando dentro de un ensayo clínico internacional en fase II. Entre los nuevos ITINN, el más desarrollado es el TMC 125. Posee una gran potencia y excelente actividad frente a virus con las mutaciones Y181C y K103N, y los primeros datos en adultos pretratados con ITINN son prometedores. En un pequeño estudio en fase II en pacientes que habían fracasado a regímenes que contuviesen efavirenz o nevirapina tras 7 días de terapia se observó una disminución media de la carga viral en torno a 1 log10 copias/ml153.
Nuevas dianas, nuevos tratamientos
Existe un conocimiento limitado de los mecanismos de protección de los individuos frente a la adquisición de la infección, así como de los mecanismos y medidas más adecuadas para el control virológico y el deterioro inmunitario. Además, aun no se han conseguido ni anticuerpos neutralizantes adecuados tras la vacunación, ni una respuesta celular efectiva, y mucho menos, eliminar el virus de los santuarios que lo protegen y perpetúan la infección. Esto significa continuar investigando en diferentes campos como la respuesta inmunitaria y factores genéticos que pueden condicionar la misma, factores virales que influyen en la evolución de la enfermedad, exploración más profunda para la neutralización del virus (vacunas y otros mecanismos de estimulación inmunitaria), y en último caso la posible erradicación de los diferentes reservorios. Existen ensayos en fase muy preliminar en adultos, no existiendo información específica en niños.
Inhibidores de integrasa. La integrasa es una enzima del VIH que integra la cadena doble de ADN del virus en el ADN cromosómico de la célula huésped. El compuesto más desarrollado es el S-1360, con buena biodisponibilidad oral, y es sinérgico in vitro con los inhibidores de la retrotranscriptasa y los IP. En estudios en animales presenta un excelente perfil de seguridad. Al igual que los ITINN poseen gran labilidad genética, y una única mutación en el gen de la integrasa confiere resistencia de alto nivel154.
Inhibidor de CCR5. Existen varios productos en investigación, entre los que destacan SCH-D, GW873140 o UK-427857, de administración oral. Los mayores problemas son su potencial toxicidad y la posibilidad de desarrollo de poblaciones de VIH X4. Estas poblaciones parecen desaparecer tras el cese del tratamiento, pero ello produce un cierto escepticismo sobre la aplicación de esta clase de antirretrovirales.
Inhibidor de CXCR4. Antirretrovirales aun poco desarrollados, cuya aplicación más interesante sería su combinación con un inhibidor del CCR5, lo que ya se está ensayando.
Inhibidor de la unión del receptor CD4. A pesar de los malos resultados de este tipo de antirretrovirales en el pasado existen datos prometedores con nuevos componentes de esta clase de fármacos. Los mayores inconvenientes son la necesidad de administración intravenosa y el desarrollo de resistencias durante el tratamiento.
Inhibidores de la transcripción. Sustancias capaces de inhibir la replicación del virus por medio de la inhibición de la transactivación del promotor del VIH, LTR, a través de la inhibición de Tat. De momento todos los estudios son preclínicos154.
Inhibidores de la maduración. Según se produzcan fracasos terapéuticos frente a otras clases de fármacos, estos nuevos compuestos, usados probablemente en combinación, podrían ser una herramienta terapéutica importante.
Posibles estrategias frente a células latentes infectadas. A pesar de los avances con el TAR disponible en la actualidad los individuos que adquieren la enfermedad permanecen crónicamente infectados. Una vez que el ADN viral se integra en el cromosoma celular, permanece latente en ella. Esta latencia podría tener diferente grados ya que se ha visto que las células latentes infectadas de pacientes virémicos producen virus de forma espontánea mientras que de los avirémicos no155.
Numerosos estudios han demostrado que los individuos en tratamiento con TAR y carga viral indetectable presentan una frecuencia de células infectadas menor de 1/106 de células T CD4+ latentes57,156, en su mayoría linfocitos CD4+ CD45RO+ de memoria, pero que esta frecuencia no disminuye a pesar de permanecer años con carga viral indetectable. Se han ensayado varios tratamientos en un intento de eliminar este tipo de células157,158, pero hasta ahora ninguno ha sido muy eficaz.
Vacunas
El desarrollo de una vacuna eficaz contra el VIH es una de las grandes asignaturas pendientes de la investigación sobre el sida159. Existen dos estrategias vacunales: la vacunación preventiva, cuyo objetivo es evitar la infección en pacientes expuestos, y la vacunación terapéutica, que intenta en los pacientes ya infectados potenciar la respuesta inmunitaria frente al VIH con el fin de que esta respuesta controle su replicación. En la actualidad ninguna de las dos estrategias ha demostrado eficacia significativa en los distintos ensayos clínicos realizados. Sin embargo, hay múltiples proyectos en marcha.
Vacunas preventivas
Algunos ensayos con vacunas elaboradas con proteínas de la envoltura (gp 120)160 o vectores vivos recombinantes, cuyos modelos más desarrollados son los que utilizan poxvirus como el canarypox (vacuna ALVAC)161, se encuentran ya en desarrollo en ensayos en fase I-II en niños expuestos, habiéndose documentado que son vacunas seguras y bien toleradas, aunque la respuesta inmunitaria específica es modesta.
Vacunas terapéuticas
La generalización del TAR ha abierto nuevas posibilidades a estas vacunas ya que en un contexto de supresión virológica y reconstitución inmunitaria su empleo podría potenciar la respuesta específica frente al VIH. En niños el ensayo PACTG 1033 es un estudio en fase I-II que evalúa la seguridad e inmunogenicidad de vacunas con vectores de poxvirus vivos atenuados recombinantes, en niños con máxima supresión de la carga viral tras el TAR iniciado precozmente. Los vectores utilizados son MVA (Modified Ankara Vaccinia virus) y fowlpox, que resultan seguros, ya que son incapaces de replicar en células humanas. El ensayo consiste en una terapia secuencial con dos dosis de la vacuna con el primer vector basalmente y al mes, seguido de recuerdo a los 2 y 6 meses de la vacuna con el segundo vector. Estos vectores vivos recombinantes expresan diversos genes del virus como env, gag, tat y nef de cepas aisladas de niños infectados, y los primeros datos sugieren que son seguros, aunque también la respuesta inmunitaria específica desarrollada es escasa. La estrategia de emplear varios vectores presenta la ventaja teórica de una mayor eficiencia en la liberación de los genes recombinados, y a su vez permite disminuir la respuesta inmunitaria hacia el vector162.
El futuro en países en desarrollo
En los países en desarrollo la situación es muy diferente a la del mundo occidental: muchos gobiernos todavía no reconocen la gravedad de la situación por lo que la propia población desconoce la extensión de la epidemia. Es fundamental que se extiendan los programas de tratamiento, utilizando los tratamientos más eficaces pero teniendo siempre en cuenta su simplicidad y bajo coste163. Los países desarrollados también podemos colaborar, a través de la Organización Mundial de la Salud (OMS) en los distintos programas existentes, y también directamente facilitando la utilización de antirretrovirales genéricos, de un precio mucho más bajo. El proyecto ESTHER (Red de solidaridad hospitalaria contra el sida) es una reciente iniciativa de algunos países europeos para favorecer en los países en desarrollo la formación técnica en el manejo integral del paciente con VIH/sida y el apoyo en el suministro de equipamiento de material de laboratorio para el diagnóstico de la infección164. Toda colaboración y apoyo es fundamental para tratar de frenar la pandemia que afecta de manera tan brutal a algunos de los países más pobres del mundo.
Coste del tratamiento antirretroviral en el niño
Los costes socioeconómicos de la infección por el VIH están comprometiendo la capacidad de las economías en desarrollo para sostener los avances conseguidos, lo cual tiene enormes repercusiones sobre los niños. Desafortunadamente, la magnitud del problema sigue sin documentarse con precisión, ya que existe un vacío evidente en los datos acerca de la incidencia de la infección en niños en el momento que pasan a la adolescencia, entre los 14-18 años, el coste de los recursos que se están utilizando y los presupuestos disponibles.
La incorporación del TAR en la infección pediátrica por el VIH ha supuesto un drástico cambio, no sólo en la historia natural y evolución de los niños infectados, sino que también ha representado un importantísimo avance en la prevención de la transmisión vertical y la consiguiente disminución del número de nuevos niños infectados. Por desgracia, muchos de los tratamientos eficaces, por problemas socioeconómicos, no están disponibles para la mayoría de los niños afectados.
La realización adecuada del tratamiento integral de la infección pediátrica por el VIH supone un alto coste económico, sin duda menor a los costes provocados por la enfermedad en evolución natural, si sumamos a los costes de los tratamientos, el de las infecciones oportunistas, los ingresos hospitalarios, los potenciales años de vida laboral perdidos o los costes laborales familiares de todas estas complicaciones. Algunos estudios hospitalarios en pacientes adultos realizados en Francia han estimado que el TAR ha supuesto un ahorro de unos 110 1 paciente/mes en gasto hospitalario global165.
Aunque el TAR ha aumentado el peso proporcional del gasto en antirretrovirales, también ha generado una marcada reducción del coste global de los cuidados médicos en los pacientes con infección por el VIH y se ha visto sobradamente compensado por la disminución de la morbimortalidad, como lo han demostrado estudios que utilizan como medida de beneficio clínico el año de vida ajustado por calidad (AVAC), que combina la esperanza de vida, o cantidad de vida y la calidad de vida del paciente.
Se ha estimado que el coste del TAR en países de nuestro entorno oscila entre 10.000 y 28.000 1 por AVAC. El TAR es más coste-efectivo que otros tratamientos como la radioterapia en el cáncer de mama, el tratamiento de la hipercolesterolemia o la diálisis peritoneal en pacientes con una esperanza de vida inferior a 6 meses.
El coste medio estimado en fármacos antirretrovirales en adultos en el año 2004 es de 8.200 1/año y en niños de 6.000 1/año, aunque este coste debería tener un factor de ajuste en función del aumento de la vida media de los niños. En un Hospital de Madrid el coste en antirretrovirales en el año 2003 fue de 6.400 1 por paciente.
En la actualidad están autorizados en nuestro país 19 fármacos antirretrovirales, algunos de ellos sin indicación pediátrica, pero existen muchas posibilidades de combinaciones para tratar a los niños infectados por el VIH, lo que hace más complejo el cálculo de los costes económicos de los antirretrovirales.
En un intento de encontrar un parámetro útil para conocer el precio del tratamiento antirretroviral en niños, que en cada revisión clínica se ajusta de acuerdo al peso o la superficie corporal y que va cambiado continuamente, se ha calculado el precio de la dosis por kilogramo y día de cada fármaco (tabla 15), según el Precio Venta del Laboratorio en el año 2004. De esta forma para saber el precio del tratamiento de un niño bastaría con sumar el precio de cada fármaco de la combinación prescrita y multiplicarlo por el peso o la superficie corporal de ese niño165.
En general, el TAR es eficiente porque aporta un importante beneficio terapéutico a un coste razonable166. Aunque la prioridad es tratar de forma individualizada de acuerdo con los datos de eficacia, toxicidad, cumplimiento, tolerancia, etc., es aconsejable considerar el aspecto económico ante dos alternativas con las mismas ventajas.
Agradecimientos
Por su contribución en la elaboración y revisión de estas guías, queremos expresar nuestro agradecimiento a los Dres. Ángel Alejo García-Mauricio del Hospital Virgen Macarena, Sevilla; Juan Antonio León Leal del Hospital Virgen del Rocío, Sevilla; Antoni Noguera Julián del Hospital San Joan de Déu, Barcelona, al Dr. Pere Soler del Hospital Vall d'Hebron de Barcelona, y a la Dra. Juncal Echevarría del Hospital Nuestra Señora de Aránzazu, San Sebastián. Asimismo agradecemos la colaboración prestada al Profesor Alfonso Delgado, presidente de la AEP, y a la Dra. Teresa Hernández-Sampelayo, presidente de la SEIP.
Este documento está avalado por el Consejo Asesor de la Secretaría del PNS.