La información que proporciona el antibiograma tiene una gran repercusión clínica y epidemiológica. Es una herramienta de gran importancia en las estrategias organizativas de apoyo a la mejor utilización de antibióticos (antibiotic stewardship).
La selección de los antimicrobianos más apropiados para informar es una decisión que debe tomar cada laboratorio clínico, previa consulta con los especialistas más implicados en el manejo de las enfermedades infecciosas. Debe prevalecer el interés clínico de los mismos.
Los antibióticos informados deben tener demostrada eficacia clínica. También hay que valorar la prevalencia de resistencia en el hospital y el área extrahospitalaria, el coste, las indicaciones clínicas aprobadas de uso por las agencias, y las recomendaciones más actualizadas de consenso sobre primera elección y alternativas.
El informe selectivo consiste en que algunos antibióticos solo se informan en circunstancias determinadas (selectivamente), que cada laboratorio debería protocolizar teniendo en cuenta las condiciones de su medio.
A veces es necesario adaptar la información al microorganismo y al lugar de la infección. En algunos casos sería conveniente incluir comentarios/observaciones adicionales a los resultados que ayuden al clínico a realizar la mejor elección.
Se hace una propuesta general de antibióticos a informar para nuestro país que debe adaptarse a cada situación particular.
The information provided in the individual susceptibility reports (antibiograms) is clinically and epidemiologically relevant, and is an important tool for antibiotic stewardship. The selection of the most appropriate antimicrobial agents to be included in the reports should be decided by each Clinical Microbiology laboratory after consulting with the departments most involved in the clinical management of infectious diseases. The clinical interest of the drugs should be the most important variable to consider; thus, reported antibiotics should have demonstrated clinical efficacy. Other variables to consider are local prevalence (in the hospital, areas of the hospital), the cost, the approved indications, and the most recent clinical guidelines regarding the drugs of choice and alternative agents. Certain antibiotics may only be reported in specific circumstances (selective reporting), which should be decided by each laboratory according to their local circumstances. It may be necessary to adapt the information provided according to the microorganism and suspected location of the infection. In some cases, it is convenient to include additional written comments or observations with the aim of helping clinicians to choose. In this review we include a proposal for our country that should be adapted to local situations.
La información que proporciona el antibiograma tiene una gran repercusión clínica y epidemiológica ya que, por una parte, condiciona y guía la elección del tratamiento antimicrobiano ante un proceso de naturaleza infecciosa1,2, y por otra puede utilizarse como estrategia para evitar el uso de determinados antimicrobianos de espectro excesivamente amplio en determinados casos o favorecer el uso de otros con un adecuado perfil de actividad e impacto ecológico3–5. Por tanto, es una herramienta de gran importancia en las estrategias organizativas de apoyo a la mejor utilización de antibióticos (antibiotic stewardship).
De hecho, el paradigma actual de manejo de las infecciones graves incluye el uso empírico de antimicrobianos de amplio espectro, necesarios para cubrir adecuadamente patógenos resistentes que, de no ser cubiertos, conducirían a un peor pronóstico, seguido de la reevaluación y modificación del tratamiento una vez que se dispone de los datos de sensibilidad, en el sentido de reducir el espectro y utilizar antimicrobianos eficaces de menor impacto ecológico («desescalamiento»)6. Así, las revisiones y recomendaciones para las estrategias de mejora en el uso de antibióticos incluyen frecuentemente aspectos relacionados con la información incluida en el antibiograma3–6 (tabla 1), si bien es cierto que no hemos encontrado estudios que evalúen de manera específica el impacto de estos aspectos.
Aspectos relacionados con el antibiograma en guías y documentos de consenso de sociedades científicas
| Referencia | Aspectos relacionados con el antibiograma |
| 3 | El laboratorio de Microbiología juega un papel crítico en la política de antibióticos mediante la provisión de los resultados del cultivo y sensibilidad de cada paciente, que permiten optimizar el uso individual de antimicrobianos (A-III). |
| Desescalamiento del tratamiento en base a los resultados de los cultivos y la eliminación de las combinaciones redundantes (A-II). | |
| 4 | Debe realizarse un antibiograma interpretado para anticipar mecanismos de resistencia difíciles de detectar y evitar fracasos terapéuticos (recomendación de «alta prioridad»). |
| Los agentes de primera línea deben listarse los primeros en los resultados de sensibilidad; debe limitarse el número de antimicrobianos informados (se sugiere un número de 6) (recomendaciones «deseables»). | |
| 5 | Evitar proporcionar de manera habitual datos de sensibilidad a antimicrobianos no incluidos en el formulario del hospital o restringidos. |
En el antibiograma se puede decidir qué antibióticos se informan y qué información se proporciona de cada antimicrobiano estudiado. La información se traduce en categorías clínicas (sensible, resistente u otras), cuyo objetivo ideal es predecir la eficacia clínica7–12. Sin embargo, es necesario recordar que la eficacia clínica relacionada con el antimicrobiano utilizado dependerá además de otras variables, como la utilización de una dosificación adecuada que permita alcanzar el parámetro farmacocinético-farmacodinámico (FC/FD) predictor de eficacia7 y, en cualquier caso, de la concentración que es capaz de alcanzar en el lugar de la infección, de la presencia de biopelícula, etc. Los importantes avances en la información de los parámetros FC/FD que predicen eficacia, y su aplicación a la determinación de los puntos de corte de sensibilidad/resistencia y a la dosificación de antimicrobianos13–15 hace aconsejable que al menos para determinados microorganismos, valores concretos de concentración inhibitoria mínima (CIM) y localizaciones específicas de infección, se proporcione el valor de la CIM. Por ejemplo, en los últimos años se ha puesto de manifiesto la importancia de la CIM de vancomicina en cepas de Staphylococcus aureus resistente a meticilina en bacteriemias o neumonías16,17. Este tema es motivo de controversia, dado que la interpretación del valor de CIM puede ser difícil para clínicos no expertos y llevar a confusión en su interpretación, pero por otro lado es una información de un extraordinario interés para modular la dosificación de antimicrobianos y/o la forma de administrarlos en situaciones complejas16–19.
Lectura interpretada del antibiograma (véase otro artículo de esta misma serie en el que se desarrolla este aspecto en profundidad).
La resistencia a antibióticos relacionados entre sí depende con frecuencia de un solo mecanismo, que puede detectarse usando varios antibióticos. Sin embargo, no todos los antibióticos usados para la detección deben ser informados. La lectura interpretada del antibiograma consiste en inferir, a partir de los fenotipos obtenidos, los mecanismos de resistencia presentes en la bacteria estudiada y modificar, en su caso, las categorías clínicas que se deriven de estos mecanismos de resistencia20–22. Un ejemplo característico es la detección del gen mecA o la resistencia a oxacilina o cefoxitina en estafilococos, que hace que se informen como resistentes a todos los beta-lactámicos (excepto ceftobiprol y ceftarolina), independientemente de su CIM9.
La complejidad de los pacientes y de sus necesidades terapéuticas, así como también de los fenotipos de resistencia bacteriana encontrados en muchas de las ocasiones, hace preciso que se ensayen cada vez más antibióticos para atender a la realidad de los pacientes y para realizar una inferencia adecuada de los mecanismos de resistencia bacteriana implicados. Lógicamente, la identificación del microorganismo es necesaria para realizar la lectura interpretada del antibiograma y la inferencia de los mecanismos de resistencia20–22.
¿Qué antibióticos informar? ¿Cómo informarlos?La selección de los antimicrobianos más apropiados para informar es una decisión que debe tomar cada laboratorio clínico consultando con los especialistas más implicados en el manejo clínico de las enfermedades infecciosas y con el servicio de Farmacia, así como con los comités de Farmacia y de Infecciones (en el caso de hospitales). En atención primaria se debe tener en cuenta el «Documento de consenso sobre la utilización de antibióticos en atención primaria» publicado recientemente23. En ambos casos debe prevalecer el interés clínico de los mismos.
Una variable que debe influir decisivamente en los antimicrobianos a informar es la disponibilidad. Así, no parece razonable informar aquéllos no comercializados en atención primaria o no aprobados en el hospital, salvo en situaciones excepcionales. Por ejemplo, en hospitales donde en el grupo de los carbapenems solo esté aprobado meropenem, debe informarse este y no imipenem. Una posible excepción sería la oxacilina, que se suele informar pero no está comercializada en España, siendo bien conocido el hecho de que el antibiótico comercializado de la familia es cloxacilina.
Los antibióticos informados deben tener demostrada eficacia clínica (no así necesariamente los probados). También hay que valorar la prevalencia de resistencia en el hospital y el área extrahospitalaria, el coste, las indicaciones clínicas aprobadas de uso por las agencias (EMEA, Agencia Española del Medicamento), y las recomendaciones más actualizadas de consenso sobre primera elección y alternativas.
Un aspecto controvertido es si deben informarse antimicrobianos de amplio espectro en el caso de microorganismos sensibles a antimicrobianos eficaces de espectro reducido. Por ejemplo, ¿debe informarse la sensibilidad a carbapenems en una cepa de Escherichia coli sensible a ampicilina, o la sensibilidad a linezolid o daptomicina en una cepa de S. aureus sensible a cloxacilina? En general, parece razonable informar al menos los antimicrobianos de primera elección para el microorganismo y el tipo de muestra, y las potenciales alternativas en caso de alergia, etc. Sin embargo, para determinados microorganismos, la decisión es mucho más compleja por diferentes motivos. Así, en algunos casos el microorganismos aislado es en realidad parte de una flora polimicrobiana, como ocurre a veces con los episodios de bacteriemia por una enterobacteria en pacientes con infecciones intraabdominales o de tejidos blandos polimicrobianas. Además, ocasionalmente pueden ocurrir 2 infecciones de manera concomitante en un paciente, o bien una infección ocurre mientras se está tratando otra, y puede ser útil conocer la actividad de otros antimicrobianos que puedan permitir la simplificación del tratamiento.
El informe selectivo consiste en que algunos antibióticos solo se informan en circunstancias determinadas (selectivamente), que cada laboratorio debería protocolizar teniendo en cuenta las condiciones de su medio. De esa manera no se informa habitualmente un elevado número de compuestos. Los antibióticos «selectivos» solo se informarían cuando el aislado fuese resistente a alguno o algunos de los de primera elección o alternativos, o por la muestra clínica de donde se aisló la bacteria (por ejemplo, cefalosporinas de tercera generación en líquido cefalorraquídeo), o en infecciones polimicrobianas, o en infecciones en varias localizaciones por un mismo microorganismo, o en caso de alergia o intolerancias del paciente. Hay antibióticos que solo se informarían en caso de que hubiese endemismos multirresistentes (por ejemplo, colistina en Acinetobacter baumannii multirresistente), alergias múltiples o para tratamiento de organismos/localizaciones raros (por ejemplo, cloranfenicol en Salmonella extraintestinal). Ciertos antibióticos solo se informarían en aislados de orina (por ejemplo, nitrofurantoína). Los resultados no informados deben estar disponibles si hay una petición motivada del clínico.
Las resistencias inesperadas, por ejemplo de E. coli a un carbapanem o de S. aureus a vancomicina, siempre deben ser informadas. En el caso de antibióticos propensos a seleccionar resistencia (por ejemplo, rifampicina o fluoroquinolonas en estafilococos, clindamicina en estafilococos y estreptococos resistentes a eritromicina, cefoxitina en enterobacterias productoras de BLEE), puede ser conveniente no informarlos5 o informarlos con una nota que recuerde al clínico ese riesgo. El riesgo es modulado por el lugar de la infección, aumenta en sitios donde es difícil obtener altos niveles del antibiótico y se reduce en los sitios donde se concentra, y por el inóculo bacteriano.
Entre las fluorquinolonas conviene informar las más activas: ciprofloxacino en enterobacterias y moxifloxacino y levofloxacino en Streptococcus pneumoniae, aunque se hayan usado otros antibióticos para detectar la resistencia (por ejemplo, norfloxacino y ciprofloxacino en neumococo).
A veces es necesario adaptar la información al microorganismo y al lugar de la infección. Por ejemplo, en Salmonella no deben informarse aminoglucósidos ni cefalosporinas de primera y segunda generación, y solo en aislados extraintestinales alguna de tercera generación. Sin embargo, en aislados de heces sí sería necesario informar cotrimoxazol, del que habitualmente puede prescindirse en el resto de enterobacterias.
En algunos casos sería conveniente incluir comentarios/observaciones adicionales a los resultados que ayuden al clínico a realizar la mejor elección. Por ejemplo, en estafilococos resistentes a la oxacilina (determinado por oxacilina o cefoxitina) debe informarse que son resistentes a todos los antibióticos beta-lactámicos (en el futuro habría que excluir al ceftobiprol y ceftarolina)24. En especies de Enterobacter y de Serratia y en Citrobacter freundii y Morganella morganii sensibles a cefalosporinas de tercera generación (cefotaxima, ceftriaxona y otras) advertir que su uso en monoterapia tiene un riesgo importante de seleccionar resistencia25,26. En neumococo sensible a levofloxacino y/o moxifloxacino pero resistente a ciprofloxacino, se debe informar de la posibilidad de aparición de resistencia durante el tratamiento con fluoroquinolonas27–29.
Con todo lo expuesto anteriormente y tomando como base documentos recientes9,11,30 y nuestra propia experiencia, hacemos una propuesta general para nuestro país (tablas 2–8), que debe adaptarse a cada situación particular.
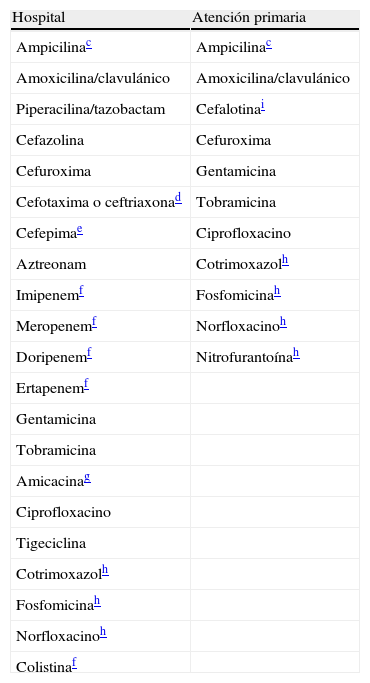
Antibióticos a informar en enterobacteriasa,b
| Hospital | Atención primaria |
| Ampicilinac | Ampicilinac |
| Amoxicilina/clavulánico | Amoxicilina/clavulánico |
| Piperacilina/tazobactam | Cefalotinai |
| Cefazolina | Cefuroxima |
| Cefuroxima | Gentamicina |
| Cefotaxima o ceftriaxonad | Tobramicina |
| Cefepimae | Ciprofloxacino |
| Aztreonam | Cotrimoxazolh |
| Imipenemf | Fosfomicinah |
| Meropenemf | Norfloxacinoh |
| Doripenemf | Nitrofurantoínah |
| Ertapenemf | |
| Gentamicina | |
| Tobramicina | |
| Amicacinag | |
| Ciprofloxacino | |
| Tigeciclina | |
| Cotrimoxazolh | |
| Fosfomicinah | |
| Norfloxacinoh | |
| Colistinaf |
Atención primaria: incluye consultas externas del hospital.
En Salmonella y Shigella asisladas de heces informar solo ampicilina, cotrimoxazol y ciprofloxacino. En el caso de aislamiento extraintestinal de Salmonella informar también cefotaxima o ceftriaxona. En Yersinia enterocolitica aislada de heces informar ciprofloxacino y cotrimoxazol.
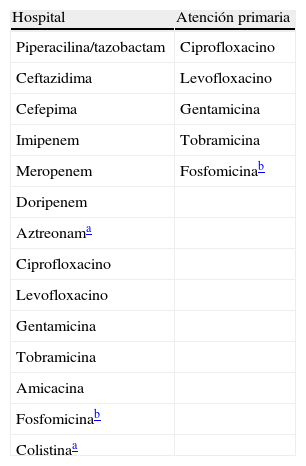
Antibióticos a informar en Pseudomonas aeruginosa.
| Hospital | Atención primaria |
| Piperacilina/tazobactam | Ciprofloxacino |
| Ceftazidima | Levofloxacino |
| Cefepima | Gentamicina |
| Imipenem | Tobramicina |
| Meropenem | Fosfomicinab |
| Doripenem | |
| Aztreonama | |
| Ciprofloxacino | |
| Levofloxacino | |
| Gentamicina | |
| Tobramicina | |
| Amicacina | |
| Fosfomicinab | |
| Colistinaa |
Atención primaria: incluye consultas externas del hospital.
Antibióticos a informar en especies de Acinetobacter
| Hospital | Atención primaria |
| Piperacilina/tazobactam | Ciprofloxacino |
| Ceftazidima | Levofloxacino |
| Cefepima | Gentamicina |
| Imipenem | Tobramicina |
| Meropenem | |
| Doripenem | |
| Ciprofloxacino | |
| Levofloxacino | |
| Gentamicina | |
| Tobramicina | |
| Amicacina | |
| Cotrimoxazol | |
| Tigeciclina | |
| Colistinaa | |
| Sulbactama | |
| Rifampicinaa |
Atención primaria: incluye consultas externas del hospital.
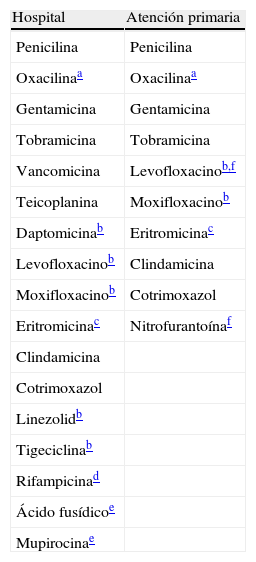
Antibióticos a informar en especies Staphylococcus.
| Hospital | Atención primaria |
| Penicilina | Penicilina |
| Oxacilinaa | Oxacilinaa |
| Gentamicina | Gentamicina |
| Tobramicina | Tobramicina |
| Vancomicina | Levofloxacinob,f |
| Teicoplanina | Moxifloxacinob |
| Daptomicinab | Eritromicinac |
| Levofloxacinob | Clindamicina |
| Moxifloxacinob | Cotrimoxazol |
| Eritromicinac | Nitrofurantoínaf |
| Clindamicina | |
| Cotrimoxazol | |
| Linezolidb | |
| Tigeciclinab | |
| Rifampicinad | |
| Ácido fusídicoe | |
| Mupirocinae |
Atención primaria: incluye consultas externas del hospital.
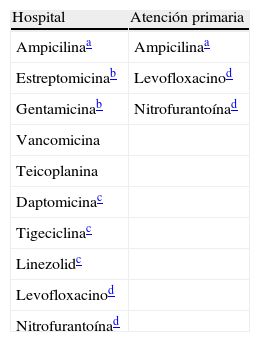
Antibióticos a informar en especies Enterococcus.
| Hospital | Atención primaria |
| Ampicilinaa | Ampicilinaa |
| Estreptomicinab | Levofloxacinod |
| Gentamicinab | Nitrofurantoínad |
| Vancomicina | |
| Teicoplanina | |
| Daptomicinac | |
| Tigeciclinac | |
| Linezolidc | |
| Levofloxacinod | |
| Nitrofurantoínad |
Atención primaria: incluye consultas externas del hospital.
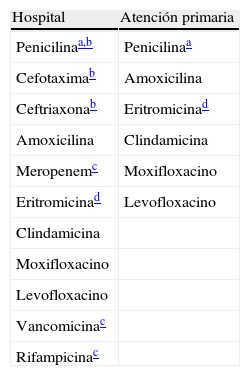
Antibióticos a informar en Streptococcus pneumoniae.
| Hospital | Atención primaria |
| Penicilinaa,b | Penicilinaa |
| Cefotaximab | Amoxicilina |
| Ceftriaxonab | Eritromicinad |
| Amoxicilina | Clindamicina |
| Meropenemc | Moxifloxacino |
| Eritromicinad | Levofloxacino |
| Clindamicina | |
| Moxifloxacino | |
| Levofloxacino | |
| Vancomicinac | |
| Rifampicinac |
Atención primaria: incluye consultas externas del hospital.
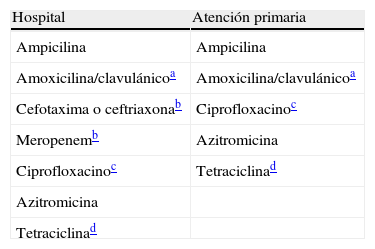
Antibióticos a informar en especies de Haemophilus.
| Hospital | Atención primaria |
| Ampicilina | Ampicilina |
| Amoxicilina/clavulánicoa | Amoxicilina/clavulánicoa |
| Cefotaxima o ceftriaxonab | Ciprofloxacinoc |
| Meropenemb | Azitromicina |
| Ciprofloxacinoc | Tetraciclinad |
| Azitromicina | |
| Tetraciclinad |
Atención primaria: incluye consultas externas del hospital.
JIA ha prestado servicios de asesoría para Bayer y ha actuado como ponente para GSK, Novartis y Bayer. JRB ha prestado servicios de asesoría y ha actuado como ponente para Pfizer, Novartis, Wyeth, Merck y Janssen, y ha recibido financiación para proyectos de investigación de Wyeth y Novartis.
Jesús Rodríguez-Baño recibe financiación para la investigación de la Red Española de Investigación en Patología Infecciosa (REIPI), Instituto de Salud Carlos III-FEDER, Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008).
Nota: Sección acreditada por el SEAFORMEC. Consultar preguntas de cada artículo en: http://www.elsevier.es/eimc/formacion