La infección por Streptococcus agalactiae, estreptococo grupo B (EGB), continúa siendo la causa más frecuente de sepsis neonatal de etiología bacteriana. En 2003, las Sociedades Españolas de Ginecología y Obstetricia, Neonatología, Enfermedades Infecciosas y Microbiología Clínica, Quimioterapia y Medicina Familiar y Comunitaria publicaron recomendaciones actualizadas para la prevención de la infección neonatal precoz por EGB. En ellas se recomendaba la identificación de gestantes portadoras de EGB mediante cultivo de muestra de exudado vaginorrectal realizado en las 35-37 semanas de gestación y la administración de profilaxis antibiótica intraparto (PAI) a todas las gestantes colonizadas.
Tras la aplicación generalizada de la PAI, la incidencia de la sepsis neonatal precoz por EGB ha disminuido de forma significativa en nuestro país.
En 2010, los Centers for Disease Control and Prevention (CDC) publicaron nuevas recomendaciones para la prevención de esta infección neonatal. Este hecho, junto con los nuevos conocimientos y la experiencia disponibles, ha llevado a las sociedades participantes a publicar este documento de consenso dirigido a todos los profesionales de los servicios de salud relacionados con el diagnóstico microbiológico y la atención al embarazo, al parto y al recién nacido.
En estas nuevas recomendaciones se actualizan los métodos microbiológicos para realizar la identificación de portadoras de EGB y la técnica de sensibilidad a antibióticos; se revisan los antibióticos de primera línea que pueden usarse para PAI (penicilina, ampicilina, cefazolina) y sus alternativas (clindamicina y vancomicina); se clarifica el significado de la presencia de EGB en orina, incluyendo criterios para el diagnóstico de infección urinaria y bacteriuria asintomática por EGB en la embarazada; se define el uso de PAI en la amenaza de parto prematuro y rotura prematura de membranas, y se revisa el manejo del recién nacido en relación con el estado de portadora de EGB de la madre.
Estas recomendaciones solo son válidas para la prevención de la infección neonatal precoz por EGB, y no son efectivas frente a la infección neonatal tardía.
Group B streptococci (GBS) remain the most common cause of early onset neonatal sepsis. In 2003 the Spanish Societies of Obstetrics and Gynaecology, Neonatology, Infectious Diseases and Clinical Microbiology, Chemotherapy, and Family and Community Medicine published updated recommendations for the prevention of early onset neonatal GBS infection. It was recommended to study all pregnant women at 35-37 weeks gestation to determine whether they were colonised by GBS, and to administer intrapartum antibiotic prophylaxis (IAP) to all colonised women.
There has been a significant reduction in neonatal GBS infection in Spain following the widespread application of IAP. Today most cases of early onset GBS neonatal infection are due to false negative results in detecting GBS, to the lack of communication between laboratories and obstetric units, and to failures in implementing the prevention protocol.
In 2010, new recommendations were published by the CDC, and this fact, together with the new knowledge and experience available, has led to the publishing of these new recommendations.
The main changes in these revised recommendations include: microbiological methods to identify pregnant GBS carriers and for testing GBS antibiotic sensitivity, and the antibiotics used for IAP are updated; The significance of the presence of GBS in urine, including criteria for the diagnosis of UTI and asymptomatic bacteriuria in pregnancy are clarified; IAP in preterm labour and premature rupture of membranes, and the management of the newborn in relation to GBS carrier status of the mother are also revised.
These recommendations are only addressed to the prevention of GBS early neonatal infection, are not effective against late neonatal infection.
Las sociedades españolas de Ginecología y Obstetricia (SEGO), de Neonatología (SEN), de Enfermedades Infecciosas y Microbiología Clínica (SEIMC), de Quimioterapia (SEQ) y de Medicina Familiar y Comunitaria (SEMFYC) designaron en junio de 2011 a un grupo de trabajo multidisciplinario de profesionales expertos, procedentes de las áreas de obstetricia, neonatología, microbiología y salud pública, con amplia experiencia en el diagnóstico y la prevención de la infección neonatal por estreptococo grupo B (EGB), para preparar el documento de recomendaciones. La redacción fue preparada, revisada y discutida por todos los miembros del grupo, y el texto del documento final de recomendaciones fue consensuado por la totalidad del grupo en una reunión final en la sede de la SEGO en enero de 2012.
Para la elaboración del documento se realizó una revisión exhaustiva de la literatura científica sobre los aspectos relacionados con cada apartado utilizando el motor de búsqueda PubMed de libre acceso a la base de datos MEDLINE. Como fuentes fundamentales se han usado las nuevas recomendaciones de los CDC1, las anteriores recomendaciones españolas2, el Manual de Microbiología Clínica de la Sociedad Americana de Microbiologia3 y las últimas revisiones publicadas4-9.
La dificultad intrínseca de realizar estudios aleatorizados y controlados sobre prevención de la infección neonatal precoz por EGB hace que estos trabajos sean prácticamente inexistentes y la mayoría de estudios se basan en comparación de resultados antes y después de realizar una estrategia de prevención1,6,10.
Las recomendaciones se han estratificado en función de su fuerza y calidad basadas en la evidencia científica disponible, y para ello se ha seguido los estándares de calidad propuestos por la Infectious Diseases Society of America (IDSA)11 (anexo 1).
JustificaciónEn 1998 se publicaron las primeras recomendaciones españolas para la prevención de la infección neonatal precoz por EGB12. Con posterioridad, en 2003 estas recomendaciones fueron actualizadas por la SEGO la SEN, la SEIMC, la SEQ y la SEMFYC2.
La aplicación de estas recomendaciones ha supuesto un cambio importante en la práctica clínica para la prevención de esta patología en nuestro país y ha producido un descenso significativo en la incidencia de esta infección13-15.
Actualmente, la mayoría de casos de infección precoz se deben a resultados falsamente negativos de los cultivos realizados para la detección de portadoras de EGB, a falta de comunicación entre laboratorios y unidades obstétricas y a fallos en el cumplimiento del protocolo de prevención1,16-19. Actualmente existe nueva información sobre la prevención de esta infección, con importantes cambios en los procedimientos diagnósticos, en los antibióticos recomendados para realizar profilaxis, en el manejo del parto prematuro y en el manejo del recién nacidos (RN) de madres colonizadas por EGB. En 2010, los Centers for Disease Control and Prevention (CDC) publicaron una actualización de las recomendaciones sobre prevención de esta patología1. Por todo ello, las sociedades científicas implicadas han considerado oportuno efectuar esta nueva revisión de las recomendaciones españolas.
ObjetivoEl objetivo de este documento es actualizar la estrategia para la prevención de la infección neonatal por EGB de comienzo precoz.
Es importante señalar que estas recomendaciones se refieren exclusivamente a la prevención de la infección neonatal precoz por EGB. Otros posibles problemas infecciosos relacionados con la embarazada y el RN, incluyendo la infección neonatal por EGB de comienzo tardío, deben ser manejados de acuerdo con los criterios clínicos de los obstetras y neonatólogos implicados en la atención de cada caso.
IntroducciónEGB es un coco grampositivo beta-hemolítico —aunque un pequeño porcentaje de cepas (3-5%) no producen hemólisis3—, posee una cápsula formada por un polisacárido muy rico en ácido siálico y el tipo de polisacárido capsular permite su clasificación en diferentes serotipos de los que hasta hoy se han identificado 10 (Ia,Ib, II-IX)20,21. El polisacárido capsular es un factor de virulencia que le permite evadir los mecanismos de defensa del huésped y su fagocitosis por el sistema inmune22,23. Otro importante factor de virulencia es la producción de hemolisina, que está ligada a la producción de un pigmento característico23-26.
EGB coloniza de forma asintomática el tracto gastrointestinal y la vagina de una alta proporción de adultos sanos7,27-30. La colonización puede ser transitoria, intermitente o persistente31 y, tanto en el hombre como en la mujer, el reservorio es el tracto gastrointestinal (recto)4,27,32. La tasa de colonización vaginorrectal por EGB es muy variable. En Europa se han señalado tasas entre el 6,5 y el 36%, con predominio de cifras próximas al 20%33. En España se han publicado tasas de colonización en embarazadas del 12 al 20%34,35.
Además de infecciones en el RN, EGB es causa de infección en gestantes y puérperas y fuera del periodo perinatal, y en adultos con patología subyacente (diabetes, neoplasias, inmunosupresión)4,5,36,37.
El RN se coloniza por EGB a su paso por el canal del parto colonizado, intraútero tras la rotura de membranas5,38 o, menos frecuentemente, por vía ascendente, aun con las membranas íntegras39. Aproximadamente el 50% de los RN de madres portadoras son colonizados por EGB29, mientras que solo el 5% de los RN de madres en que EGB no se detecta por cultivo están colonizados5,40. Un elevado grado de colonización vaginal se considera un factor de riesgo de colonización y de infección neonatal precoz41-43.
Dado que la colonización vaginal por EGB puede ser intermitente, los cultivos realizados antes del parto no son absolutamente fiables para predecir el estado de portadora en el momento del parto27,28,31,44,45. Por ello, embarazadas que hayan estado colonizadas por EGB en un embarazo anterior pueden no estarlo en el embarazo actual.
Infección neonatal precoz por estreptococo grupo BEn ausencia de medidas de prevención, entre el 1 y el 2% de los RN colonizados durante el parto desarrollan una infección precoz (en los primeros 7días de vida)1,46,47. Este cuadro cursa como sepsis, neumonía o meningitis, y en la gran mayoría de casos se presenta durante las primeras 24h de vida4,5,7,48. La mortalidad, que en los años 1970-1980 alcanzaba el 50%, actualmente se ha reducido al 4-5% como resultado de los avances en la asistencia neonatal1,5,14. Sin embargo, como consecuencia de la infección, el 25-30% de los RN afectados padecen importantes secuelas neurológicas49-51.
Además de la colonización materna por EGB, diferentes factores aumentan el riesgo de infección neonatal precoz. Entre los factores de riesgo se incluyen: prematuridad, rotura prolongada de membranas (más de 18h), fiebre intraparto (≥38°C), bacteriuria por EGB durante el embarazo y RN previo afectado por infección por EGB, que traduce bajos niveles de anticuerpos en la madre frente a la cepa colonizante1,5,42,52-58. Sin embargo, el 50% de las infecciones se presentan en RN sin factores de riesgo1,13,59-61.
EGB es también causa importante de infección durante el embarazo (corioamnionitis) y en el posparto (endometritis)62-65, y aunque los datos no son concluyentes, también se ha señalado asociación entre colonización vaginal por EGB y parto prematuro, rotura pretérmino de membranas, bajo peso al nacer y muerte intraútero42,66-68.
La infección por EGB después de la primera semana de vida se denomina infección neonatal tardía47 y se presenta habitualmente como bacteriemia o meningitis5,69. La fuente de contagio de los RN que desarrollan infección tardía no está clara, pudiendo provenir de la madre colonizada o de otras fuentes (personal sanitario, familiares, etc.); más del 50% de RN que desarrollan infección neonatal tardía nacen de madres no colonizadas69. La estrategia de prevención basada en la aplicación de PAI no es efectiva para prevenir la infección neonatal tardía, y actualmente no existe ninguna estrategia que permita su prevención1,69,70.
EGB es, aún hoy, una de las causas más frecuentes de infección bacteriana perinatal en España14,15 y en otros países desarrollados1,6,71. La incidencia de la infección neonatal precoz por EGB en Estados Unidos en la década de los ochenta y los primeros años de los noventa (aun sin medidas de prevención) era de 2 a 3 casos por 1.000RN10,61,72. En Europa, la incidencia publicada anterior a 1999 varía entre 0,2 y 4 por 1.000RN8,73.
Varios estudios sugieren que la incidencia real de la infección neonatal precoz por EGB puede ser 2 a 3 veces mayor que la definida por el aislamiento de EGB a partir de una localización anatómica normalmente estéril (sangre, líquido cefalorraquídeo)50,74. La ausencia de confirmación microbiológica en RN con sepsis clínica puede deberse a los antibióticos administrados a la madre y/o al pequeño volumen de sangre obtenido para realizar hemocultivos en los RN75,76.
Prevención de la infección neonatal precoz por estreptococo grupo BProfilaxis antibiótica intrapartoEn los últimos 25 años se ha demostrado que la administración intravenosa de penicilina o ampicilina intraparto durante 4 o más horas antes del final parto es efectiva para prevenir la transmisión vertical de EGB1,46,77-80. La cefazolina tiene excelente actividad antibacteriana frente a EGB, posee una farmacocinética y una farmacodinamia semejantes a las de la penicilina y alcanza altas concentraciones intraamnióticas, por lo que se considera una alternativa a la penicilina y a la ampicilina en pacientes con hipersensibilidad moderada a beta-lactámicos1,81-85.
La eficacia de otros antibióticos en caso de alergia a beta-lactámicos no ha sido probada en ensayos clínicos, y hay pocos datos sobre la efectividad de la eritromicina, la clindamicina y la vancomicina para alcanzar concentraciones adecuadas en el líquido amniótico1.
La pauta de administración intraparto de penicilina o ampicilina para prevenir la infección neonatal precoz por EGB ha sido ampliamente discutida6,86,87. Aunque tiempos de administración inferiores a 4h antes del parto pueden ser efectivos para interrumpir la transmisión al RN88,89, la recomendación actual es administrar PAI durante 4 o más horas antes del parto1.
Se han aplicado 2 estrategias para seleccionar las embarazadas candidatas a recibir PAI: a) selección basada en la existencia de los factores de riesgo (prematuridad, rotura prolongada de membranas, fiebre intraparto), y b) basada en la colonización por EGB demostrada por cultivo anteparto90.
Diferentes estudios retrospectivos efectuados en Estados Unidos compararon las 2 estrategias de prevención y concluyeron que la estrategia de cribado prenatal universal y profilaxis antibiótica intraparto a todas las portadoras era el doble de efectiva que la estrategia basada en factores de riesgo10. Por ello, los CDC adoptaron esta estrategia en 200261, que se ha confirmado en estudios recientes91.
Los programas de prevención basados en administración de PAI a las madres colonizadas por EGB han reducido la incidencia de infección neonatal precoz por EGB en Estados Unidos hasta 0,34-0,37 casos por 1.000RN en 2003-20051,65. En Australia, tras la instauración de PAI la incidencia de infección neonatal precoz por EGB disminuyó desde 1,43 por 1.000RN en 1993 a 0,25 en 200192. En España los datos de la Fundación Castrillo indican una incidencia de infección neonatal precoz por EGB por 1.000RN de 1,3 en 1996-1997, de 0,7 en 2000-2001 y de 0,36 en 201014,15. Datos del área de Cataluña indican un declive desde 1,92 por 1.000RN en 1994 hasta 0,26 en 200113 y 0,18 en 200970.
La aplicación intraparto de antisépticos vaginales, fundamentalmente clorhexidina, para prevenir la transmisión vertical de EGB no ha demostrado utilidad93.
Vacunas frente a estreptococo grupo BDado que un bajo nivel de anticuerpos en la madre (y por tanto en el feto y en el RN) frente al polisacárido capsular del EGB es factor determinante en el desarrollo de infección del RN58, sería posible prevenir la infección neonatal por EGB mediante la vacunación de las embarazadas. Este enfoque es prometedor y se han hecho progresos importantes, sin embargo, no está aún contrastada su utilización clínica. La mayor dificultad para desarrollar una vacuna frente a EGB es la existencia de diferentes serotipos94,95. Para resolver esta dificultad, actualmente están en desarrollo vacunas que incorporan proteínas de superficie y de los pili. La puesta a punto de una vacuna efectiva frente a EGB se complica por la dificultad de administrar vacunas a embarazadas, por el riesgo de alteraciones en el feto y subsecuentes demandas legales, lo cual hace difícil la realización de los ensayos clínicos necesarios para determinar su efectividad y su seguridad. Otro tema no resuelto es la elección de la población diana para aplicar la vacuna, adolescentes o embarazadas96,97. El desarrollo de una vacuna efectiva frente a EGB podría también ser eficaz en la prevención de la infección neonatal tardía para la que no existen medidas de prevención69. También, una vacuna podría contribuir a proteger a los grupos de población adulta más susceptibles de padecer infección por EGB4,5,36.
Profilaxis antibiótica del recién nacidoSe ha sugerido que la administración de penicilina al RN asintomático lo protege frente a la infección neonatal precoz por EGB cuando, existiendo indicación de PAI, no se administró o no fue adecuada. En estos casos se ha recomendado administrar al RN una dosis de penicilina G intramuscular durante la primera hora de vida y mantenerlos bajo observación durante al menos 48h2,98-100.
Detección de estreptococo grupo B en la embarazadaDetección de estreptococo grupo B por cultivoEl objeto del cribado de EGB en la embarazada es predecir su colonización vaginorrectal en el momento del parto para seleccionar las embarazadas candidatas a recibir PAI. Por ello deben usarse los métodos más efectivos para la detección de EGB. La muestra adecuada es el exudado vaginorrectal, realizando la obtención de la muestra del tercio externo de vagina y de la zona anorrectal (introduciendo el escobillón en el ano). La obtención puede realizarse con un único escobillón tomando primero la muestra vaginal y luego introduciéndolo en el esfínter anal. También, puede utilizarse un escobillón para la obtención de la muestra vaginal y otro para la muestra rectal. Tras una cuidadosa información a la embarazada, ella misma puede realizar la obtención de la muestra vaginorrectal, y los resultados obtenidos con esta modalidad de obtención de muestra no son diferentes a los obtenidos cuando la toma es realizada por un profesional sanitario101. En general, el procedimiento de autotoma para obtención del escobillón vaginal y rectal o vaginorrectal para cultivo de EGB no ha sido evaluado en nuestro sistema de salud. Por ello, antes de recomendar su uso, es necesaria una evaluación del método.
Aunque el estado de portadora de EGB puede ser intermitente, se acepta que los cultivos vaginorrectales realizados con una técnica adecuada menos de 5semanas antes predicen de forma fiable el estado de portadora de EGB en el momento del parto1,44, mientras que cultivos realizados con anterioridad a 5semanas al parto no son fiables para predecir el estado de portadora1.
Factores críticos que influyen en la efectividad de la detección de EGB en la embarazada son la adecuada toma de la muestra, la calidad de los escobillones y de los medios de transporte, las condiciones de conservación y el tiempo que transcurre entre la obtención de la muestra y el procesamiento8,102.
La identificación del EGB puede hacerse por observación de su pigmento rojo específico103 en medio Granada, 100% específico de EGB34, aglutinación con látex, prueba del hipurato, prueba de CAMP o MALDI-TOF104.
La técnica recomendada por los CDC y por la Sociedad Americana de Microbiologia1,3 para el procesamiento de las muestras vaginales y rectales requiere incubación en caldo de enriquecimiento selectivo Todd Hewitt con gentamicina+nalidíxico o con colistina+nalidíxico y subcultivo en agar sangre y posterior identificación de las colonias sospechosas.
También se recomienda sembrar directamente el escobillón en un tubo de caldo Granada, que no requiere incubación en anaerobiosis y permite simultanear la detección directa de EGB con el enriquecimiento selectivo1,105,106. Otras opciones incluyen sembrar directamente la muestra en una placa de agar Granada, además de hacerlo simultáneamente en el caldo de enriquecimiento. La opción de sembrar una única placa de medio Granada no es recomendada por los CDC, aunque algunos autores han comunicado una sensibilidad equivalente al enriquecimiento selectivo34,107.
Las nuevas recomendaciones de los CDC indican como prueba diagnóstica la aglutinación directa con látex, sobre el caldo de enriquecimiento tras 18-24h de incubación, para detección de antígeno específico de grupo1,108. Sin embargo, esta técnica no está indicada para este fin por los fabricantes del producto y la elevada frecuencia de resultados falsos positivos y negativos impide, de momento, su recomendación en nuestro medio.
Una limitación de la detección de EGB en medio Granada es que no se detectan las cepas no hemolíticas, pues las cepas no hemolíticas no producen pigmento34. La frecuencia de cepas no hemolíticas de EGB se estima en el 4% entre las embarazadas portadoras. Al no producir hemolisina, estas cepas son menos virulentas23,25,26,109 y su frecuencia como causa de infección neonatal precoz es muy baja110.
EGB también puede ser detectado por cultivo en medios cromogénicos111. En medios cromogénicos para EGB el aspecto de las colonias varía según el fabricante (cada fabricante usa su propia mezcla de cromógenos), y como el contraste de color entre EGB y otros microorganismos puede ser pobre, cuando el número de colonias de EGB es pequeño con relación a otras bacterias, como enterococos, su detección es difícil. Al no existir ningún cromógeno específico de EGB las colonias sospechosas han de ser confirmadas con otras pruebas específicas1.
Técnicas de diagnóstico rápido para detección de estreptococo grupo B en gestantesSe han hecho importantes progresos en el desarrollo de pruebas rápidas de detección de EGB basadas en la amplificación de ácidos nucleicos, y algunas han sido comercializadas y autorizadas por la FDA (Xpert GBS Cepheid). Sin embargo, su alto precio y la necesidad de garantizar su disponibilidad hacen difícil, por ahora, su uso rutinario1,8,112. Otra limitación de estas pruebas es que no permiten el análisis de resistencias necesario para optimizar la PAI en mujeres alérgicas a la penicilina. Sin embargo, pueden ser útiles para indicar o no PAI en gestantes sin factores de riesgo con embarazo a término, cuyo estado de colonización por EGB se desconoce 1,8.
El empleo de pruebas rápidas basadas en detección de antígeno de EGB directamente de muestras de exudado vaginal o rectal son muy específicas, pero la elevada frecuencia de resultados falsamente negativos desaconseja su uso para el estudio de la colonización intraparto112.
Sensibilidad a los antibióticosEGB continúa siendo muy sensible a la penicilina y a la mayoría de los antibióticos beta-lactámicos113, por ello la penicilina continua siendo el tratamiento de elección para tratar las infecciones causadas por EGB1. Recientemente en Estados Unidos y Japón se han identificado algunas cepas de EGB con sensibilidad disminuida a la penicilina114, debida a una mutación en los genes que codifican una proteína fijadora de penicilina (PBP 2X). La repercusión clínica de este fenómeno no está clara y, hasta ahora, no altera la recomendación de uso de antibióticos beta-lactámicos en la PAI1.
La resistencia de EGB a los macrólidos y a la clindamicina se sitúa por encima del 20%1,115. En EGB existen varios mecanismos de resistencia a los macrólidos, y el más común se debe a una modificación ribosomal debida a una metilasa codificada por los genes erm. Esta metilasa confiere resistencia a la eritromicina y a las lincosamidas (clindamicina y lincomicina), y conforma el fenotipo MLSB116,117. En general, la resistencia a la eritromicina se asocia a resistencia a la clindamicina. Entre las cepas de EGB resistentes a la eritromicina y a la clindamicina existen 2 fenotipos: el MLSB-constitutivo, resistente a la eritromicina y a la clindamicina, y el MLSB-inducible, que aparece en las pruebas de sensibilidad como resistente a la eritromicina y sensible a la clindamicina. Para detectar resistencia a la clindamicina en las cepas de EGB con fenotipo MLSB-inducible es necesario efectuar una prueba de inducción, como el test D, utilizando discos de eritromicina y clindamicina1,118.
En España la resistencia a los macrólidos y a la clindamicina oscila entre el 12 y el 20%, y la presencia del fenotipo MLSB-inducible es hasta ahora muy minoritaria70,119,120.
Dificultades y barreras de la prevenciónLa utilidad de cualquier estrategia de prevención depende de que sea realizable, de los costes asociados y del grado de cumplimiento. Por ello, un programa generalizado de detección y profilaxis de la embarazada y vigilancia de los RN con riesgo requiere concienciación general y actuación coordinada de los clínicos, de los microbiólogos y de la administración18,121-123.
Actualmente, la mayoría de casos de infección precoz por EGB en RN no prematuros se deben a utilización de técnicas de detección de EGB inadecuadas, que originan resultados falsamente negativos en el cribado de EGB, a falta de comunicación adecuada entre los laboratorios y las unidades obstétricas, y a fallos en el cumplimiento del protocolo de prevención1,8,9,14,45. Estas circunstancias potencialmente evitables determinan las llamadas «oportunidades perdidas» para la prevención de la infección neonatal precoz por EGB1,10,17,19,45,48,49,60,76,122,124, y a su minimización se dedica una parte fundamental de las nuevas recomendaciones.
No puede descartarse que los cultivos negativos en embarazadas cuyos RN desarrollan infección neonatal precoz por EGB sean en realidad resultados erróneos (falsos negativos) debido a deficiencias en la obtención, transporte, procesamiento de las muestras y/o al uso de técnicas microbiológicas deficientes. Por ello, la utilización de buenas técnicas microbiológicas para detectar EGB, el uso de medios de transporte adecuados y minimizar el tiempo entre la obtención de la muestra y su procesamiento son fundamentales para mejorar la fiabilidad de la detección de EGB en embarazadas8,71,102.
Se ha demostrado que la aplicación sistemática de la PAI incrementa la proporción de embarazadas que reciben antibióticos durante el parto1,51, y ello podría aumentar el riesgo de infección neonatal causada por bacterias resistentes, fundamentalmente Enterobacteriaceae. En los primeros años del uso generalizado de la PAI se publicaron informes alarmantes sobre esta posibilidad125,126, aunque el aumento de infecciones causadas por gramnegativos no se ha confirmado posteriormente15,127-129.
Dado que la sepsis neonatal causada por bacilos gramnegativos reviste especial gravedad y se asocia frecuentemente con la prematuridad130, se debe evitar el uso innecesario o prolongado de antibióticos en la PAI que debe limitarse estrictamente a aquellos casos en que es necesaria1,15,48,131.
También es importante evaluar la mejor estrategia para manejar clínicamente los RN asintomáticos de madres portadoras de EGB, se haya o no realizado una adecuada PAI, pues fácilmente puede llegarse a sobreactuaciones médicas frente a estos RN1,7,132.
RecomendacionesLa eficacia demostrada de la PAI para prevenir la infección neonatal precoz por EGB determina que las sociedades participantes recomienden el cribado universal de las embarazadas en las semanas 35-37 de gestación, para detectar el estado de portadora de EGB, y la administración de PAI a todas las gestantes detectadas como portadoras (AII).
Estas recomendaciones son, con algunas modificaciones, similares a las realizadas por estas sociedades en 2003 y por los CDC en 2010.
La PAI no es eficaz en la prevención de la infección neonatal tardía por EGB, por lo que estas recomendaciones no son aplicables para prevenir estos casos.
Para la graduación de las evidencias científicas se han seguido los estándares de calidad propuestos por la Infectious Diseases Society of America (IDSA)11.
Detección de portadoras de estreptococo grupo BObtención y transporte de muestrasLa detección de embarazadas portadoras de EGB debe efectuarse mediante cultivo de muestras de exudado vaginal y rectal realizado en las semanas 35-37 de gestación (AII).
La muestra puede obtenerse utilizando un único escobillón. En este caso, se obtendrá primero el exudado vaginal y posteriormente el exudado rectal introduciendo el mismo escobillón en el esfínter anal. También pueden obtenerse las muestras utilizando escobillones diferentes para la obtención de la muestra vaginal y rectal (AII).
Las muestras cervicales no son aceptables (AII).
La muestra de exudado vaginal ha de obtenerse antes de cualquier manipulación vaginal, no deben utilizarse productos de higiene femenina antes de la obtención y la embarazada no debe estar recibiendo tratamiento antibiótico (AIII).
La muestra debe obtenerse del tercio externo de la vagina (sin usar espéculo) y de la zona anorrectal (introduciendo el escobillón a través del esfínter anal). Los escobillones se introducirán en un medio de transporte adecuado y se enviarán al laboratorio el mismo día de la obtención. Si ello no es posible, pueden conservarse hasta 24h en frigorífico antes de su envío al laboratorio (AII). La petición debe indicar claramente que la muestra es para cribado (screening) de EGB y si existe sospecha de alergia a antibióticos beta-lactámicos.
Resumen de la obtención de muestra para detección de portadoras de estreptococo grupo B- •
A quién. Todas las embarazadas.
- •
Cuándo. Entre la 35 a la 37 semanas de gestación.
- •
Dónde. Tercio externo de la vagina y el recto.
- •
Con qué. Uno o dos escobillones que, después de la toma, se introducirán en el medio de transporte.
- •
Transporte. Enviar al laboratorio el mismo día de la obtención y, si no es posible, al día siguiente. Si la muestra no puede ser enviada al laboratorio el día de su obtención, debe conservarse en frigorífico hasta su envío.
- •
Conservación de la muestra en el laboratorio hasta el procesamiento. 24h en frigorífico. Un tiempo de conservación mayor puede disminuir el inóculo de EGB presente en la muestra, y este hecho, en pacientes con bajos inóculos, puede dar lugar a resultados falsos negativos del cultivo.
- •
Petición. Indicar claramente «Cribado de EGB» e indicar posible alergia a penicilinas.
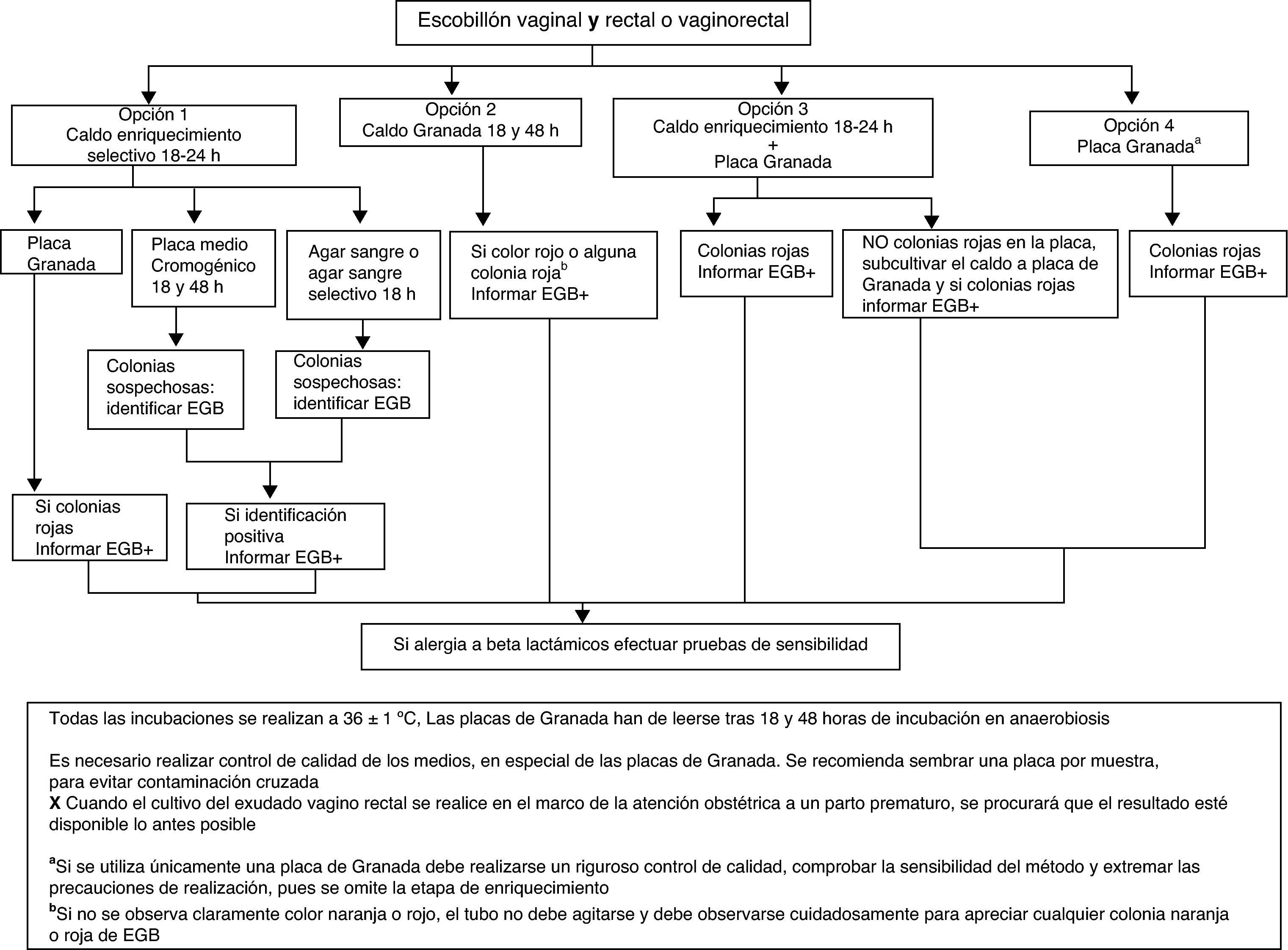
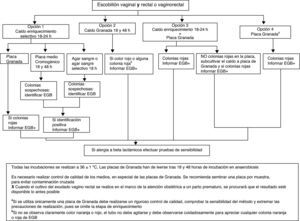
El procedimiento a emplear se resume en la figura 1.
- •
Opción 1. Inocular la muestra en medio líquido de enriquecimiento selectivo para EGB (Todd Hewitt con colistina y nalidíxico o con gentamicina y nalidíxico) y tras 18-24h de incubación subcultivar a una placa de medio Granada, a una placa de agar sangre, a una placa de agar sangre selectivo (p.ej., colistina-nalidíxico) o a una placa de medio cromogénico que permita la identificación de EGB (AI).
- •
Opción 2. Inocular la muestra en caldo Granada e incubar en aerobiosis 18h. Observar la presencia de pigmento tras 24h de incubación. Los cultivos negativos (ausencia de pigmento anaranjado en el medio de cultivo) se reincubarán 24h más antes de descartarlos como negativos (AI).
- •
Opción 3. Inocular un medio líquido de enriquecimiento selectivo (AI) y después sembrar una placa de agar Granada (CII). Si la placa de Granada es negativa a las 18h, subcultivar el caldo de enriquecimiento a un medio de cultivo adecuado, como en la opción 1.
- •
Opción 4. Sembrar en medio Granada en placa e incubar en anaerobiosis durante 48h antes de considerarla negativa (AII). Esta opción requiere un riguroso control de calidad para comprobar su sensibilidad.
Las colonias anaranjadas o rojas en medio Granada se identifican directamente como EGB (AI), las colonias beta-hemolíticas en agar sangre y las colonias que den la coloración indicada en medio cromogénico (diferente según el fabricante) se identifican mediante aglutinación con látex, prueba del hipurato, prueba CAMP o MALDITOF (AII).
No es necesario realizar antibiograma, salvo en caso de alergia a beta-lactámicos (AIII).
En estos casos, se ha de determinar sensibilidad a la clindamicina y a la eritromicina y determinar resistencia inducible a la clindamicina cuando la cepa presente resistencia a la eritromicina y sensibilidad a la clindamicina (AIII).
Los resultados de los cultivos han de estar disponibles en el momento del parto, por lo que es fundamental asegurar una adecuada comunicación entre el laboratorio y los centros asistenciales. Cuando el cultivo del exudado vaginorrectal se realice en el marco de la atención obstétrica a una amenaza de parto prematuro y/o rotura prematura de membranas (RPM) inferior a 37 semanas, se procurará que el resultado esté disponible lo antes posible.
ObservacionesCada laboratorio debe controlar que su técnica de detección de EGB tenga la sensibilidad adecuada, lo cual puede inferirse de la frecuencia de portadoras de EGB detectada, que no debe ser inferior al 15%.
Es importante adquirir medios de cultivo de alta calidad y realizar controles de calidad. Esto es fundamental con las placas de medio Granada, pues se observan resultados no satisfactorios en algunos lotes de medio.
Como alternativa menos satisfactoria a la incubación en anaerobiosis, las placas de agar Granada pueden incubarse en aerobiosis y colocar un cubreobjetos sobre el inóculo para facilitar la producción de pigmento por las colonias de EGB (CII).
Se debe ser cuidadoso respecto a la siembra de múltiples escobillones de diferentes pacientes en una única placa de medio, pues puede producirse contaminación cruzada.
La siembra de los medios cromogénicos ha de efectuarse de forma que se obtengan colonias bien aisladas, pues en cultivos polimicrobianos con escasa cantidad de EGB las colonias de EGB pueden ser difíciles de detectar (BIII).
Un escaso número de cepas de EGB (3-5%) son no hemolíticas y no pigmentadas y se consideran menos virulentas. Estas cepas crecen en medio Granada, como colonias blancas no pigmentadas, y en agar sangre, como colonias no hemolíticas. La detección de estas cepas requiere el empleo de técnicas microbiológicas habituales no basadas en la detección del pigmento característico de EGB (CII).
Aspectos obstétricosIndicaciones del cribado para detección de portadoras de estreptococo grupo BTodas las gestantes entre las semanas 35 y 37, preferentemente en la semana 36, incluyendo gestantes con cesárea programada (por si antes de la cesárea se produce un parto espontáneo) (AII).
Dada la naturaleza intermitente de la colonización, los cultivos realizados 5 semanas o más antes del parto no predicen adecuadamente la colonización en el parto y se deben repetir si han transcurrido más de 5 semanas y el parto aún no se ha producido (AII). Debe indicarse a la embaraza que si el parto no se ha producido en 4 semanas desde la obtención de la muestra debe acudir a la consulta para repetir el cultivo.
No es necesario efectuar la determinación de EGB si existe un hijo anterior con infección neonatal por EGB o si se ha detectado la presencia de EGB en orina durante la gestación. En estos casos deberá administrase PAI (AIII).
Cuando se haya realizado más de un cultivo, la administración o no de PAI debe indicarse según el resultado del último cultivo (CIII).
Indicaciones para la administración de profilaxis antibiótica intrapartoProfilaxis antibiótica intraparto indicada- 1.
Todas las mujeres identificadas por cultivo como portadoras vaginales o rectales de EGB en un cultivo al final del embarazo. El momento óptimo para la toma del cultivo es en la semana 35-37 de gestación (AII).
- 2.
Todas las mujeres en que se detecta EGB en orina durante la gestación, independientemente del resultado del cultivo vaginorrectal si este se ha realizado. No es necesario realizar cultivo vaginorrectal en la semana 35-37 (AII).
- 3.
Todas las gestantes que previamente han tenido un hijo con infección neonatal por EGB, con independencia del resultado del cultivo vaginorrectal si este se ha realizado (AIII).
- 4.
Todos los partos con menos de 37 semanas de gestación en que no se disponga del resultado del cultivo (AIII).
- 5.
Todos los partos en que exista rotura de membranas superior a 18h cuando no se disponga del resultado del cultivo (AII).
- 6.
Todos los partos en que exista fiebre intraparto (38¿C o más) cuando no se disponga del resultado del cultivo (AII). En este caso debe considerarse la posible existencia de corioamnionitis u otra infección maternal.
- 7.
Mujeres a las que se les ha realizado una prueba molecular (PCR) intraparto de detección de colonización por EGB y el resultado es positivo (AII). Estas pruebas se realizan solo en algunos hospitales y habitualmente no están disponibles.
Si al comienzo del parto una prueba rápida de PCR es negativa pero existe algún factor de los indicados en los puntos 4, 5 y 6, está indicada PAI (AIII).
Profilaxis antibiótica intraparto no indicada- 1.
Cultivo vaginorrectal negativo a EGB en la presente gestación (en un cultivo practicado durante las 5 semanas previas al parto) aunque hayan sido positivas en un embarazo anterior (B III).
- 2.
Cesárea programada sin comienzo del parto y membranas íntegras, aunque el cultivo a EGB haya sido positivo (CIII).
- 3.
Partos en embarazo de más de 37 semanas de duración con estado de colonización por EGB desconocido y sin factores de riesgo. En estos casos (no realización de cultivo, pérdida de resultados, etc.), que son no deseables y deben ser excepcionales, no se utilizará PAI y el RN se someterá a observación (CIII).
El uso, en su caso, de profilaxis antibiótica para prevenir complicaciones infecciosas en cesáreas no debe ser alterado por la presencia o no de EGB.
La observación del RN no requiere necesariamente su ingreso separado e la madre. El alta hospitalaria del RN puede hacerse siempre que se cumplan todos los criterios de alta y no tiene que estar condicionada por la posible infección por EGB.
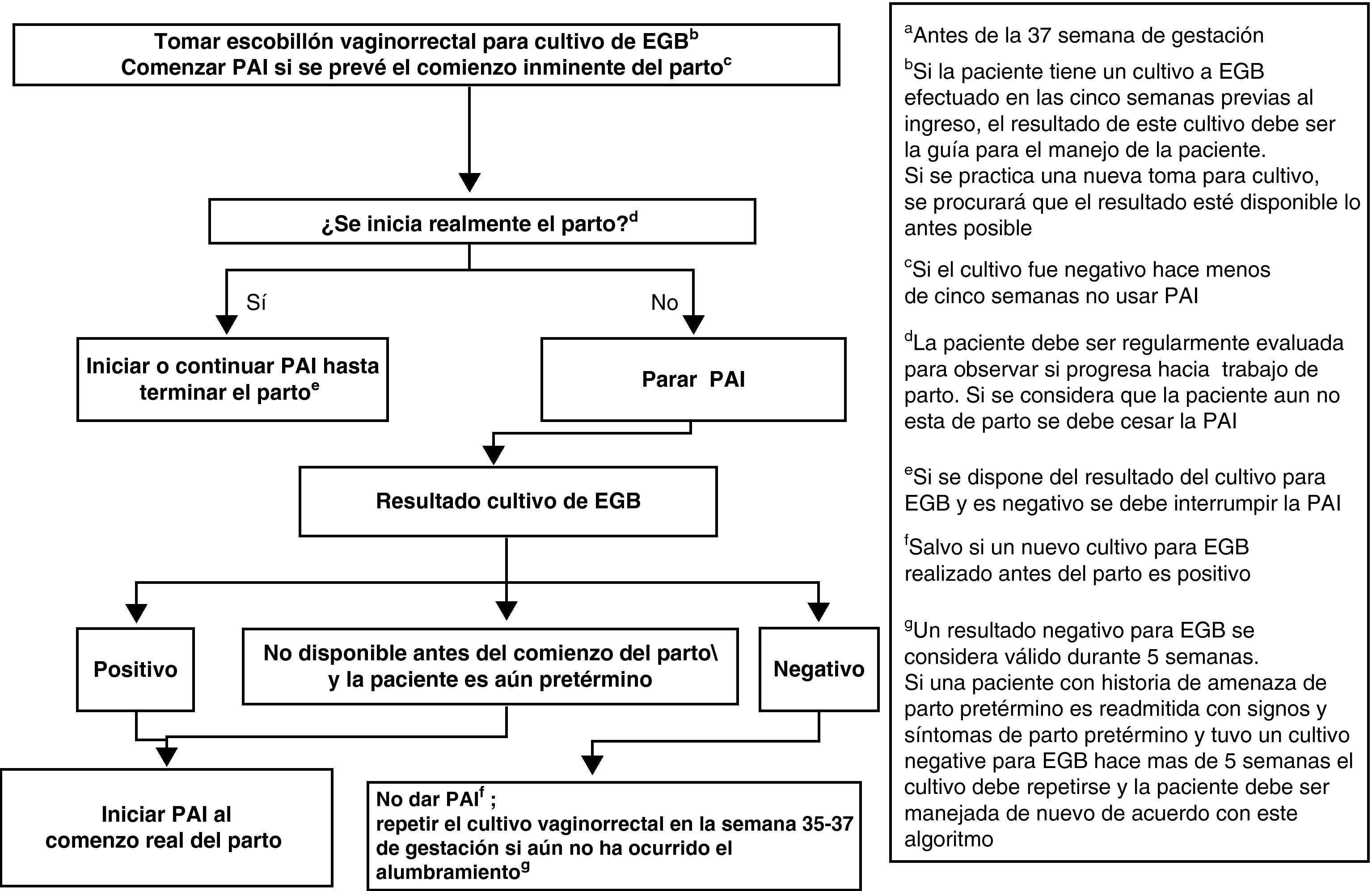
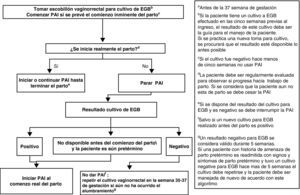
Profilaxis antibiótica intraparto y amenaza de parto pretérmino (menor de 37 semanas) con o sin rotura prematura de membranasLa mujer admitida con amenaza de parto pretérmino, sin RPM, debe ser manejada de acuerdo con la figura 2.
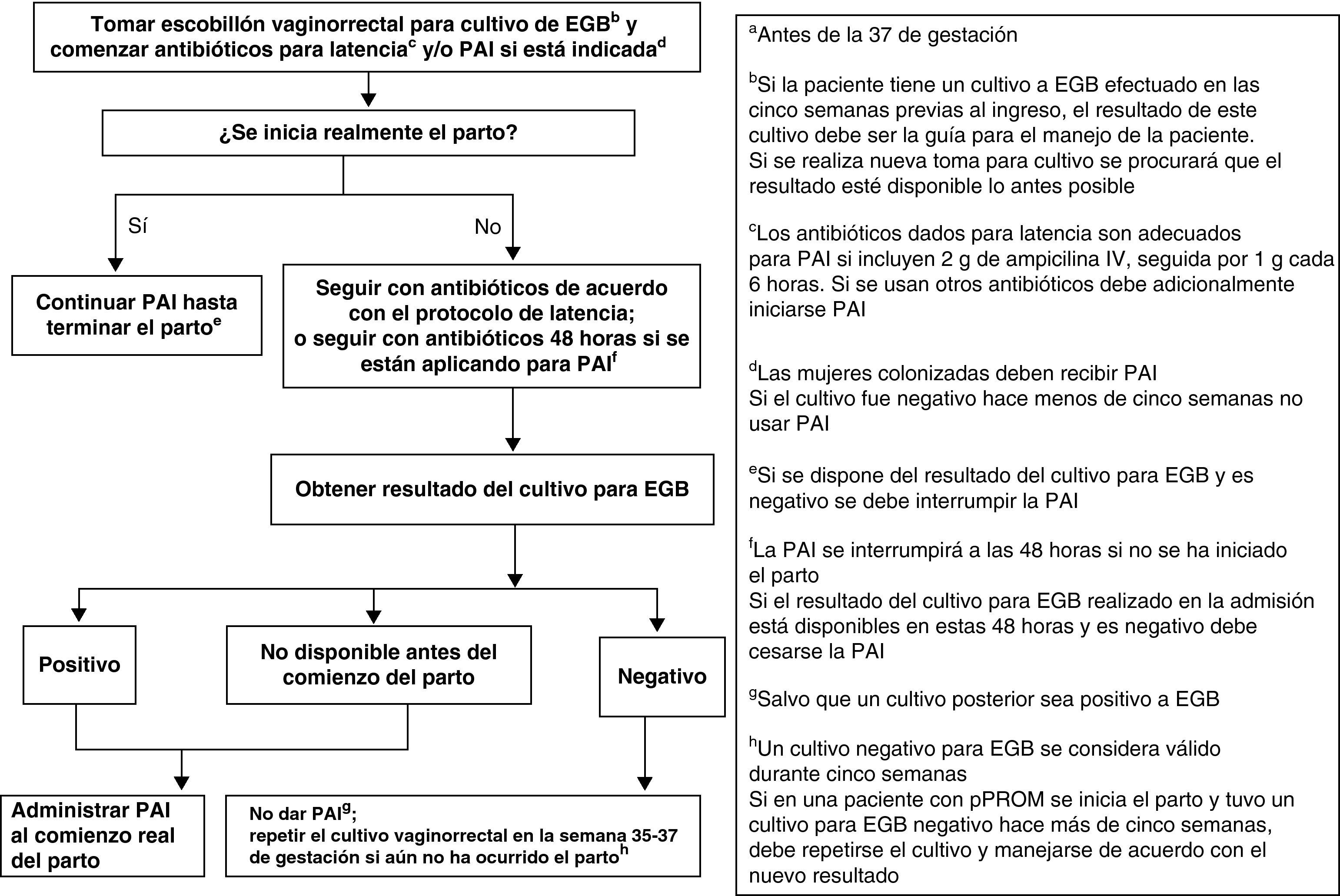
Las mujeres admitidas con amenaza de parto pretérmino y RPM deben ser manejadas de acuerdo con la figura 3.
Al ingreso se le tomará muestra de exudado vaginorrectal para detección de EGB, si no se ha realizado en las últimas 5 semanas (AII). Es también recomendable que al ingreso se obtenga una muestra vaginal para investigación de otros microorganismos potencialmente patógenos (p.ej., E. coli) (CIII).
El cultivo de la muestra vaginorrectal se repetirá si no ha ocurrido el parto y han transcurrido más de 5 semanas desde el cultivo anterior (AII).
Si la mujer tiene un cultivo negativo en las 5 semanas anteriores, no se usará PAI (AII).
Si la gestante tiene un cultivo positivo en las últimas 5 semanas, o si el resultado del cultivo es desconocido, se iniciará la PAI cuando se prevea el comienzo inminente del parto (AIII), y se interrumpirá la PAI si el parto no progresa (BIII).
Cuando exista RPM, la PAI se debe iniciar desde el momento del ingreso. Si el parto no progresa, se interrumpirá la PAI tras 48h (AI). También, si el resultado del cultivo realizado en admisión es negativo, debe interrumpirse la PAI (AII).
En gestantes con cultivo positivo en que se interrumpió la PAI porque el parto no progresaba, la PAI se reanudará cuando comience de nuevo el parto (AII).
ObservacionesLa mujer con RPM que no está de parto y está recibiendo antibióticos para prolongar la latencia que incluyen cobertura adecuada de EGB debe ser manejada según la condición de su RPM, sin tener en cuenta el resultado del cultivo (BIII).
La mujer con RPM que no está de parto y no está recibiendo antibióticos para prolongar la latencia o estos antibióticos no tienen cobertura para EGB, debe recibir PAI por 48h salvo que tenga un cultivo negativo en las 5 semanas anteriores (AIII). Si los resultados del cultivo para detección de EGB están disponibles en esas 48h y el resultado es negativo, la PAI debe ser discontinuada (CIII).
Si se indican antibióticos para prolongar la latencia, estos se consideran también adecuados para la PAI de EGB (mientras la paciente está recibiendo este tratamiento) si incluyen 2g de ampicilina intravenosa (i.v.) seguida de 1g cada 6h (AIII). Si se usan otros antibióticos para prolongar la latencia y se requiere utilizar PAI, deben añadirse además antibióticos adecuados para la PAI (BIII).
Un resultado negativo del cultivo no debe influir en la administración de antibióticos indicados por cualquier otro motivo (AIII), como, por ejemplo, sospecha de corioamnionitis.
La administración oral de antibióticos no es adecuada para la PAI (DII).
Profilaxis antibiótica intraparto y sospecha de corioamnionitisEn caso de existir algún signo clínico o biológico que haga sospechar corioamnionitis u otro tipo de infección bacteriana materna, la administración de antibióticos a la madre adquiere carácter terapéutico y se deben utilizar los recursos diagnósticos apropiados (p.ej., hemocultivo, cultivo de líquido amniótico) y un tratamiento antibiótico que además de EGB cubra otros probables patógenos, principalmente bacilos gramnegativos como E. coli (p.ej., gentamicina, cefalosporinas de amplio espectro, amoxicilina-clavulánico) (AIII).
Los signos clínicos de corioamnionitis pueden estar ausentes en el momento de la evaluación inicial, sobre todo en amenaza de parto prematuro con membranas intactas.
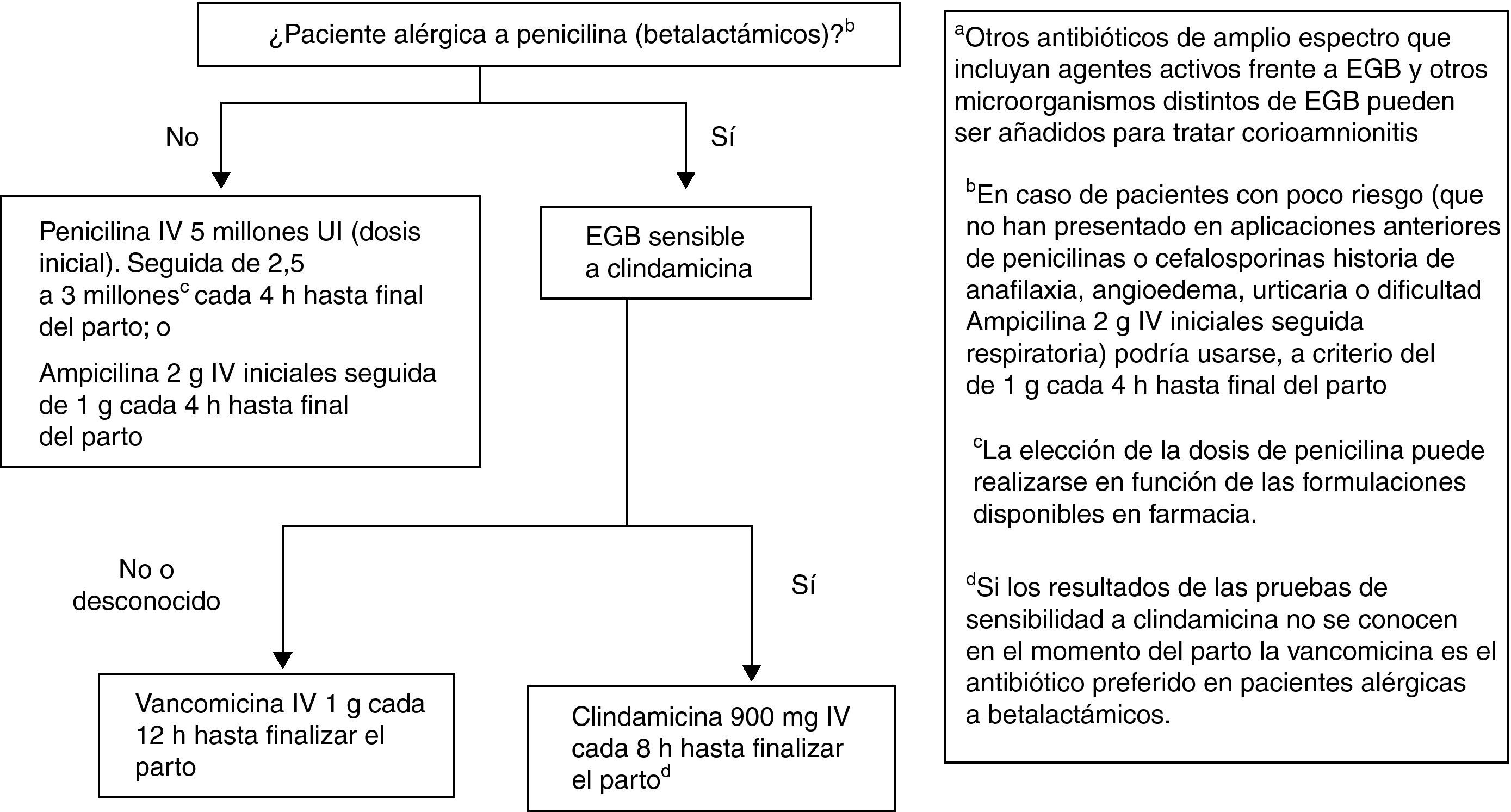
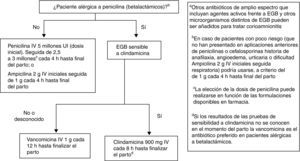
Recomendaciones antibióticas para profilaxis antibiótica intraparto de la infección neonatal precoz por estreptococo grupo BLas recomendaciones se muestran en la figura 4.
La PAI debe administrase de acuerdo con la siguiente pauta:
Penicilina i.v., 5 millones de UI (dosis inicial), seguida de 2,5 a 3 millones de UI, i.v., cada 4h hasta final del parto. Como alternativa puede administrarse ampicilina 2g i.v. iniciales seguida de 1g cada 4h hasta el final del parto (AI). La penicilina sigue siendo el agente de elección por su menor espectro antimicrobiano, aunque la ampicilina es aceptable (AI).
En la petición de cultivo para cribado de EGB se debe informar si hay sospecha de alergia a la penicilina o a las cefalosporinas (AIII).
En pacientes alérgicas, si a juicio del clínico no hay riesgo de anafilaxia, la alternativa a la penicilina o a la ampicilina puede ser la cefazolina, 2g i.v., como dosis inicial, seguida de 1g i.v. cada 8h hasta el final del parto (BII).
ObservacionesEn pacientes alérgicas a la penicilina debe realizarse el estudio de la sensibilidad de EGB a la eritromicina y la clindamicina. Si la cepa es resistente a la eritromicina y sensible a la clindamicina, debe realizarse una prueba de resistencia inducible a la clindamicina (AII). Si esta prueba no se ha realizado o no se conoce el resultado, la cepa debe ser considerada resistente a la clindamicina y el antibiótico a usar es la vancomicina (CIII).
Si la paciente es alérgica a la penicilina y la cepa es sensible a la clindamicina, este es el antibiótico que debe usarse (CIII).
La eritromicina no es alternativa aceptable para usarse en la PAI para prevención de infección neonatal precoz por EGB (A III).
Si existen signos clínicos y/o biológicos de posible infección materna y/o fetal, la administración de antibióticos adquiere carácter terapéutico y debe cubrir un espectro de etiologías más amplio (p.ej., ampicilina-gentamicina u otros antibióticos de acuerdo con la política antibiótica del centro) (AIII).
Desde el punto de vista del manejo del RN, solo se considera profilaxis adecuada la realizada con penicilina, ampicilina o cefazolina con la pauta indicada (AII).
Otros puntos sobre el manejo obstétricoLos datos disponibles no son suficientes para sugerir que el estado de portadora de EGB deba influir sobre los procedimientos obstétricos de monitorización, maduración cervical o inducción del parto. Estos procedimientos se reservarán para sus indicaciones y no se modificarán en las mujeres colonizadas por EGB (CIII).
Los datos disponibles no son suficientes para hacer recomendaciones respecto al momento de aplicación de los procedimientos destinados para facilitar la progresión del parto, tales como la amniotomía en las mujeres colonizadas por EGB (CIII).
Dado que la PAI se considera óptima si comienza al menos 4h antes del final del parto, la aplicación de estos procedimientos debe adaptarse en lo posible a este tiempo (CIII).
Presencia de estreptococo grupo B en la orina de la gestanteSi en el cribado de la bacteriuria asintomática de la gestante se detecta la presencia de EGB en orina en cualquier número de ufc/ml, debe informarse, pero no se deben usar antibióticos para intentar erradicar el estado de portadora vaginorrectal de EGB en la gestante (AIII).
Sin embargo, cuando en el cribado de infección urinaria durante el embarazo se detecte bacteriuria asintomática por EGB (recuentos iguales o superiores a 100.000ufc/ml en una muestra), o en el transcurso del embarazo se detecta una infección urinaria por EGB (igual o más de 10.000ufc/ml con piuria y/o clínica compatible de infección del tracto urinario), debe instaurarse tratamiento y realizar seguimiento con urocultivos mensuales (AIII).
Todas las gestantes con presencia de EGB en orina durante el embarazo requieren la administración de PAI, sin que sea necesario realizar cultivo vaginorrectal en la semanas 35-37 (AIII).
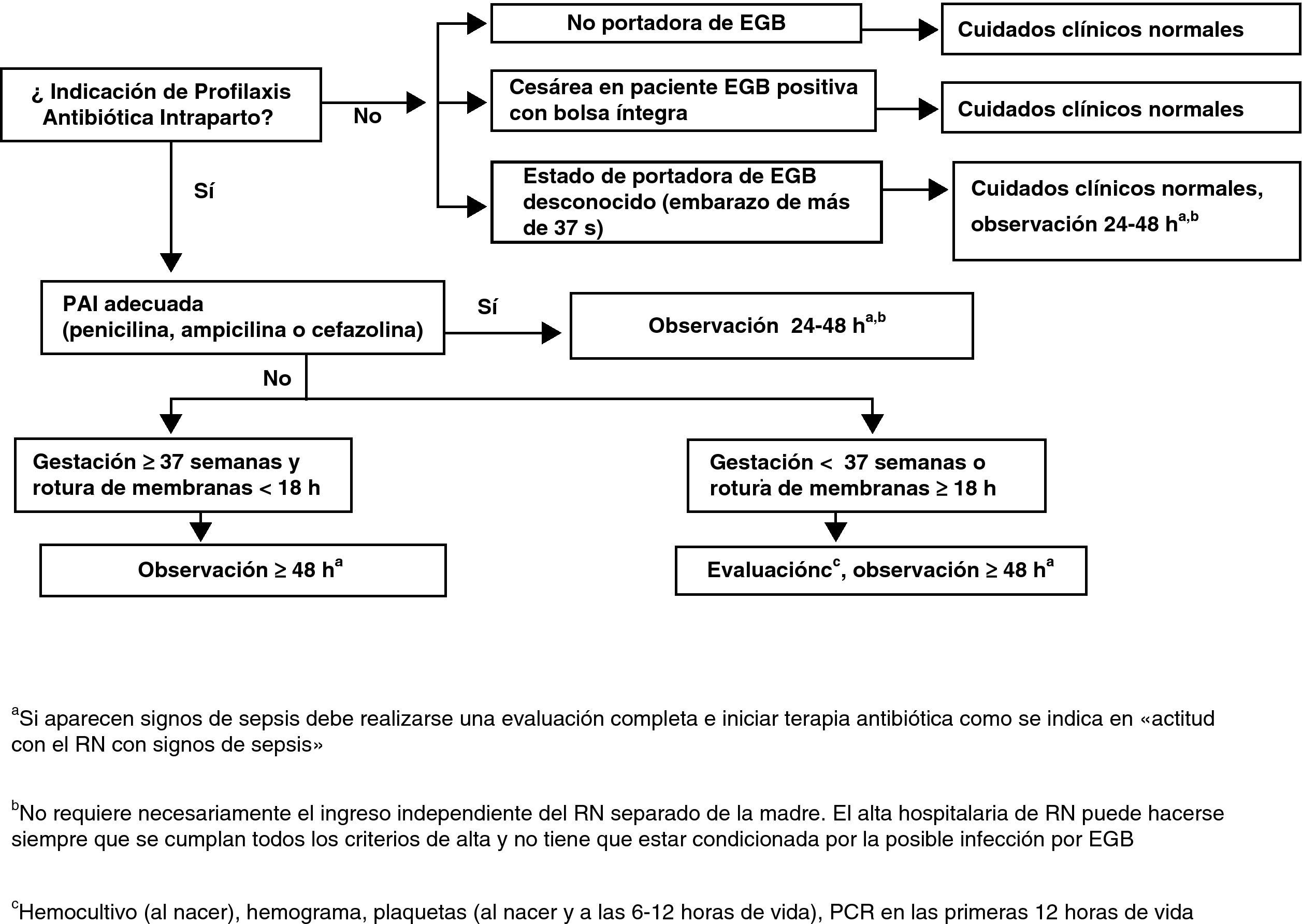
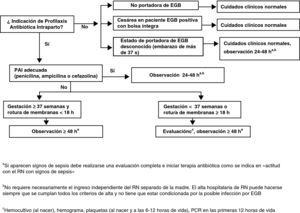
Actitud con el recién nacidoActitud con el recién nacido asintomático sin sospecha de corioamnionitis maternaLos puntos fundamentales del manejo de estos RN se muestran en la figura 5.
Las estrategias actuales de prevención de la infección neonatal precoz por EGB no son capaces de prevenir todos los casos. Por ello la detección rápida de la infección es fundamental para minimizar la morbilidad y la mortalidad en los casos de infección neonatal precoz por EGB que aún se producen.
Solo se considera profilaxis completa la realizada con penicilina, ampicilina o cefazolina a las dosis indicadas.
Esto significa un mínimo de 2 dosis de penicilina o ampicilina en todos los partos y un mínimo de 2 dosis de cefazolina si el parto se prolonga más de 8h.
Los demás antibióticos y dosificaciones se consideran PAI incompleta respecto al manejo del RN (AII).
Madre sin indicación de profilaxis antibiótica intraparto no portadora de estreptococo grupo BManejar de acuerdo con los cuidados neonatales habituales (CIII).
Madre sin indicación de profilaxis antibiótica intraparto, gestación de más de 37 semanas sin ningún factor de riesgo y estreptococo grupo B desconocidoNo se requieren pruebas diagnósticas adicionales (BIII).
En caso (no deseable y que debe ser excepcional) que se desconozca si la madre es portadora de EGB (no realización de cultivo, pérdida de resultados, etc.), el RN se someterá a observación que se prolongará 48h. La observación del RN no requiere necesariamente su ingreso separado de la madre. El alta hospitalaria del RN puede hacerse siempre que se cumplan todos los criterios de alta y no tiene que estar condicionada por la posible infección por EGB (BIII).
Madre portadora de estreptococo grupo B, profilaxis antibiótica intraparto correctaNo se requieren pruebas diagnósticas adicionales. El RN se someterá a observación. Esta observación no requiere necesariamente el ingreso del RN separado de la madre. El alta hospitalaria del RN puede hacerse siempre que se cumplan todos los criterios de alta y no tiene que estar condicionada por la posible infección por EGB (BIII).
Esta recomendación está basada en:
- •
La efectividad demostrada de la profilaxis antibiótica intraparto para prevenir la infección neonatal por EGB y disminuir la transmisión vertical.
- •
Que la administración intraparto de antibióticos no parece alterar el curso clínico ni retrasar la aparición de síntomas en el RN infectado intraútero.
- •
Que la gran mayoría de las manifestaciones clínicas de las infecciones neonatales precoces por EGB se inician durante las primeras 24h de vida posnatal.
El RN será sometido a observación clínica durante 48h y no son necesarias pruebas diagnósticas adicionales (BIII).
Si existe sospecha clínica de sepsis se realizará un estudio diagnóstico de sepsis en las primeras 12 y 24h de vida: recuento y fórmula leucocitaria, plaquetas y proteína C reactiva, se obtendrán muestras para diagnóstico microbiológico y se iniciará tratamiento antibiótico. En el caso de que el RN no haya recibido ningún tipo de PAI, se recomienda administrar al RN (independientemente del estado clínico o del resultado de las pruebas realizadas) una sola dosis de penicilina G intramuscular durante la primera hora de vida (50.000UI si el peso al nacer es mayor de 2.000g o 25.000UI si el peso es menor) (BIII).
Madre que debió recibir profilaxis antibiótica intraparto pero no la recibió o no fue adecuada con gestación de menos de 37 semanas o con rotura de membranas de 18 o más horasEl RN se someterá a observación durante al menos 48h y se le practicará hemocultivo, recuento y fórmula leucocitarios, plaquetas y proteína C reactiva en las primeras 12 y 24h de vida (AIII).
Estos RN serán manejados de acuerdo con sus características de inmadurez y edad gestacional.
Se recomienda, en el caso de que el RN no haya recibido ningún tipo de PAI, administrar al RN (independientemente del estado clínico o del resultado de las pruebas realizadas) una sola dosis de penicilina G intramuscular durante la primera hora de vida (50.000U si el peso al nacer es mayor de 2.000g o 25.000U si el peso es menor) (BIII).
Actitud con el recién nacido asintomático con sospecha de corioamnionitis maternaSi durante el parto se han presentado signos o síntomas maternos o fetales que sugieran corioamnionitis, independientemente del tratamiento que se haya administrado intraparto (tratamiento que además de frente a EGB debe ser activo frente a otros posibles patógenos), de la edad gestacional y del estado del RN, se iniciará evaluación diagnóstica incluyendo hemocultivo, recuento y fórmula leucocitaria, plaquetas y proteína C reactiva a las 12 y 24h de vida (AIII).
Inmediatamente después se instaurará tratamiento antibiótico empírico activo frente a EGB y otros microorganismos capaces de causar infección neonatal (AIII).
El tratamiento se prolongará hasta tener los resultados analíticos y los cultivos.
Es necesario consultar con el obstetra para evaluar la sospecha de corioamnionitis materna (AIII).
Actitud con el recién nacido con signos de sepsisCualquier RN con signos o síntomas de sepsis (independientemente de si la madre es o no portadora de EGB), con PAI o sin ella, será sometido a evaluación diagnóstica completa: hemocultivo, recuento y fórmula leucocitaria, plaquetas, proteína C reactiva y estudio de líquido cefalorraquídeo (después de estabilizar al RN) y radiografía de tórax si hay anormalidades respiratorias. Se iniciará tratamiento inmediato con antibióticos activos frente a EGB y otros microorganismos que son agentes causales de infección neonatal (AII).
Consideraciones sobre el manejo posterior del recién nacidoEn RN de madres que hubiesen recibido alguna dosis de antibióticos intraparto y posteriormente presenten clínica o marcadores de infección positivos se recomienda repetir el hemocultivo (AIII), y si se dispone de la técnica, efectuar una prueba de amplificación de ácidos nucleicos (PCR) para detección de otros microorganismos (CIII).
Si a las 48h de vida el hemocultivo es negativo, la situación clínica es normal y los marcadores de infección (hemograma, PCR) son negativos, se recomienda suspender la administración de antibióticos (si se habían iniciado) (CIII) y considerar el caso como una falsa sospecha de sepsis.
Si a las 48h el hemocultivo es negativo, pero existe clínica de infección y/o los marcadores de infección fueron o son positivos, se realizará el diagnóstico de sepsis clínica del RN y se continuará o se iniciará la administración de antibióticos (AIII).
Si a las 48h el hemocultivo es positivo y los marcadores de infección fueron o son positivos, se iniciará o continuará la administración de antibióticos y se realizará el diagnóstico de sepsis del RN (AIII).
Si a las 48h el hemocultivo es positivo pero no hubo ni hay clínica de sepsis y los marcadores de infección fueron negativos, se realizará el diagnóstico de bacteriemia neonatal asintomática y se iniciará o continuará tratamiento antibiótico, para disminuir el riesgo de desarrollo de sepsis y/o meningitis vertical (BIII).
Observación importanteEstas recomendaciones no avalan una pauta única de comportamiento. Otras pautas alternativas para la prevención de la infección neonatal por EGB pueden ser también adecuadas de acuerdo con las circunstancias particulares de cada centro asistencial y del juicio clínico de los clínicos implicados en la atención de cada caso.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Calidad de la evidencia científica para las recomendaciones11
- 1.
Potencia de la recomendación
- •
Categoría A. Buena. Apoya la recomendación de uso.
- •
Categoría B. Moderada. Apoya la recomendación de uso.
- •
Categoría C. Escasa para apoyar la recomendación de uso o contra su uso.
- •
Categoría D. Moderada evidencia que apoya la recomendación contra su uso.
- •
Categoría E. Buena evidencia que apoya la recomendación contra su uso.
- •
- 2.
Calidad científica de la recomendación
- •
Grado I. Basada en al menos un ensayo controlado y aleatorizado, bien diseñado.
- •
Grado II. Basada en al menos un ensayo bien diseñado, sin aleatorización, desde estudios analíticos de cohortes o casos y controles (preferiblemente de más de un centro), desde múltiples series temporales, o desde resultados muy evidentes en experimentos no controlados.
- •
Grado III. Basada en las opiniones de expertos respetados, en la experiencia clínica, estudios descriptivos o comités de expertos.
- •
SEIMC: Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica; SEGO: Sociedad Española de Ginecología y Obstetricia; SEN: Sociedad Española de Neonatología; SEQ: Sociedad Española de Quimioterapia; SEMFYC: Sociedad Española de Medicina Familiar y Comunitaria.
La parte de recomendaciones de este documento se ha publicado en la revista Progresos de Obstetricia y Ginecología, 2012;55(7):337–46 como protocolo asistencial, por la Sociedad Española de Ginecología y Obstetricia; en la Revista Española de Quimioterapia, y como documento de trabajo por la Escuela Andaluza de Salud Pública.