El desarrollo de una vacuna preventiva contra el virus de la inmunodeficiencia humana de tipo 1 (VIH-1) es una de las mayores esperanzas para el control de la pandemia en los próximos años. Sin embargo, es claro que una de las mayores dificultades de una vacuna contra el virus es su alta tasa de mutación, lo que le permite evadir la respuesta inmune del húesped. La producción de anticuerpos neutralizantes (AcN) contra la envoltura vírica parece tener un papel importante en el control de la infección y en la ejecución de una protección eficaz luego de la inmunización. Diversos trabajos han mostrado que el dominio V1/V2 de la glucoproteína 120 del VIH-1 se encuentra involucrado en el tropismo vírico durante la infección, en el enmascaramiento de epítopes neutralizantes conservados, en los cambios conformacionales tras la unión a los correceptores y en la inducción de AcN. Sin embargo, hay pocos estudios enfocados sobre este dominio. Por otra parte, por ser uno de los dominios altamente glucosilados, numerosos estudios han determinado la influencia de los hidratos de carbono sobre la producción de AcN. Por tanto, la presente revisión está enfocada en la importancia de los AcN dirigidos contra epítopes de las regiones variables (principalmente V1/V2), su importancia en la protección contra la infección por el VIH-1, el papel que desempeñan esas regiones en la evasión de la respuesta inmune y, finalmente, se discute la importancia de los AcN en la búsqueda de una vacuna eficaz contra el virus.
The development of a preventive vaccine against human immunodeficiency virus type-1 (HIV-1) provides hope for control of the pandemic over the coming years. Nevertheless, it is clear that one of the greatest difficulties in achieving this vaccine is the high mutation rate of the virus, which enables it to evade the host's immune response. The production of neutralizing antibodies (NAb) against the HIV-1 envelope proteins is believed to play an important role in controlling the infection and in providing effective protection following vaccination. Several studies have shown that the V1/V2 domain of the HIV-1 gp120 envelope protein is involved in viral tropism during infection, in masking conserved neutralizing epitopes, in the conformational changes occurring after coreceptor binding, and in NAb induction. Nonetheless, this domain has been poorly investigated. However, because the V1/V2 domain is highly glycosylated, numerous studies have determined the influence of carbohydrates on NAb production. The present review focuses on the importance of NAb directed against epitopes of the variable regions, mainly V1/V2, their importance in protecting against HIV-1 infection, and the role these regions play in evading the immune response. Lastly, we will discuss the importance of NAb in the search for an effective vaccine against HIV-1.
Los anticuerpos producidos durante la infección por el virus de la inmunodeficiencia humana de tipo 1 (VIH-1) son sintetizados pocas semanas después de la primoinfección; algunos son importantes en el diagnóstico de la enfermedad (anticuerpos contra la proteína 24)1, y otros, conocidos como anticuerpos neutralizantes (AcN), que tienen la capacidad de neutralizar el virus y están dirigidos contra la envoltura vírica, esencialmente contra epítopes de la glucoproteína 120 (gp120)2. Numerosos estudios han reportado la correlación entre la presencia de AcN y el estadio de la enfermedad3. Sin embargo, hay una gran controversia entre la eficacia de estos anticuerpos y el verdadero beneficio que éstos representan en los pacientes4. Los AcN dirigidos contra las proteínas de envoltura del virus representan la primera línea de defensa en las respuestas adaptativas contra el VIH-1. En la última década se han descrito numerosos anticuerpos policlonales y monoclonales (AcM) capaces de neutralizar un gran número de aislamientos primarios; de esta forma, esto indica que hay ciertas regiones de la envoltura que se encuentran altamente conservadas entre los diferentes tipos del virus5,6. Sin embargo, es bien conocido que la mayoría de los aislamientos primarios son refractarios a la acción de estos AcN, lo que representa uno de los principales problemas en la realización de una vacuna eficaz contra el VIH-1. Se han identificado diferentes dominios, como los causantes de la producción de estos AcN; se han descrito AcN contra las regiones variables (V1 a V5) de la gp120, especialmente contra la región V3. Otros reportes, incluidos estudios clínicos, muestran que la región V1 es altamente inmunogénica y que induce la producción de AcN7,8. Por tanto, en los últimos años, las regiones V1 y V2 han sido objeto de estudio de diferentes grupos, ya que se ha demostrado que además de inducir AcN, también desempeñan un papel fundamental tanto en el tropismo vírico como en la infección de las células blanco9,10. Por otra parte, estudios más recientes han demostrado que las regiones V1 y V2 enmascaran y protegen los epítopes neutralizantes más conservados de la gp1209.
En la presente revisión se hará un análisis de las características principales de las regiones V1 y V2, de su papel en el proceso de infección, de su importancia en el doble y contradictorio papel de enmascaramiento de epítopes inductores de AcN y, a la vez, de su capacidad para inducir estos anticuerpos.
Virus de la inmunodeficiencia humana de tipo 1Proteínas de envoltura vírica: glucoproteína 41 y glucoproteína 120En el retículo endoplásmico de las células infectadas se sintetizan las glucoproteínas víricas como precursores; posteriormente, en el aparato de Golgi se adicionan cadenas ricas en azúcares, lo que lleva a la formación de la glucoproteína 160 (gp160), que finalmente es procesada por la proteasa celular furina, lo que genera la forma madura gp120 y gp4111. Una vez que las 2 proteínas alcanzan la membrana celular de la célula infectada son incorporadas por las partículas víricas que se liberan en los pasos finales del ciclo replicativo vírico. Tanto la gp120 como la gp41 presentan una gran variabilidad (más de un 35%) en la secuencia primaria entre los diferentes subtipos del VIH-1 descritos12. Esta variabilidad genética es fundamental en la evasión de la respuesta inmune sobre la acción de los AcN, así como en el desarrollo de la resistencia a los antirretrovíricos13.
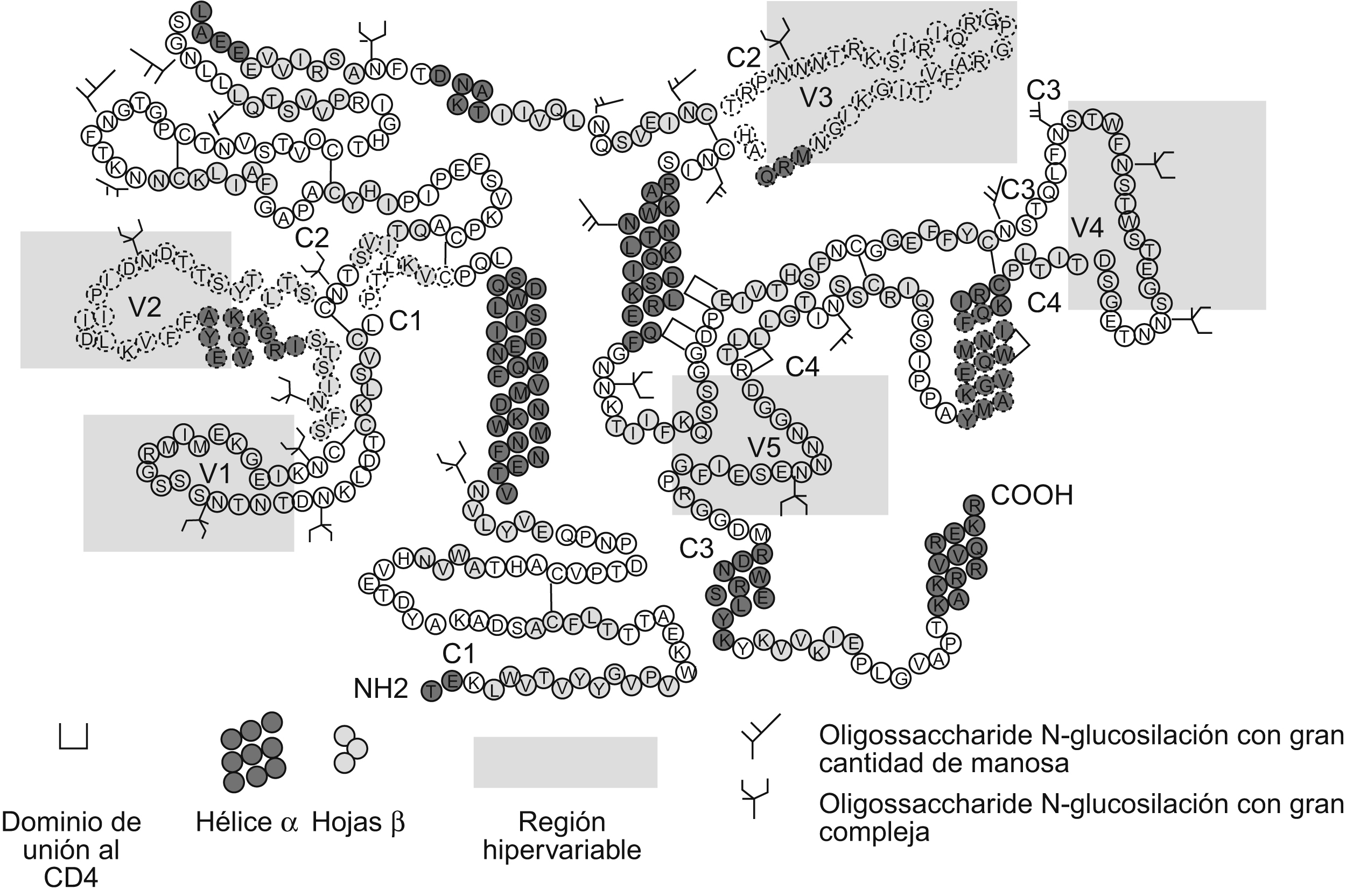
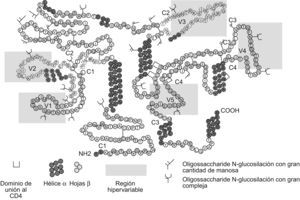
La gp120 (figura 1) está compuesta por 5 regiones variables (V1 a V5) y 5 regiones constantes (C1 a C5)14 que tienden a ser similares entre los diferentes aislamientos víricos. Las regiones V1 y V2 se encuentran unidas por puentes de disulfuro y forman el dominio V1/V2; las otras 3 regiones (V3, V4 y V5) forman asas independientes dentro de la gp120. En las diferentes regiones variables y constantes se encuentran distribuidos 24 sitios de glucosilación: las regiones constantes C1 a C5 presentan 15 sitios de glucosilación. En las regiones variables se encuentran 9 sitios de glucosilación: 3 en la región V1; 2 en la región V2; uno en la región V3; 2 en la región V4, y finalmente uno en la región V515.
Figura 1. Estructura de la glucoproteína 120 con las regiones variables (V1-V5) delimitadas por la sombra amarilla y las regiones constantes (C1-C5), igualmente que los sitios de glucosilación. En el diagrama se observan las 5 regiones que contienen residuos de azúcares N en forma de rama. Los epítopes que inducen anticuerpos neutralizantes están marcados con líneas discontinuas. En el caso del dominio V1/V2, estos epítopes están ubicados en la región V2. Tomada de Moog et al en 1997.
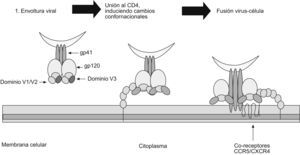
Función de las glucoproteínas 120 y 41 durante las etapas tempranas de la infección por el virus de la inmunodeficiencia humana de tipo 1Aunque el tropismo del VIH-1 está definido por receptores específicos en la superficie celular, la unión temprana de los viriones a la célula está mediada por una variedad de moléculas que incluye el heparán sulfato16, la molécula de adherencia celular LFA-117, la nucleolina18 y el receptor DC-SIGN, importante en la transmisión (en trans) del VIH-1 entre las células dendríticas y los linfocitos T CD4+, mecanismo que representa una etapa crucial en el establecimiento de la infección19. Como la afinidad de las glucoproteínas víricas con el CD4 es relativamente baja (especialmente en los aislamientos primarios)20, es por la existencia de otras moléculas en la superficie celular que hay una buena concentración de virus antes de que se inicie la interacción específica entre las proteínas víricas y los receptores celulares21. La entrada del VIH-1 a la célula involucra la unión de la gp120 con el receptor de membrana CD4, que se expresa principalmente en una subclase de linfocitos T, pero igualmente puede encontrarse en otras poblaciones celulares del sistema inmune como los monocitos y las células dendríticas22. La unión entre la gp120 y el CD4 conlleva cambios conformacionales tanto de la gp120 como del CD4; esto facilita la interacción con los correceptores CCR5 y CXCR4 que corresponden a receptores de quemocinas. El receptor CXCR4 es el mayor correceptor para un grupo de virus fenotípicamente identificado denominados virus T-trópicos (X4); por su parte, CCR5 es el principal correceptor de virus M-trópicos (R5)23,24. Sin embargo, también se han aislado virus con tropismo por los 2 tipos de correceptores. Es claro que CCR5 y CXCR4 representan in vivo los principales correceptores para el VIH-1. Sin embargo, es importante señalar que en la literatura médica se han descrito otros correceptores alternativos menores para el VIH-1 tales como el CCR2B, el CCR3, el CCR8, el GPR15, el STRL33, el US28, el CX3CR1, el APJ y el chemR2325 y, aunque su función in vivo y durante el transcurso de la infección no es muy clara, estos correceptores pueden amplificar enormemente el número de células blanco del virus. La unión a los correceptores produce nuevos cambios conformacionales y permite la disociación entre la gp120 y la gp41, y de esta forma da nacimiento al péptido de fusión que permite la unión entre las 2 membranas26,27. Una vez en el citoplasma, el virión experimenta un desensamblaje progresivo, conocido como desnudamiento, que conlleva la liberación de las moléculas de ácido ribonucleico y de las proteínas víricas involucradas en los episodios posteriores del ciclo vírico.
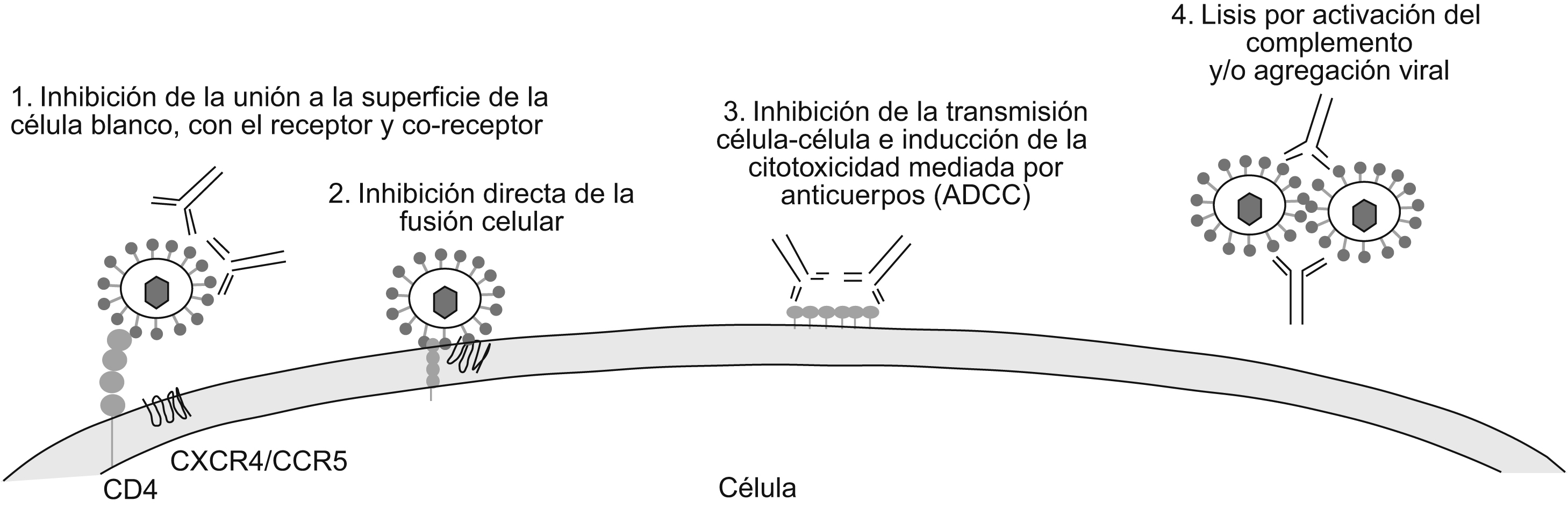
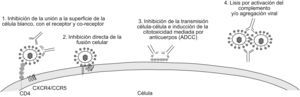
Respuesta inmune contra el virus de la inmunodeficiencia humana de tipo 1Típicamente, una respuesta inmune eficaz contra una infección vírica incluye la activación de la respuesta celular, crucial para el control y la erradicación de la infección, y la respuesta humoral, determinante en la prevención y modulación de la infección. La respuesta celular incluye, principalmente, la activación de los linfocitos T CD8+ citotóxicos que reconocen y eliminan las células infectadas que presentan antígenos víricos de superficie, bajo el contexto del complejo mayor de histocompatibilidad de tipo i . Por su parte, la respuesta humoral se encarga de la producción de los AcN, que permiten reducir de manera eficaz el inóculo infeccioso en el transcurso de las primeras etapas de la replicaciones28 e interferir en la infección de nuevas células29. En la infección por el VIH-1 los primeros anticuerpos producidos durante la infección no poseen actividad neutralizante1. Los AcN tardan más tiempo en producirse3,30,31 y están dirigidos principalmente contra las glucoproteínas de envoltura vírica (esencialmente contra la gp120, que se encuentra anclada en la superficie vírica debido a la gp41)2. Sin embargo, estudios más recientes de Richmann et al han demostrado que los AcN se producen desde las primeras etapas de la infección32. Los anticuerpos que se generan durante la infección por el VIH-1 pueden proteger a través de diversos mecanismos (figura 2). El principal mecanismo y el más estudiado es la neutralización de partículas víricas libres, que reduce la infectividad del virus mucho antes de que se inicien los mayores episodios del ciclo vírico. Se han descrito numerosos anticuerpos con capacidad neutralizante. Entre éstos se pueden encontrar AcN dirigidos contra las glucoproteínas de envoltura que en su mayoría son anticuerpos específicos de los hidratos de carbono, como el 2G1233,34; otros tienen la capacidad de inhibir la unión a las moléculas de adherencia35. También se han descrito anticuerpos específicos de diferentes regiones de la gp120 como los que se unen al dominio CD4bs (o al sitio de unión al CD4) como b12 y 15e36,37. Otro grupo de AcN reconoce epítopes discontinuos en el sitio de unión a los correceptores, que se exponen luego de la unión de la gp120 al CD4 y son generalmente conocidos como anticuerpos anti-CD4i (como el 17b y el X5)38,39,40; igualmente se han descrito anticuerpos específicos contra los dominios V2, como el 697-D 41, y V3, como el 19b, 447/52-D42,43,44. Otro mecanismo de acción de los anticuerpos igualmente importante es la inhibición de la fusión luego de la adherencia; en este caso vale la pena resaltar a los anticuerpos 2F5, 4E10 y Z13 que reconocen un epítope localizado en la membrana proximal externa de la gp4145,46. Mecanismos adicionales como la virólisis mediada por el complemento, la agregación de partículas víricas infecciosas y la citotoxicidad celular dependiente de anticuerpos (CCAD) pueden desempeñar un papel importante en la reducción de la infectividad vírica47. Sin embargo, un último estudio de Burton et al demostró que en un modelo de macacos la CCAD es más importante que la activación de complemento en la reducción de las partículas víricas48. Otros estudios han demostrado que los anticuerpos no neutralizantes pueden activar intracelularmente el transporte de inmunoglobulina A (IgA) o inmunoglobulina M polimérica a través del epitelio de la mucosa y neutralizar partículas víricas en transcitosis28.
Figura 2. Mecanismos de acción de los anticuerpos neutralizantes contra el virus de la inmunodeficiencia humana de tipo 1. 1) Anticuerpos unidos a las proteínas de envoltura víricas inhiben la interacción entre el virus y la célula blanco debido a la ocupación de los sitios de unión con los receptores y correceptores. 2) Luego de la unión a los receptores y correceptores víricos y a causa de los cambios conformacionales, los anticuerpos netralizantes pueden inhibir la fusión de membranas y también la entrada vírica. 3) Los anticuerpos neutralizantes pueden, de igual forma, inhibir la transmisión vírica de célula a célula y activar la citotoxicidad mediada por anticuerpos, llevando a cabo la lisis de células infectadas. 4) Otros mecanismos como la agregación y la virólisis por activación de complemento desempeñan un papel importante en la neutralización.
Papel de las diferentes regiones de la envoltura en la inducción de los anticuerpos neutralizantes dirigidos contra el virus de la inmunodeficiencia humana de tipo 1La identificación de los epítopes involucrados en la inducción de Ac capaces de proteger contra el VIH-1 ha sido uno de los trabajos más destacados de los últimos 10 años. El fruto de estos estudios ha mostrado que el VIH-1 es capaz de inducir una respuesta policlonal de anticuerpos, y que esta respuesta está dirigida contra diferentes proteínas víricas. Debido a los estudios con sueros policlonales se ha identificado la especificidad de estos anticuerpos y su asociación con la protección que éstos confieren. Sin embargo, es a causa de los trabajos con anticuerpos monoclonales humanos (AcMH) que se han podido definir claramente los epítopes con capacidad neutralizante y su localización precisa tanto en la gp120 como en la gp4149,50,51,52.
Los epítopes descritos en la gp41 inducen AcN contra diferentes aislamientos primarios; ejemplos de éstos son los AcM 4E10, Z13 y 2F5, que están dirigidos contra una secuencia lineal relativamente conservada del ectodominio de la gp4145,46,53. Sin embargo, se ha reportado que la gp41 es poco inmunogénica, especialmente el epítope reconocido por 2F5 (ELDKWA), y los diferentes autores aseguran que este epítope requiere un contexto molecular particular, pero que ese contexto reduce la eficacia en la presentación al sistema inmune46,54.
El dominio de unión al CD4 de la gp120 o CD4bs (del inglés CD4-binding site) es altamente conservado y, como su nombre lo indica, es el causante de la interacción entre la envoltura del virus y la molécula CD4 en la superficie de las células blanco. Es de notar que la mayoría de los anticuerpos anti-CD4bs tienen la particularidad de ser no neutralizantes contra aislamientos primarios36,37. Una excepción es el AcMH IgG1b12, que es un anticuerpo recombinante que posee una actividad neutralizante contra aislamientos primarios55, con el que se pudo deteminar el papel crucial del dominio CDbs en la infección contra el VIH-1. Se han descrito anticuerpos contra el dominio CD4i en un subgrupo de pacientes infectados, y debido a estas observaciones se ha determinado que ese epítope es altamente inmunogénico y que desempeña un papel importante en la unión a los receptores de quemocinas luego de los cambios conformacionales ocurridos tras la unión entre la gp120 y el CD4. Esto demuestra que es un epítope que se expone en forma transitoria, por lo que la cantidad de anticuerpos dirigidos contra esa región puede ser bastante reducida. Los anticuerpos descritos contra el epítope como el 17b han sido de gran utilidad para la cartografía de la gp120, pero desafortunadamente éste y otros anticuerpos específicos del dominio (48D) han mostrado una limitada actividad neutralizante contra aislamientos primarios39,40. Por el contrario, los fragmentos de unión al antígeno y una sola cadena del fragmento pueden neutralizar aislamientos primarios de manera efectiva39. La posible explicación a este fenómeno puede ser una simple cuestión de conformación, ya que se sabe que la distancia entre el CD4i y la membrana celular es muy corta, lo que hace imposible que una IgG completa pueda acomodarse para ejercer su función neutralizante39. Alrededor de un 50% de la masa de la gp120 está compuesta de hidratos de carbono56. Se han descrito AcMH contra regiones glucosiladas con capacidad neutralizante contra cepas de laboratorio y contra aislamientos primarios, como el 2G1234,57. El 2G12 reconoce un epítope único, poco inmunogénico57 en una región rica en hidratos de carbono. Estudios cristalográficos recientes han determinado que la estructura del anticuerpo es poco usual y permite mútiples interacciones con un grupo de hidratos de carbono de tipo manosa altamente conservado58. Otra propiedad interesante de este Ac es que posee la capacidad de activar la CCAD y la cascada del complemento57. Sin embargo, a pesar de todas estas propiedades, quedan muchos interrogantes sobre la utilización de este epítope en el diseño de una vacuna, ya que los mecanismos de neutralización de este anticuerpo no están claramente definidos.
Las regiones variables V2 y V3 han sido descritas como potentes inductoras de AcN; sin embargo, se presentan múltiples inconvenientes al momento de pensar en el valor real de estos epítopes como candidatos vacunales. Una de las principales dificultades es que estas regiones sólo inducen anticuerpos específicos para cada aislamiento, y además, por su naturaleza altamente variable, es inevitable que el virus escape a la acción de estos anticuerpos59. En lo que concierne a la región V1/V2, hay un gran escepticismo ya que la mayoría de los anticuerpos dirigidos contra esa región son antigenoespecíficos y, a pesar de su capacidad neutralizante sobre aislamientos primarios y de ser un epítope inmunogénico41,60 los estudios en la región V1/V2 aún muestran muchas divergencias. Por mucho tiempo, se ha considerado a la región V3 como el principal inductor de la respuesta neutralizante61. Los diferentes trabajos han mostrado que es un epítope altamente inmunogénico pero que, al igual que el dominio V1/V2, la mayoría de estos AcN son tipoespecíficos62,63. Sin embargo, estudios recientes han mostrado que AcN monoclonales contra V3 pueden tener una acción neutralizante no solamente contra aislamientos de tipo B64,65 sino también contra aislamientos de tipo A y F42. Estudios estructurales del dominio V3 mostraron que éste posee estructuras conservadas que son importantes para la interacción con los correceptores de quemocinas, lo que demuestra de esta forma la gran importancia de V3 en la infectividad vírica66. La característica de poseer regiones conservadas hace que V3 sea una región semiconservada, lo que explica claramente la presencia de AcN de reactividad cruzada67. Por una parte, algunos estudios han demostrado que deleciones en esa región variable conllevan la producción de partículas víricas no infecciosas68. Por otra parte, diferentes autores han demostrado que la poca actividad neutralizante de estos anticuerpos contra las regiones variables es el resultado de una combinación de inmunodominancia de las regiones hipervariables (V1 a V5), lo que permite que el virus pueda escapar con facilidad a la neutralización69,70.
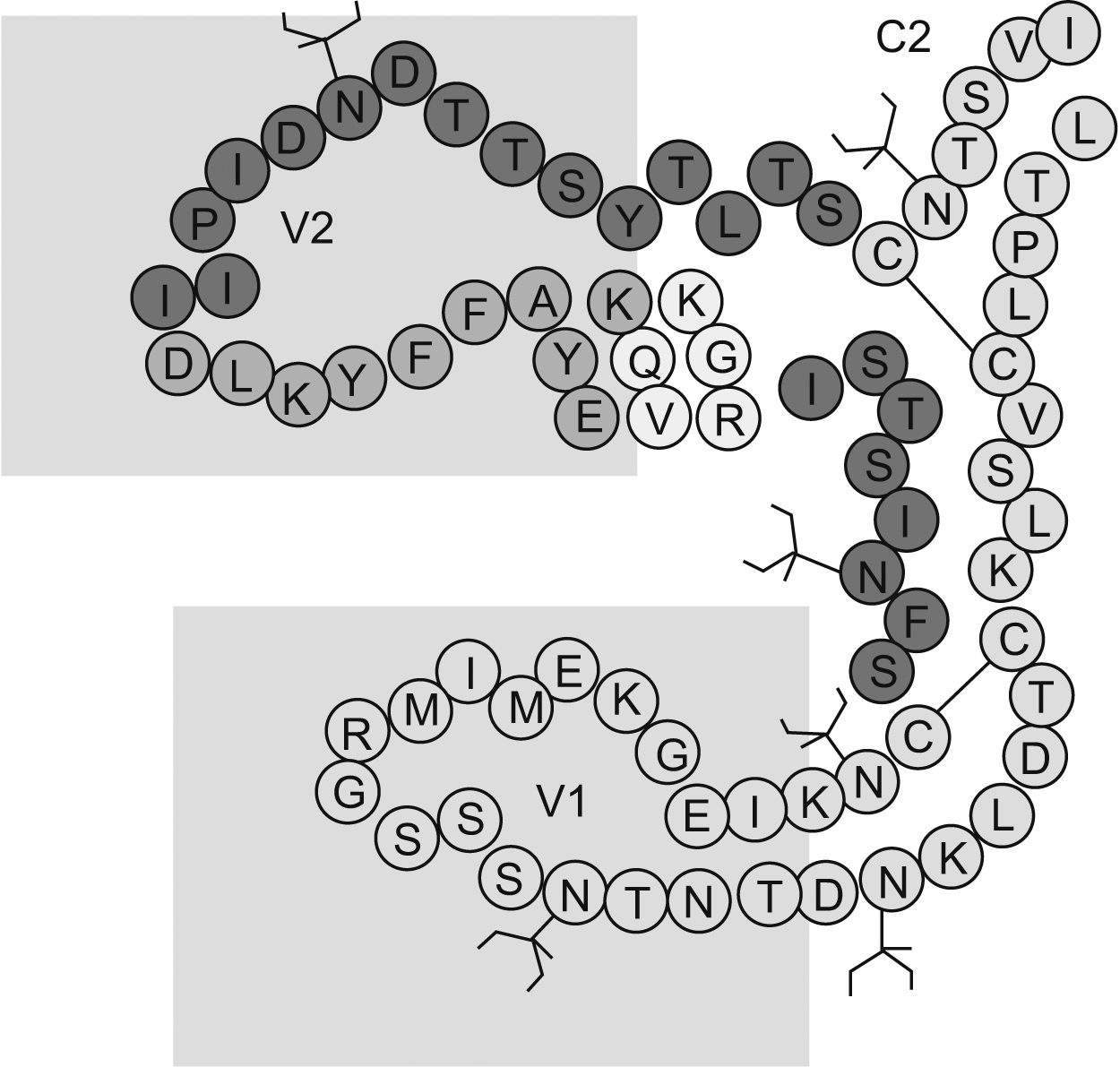
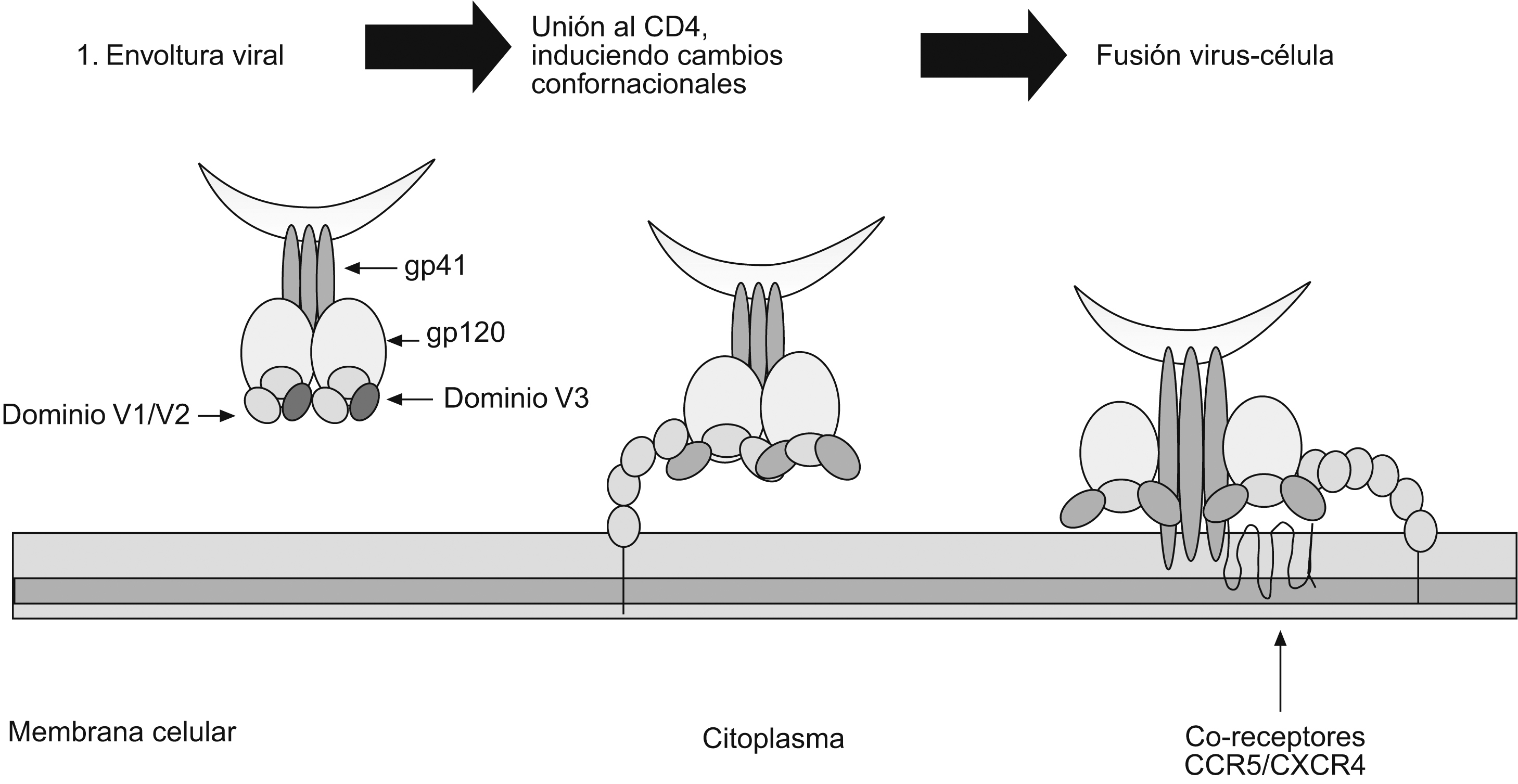
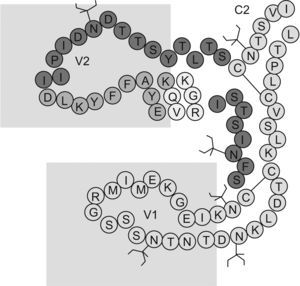
El papel del dominio V1/V2 en la inducción de anticuerpos neutralizantesEl dominio V1/V2 está conformado por 2 regiones hipervariables y se caracteriza por presentar una secuencia de aminoácidos muy heterogénea. Contiene epítopes lineales y conformacionales que acumulan inserciones y deleciones, que son críticas para su funcionamiento y presentan, además, diferentes patrones de glucosilación (figura 3). El dominio V1/V2 desempeña un papel importante en el tropismo vírico y en la regulación de la entrada del virus a la célula, incluida la utilización del receptor independiente de CD471,72,73,74,75. Se ha documentado que mutaciones de aminoácidos conservados en el dominio V1/V2 interfieren con la formación de sincitios in vitro73 e incrementan la afinidad de los anticuerpos a epítopes que enmascaran los sitios de unión al CD4 y a los correceptores, lo que demuestra que el dominio V1/V2 puede ocultar epítopes conservados, blanco de los AcN68,76,77 (figura 4). Trabajos recientes lo han mostrado como un dominio regulador en la sensibilidad de los aislamientos primarios a la neutralización, debido igualmente a su capacidad de enmascarar epítopes9. Los AcMH dirigidos contra la región V2 han sido aislados y caracterizados a partir de pacientes seropositivos. Uno de estos estudios reporta el anticuerpo 697-D, dirigido contra un epítope conformacional (aproximadamente 20 aminoácidos entre el segmento 164 y 194 de la gp120) relativamente conservado en la región V2 (figura 3)41. Los autores sugieren que su reconocimiento depende de la conformación, ya que al desnaturalizar la gp120 su afinidad disminuye; además, presenta un débil reconocimiento de péptidos lineales. Este AcMH posee actividad neutralizante contra algunos aislamientos primarios, pero no contra cepas de laboratorio41. Debido a otro AcM (C108g) específico para la región V2 aislado a partir de un chimpancé infectado con la cepa vírica HXB278,79 se evidenció que el dominio V2 es un excelente blanco vacunal. El C108g es un anticuerpo específico que está dirigido contra la región N-terminal de V2, entre los aminoácidos 162 y 169, que corresponde a un epítope dependiente de glucosilación y se encuentra expuesto en la superficie de la partículas víricas (HXB2). Igualmente, se demostró que este anticuerpo es capaz de neutralizar cepas víricas a concentraciones más bajas que cualquier otro anticuerpo utilizado80,81. Adicionalmente, su actividad neutralizante es sinérgica con anticuerpos dirigidos contra la región V3 o contra el sitio de unión a CD480. Estudios más recientes demostraron que C108g es capaz de neutralizar aislamientos M-R582, que son relativamente resistentes a los AcN debido al enmascaramiento antigénico. El conjunto de todos estos resultados muestran que los AcM específicos para la región V2 presentan una buena actividad neutralizante, pero esta actividad es más efectiva en cepas víricas adaptadas a laboratorio que en aislamientos primarios. Posiblemente se deba a que la región V2 no sólo es variable en la secuencia primaria, sino también en longitud, a consecuencia de deleciones o inserciones que eliminan elementos conservados que pueden ser un mayor blanco de neutralización; o a consecuencia de cambios conformacionales9,71,73,83. Otros AcM descritos con capacidad de reconocer epítopes conformacionales, como es el caso de los AcM G3-136 y BAT-085, que reconocen epítopes lineales (aminoácidos 169 a 183) dentro de V2, han mostrado una actividad neutralizante contra el VIH-1 sin bloquear la unión al receptor60. Por otra parte, Rong et al evaluaron la contribución del dominio V1/V2 en la sensibilidad a la neutralización del VIH-1 por parte de anticuerpos autógenos. El trabajo demostró que el incremento en la longitud del dominio V1/V2 y pequeñas mutaciones, como cambios de treonina por isoleucina y de treonina por lisina, son mecanismos que le permiten (para el caso de virus del subtipo C) escapar a la neutralización por anticuerpos autógenos83. Por otra parte, en ausencia de V1/V2 se observó un aumento en la sensibilidad a la neutralización de los diferentes subtipos, incluso del subtipo B, que normalmente es resistente a la neutralización por AcM contra V384. Esto demuestra el papel del dominio V1/V2 en la modulación de la actividad neutralizante de los Ac contra V384. El dominio V1/V2 se encuentra precedido por un pequeño tallo de aminoácidos conservados, que están involucrados en la unión del virus con el receptor85; es probable que esta pequeña región de aminoácidos dentro del dominio desempeñe un papel importante como blanco para los AcN. Sin embargo, teniendo en cuenta que hasta el momento no se han descrito anticuerpos específicos dirigidos contra esta región, se puede dar paso a varias hipótesis: a) que es un sitio poco inmunogénico; b) que se expone de manera poco frecuente30, o c) que hay una vía de evasión de la neutralización, en la que el dominio V1/V2 puede estar involucrado83.
Figura 3. Estructura de las regiones variables V1 y V2. El dominio V1/V2 presenta entre 5 y 11 sitios de N-glucosilacion, representados en el diagrama en forma de rama. Contiene epítopes lineales y conformacionales y se caracteriza por tener una composición de aminoácidos muy heterogénea; sin embargo, presenta un epítope relativamente conservado (púrpura), que es blanco de los anticuerpos neutralizantes.
Figura 4. Visión general de las etapas importantes durante la infección de las células blanco por el virus de la inmunodeficiencia humana. Papel de las diferentes estructuras involucradas en la unión de la glucoproteína 120 a los receptores y correceptores. 1) Estructura trimérica funcional de la glucoproteína 160 en el diagrama la región V1/V2 (púrpura) y V3 (verde), en la que se puede observar la función de enmascaramiento de epítopes de la parte de las 2 regiones variables. 2) Luego de la unión de la glucoproteína 120 al receptor CD4, que induce cambios conformacionales, las regiones V1/V2 y V3 se abren permitiendo la unión a los correceptores. 3) Luego de los cambios conformacionales V1/V2 y V3 se unen directamente a los correceptores, lo que induce otros cambios conformacionales que permiten la exposición de la glucoproteína 41 y la formación del péptido de fusión, además de otros epítopes neutralizantes.
Efecto de la glucosilación del dominio V1/V2 en el reconocimiento por los anticuerpos neutralizantesEl dominio V1/V2 posee epítopes altamente glucosilados, por lo que se ha sugerido que la glucosilación puede ser la causa de la baja actividad neutralizante observada; esto adquiere mayor importancia si se tiene en cuenta que entre los mecanismos de resistencia a la neutralización se encuentra la presencia de azúcares en ciertas regiones de la forma nativa de la gp12086, lo que puede ocasionar el enmascaramiento antigénico9,76. Igualmente, se han descrito epítopes de neutralización tipoespecíficos60,87,88, pero a la vez las deleciones que alteran las secuencias que codifican por los aminoácidos implicados en la glucosilación del dominio V1/V2 conllevan un incremento en la sensibilidad a la neutralización89. Este resultado refuerza la hipótesis de que la glucosilación es un mecanismo clave en la inducción y función de los AcN. Recientemente se demostró que la glucosilación del dominio V1/V2 del virus NL4-3 es indispensable para mantener la funcionalidad vírica y que, a la vez, enmascara los epítopes inductores de AcN90. Por otra parte, estudios recientes de este grupo de estudio desmostraron que hay anticuerpos de tipo IgA en saliva parótida (S-IgA) de pacientes seropositivos capaces de reconocer proteínas V1/V2 recombinantes de diferentes subtipos de aislamientos primarios (A, B y C), con la particularidad de que el reconocimiento por parte de las S-IgA es 16 veces mayor que las IgG séricas, y que este reconocimiento es dependiente de la glucosilación (Granados-Gonzalez et al. AIDS Research and Human Retroviruses, 2008. [En prensa]). En resumen, el conjunto de todos esos hallazgos demuestra que el dominio V1/V2 contiene epítopes blanco para la neutralización, pero se encuentran enmascarados por azúcares89.
Papel de los anticuerpos neutralizantes en la producción de una vacuna eficaz contra el virus de la inmunodeficiencia humana de tipo 1Como se mencionó anteriormente, la envoltura vírica es altamente glucosilada, lo que puede generar: a) pobre inducción de anticuerpos, pues los hidratos de carbono son poco inmunogénicos y pueden enmascarar epítopes inductores de AcN; b) las glucosilaciones producen cambios conformacionales en la gp120, lo que limita la accesibilidad a los epítopes neutralizantes en la región V3 pero no en la región V241 y c) la diversidad genética observada en la envoltura hace que los AcN sean efectivos sólo para ciertas cepas víricas y sólo en muy pocos casos presentan reactividad cruzada. Por otra parte, estudios recientes han mostrado que hay otros mecanismos más complejos que son importantes en el escape vírico a los AcN, como la oligomerización y la glucosilación del sitio de unión de la gp120 al receptor91. Sin embargo, teniendo en cuenta que una vacuna eficaz contra el VIH-1 debe asegurar la producción de AcN que sean capaces de inhibir la mayoría de las cepas víricas, hoy es claro (y con las evidencias que se mostraron anteriormente) que es absolutamente necesario continuar estudiando el papel de estos anticuerpos en la infección por el VIH-1 para entender la relación existente entre la estructura de la envoltura vírica y la capacidad de inducción de los AcN. Por otra parte, con los resultados encontrados en el transcurso de los últimos 10 años se puede asegurar que una única vacuna que sea eficaz contra todas las cepas víricas de VIH-1 es casi una utopía debido a la gran diversidad genética del virus. Es por esto que el diseño de una vacuna polivalente que sea capaz de representar los tipos más frecuentes del virus ha sido el estudio de numerosos equipos en los últimos años y, probablemente, la única forma de encontrar finalmente una vacuna eficaz contra el VIH-1.
ConclusionesLa importancia de estudiar el domino V1/V2 como una herramienta para el diseño de vacunas radica en que este dominio, junto con la región V3, son causantes de los cambios conformacionales llevados a cabo en el momento de la interacción entre virus y célula. Además, se ha descrito que al inmunizar ratones con proteínas correspondientes a las regiones variables de la gp120, sin la presencia del dominio V1/V2, los animales no son capaces de generar AcN, lo que demuestra que este dominio también es importante en términos de inmunogenicidad para la inducción de AcN92. Si bien las regiones variables son reconocidas como inductoras de la producción de AcN, persiste cierto escepticismo acerca del verdadero rol de estos anticuerpos frente a una infección natural por el VIH-1; en primer lugar, porque generalmente esos anticuerpos son específicos para ciertos aislamientos víricos únicamente y, en segundo lugar, porque la misma naturaleza variable de esas regiones hace pensar que inevitablemente el VIH-1 está «programado» para escapar de los AcN fácilmente, y es precisamente por esta misma razón que es necesario continuar la búsqueda de epítopes inductores de AcN, en las regiones variables de la gp120 de los diferentes subtipos víricos.
La comprensión no sólo de los mecanismos de inducción de los AcN sino también de los mecanismos de funcionamiento es indispensable en un futuro próximo para el diseño racional de una vacuna eficaz. Actualmente se cuenta con mucha información sobre la funcionalidad de las regiones variables (V1-V5), en especial del dominio V1/V2 (como se discutió en la presente revisión), que puede utilizarse en la búsqueda de nuevas estrategias orientadas a producir una vacuna eficaz y universal. Además, por ser un dominio altamente glucosilado puede utilizarse como modelo para determinar el papel de esta modificación postraducional, en la inducción o en el bloqueo de una respuesta inmune efectiva, capaz de proteger al huésped. También es claro que durante la infección por el VIH-1, la respuesta humoral de AcN y no neutralizantes es insuficiente, lo que hace necesario el diseño de una vacuna igualmente inductora de la inmunidad celular para una efectiva protección. Las características del genoma vírico han permitido que se produzca una corriente constante de nuevas variantes y ciertas cepas recombinantes, ocasionadas por la acumulación de la sustitución de bases, inserciones y deleciones ocasionadas durante la replicación, o a la adición o pérdida de sitios de glucosilación. Posiblemente debido a esta estrategia, a pesar de que se produce una respuesta de anticuerpos, éstos son poco eficaces en el proceso de neutralización del virus y, por tanto, parecen no presentar una respuesta inmune protectora eficaz al huésped. En cuanto a lo estructural, el virus puede evadir el reconocimiento por los anticuerpos dirigidos contra las regiones constantes, porque las regiones variables, como V1/V2, se encargan de enmascararlas9,76,93.
Recibido 2 Agosto 2007
Aceptado 11 Febrero 2008
Autor para correspondencia. viviana.granados@univ-st-etienne.fr