La linfadenitis cervical es la infección más frecuente por micobacterias no tuberculosas (MNT) en niños inmunocompetentes, principalmente menores de 5 años. Durante años se ha considerado a Mycobacterium lentiflavum (M. lentiflavum) una inusual MNT causante de esta patología.
MétodosSe realizó un estudio retrospectivo, observacional desde 2009 a 2016, que incluyó a pacientes pediátricos del Hospital Infantil Universitario Niño Jesús de Madrid, diagnosticados clínicamente y microbiológicamente de linfadenitis cervical por MNT.
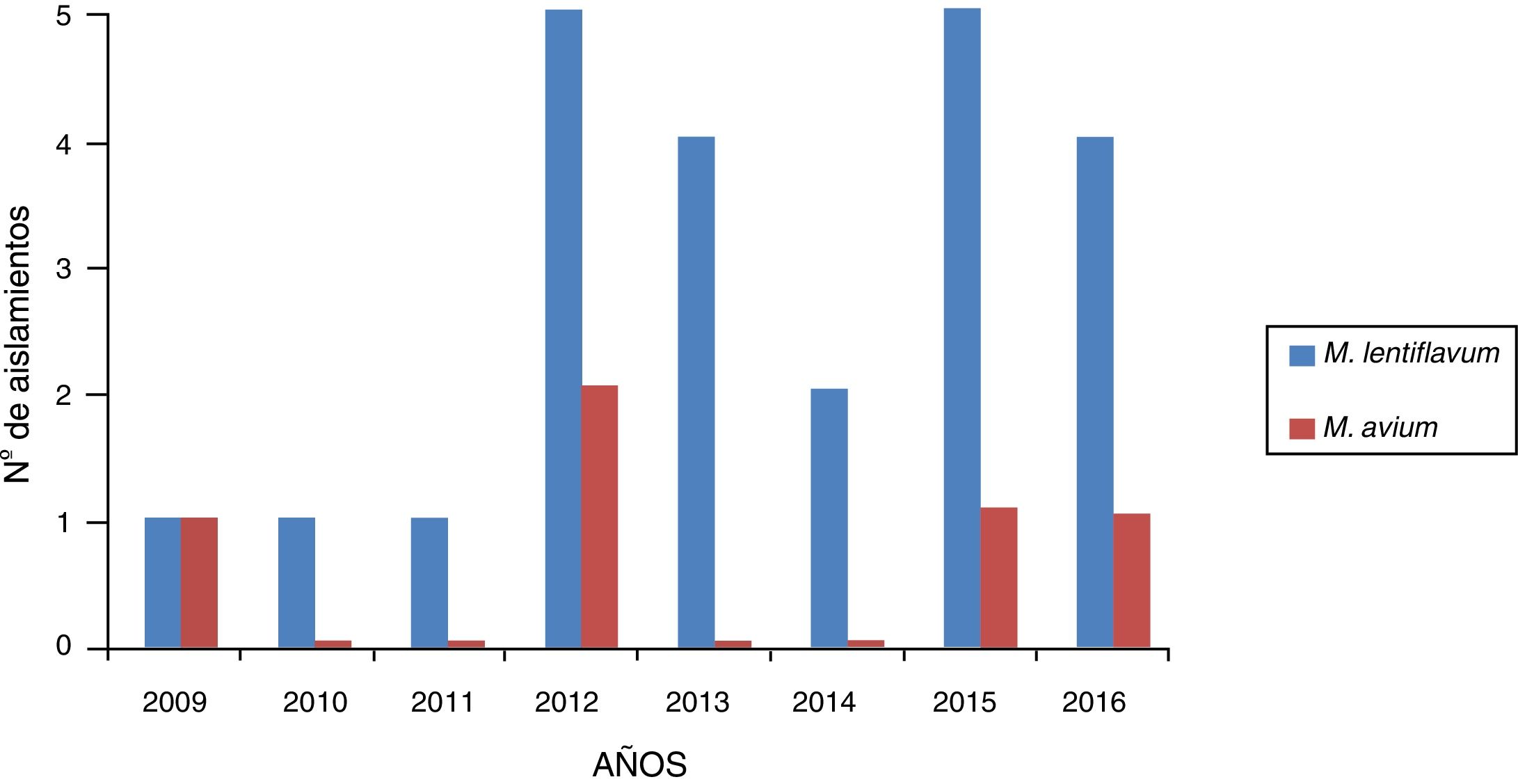
ResultadosEn el periodo estudiado se registraron 28 casos de linfadenitis cervical. En 23 (82,14%) pacientes se aisló M. lentiflavum y en 5 (17,85%), Mycobacterium avium. De los 23 pacientes con infección por M. lentiflavum, la localización más frecuente fue la submandibular (43,47%), 15 (65,21%) fueron niños, la media de edad global fue de 30,8 meses y todos los casos evolucionaron satisfactoriamente.
ConclusiónM. lentiflavum debe ser considerado como un importante patógeno emergente causante de linfadenitis cervical en población pediátrica.
Cervical lymphadenitis is the most common nontuberculous mycobacteria (NTM) infection in immunocompetent children, mainly in those under 5years. For many years Mycobacterium lentiflavum (M. lentiflavum) has been considered a rare NTM causing lymphadenitis.
MethodsA restrospective study was performed in pediatric patients with microbiologically confirmed NTM cervical lympahdenitis at the Niño Jesús Hospital in Madrid during 2009-2016.
ResultsDuring the period studied, 28 cases of cervical lymphadenitis were recorded. In 23 (82.14%) and in 5 (17,85%) cases, M. lentiflavum and Mycobacterium avium were isolated, respectively. In those patients infected with M. lentiflavum, the most frequent location was sub-maxilar (43.47%); 15 (65.21%) were boys, global median age was 30,8 months and all cases showed a satisfactory evolution.
ConclusionWe propose that M. lentiflavum should be considered an important emergent pathogen cause of cervical lymphadenitis in the pediatric population.
La linfadenitis cervical es la manifestación más frecuente de la infección por micobacterias no tuberculosas (MNT) en niños inmunocompetentes, principalmente menores de 5 años1-3. Las MNT son bacterias ubicuas, aisladas a partir de una gran número de fuentes como tierra, aguas naturales y de suministro, leche, polvo, aves y otros animales y de distribución mundial3,4. La linfadenitis cervical, o inflamación de los ganglios linfáticos, por MNT se produce tras la ingesta o inhalación de productos contaminados y supone entre un 10-20% de todas las linfadenitis cervicales en niños preescolares5. El hallazgo clínico más frecuente es la aparición de una masa indolora, única en la mayor parte de los casos, en la región submandibular, cervical anterior o preauricular.
En países desarrollados como EE. UU. y gran parte de Europa, Mycobacterium avium (M. avium) complex (MAC) es el principal agente responsable (70-80%)6. El segundo agente varía en función de los países, siendo Mycobacterium malmoense en Suecia y Reino Unido, y Mycobacterium haemophilum en Holanda e Israel7. En 1997 se describieron los 2primeros casos clínicos de linfadenitis producida por Mycobacterium lentiflavum (M. lentiflavum)8. Durante muchos años se ha considerado a M. lentiflavum como un patógeno inusual causante de linfadenitis cervical; sin embargo, en los últimos años en España y Australia se ha detectado un elevado incremento en el número de casos producidos por esta MNT, llegando a situarse como segunda causa de linfadenitis en niños solo por detrás de MAC9,10. Estos datos permiten considerar a M. lentiflavum como un patógeno emergente, responsable de linfadenitis cervical.
El objetivo de este estudio es describir los casos de linfadenitis cervical por MNT en los últimos años en la población pediátrica de nuestra Área de Salud, centrándonos en la epidemiología, las características clínicas y el tratamiento de los producidos por M. lentiflavum.
MétodosSe realizó un estudio retrospectivo, observacional, desde 2009 hasta 2016, que incluyó a pacientes pediátricos del Hospital Infantil Universitario Niño Jesús de Madrid, diagnosticados clínicamente de linfadenitis, en los que se obtuvo un aislamiento de MNT. El Hospital Infantil Universitario Niño Jesús es una institución pública del Servicio Madrileño de Salud que presta servicios sanitarios especializados en la especialidad de Pediatría y sus áreas específicas a pacientes pediátricos (de 0 a 18 años) de la Comunidad de Madrid y de todas las comunidades autónomas, de manera acorde con la normativa y legislación vigente. Se utilizó como base de datos el Sistema Informático del Laboratorio Servolab (Beckman Coulter, Inc., Brea, CA, EE. UU.).
Se revisaron las historias clínicas de los pacientes para obtener información de datos demográficos, clínicos y de tratamiento y evolución de los mismos. La realización del estudio fue aprobada por el Comité Ético de Investigación Clínica del Hospital Infantil Universitario Niño Jesús (código interno R-0053/16). El diagnóstico de las micobacterias fue realizado en el Servicio de Microbiología del Hospital Universitario de la Princesa de Madrid.
Las muestras para microbiología se obtuvieron mediante punción aspiración con aguja fina o biopsia de la lesión. La baciloscopia de muestra directa se realizó mediante la tinción de auramina y el cultivo de micobacterias se llevó a cabo en medio líquido MGIT (Becton-Dickinson Diagnostic Systems, Sparks, MD, EE. UU.), incubándose durante un máximo de 8 semanas en el sistema automatizado BACTEC MGIT 960 (Becton-Dickinson Diagnostic Systems, Sparks, MD, EE. UU.). Tras la detección de una muestra positiva por parte del sistema, se realizó una tinción de Ziehl-Neelsen y se cultivó en medio sólido Coletsos (Biomerieux, Lyon, Francia). La identificación de los aislamientos se realizó mediante la técnica GenoType CM/AS (HAIN Lifescience, Nehren, Alemania) y a partir de 2015 mediante la técnica de espectrometría de masas MALDI-TOF (Bruker-Daltonics, Bremen, Alemania), admitiéndose la identificación como aceptable cuando el score fue igual o superior a 1,8. En aquellos casos en los que la identificación no fue posible en nuestro laboratorio, los aislamientos se enviaron al Servicio de Micobacteriología del Centro Nacional de Microbiología (Instituto de Salud Carlos III) y esta se llevó a cabo mediante reacción en cadena de la polimerasa seguida de restricción enzimática del gen que codifica la proteína de choque térmico 65 (hsp65).
ResultadosSe registraron 28 casos de MNT de muestras de pacientes con linfadenitis: 23 causados por M. lentiflavum (82,14%) y 5 por M. avium (17,85%). De las 28 cepas, 2 fueron enviadas para su identificación al Centro Nacional de Microbiología, siendo finalmente identificadas como M. lentiflavum. En la figura 1 se muestra la distribución de los aislamientos en los 8años estudiados.
De los 23 pacientes pediátricos que presentaron linfadenitis por M. lentiflavum, 8 eran niñas y 15 niños, cuya media de edad era 30,8 meses (rango: 14-61 meses). Solo 3 de los pacientes presentaban algún antecedente clínico o enfermedad relevante: distrofia de Duchenne o meningitis neonatal o microcefalia leve. Los pacientes no presentaban ninguna inmunodeficiencia y todos eran residentes habituales de la Comunidad de Madrid.
La tabla 1 refleja las características clínicas y el tratamiento de los pacientes estudiados. Con relación al tratamiento, 5 (21,74%) de los pacientes recibieron tratamiento antimicobacteriano, requiriendo 3 de ellos también tratamiento quirúrgico: 2drenaje y escisión, y uno extirpación completa de la adenopatía. El tratamiento antimicobacteriano de este último consistió en claritromicina, rifabutina y etambutol. Los 2pacientes que requirieron drenaje recibieron uno claritromicina y rifampicina, y otro azitromicina y etambutol. Los 2pacientes cuyo tratamiento fue solo antimicobacteriano recibieron claritromicina.
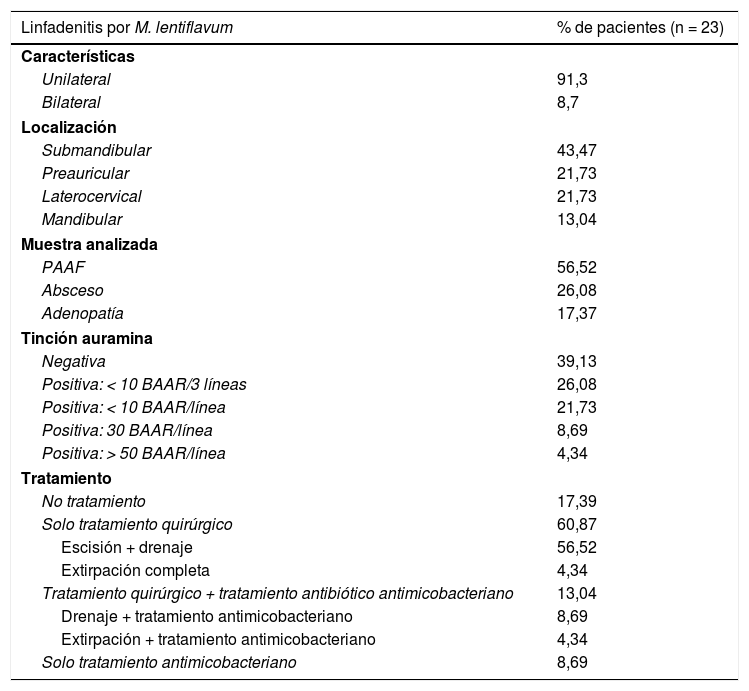
Características clínicas y tratamiento de los 23 pacientes que presentaron linfadenitis por M. lentiflavum en nuestra cohorte (2009-2016)
| Linfadenitis por M. lentiflavum | % de pacientes (n = 23) |
|---|---|
| Características | |
| Unilateral | 91,3 |
| Bilateral | 8,7 |
| Localización | |
| Submandibular | 43,47 |
| Preauricular | 21,73 |
| Laterocervical | 21,73 |
| Mandibular | 13,04 |
| Muestra analizada | |
| PAAF | 56,52 |
| Absceso | 26,08 |
| Adenopatía | 17,37 |
| Tinción auramina | |
| Negativa | 39,13 |
| Positiva: < 10 BAAR/3 líneas | 26,08 |
| Positiva: < 10 BAAR/línea | 21,73 |
| Positiva: 30 BAAR/línea | 8,69 |
| Positiva: > 50 BAAR/línea | 4,34 |
| Tratamiento | |
| No tratamiento | 17,39 |
| Solo tratamiento quirúrgico | 60,87 |
| Escisión + drenaje | 56,52 |
| Extirpación completa | 4,34 |
| Tratamiento quirúrgico + tratamiento antibiótico antimicobacteriano | 13,04 |
| Drenaje + tratamiento antimicobacteriano | 8,69 |
| Extirpación + tratamiento antimicobacteriano | 4,34 |
| Solo tratamiento antimicobacteriano | 8,69 |
BAAR: bacilos ácido-alcohol resistentes; PAAF: punción aspiración con aguja fina.
Los pacientes fueron estudiados para su evolución en la consulta de cirugía, no aportando la revisión de las historias clínicas ningún caso de secuela ni recidiva.
DiscusiónHasta nuestro conocimiento, este estudio representa la serie más amplia de casos de linfadenitis causada por M. lentiflavum en niños, con un total de 23 casos. Durante años, como se recoge en la literatura publicada, MAC era la principal MNT responsable de esta enfermedad en países desarrollados y el aislamiento de M. lentiflavum era muy inusual. Sin embargo, en los últimos años se han publicado 2estudios con series de casos en los que esta MNT era la segunda aislada con más frecuencia. Uno de ellos es un estudio multicéntrico nacional en Australia donde M. lentiflavum fue la segunda MNT por detrás de MAC10 y el otro se llevó a cabo en España y fue un estudio multicéntrico, retrospectivo de 2000 a 2010, en el que participaron 6 hospitales de Madrid, volviendo a ser M. lentiflavum la segunda MNT más aislada (37,7%) tras MAC (48,8%)9.
En cuanto a las características clínicas de las adenopatías de nuestra serie, la gran mayoría de ellas fueron unilaterales (91,3%) y con localización submandibular (43,47%). Ambas características coinciden con las reflejadas en otros estudios similares, tanto de adenopatías producidas por M. lentiflavum como por MAC3,9,11. Encontramos en nuestro estudio una tasa más elevada de muestras con tinción positiva; 60,87% frente a < 35%, pudiendo ser debido a distintos factores, entre los que caben destacar por un lado, la cantidad de muestra procesada, ya que en nuestro caso, se recibía también un frotis de la misma, realizado en el momento de la obtención y teñido después en nuestro laboratorio y, por otro, al tipo de tinción empleada, auramina frente a Zielh-Neelsen de otros trabajos3,9. Respecto al tratamiento, el 17,39% de nuestros pacientes tuvieron curación espontanea de la adenopatía y la mayoría (60,87%) recibieron solo tratamiento quirúrgico sin necesidad de antibióticos, siendo la escisión parcial y el drenaje la opción más frecuente. Esta es también otra diferencia respecto a una de las otras series publicadas, donde el 64,7% de los pacientes recibieron tratamiento combinado de cirugía y antimicrobianos, siendo la extirpación completa la opción quirúrgica más empleada9. Esta diferencia podría ser debida a criterios establecidos en las distintas guías médico-quirúrgicas de cada hospital.
El aumento en el número de aislamientos de M. lentiflavum en los últimos años se puede atribuir a diferentes factores: por un lado, la extensión, en un cada vez más importante número de laboratorios, de la utilización de medios líquidos automatizados para el aislamiento de micobacterias, se traduce en un incremento en la detección de estos microorganismos, como así lo avalan diferentes estudios12,13. A su vez, el incremento de la enfermedad estudiada en este trabajo, podría ser debido a la falta de un posible efecto de protección cruzada de la vacuna BCG, como se ha comentado previamente13. Finalmente, el aumento, y más en concreto de esta especie, podría ser explicado desde el punto de vista de la utilización de nuevas técnicas de diagnóstico molecular en los laboratorios clínicos. M. lentiflavum es difícil de distinguir de otras MNT mediante métodos fenotípicos y bioquímicos, por lo que es posible que en el pasado haya podido ser identificada erróneamente como MAC u otra MNT9,14. Las técnicas moleculares y más recientemente la espectrometría de masas son una herramienta vital para poder llevar a cabo una correcta identificación de las MNT a nivel de especie y pueden desempeñar un papel fundamental en este aspecto15.
Caben destacar algunas limitaciones en el estudio; la primera es que la serie refiere solamente aquellos casos con cultivo positivo y sería de gran interés recoger aquellos con alta sospecha de MNT en los que no hay evidencia de la micobacteria y comparar la evolución de los mismos (las técnicas de biología molecular podrían tener aquí un papel importante). Por otro lado, el grupo de pacientes estudiado no presentó ningún tipo de inmunodeficiencia; la comparación con resultados obtenidos a partir de población inmunodeprimida aportaría datos en el estudio de la epidemiología de M. lentiflavum.
Con el objeto de asentar estos hallazgos, consideramos necesaria la realización de estudios más amplios a nivel internacional para conocer si el aumento en el número de casos en países como España o Australia puede deberse a factores ecológicos locales, puesto que hay publicaciones que indican que el agua de consumo es la fuente de infección por esta micobacteria16-18.
En resumen, basándonos en otros estudios publicados y en nuestra serie, consideramos que M. lentiflavum debe ser considerada una importante MNT causante de linfadenitis en niños.
AutoríaTodos los autores declaran que han leído y aprobado el manuscrito y de que los requisitos para la autoría se han cumplido.
Conflicto de interesesLos autores declaran no haber tenido ninguna fuente de financiación para la elaboración de este documento ni tener conflicto de intereses.
Nos gustaría agradecer a la Dra. María Soledad Jiménez, del Servicio de Micobacteriología del Centro Nacional de Microbiología (Instituto de Salud Carlos III), por su colaboración.