Sr. Editor: La criptococosis es una enfermedad infecciosa sistémica, que se manifiesta fundamentalmente en personas inmunodeprimidas. Actualmente se distinguen dos especies diferentes, Cryptococcus neoformans y C. gattii, con fundamentos ecológicos y epidemiológicos distintos1. C. gattii aparece fundamentalmente en climas tropicales y subtropicales, se relaciona con Eucalyptus camaldulensis y su presencia se describe inicialmente en Australia. También se ha aislado en climas templados continentales y se ha asociado a otros árboles2,3. En España ha sido causante de enfermedad pulmonar en cabras autóctonas de Extremadura4 y recientemente se ha comunicado el caso de un paciente inmunocompetente que desarrolló un criptococoma5. Presentamos la segunda descripción de enfermedad humana, de adquisición autóctona por C. gattii en España.
Varón de 66 años, que 15 años antes de su ingreso había realizado un viaje a Uruguay, vivía en un hábitat rural, con presencia de eucaliptos a escasos metros de su vivienda, y sin antecedentes de contacto con aves exóticas. Había sido diagnosticado de silicosis, y 4 meses antes de su ingreso, de lupus eritematoso sistémico (LES), recibió corticoides de forma intermitente. El paciente consulta por cefalea temporo-frontal intensa. En la exploración física destacaba una marcha con aumento de la base de sustentación e importante inestabilidad. El fondo de ojo puso de manifiesto edema de papila bilateral. Se inició tratamiento con pulsos de esteroides intravenosos, manitol y acetazolamida. La tomografía computarizada cerebral mostró calcificaciones a nivel de los ganglios basales bilaterales. La resonancia magnética (RM) y la angio-RM no mostró alteraciones significativas. El líquido cefalorraquídeo (LCR) presentaba una presión de salida de 17,5 cm/H2O, 63 células/μL (el 98% mononucleares y el 1% polimorfonucleares). En el LCR se aisló Cryptococcus spp. La cepa fue enviada al Servicio de Micología del Centro Nacional de Microbiología, para identificación definitiva y estudio de sensibilidad. La determinación de antígeno de Cryptococcus en sangre fue 1/512 y en el LCR de 1/128. Se inició tratamiento con anfotericina B en dosis de 0,7-1 mg/kg/día y 5-fluorocitosina durante 14 días, y posteriormente fluconazol 400 mg/día.
En el Centro Nacional de Microbiología, la cepa se identificó mediante exámenes morfológicos y estudios bioquímicos. El microorganismo mostró unas características compatibles con las de C. neoformans. Además, fue capaz de hidrolizar la glicina y de ser resistente a la L-canavanina, por lo que fue identificado como C. gattii. Esta identificación fue confirmada mediante técnicas de secuenciación del ADN fúngico, concretamente las zonas ITS (Internal Transcriber Spacers) del ADN ribosómico. La secuenciación se realizó mediante técnicas de referencia incluyendo cepas control6. Asimismo, el estudio de sensibilidad también se realizó mediante métodos estandarizados7.
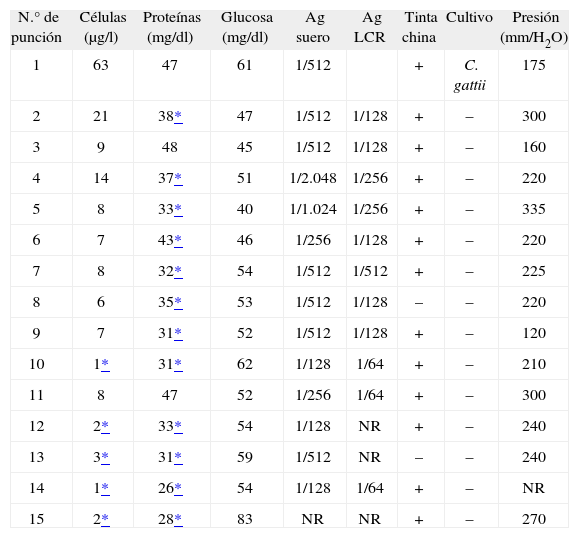
Inicialmente la evolución clínica fue favorable. A los 15 días del cambio a fluconazol, reapareció la cefalea, momento en el que se recibió la identificación de la cepa como C. gattii. El estudio de sensibilidad mostró unas concentraciones mínimas inhibitorias (CMI) de 0,12 mg/l de anfotericina-B, 128 mg/l de fluconazol, 0,50 mg/l de itraconazol, 1 mg/l de voriconazol y 16 mg/l de 5-fluorocitosina, por lo que se cambió el tratamiento a anfotericina B liposomal (5 mg/kg/día). Ante la presencia de presiones de salida de LCR elevadas, la detección continuada de microorganismos compatibles con Cryptococcus en los exámenes del LCR con tinta china y el mantenimiento de los títulos elevados de antígeno criptocócico (tabla 1), se decidió incrementar la dosis del polieno hasta 10 mg/kg/día. Posteriormente, se asoció voriconazol a dosis de 400 mg/día y, finalmente, se administró voriconazol 800 mg/día, por vía oral. La sintomatología clínica desapareció, aunque se decidió colocar un shunt en el ventrículo peritoneal. Finalmente, el enfermo falleció por un episodio de insuficiencia respiratoria, mientras disfrutaba de un permiso domiciliario, sin que pudiera conocerse la causa de su muerte.
Evolución de los parámetros analíticos del líquido cefalorraquídeo
| N.° de punción | Células (μg/l) | Proteínas (mg/dl) | Glucosa (mg/dl) | Ag suero | Ag LCR | Tinta china | Cultivo | Presión (mm/H2O) |
| 1 | 63 | 47 | 61 | 1/512 | + | C. gattii | 175 | |
| 2 | 21 | 38* | 47 | 1/512 | 1/128 | + | – | 300 |
| 3 | 9 | 48 | 45 | 1/512 | 1/128 | + | – | 160 |
| 4 | 14 | 37* | 51 | 1/2.048 | 1/256 | + | – | 220 |
| 5 | 8 | 33* | 40 | 1/1.024 | 1/256 | + | – | 335 |
| 6 | 7 | 43* | 46 | 1/256 | 1/128 | + | – | 220 |
| 7 | 8 | 32* | 54 | 1/512 | 1/512 | + | – | 225 |
| 8 | 6 | 35* | 53 | 1/512 | 1/128 | – | – | 220 |
| 9 | 7 | 31* | 52 | 1/512 | 1/128 | + | – | 120 |
| 10 | 1* | 31* | 62 | 1/128 | 1/64 | + | – | 210 |
| 11 | 8 | 47 | 52 | 1/256 | 1/64 | + | – | 300 |
| 12 | 2* | 33* | 54 | 1/128 | NR | + | – | 240 |
| 13 | 3* | 31* | 59 | 1/512 | NR | – | – | 240 |
| 14 | 1* | 26* | 54 | 1/128 | 1/64 | + | – | NR |
| 15 | 2* | 28* | 83 | NR | NR | + | – | 270 |
Ag: antígeno; LCR: líquido cefalorraquídeo; NR: no realizado.
C. gattii causa, con frecuencia, enfermedad en pacientes inmunocompetentes5. El reciente brote comunicado en la isla de Vancouver (British Columbia, Canadá)8,9, pone en duda que su distribución se localice únicamente en climas tropicales o subtropicales. Cuando produce afectación del sistema nervioso central (SNC), se asocia con complicaciones como hidrocefalia y parálisis de nervios craneales. Por otra parte, los estudios de sensibilidad sugieren que esta variedad tiene CMI superiores a los aislamientos de otras especies de Cryptococcus, lo que podría asociarse a una respuesta más lenta a la terapia antifúngica10–12. No obstante, en un estudio realizado en pacientes con el virus de inmunodeficiencia adquirida (VIH+), los aislamientos de C. gattii tuvieron una CMI baja para los antifúngicos testados13, si bien, como reconocen los autores, no se conoce la correlación entre estos resultados y el seguimiento clínico. Aunque fluconazol en general es más efectivo que el itraconazol in vivo, en nuestro caso la cepa mostró una CMI superior para fluconazol como ya han comunicado otros autores11. Chen et al10 estudiaron la sensibilidad de 18 cepas de C. gattii; todas fueron sensibles a itraconazol, pero 4 cepas tuvieron sensibilidad disminuida y 2 fueron resistentes a fluconazol; resultados similares fueron comunicados en 18 cepas aisladas en Malasia, donde la única cepa resistente a fluconazol fue sensible a itraconazol14. Nuestro caso mostró una respuesta lenta, con persistencia durante meses de una tinción de tinta china positiva y elevación de la presión del LCR y un lento declinar de las cifras de antígeno criptocócico, a pesar de la utilización de dosis elevadas de antifúngicos. La existencia de resistencia a fluconazol en la cepa de nuestro paciente indica no sólo la necesidad de identificar la especie de Cryptococcus, sino también de medir la CMI del aislado para realizar un tratamiento adecuado.
Desde nuestro punto de vista, debería vigilarse la emergencia de esta variedad de Cryptococcus en nuestro país, ante la aparición de este segundo caso autóctono que debería estimular la búsqueda del nicho ecológico de este hongo en España, que en nuestro caso probablemente se asoció a la presencia de eucaliptos en las inmediaciones de la vivienda del paciente.