Caso clínico
Varón de 35 años adicto a drogas por vía parenteral e inhalada que fue ingresado por tumoración laterocervical derecha, que en 2 meses había triplicado su tamaño. Entre sus antecedentes personales destacaban:
1.Infección por el VIH estadio C3 (tuberculosis diseminada hacía 2 años) en buena situación inmunológica y virológica (300 linfocitos T CD4+/μl y carga viral indetectable) tras tratamiento antirretroviral con zidovudina, lamivudina y efavirenz, y la posterior sustitución de zidovudina (por toxicidad medular) por estavudina y nueva sustitución de este fármaco por abacavir.
2.Hepatopatía crónica por el VHC sin datos de cirrosis.
3.Polineuropatía mixta grave desde 3 años antes, interpretada como de probable de origen multifactorial (infección por el VIH, tratamiento previo con estavudina, uremia, enolismo y nutrición deficiente).
4.Gammapatía monoclonal IgA κ diagnosticada 2 años antes con excreción de cadenas ligeras (λ y κ) en orina, sin que un estudio óseo (radiográfico y gammagráfico) y una biopsia de médula ósea mostraran alteraciones.
5.Insuficiencia renal con proteinuria en rango no nefrótico y deterioro progresivo del aclaramiento en 2 años, que había llevado a iniciar un programa de hemodiálisis 10 meses antes.
6.Trombosis venosas profundas de repetición en ambas extremidades inferiores y un episodio de tromboembolismo pulmonar, comprobándose déficit grave de proteína S; anticoagulado con acenocumarol desde hacía un año.
7.Hipotiroidismo subclínico.
8.Excoriaciones hiperqueratósicas e hiperpigmentadas atribuidas a rascado frecuente por prurito permanente. Seis meses antes había ingresado por hemorragia digestiva secundaria a ulcus gástrico, sin que la biopsia gástrica aportara información diagnóstica.
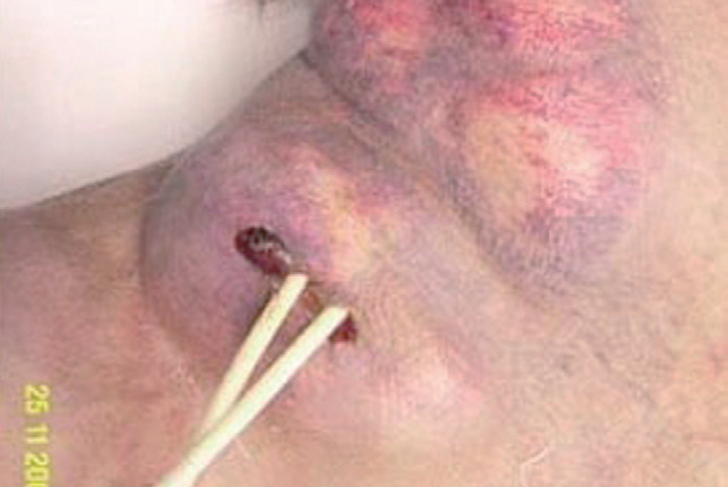
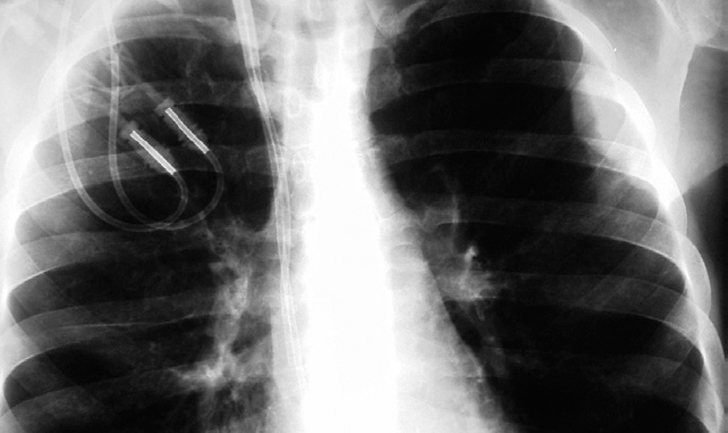
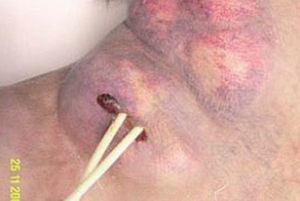
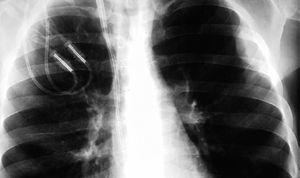
En la exploración física se encontraba afebril, desnutrido, con cierta dificultad para la marcha, pero consciente y orientado. La piel mostraba una coloración oscura (etnia gitana), con numerosos tatuajes y lesiones hiperqueratósicas e hiperpigmentadas en las extremidades. La auscultación cardiorrespiratoria era normal, y en el abdomen se palpaba hepatoesplenomegalia de 3 cm por debajo de la arcada costal. Llamaba la atención una gran masa laterocervical derecha, en la zona de inserción del catéter yugular de hemodiálisis, polilobulada, algo eritematosa y con algunas zonas fluctuantes a la palpación (fig. 1). La analítica mostraba: hemoglobina, 11 g/dl; hematócrito, 33%; VCM, 89 fl; 4.720 leucocitos/μl (53% neutrófilos; 32% linfocitos), 126.000 plaquetas/μl; creatinina, 6,01 mg/dl; urea, 87 mg/dl; sodio, 141 mEq/l; potasio, 5,4 mEq/l; calcio, 7,2 mg/dl; fósforo, 7,2 mg/dl; proteínas totales, 5,2 g/dl; AST, ALT, FA, GGT y bilirrubina normales; VSG, 90 mm/h; aumento monoclonal de IgA tipo κ en sangre (1.000 mg/dl) y excreción en orina de cadenas ligeras tipo λ (40 mg/dl) y κ (31 mg/dl); hormona tirostimulante, 5,42 mU/dl; tiroxina libre, 0,7 μg/ml. La radiografía de tórax mostraba una tumoración extrapleural en hemitórax izquierdo sin derrame pleural asociado, que no era apreciable en las radiografías previas de los últimos meses (fig. 2).
Figura 1. Masa laterocervical derecha, con catéter yugular para diálisis.
Figura 2. Radiografía de tórax que muestra la masa extrapleural izquierda.
Evolución
Se realizaron dos punciones-biopsia (la segunda guiada por ecografía) sobre un conglomerado adenopático hipervascularizado, siendo todas las tinciones y cultivos negativos, incluidos los realizados en medio de cultivo para micobacterias, y la citología de la segunda mostró escasas células con rasgos plasmocitoides.
Durante el estudio, el paciente falleció de forma inesperada, víctima de una hiperpotasemia por abandono voluntario de las sesiones y/o posible obstrucción del catéter de diálisis.
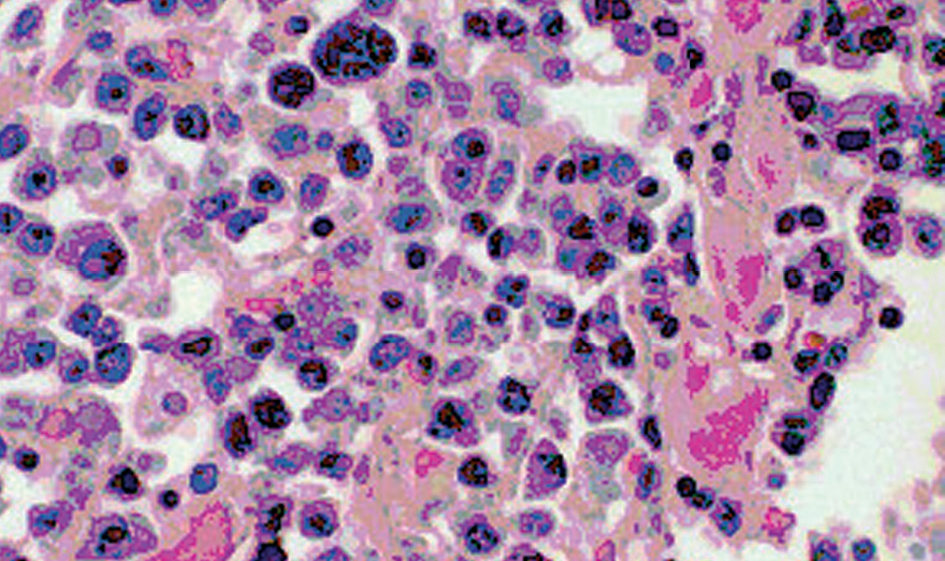
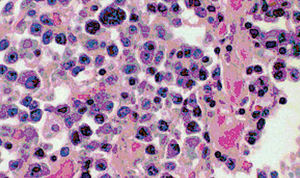
Se practicó necropsia que mostró en el conglomerado adenopático laterocervical derecho, ganglios abdominales y retroperitoneales, un infiltrado difuso con células de tamaño homogéneo (entre 20 y 30 μ) con citoplasmas bien delimitados y densos, de coloración eosinófila y núcleos centrales con nucléolo prominente y cromatina adosada a la membrana nuclear (aspecto vesiculoso). Se observaba un elevado índice mitótico y algunas células presentaban formas plasmocitoides (fig. 3). En el pulmón izquierdo existía una masa de 6 cm de diámetro máximo, adherida a la pleura con las mismas características histológicas, y en la submucosa gástrica una discreta plasmocitosis policlonal, sin lesiones ulceradas en mucosa. La médula ósea no estaba afectada. El estudio inmunohistoquímico mostraba una neoplasia con elevada fracción de crecimiento y fenotipo positivo para MUM1, CD38, CD138 y λ; y negativo para p53, CD3, CD20, y cadenas pesadas. La detección de productos de latencia del virus de Epstein-Barr (LMP-1 y EBER) fue positiva en la mayoría de las células tumorales y el estudio del virus herpes humano tipo 8 (HHV-8) mediante reacción en cadena de la polimerasa (PCR) fue negativo. Existía así mismo una amiloidosis sistémica AA masiva en riñones, suprarrenales y tiroides, junto al hallazgo de numerosas lesiones tuberculosas calcificadas con escasa actividad granulomatosa, siendo las tinciones negativas para bacilos ácido-alcohol resistentes. Un estudio retrospectivo de la biopsia gástrica mostró escasas acumulaciones de células plasmocitoides tipo λ.
Figura 3. Infiltrado celular de la masa tumoral que muestra una rica red de vasos de paredes finas y acumulaciones de células con rasgos plasmocitoides. (Hematoxilina-eosina, x400.)
Diagnóstico
1.Linfoma plasmablástico con expresión clínica de síndrome POEMS.
2.Amiloidosis tipo AA con afectación masiva renal, adrenal y tiroidea, posiblemente secundaria a tuberculosis residual extensa.
Comentarios
La presencia de una masa de rápido crecimiento en la que se han descartado infecciones piógenas y reactivación de tuberculosis en un paciente infectado por el VIH debe hacer considerar un linfoma como primera posibilidad diagnóstica, ya que en este colectivo su incidencia es hasta 100 veces superior que en la población no infectada por el virus 1. La existencia de una masa extrapleural también de rápido crecimiento, la gammapatía monoclonal IgA y la afectación gástrica orientaba además hacia un plasmocitoma o un linfoma plasmablástico también relacionados con el VIH desde hace años 2-5 y cuya diferenciación histológica no siempre es fácil 6,7. También es interesante resaltar que aunque el fenotipo del tumor era l (como suele ser habitual en el 95% de estos tumores) la expresión periférica fue discordante (cadenas k).
El síndrome POEMS es un acrónimo acuñado por Barwick en 1980 8, que viene definido por polineuropatía, organomegalia, endocrinopatía, pico monoclonal y trastornos cutáneos (de la palabra inglesa skin, piel). No existe una única prueba que establezca el diagnóstico, el cual viene dado por la presencia de los dos criterios mayores (polineuropatía y pico monoclonal) y al menos uno de los otros criterios. Otros fenómenos asociados descritos son: desarrollo de insuficiencia renal, hipertensión pulmonar e insuficiencia cardíaca, trombosis venosas y arteriales, acropaquia y derrames pleural o ascítico 9. Su origen es desconocido e incluso se ha llegado a dudar de su existencia como entidad nosológica, aunque parece clara su relación con ciertos mielomas, la enfermedad de Castleman y otras neoplasias hematológicas. Algunas de ellas están asociadas a la infección por el HHV-8 10 y se ha especulado en su génesis con un hipotético desequilibrio de citocinas inflamatorias, interleucinas, factor de necrosis tumoral y el factor de crecimiento endotelial.
Nuestro paciente presentaba: a) polineuropatía desde hacía años, habitualmente el primer síntoma de este síndrome; b) organomegalias; c) trastornos endocrinos como hipotiroidismo y una probable insuficiencia suprarrenal (aunque también explicables por la amiloidosis); d) pico monoclonal de inmunoglobulina, y e) trastornos cutáneos. Sin embargo, estos fenómenos podían ser explicados por otras causas intercurrentes (déficit nutricional, tóxicos, amiloidosis, rascado por prurito) lo que retrasó el diagnóstico hasta la aparición de la masa. Es necesaria por tanto una gran sospecha clínica para el diagnóstico de síndrome POEMS, cuya importancia reside en que puede ser el heraldo que preceda al desarrollo de una neoplasia hematológica en estos pacientes.
Agradecimientos
Deseamos agradecer a los Dres. M. A. Piris y F.I. Camacho, del Centro Nacional de Investigaciones Oncológicas, su inestimable aportación al presente caso.