Epidemiología y factores de riesgo
La prevalencia de pacientes con sonda urinaria (SU) en el ámbito comunitario se ha cifrado entre el 0,02 y el 0,07% 1. En residencias de ancianos, hasta el 20% de los internos pueden ser portadores de una SU permanente 2, y entre los pacientes acogidos a programas de asistencia domiciliaria la frecuencia puede oscilar entre el 4% en la población general asistida 3 y el 38% en las ancianas con incontinencia 4. En España, la incidencia de lesiones de la médula espinal oscila entre 12 y 20 por millón de habitantes y año. El 15% de estos pacientes llevarán SU 5 años después del accidente 5 y, de los restantes, una proporción significativa vaciará su vejiga regularmente mediante la inserción y retirada de un catéter varias veces al día (cateterización intermitente). Por último, un número indeterminado de pacientes es portador de una SU con carácter transitorio. Por lo general se trata de individuos que han padecido un episodio de retención aguda de orina y esperan la resolución quirúrgica del problema obstructivo o son remitidos al domicilio tras la práctica de ciertas intervenciones urológicas (estenosis uretrales, prostatectomía radical y neovejigas) en las que puede ser recomendable mantener el catéter vesical durante al menos una semana.
Desde un punto de vista práctico tiene cierto interés diferenciar entre el uso transitorio y permanente del catéter urinario, tomando 30 días como el período de tiempo que separa ambos conceptos. La distinción es relevante a la hora de considerar tanto la posibilidad de profilaxis de la bacteriuria o de la infección urinaria (IU) sintomática como el espectro de complicaciones previsibles.
Cateterismo de corta duración
En los pacientes portadores de sonda conectada a un sistema de drenaje cerrado, el riesgo de bacteriuria de alto grado (> 10 5 unidades formadoras de colonias [UFC]/ml) oscila entre el 3 y el 10% por día 6. Al cabo de 2 semanas, alrededor del 50% de los pacientes sondados presenta bacteriuria intensa, y ésta es prácticamente universal después de los 30 días 7. Sin embargo, la mayor parte de los episodios de bacteriuria son asintomáticos. En un estudio llevado a cabo en pacientes con catéteres de corta duración, menos del 10% de los individuos con bacteriuria presentaron síntomas posiblemente relacionados con una IU, la frecuencia de disuria y fiebre fue similar a la observada en los pacientes sin bacteriuria, y la tasa de bacteriemia secundaria relacionada con el foco urinario fue inferior al 2% 8. Otros estudios han encontrado que se dan síntomas de IU y bacteriemia hasta en el 30 y el 4% de los casos, respectivamente 9.
Varias investigaciones llevadas a cabo en pacientes hospitalizados han establecido los factores de riesgo para el desarrollo de bacteriuria o IU sintomática asociada con la cateterización de corta duración. Muchos de esos factores son, sin embargo, probablemente aplicables a la misma situación en pacientes no ingresados. La circunstancia que de forma más clara incrementa el riesgo de bacteriuria es, por supuesto, la duración de la cateterización, especialmente si se prolonga más de 6 días. Otros factores asociados con una mayor frecuencia de bacteriuria son el sexo femenino, el ingreso en un servicio de urología (probablemente un marcador de padecer alguna uropatía), ciertas enfermedades subyacentes (diabetes, malnutrición, insuficiencia renal), presentar infecciones de otra localización, la contaminación de la bolsa de recogida, ser portador de un catéter ureteral, las desconexiones inadvertidas o erróneas del catéter con el sistema de drenaje, y el hecho de que el tubo que conecta la SU con la bolsa quede por debajo de ésta o por encima del nivel de la vejiga 10-12.
Por el contrario, en todos los estudios, la administración de antibióticos sistémicos se ha asociado con una disminución de la incidencia de bacteriuria, aunque el efecto protector sólo es apreciable durante los primeros 14 días de cateterización y especialmente significativo en los primeros 5 días 13-15.
Respecto a los factores predisponentes de IU clínica, ha podido demostrarse que en mujeres con bacteriuria asintomática (BA) cateterizadas durante 1 a 76 días (mediana 4 días), la retirada de la sonda conlleva un riesgo elevado (26%) de desarrollo de síntomas durante las 2 semanas siguientes 16. La existencia de obstrucción significativa del aparato urinario es asimismo frecuente en los pacientes que desarrollan bacteriemia o mueren como consecuencia de una infección urinaria relacionada con el catéter 17.
Cateterismo permanente
En los individuos portadores de una SU permanente, la IU sintomática, definida como morbilidad febril no atribuible a otra causa, es relativamente común y se ha cifrado en 6,6 a 11 episodios por 1.000 días de cateterización en ancianos institucionalizados 18,19 y de 2 a 3,4 episodios por 1.000 días de cateterización en pacientes que requieren asistencia domiciliaria 3. El riesgo de bacteriemia durante estos episodios oscila entre el 10 y el 24% 20, y puede llegar a ser 60 veces superior al de los pacientes no cateterizados 6. Por último, la incidencia de IU sintomática en los pacientes con lesiones de la médula espinal que practican cateterización intermitente se sitúa en torno a 4 episodios por 1.000 días en riesgo 21. En los pacientes portadores de una SU permanente, el desarrollo de IU sintomática, incluidas bacteriemia y sepsis grave, se ha relacionado con la obstrucción del catéter 18, la bacteriuria por Serratia marcescens 22, la aparición de hematuria relacionada con los recambios traumáticos de la sonda 23,24 y la piuria intensa (> 50 células por campo de alto aumento) 3.
Independientemente de las características de los pacientes, la evidencia disponible indica que el sondaje uretral causa IU sintomática con mayor frecuencia que cualquier otro procedimiento de drenaje vesical, tales como el colector en el varón o la cateterización suprapúbica en uno y otro sexo 3,9,21. La cateterización vesical permanente se asocia también con una elevada incidencia de complicaciones a menudo relacionadas con la presencia de bacteriuria o infección clínica, como la obstrucción completa de la SU (50% en 3 meses de seguimiento), la hematuria macroscópica (30%) y la litiasis vesical o renal, además de con un aumento del riesgo de padecer cáncer de vejiga y, posiblemente, de muerte en los ancianos 2-4. Por todo ello, la utilización permanente de una SU de inserción uretral debe restringirse a los individuos en los que realmente no exista otra posibilidad de drenaje vesical.
Patogenia
Los catéteres urinarios se fabrican con polímeros naturales o sintéticos, de los cuales los más frecuentemente utilizados son el látex siliconizado y la silicona pura 25. Con independencia de la naturaleza química del material, cualquier bacteria o especie de Candida es capaz de adherirse al mismo y constituir biopelículas. En el paciente sin bacteriuria al que se coloca una SU conectada a un sistema de drenaje cerrado, la superficie externa del catéter y, a partir de ella, la orina vesical es alcanzada primariamente por los organismos que colonizan el meato uretral (vía exoluminal) 26. Los pacientes que requieren sondaje vesical prolongado presentan una mayor frecuencia de colonización del periné, introito vaginal y región periuretral por organismos potencialmente patógenos, incluidos Pseudomonas aeruginosa y otros con sensibilidad restringida a los antibióticos, debido a una combinación de circunstancias entre las que se cuentan la edad avanzada, el padecimiento de una enfermedad crónica debilitante, la incontinencia fecal, la elevación del pH, la humedad excesiva y la exposición a antibióticos 2,27.
La vía de acceso intraluminal es también posible y, al contrario de lo que ocurre con los cocos grampositivos (estafilococos, enterococos) y Candida, parece ser utilizada por las bacterias gramnegativas con la misma frecuencia que la exoluminal 28. El acceso primario a la luz del catéter puede resultar de la apertura del sistema cerrado o de la contaminación de la orina contenida en la bolsa de recogida. Una vez que las bacterias alcanzan la vejiga urinaria o si el paciente ya presenta bacteriuria en el momento de ser sondado, el acceso a la superficie luminal es, obviamente, inmediato.
El tiempo transcurrido desde el contacto de los microorganismos con el biomaterial hasta la constitución de biopelículas maduras es corto. En pacientes sin bacteriuria en el momento de la colocación del dispositivo se observan biopelículas bien constituidas al cabo de una semana, mientras que en el paciente bacteriúrico este lapso se reduce a 3 días 29,30. En el sondaje vesical permanente, la población bacteriana está constituida típicamente por 2 a 4 especies, la biopelícula tiene un grosor de 3 a 490 μm y alberga, embebidas en una matriz extracelular, un promedio de 400 capas de células 30. Los mecanismos a través de los cuales los distintos organismos se adhieren a los biomateriales o entre sí y regulan la producción de los exopolisacáridos que componen la matriz extracelular son relativamente específicos de cada especie y su discusión detallada está fuera de la perspectiva de esta revisión 31-33.
Una vez constituidas, las biopelículas microbianas son extremadamente resistentes a la acción bactericida de los antibióticos y antisépticos, suponen un reservorio a partir del cual se inocula continuamente la orina vesical y están directamente implicadas en la obstrucción de los catéteres cuando la flora contiene bacterias productoras de ureasa, particularmente Proteus mirabilis 34. La causa más frecuente del bloqueo de los catéteres urinarios es la formación de depósitos de estruvita (fosfato amónico-magnésico) y apatita (fosfato cálcico), denominados incrustaciones, que acaban ocluyendo los orificios de drenaje y la luz de la SU. La precipitación de estos minerales ocurre cuando el pH urinario se eleva por encima de 6,7 tras la formación de amonio a partir de la urea por la acción de las ureasas bacterianas. El depósito de los cristales se inicia siempre en la inmediata vecindad de las bacterias asentadas en la biopelícula. La práctica totalidad de las especies de Proteeae (P. mirabilis, Proteus spp., Morganella morgagnii y Providencia stuartii), Staphylococcus epidermidis, Staphylococcus aureus, Corynebacterium urealyticum y Ureaplasma urealyticum, así como el 60% de las cepas de Klebsiella pneumoniae y el 30% de las de P. aeruginosa y S. marcescens producen ureasa 35. En la práctica clínica, P. mirabilis es el agente más comúnmente relacionado con la obstrucción recurrente de los catéteres urinarios, debido a su relativa frecuencia y a que produce la ureasa más activa. En los pacientes con bacteriuria persistente que han experimentado un episodio previo de bloqueo, es previsible que una nueva SU termine de nuevo ocluida en el plazo de 2 semanas 36. La IU por organismos productores de ureasa puede dar lugar asimismo a la formación de cálculos de estruvita-apatita o incrustaciones en la vejiga urinaria o la pelvis renal. Esta complicación suele observarse en pacientes portadores de catéteres ureterales o de nefrostomía o sometidos a intervenciones urológicas o trasplante renal. El organismo implicado en la mayoría de estos casos es C. urealyticum, un comensal de la piel que puede hallarse hasta en el 30% de la población hospitalizada 37,38.
El material del catéter tiene cierta influencia en la facilidad con que las bacterias se adhieren al mismo, así como en la formación de incrustaciones. En términos generales, las bacterias se adhieren peor a la silicona que a otros polímeros (excepto si están recubiertos de hidrogel-sales de plata), y los catéteres de silicona pura tardan más en obstruirse por la formación de incrustaciones, un hecho que puede deberse en parte a su mayor calibre 39,40. Sin embargo, ningún material utilizado hasta ahora está exento de este problema.
Otro fenómeno interesante, relacionado con la composición del catéter, se refiere a la constatación de que el material desprendido de las SU de látex siliconizado disminuye entre 4 y 16 veces la actividad de los carbapenems frente a P. aeruginosa, debido a la inhibición reversible de la expresión de la porina OprD 41. La importancia práctica de esta observación es, sin embargo, desconocida.
La relevancia clínica de la formación de biopelículas bacterianas en las superficies de las SU quedaría limitada a su implicación directa en la obstrucción de las mismas, si no constituyeran un nicho difícil de erradicar con antibióticos capaz de inocular continuamente la orina vesical, la próstata y eventualmente el riñón o ser el origen de bacteriemia relacionada con la manipulación del dispositivo. La presencia de una SU determina que cualquier microbio introducido en la vejiga urinaria alcance densidades elevadas (> 10 5/ml) en los 3 días siguientes 42. Es probable que los microorganismos presentes en la vejiga urinaria de los pacientes portadores de SU constituyan biopelículas sobre la superficie urotelial o en el interior de las células, donde inducen con frecuencia una respuesta inflamatoria local caracterizada por la presencia de citocinas proinflamatorias en la orina y piuria.
La incidencia de piuria en pacientes bacteriúricos puede oscilar entre el 37-46% y más del 90%, dependiendo de que la cateterización sea transitoria o prolongada, respectivamente, y es mucho más acusada cuando la infección es debida a bacilos gramnegativos que a cocos grampositivos o Candida 43.
La persistencia de la bacteriuria a las 2 semanas de la retirada de la SU en dos terceras partes de las mujeres que han llevado un catéter durante un período breve de tiempo demuestra claramente que la persistencia de la infección vesical no depende exclusivamente de la presencia del microorganismo en el dispositivo 16. Por otro lado, en los lesionados medulares con bacteriuria es común observar bacterias adheridas a las células uroteliales descamadas, y la presencia de más de 20 organismos por célula se ha asociado con IU sintomática 44. Las adhesinas implicadas en la adherencia al urotelio y el desencadenamiento de la respuesta inflamatoria probablemente varían con los distintos microorganismos. En el caso de Escherichia coli, las frimbrias de tipo 1, presentes en todas las cepas, fijan la bacteria al urotelio mediante la unión a los residuos de manosa de una proteína de superficie denominada uroplaquina. Dicha interacción promueve el paso del microbio al interior de la célula y aporta, además, la colaboración necesaria para que la interacción del lipopolisacárido bacteriano con el receptor TLR4 de la célula urotelial determine en ésta la síntesis de citocinas proinflamatorias 45,46. La localización intracelular, reconocida en E. coli, podría constituir un mecanismo de persistencia del microbio en el epitelio vesical. La menor incidencia de piuria asociada a la infección por cocos grampositivos puede deberse al hecho de que la interacción del peptidoglucano y otros componentes de la pared de estos organismos con su receptor específico (TLR2) promueve en el urotelio una respuesta proinflamatoria menos intensa 47.
En pacientes febriles o bacteriémicos con IU asociada al catéter, la IU se encuentra probablemente localizada en el riñón (pielonefritis), en la próstata o, más raramente, en las glándulas periuretrales o en el epidídimo. La elevada frecuencia de episodios febriles autolimitados (< 24 h) en individuos con SU permanente 18 sugiere que un número significativo de los mismos puede deberse a bacteriemias de bajo grado introducidas a través de lesiones del urotelio producidas por decúbitos del propio catéter o cambios de presión intravesical relacionados con variaciones de su posición 3. En ancianos que han fallecido llevando una SU permanente, se documenta inflamación renal aguda hasta en el 38% de los casos 48, y en lesionados medulares es frecuente la localización de bacterias en la próstata 49.
En presencia de un catéter urinario o anomalías del funcionalismo vesical, el desarrollo de IU sintomática no depende tanto de la disponibilidad de factores de virulencia específicos del agente implicado para producir infección invasiva. Las cepas de E. coli poseen con menor frecuencia determinantes como fimbrias P o hemolisina, típicamente asociados con pielonefritis o prostatitis aguda en individuos sin uropatía 50,51.
El recambio de una SU permanente cursa con bacteriemia en el 10-17% de los pacientes 23,24,52. No obstante, si el procedimiento no es traumático, la práctica totalidad de esos episodios son asintomáticos y, por tanto, el recambio de una SU puede considerarse en términos generales una maniobra segura. En varios estudios, la mayoría de los organismos implicados han sido los grampositivos, básicamente S. epidermidis, enterococos y otros componentes de la flora uretral 23. La naturaleza de los agentes causales y la mayor incidencia cuando se produce hematuria sugiere que la bacteriemia proviene de lesiones existentes o infringidas a la mucosa de la vejiga urinaria, la uretra o quizá la próstata en el varón.
Etiología
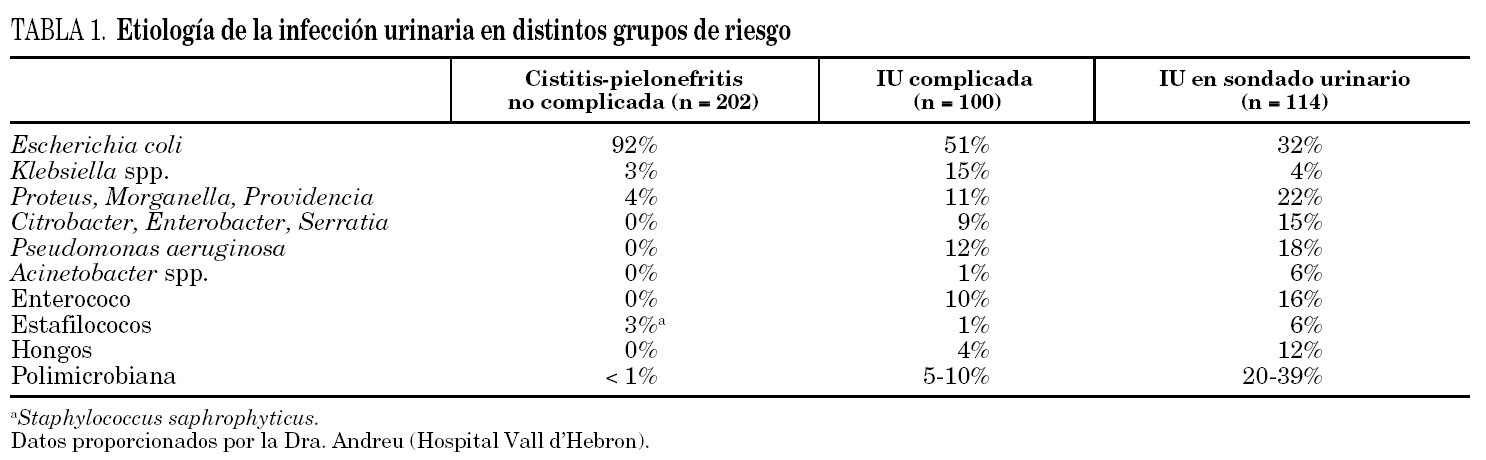
Los escasos estudios que han evaluado la etiología de las IU en individuos sometidos a cateterización vesical prolongada en el domicilio indican que los agentes etiológicos no difieren significativamente de los que causan infección en los pacientes ingresados en hospitales de agudos o en centros de larga estancia 52. Aunque los datos son también escasos, lo mismo parece ser cierto para los pacientes con otros sistemas de drenaje como la cateterización suprapúbica, la cateterización intermitente y el drenaje externo 20,27. Si bien la prevalencia entre los distintos estudios varía, E. coli, P. mirabilis, Klebsiella spp., P. aeruginosa y enterococos suelen ser los microbios más comunes, y cada uno de ellos se halla involucrado en el 15-30% de los casos. Menos frecuentes son las especies de Proteeae distintas de P. mirabilis (Providencia spp., M. morgagnii, Proteus spp., ≈ 15%), otras enterobacterias (Enterobacter spp., S. marcescens, Citrobacter spp. (≈ 7-10%), Acinetobacter spp.) y otros no fermentadores (< 5%), estafilococos coagulasa-negativos (= 5-10%), otros cocos grampositivos incluido S. aureus (≈ 10%) y Candida spp. (≈ 1%) 20,21,53,54. En la tabla 1 se muestra la etiología de la IU en el paciente sondado en comparación con otros grupos de riesgo.
Las principales características de la flora aislada de la orina obtenida a través del catéter en los pacientes con SU permanente son su naturaleza polimicrobiana en al menos tres cuartas partes de los casos, con 2 a 6 microbios por espécimen, el hecho de que la práctica totalidad de los mismos se hallan en concentraciones superiores a 10 5/ml, y el carácter cambiante de la población microbiana, tanto en especie como en concentración 18,55. En pacientes que no reciben antibióticos, la media de cambio de especie se sitúa en torno a 1,5 por mes. En un estudio en el que se practicaron cultivos semanales 18, algunos organismos, como los estafilococos (coagula-negativos o positivos), Streptococcus viridans, difteromorfos, Citrobacter, Serratia y Acinetobacter, fueron recuperados en al menos el 75% de las veces de muestras aisladas. Aunque la orina obtenida a través de la SU constituye una muestra sensible de los organismos presentes en el interior de la vejiga, la composición de la flora vesical es con menor frecuencia polimicrobiana y a menudo está presente en concentraciones ligeramente inferiores 54,56,57.
Las personas de la comunidad sometidas a sondaje vesical prolongado, además de albergar con frecuencia especies microbianas con una sensibilidad a los antibióticos restringida, probablemente constituyen un reservorio de cepas resistentes de organismos comunes como S. aureus, E. coli o Klebsiella, dada su mayor exposición a ingresos en hospitales o instituciones y a la administración de antibióticos. La presencia de una SU es un factor de riesgo reconocido de colonización por S. aureus resistente a la cloxacilina 58 y de bacteriuria debida a E. coli y K. pneumoniae productores de betalactamasas de espectro extendido (BLEE) en ancianos institucionalizados 59. De todos los episodios de bacteriemia extrahospitalaria en pacientes con SU permanente diagnosticados en nuestro hospital durante los 2 últimos años, el único caso de bacteremia por S. aureus (2% del total) fue causado por una cepa resistente a la cloxacilina, y el 7% de todos los episodios se debieron a cepas de E. coli productoras de BLEE.
Manifestaciones clínicas
Las manifestaciones clínicas de la IU relacionada con SU son mucho menos específicas que las observadas en los individuos no cateterizados, debido en gran medida a las características de la población afectada, constituida mayoritariamente por ancianos debilitados o pacientes con problemas neurológicos que alteran la percepción sensitiva (diabetes, lesiones medulares). La fiebre sin clínica focal constituye probablemente el signo más común. De hecho, en pacientes portadores de una SU con fiebre, la IU se cuenta siempre entre los dos orígenes más frecuentes del mismo, por delante o por detrás del foco respiratorio 18,60.
En los ancianos, la IU, al igual que cualquier otro tipo de infección, puede manifestarse sólo como delirio, anorexia o decaimiento general. Los síntomas de localización, en particular el dolor lumbar unilateral, son poco frecuentes, mientras que el dolor localizado en el hipogastrio, la uretra, el pene o la vulva puede ser una manifestación tan corriente en los pacientes portadores de un catéter, no infectados (hasta un 60%) 1, que resulta poco definitorio. Los lesionados medulares pueden experimentar espasticidad, signos de disreflexia (diaforesis o molestia abdominal) o inquietud 3,5. Por último, algunos signos indirectos, como la hematuria y la piuria macroscópicas, la obstrucción del catéter o la pérdida de orina alrededor del mismo (a menudo un signo de obstrucción), pueden ser indicativos de IU tributaria de tratamiento. Los varones deben ser explorados en busca de supuración periuretral, un signo de infección de las glándulas periuretrales o absceso prostático, así como de datos sugestivos de epididimitis.
Diagnóstico
La presencia de piuria y bacteriuria son tan frecuentes en los pacientes cateterizados que carecen de valor predictivo de infección clínica 3,5,60,61. No obstante, la piuria intensa o macroscópica y la hematuria franca de causa no aparente son sugestivas de IU en el contexto apropiado. La ausencia de piuria tampoco descarta completamente la existencia de infección, sobre todo en los pacientes cateterizados durante un período de tiempo corto. En esta última circunstancia, alrededor del 10% de los pacientes sin piuria presentarán bacteriuria, especialmente si la infección se debe a un coco grampositivo o Candida 43. De igual forma, el sedimento de orina puede ocasionalmente mostrar un número normal de leucocitos en infecciones por bacterias productoras de ureasa, debido a que estas células pueden destruirse al ser centrifugadas en una orina alcalina. Por otro lado, en el paciente cateterizado, cualquier recuento microbiano obtenido a través del catéter es potencialmente significativo. En la práctica, la presencia de > 10 3 organismos/ml constituye un indicador sensible de bacteriuria 12.
La elevada incidencia de IU por cocos grampositivos (sobre todo enterococos) puede justificar, cuanto menos en los pacientes que se consideren tributarios de tratamiento oral, la práctica de una tinción de Gram de orina obtenida preferentemente tras el recambio del catéter. La presencia de cocos grampositivos establecería la necesidad de administrar antibióticos activos frente a este organismo, y su ausencia probablemente la descartaría.
En pacientes asintomáticos con SU permanente no se recomienda la detección periódica de la presencia de piuria o bacteriuria 62. Dado que la BA persistente tras la retirada de la SU puede asociarse con una elevada incidencia de IU sintomática 16, en las guías recientes de la Sociedad Americana se recomienda la obtención de un urinocultivo en el momento de extraer el catéter con el objeto de tratar a los individuos en los que resulte positivo 62.
Prevención
En relación con la prevención de la IU en los pacientes sometidos a cateterismo uretral, hay que tener en cuenta 3 consideraciones generales.
La primera se refiere a la necesidad de evaluar críticamente la utilización de este tipo de dispositivo, incluyendo la consideración del empleo de otros sistemas de drenaje vesical, y proceder a su retirada en cuanto deje de ser imprescindible. Existe evidencia de que cerca del 50% de las indicaciones o de la duración del cateterismo uretral son injustificadas 9,61,63. Incluso buena parte de los ancianos institucionalizados puede librarse del catéter tras un proceso de entrenamiento destinado a fomentar la continencia 61.
La segunda se refiere al hecho de que ninguna medida profiláctica explorada hasta ahora ha demostrado ser eficaz para prevenir la aparición de BA en pacientes con cateterismo prolongado (> 30 días). Por lo tanto, en esta situación, el término profilaxis carece de sentido, excepto para describir medidas encaminadas a evitar la infección clínica o el mal funcionamiento del catéter (obstrucción) derivado de la formación de biopelículas microbianas.
La tercera se refiere a la conveniencia de recordar que la mayor parte de las bacteriurias relacionadas con el cateterismo de corta duración son asintomáticas y, por tanto, en pacientes de bajo riesgo, el impacto clínico de estrategias que previenen eficazmente la aparición de bacteriuria puede ser relativamente menor o incluso verse superado por los efectos adversos u otros inconvenientes derivados de la aplicación de las mismas.
Las medidas generales destinadas a prevenir la bacteriuria relacionada con el cateterismo de corta duración incluyen la utilización de un equipo estéril y una técnica aséptica en el momento de la inserción, reducir al mínimo inevitable las desconexiones de la SU con el sistema colector y asegurar que este último esté siempre en una posición declive respecto a la vejiga, evitando además que el tubo caiga por debajo de la bolsa de recogida 9-12. Un estudio de asignación aleatorizada llevado a cabo en pacientes obstétricas indicó que la limpieza de la región periuretral con agua corriente en lugar de una solución antiséptica (clorhexidina) no se asociaba con una mayor incidencia de bacteriuria 64. El requerimiento de antisépticos durante la inserción del catéter continúa siendo una cuestión controvertida 65,66. El empleo de sistemas de drenaje complicados, la desinfección diaria del meato uretral, la irrigación de la vejiga con antibióticos o antisépticos o la adición de estos últimos a la bolsa recolectora no han demostrado ser eficaces 9,17,65. Las manos deben lavarse antes y después de vaciar el depósito de orina para minimizar la contaminación exógena del mismo y el riesgo de transmisión cruzada en los pacientes institucionalizados.
Varios estudios, tanto observacionales como controlados, han indicado que la administración de antibióticos sistémicos reduce la incidencia de BA e IU clínica durante los primeros 5 a 14 días de cateterización 9,10,13-15,67-70. Las IU observadas bajo profilaxis a menudo se deben, obviamente, a organismos resistentes al antibiótico utilizado. Todos estos estudios se han llevado a cabo, sin embargo, en pacientes hospitalizados o sometidos a procedimientos quirúrgicos del aparato genitourinario y, por tanto, resulta difícil extrapolar sus enseñanzas a las situaciones de cateterismo transitorio que puedan encontrarse en la comunidad. El riesgo de seleccionar organismos resistentes puede ser en la actualidad particularmente elevado en nuestro entorno, donde ya circulan con frecuencia enterobacterias comunes con elevados niveles de resistencia a una amplia gama de antibióticos orales. Si se tiene en cuenta, además, que la mayoría de las bacteriurias asociadas al catéter son asintomáticas y la posibilidad de producir efectos adversos, parece claro que la administración de profilaxis debe limitarse a los pacientes con un riesgo elevado de desarrollar infección sintomática u otras complicaciones de la bacteriuria 10,11.
Aunque no todas las situaciones de alto riesgo han sido bien definidas, probablemente se beneficien de profilaxis de la BA los pacientes sometidos a intervenciones genitourinarias, los neutropénicos o con inmunodepresión grave, los trasplantados renales, las embarazadas (riesgo de pielonefritis del 30%), los pacientes con riesgo de endocarditis sometidos a manipulaciones urológicas y, quizá, los que padezcan obstrucción significativa del aparato urinario alto, reflujo vesicoureteral o sean portadores de un catéter ureteral 6,12,67,69. Está bien establecido que debe detectarse sistemáticamente la presencia de BA en embarazadas y antes de proceder a la cirugía urológica. Aunque no se ha establecido si es necesario detectar la presencia de BA antes de efectuar otros procedimientos quirúrgicos, se aconseja tratar la BA antes de practicar cirugía cercana al área perineal, como en la cirugía del raquis o la colocación de prótesis de cadera, por la gravedad y/o dificultad que presenta el tratamiento de las infecciones en estas localizaciones. En la actualidad existen discrepancias sobre la necesidad de detectar rutinariamente la presencia de BA en el trasplante renal y en pacientes inmunodeprimidos 62.
En los pacientes asintomáticos sometidos a cateterización permanente, la administración "profiláctica" de antibióticos no previene el desarrollo de bacteriuria ni la aparición de infecciones clínicas 6,9,63. Tampoco existe evidencia de que el tratamiento de la BA en los ancianos institucionalizados mejore la supervivencia 71. En los individuos con vejiga neurógena sometidos a cateterización intermitente, aunque la profilaxis con antibióticos disminuye la prevalencia de bacteriuria, no reduce de manera significativa la incidencia de episodios sintomáticos 72. En ambas circunstancias los antibióticos determinan, además, la selección de organismos resistentes. Por todo ello, la utilización de antibióticos sólo está indicada para intentar prevenir o solventar problemas clínicos específicos.
La presencia de P. mirabilis u otros agentes productores de ureasa en pacientes con obstrucción recurrente del catéter por incrustaciones constituye un inconveniente serio, por lo que puede estar justificada la administración profiláctica de antibióticos con el objeto de intentar evitar la recolonización del nuevo catéter y prolongar su funcionamiento. Sin embargo, no se conoce con certeza cuáles son las medidas más adecuadas para prevenir este problema. La irrigación vesical con soluciones acidificantes a base de citrato parece no ser eficaz 34, y la utilización de ácido acetohidroxámico (inhibidor de la ureasa) está a menudo limitada por una elevada incidencia de efectos adversos. En un estudio, el hipurato de metenamina demostró cierta eficacia 6. En casos particularmente problemáticos puede ser oportuno un programa que incluya la utilización de catéteres de silicona, una elevada ingestión hídrica, la administración de antibióticos o metenamina y el ácido acetohidroxámico (o quizá, en el futuro, la fluorofamida, si demuestra ser poco tóxica) 73. El hallazgo de S. marcescens, debido a su posible asociación con un riesgo sustancial de bacteriemia, justificaría un intento de erradicación con antibióticos. Por último, puede estar plenamente justificada la profilaxis en un paciente ocasional con episodios sintomáticos recurrentes que pongan en peligro su vida o la calidad de la misma.
Una práctica usual en pacientes crónicamente cateterizados consiste en cambiar el catéter de forma programada a intervalos de 4 a 12 semanas con el fin de anticiparse a la emergencia que supone la obstrucción del mismo. No está claro, sin embargo, que el recambio de la SU a intervalos prefijados reduzca la incidencia de complicaciones, ya que el paciente propenso a la obstrucción probablemente requeriría cambios del catéter más de una vez al mes. Varios comités de expertos recomiendan que no se cambie la SU excepto cuando haya un problema concreto que anule su función 65. El recambio del catéter conlleva un riesgo de bacteriemia sintomática tan bajo que la administración profiláctica de antibióticos sólo está justificada en el paciente en el que se ha producido un traumatismo (evidenciado habitualmente por la presencia de hematuria macroscópica), tiene antecedentes de IU sintomática relacionada con recambios previos o es portador de una lesión valvular con riesgo de endocarditis.
Durante las últimas 2 décadas ha habido un considerable interés en incorporar sustancias antimicrobianas a los biomateriales con la finalidad de evitar la adherencia de los organismos y la eventual formación de biopelículas. En el caso de los catéteres urinarios, varias coberturas argénticas (óxido de plata, hidrogel y sales de plata 74,75) y de antibióticos (minociclina-rifampicina 76 y nitrofurazona 77) han alcanzado la fase de desarrollo clínico.
Los catéteres cubiertos de óxido de plata fueron retirados del mercado por falta de eficacia, especialmente en varones. La protección ofrecida por estos dispositivos parece limitarse a períodos de cateterización no superiores a 2 semanas y, por tanto, es dudoso que desempeñen algún papel en los pacientes con SU permanente.
Los estudios que han evaluado los catéteres recubiertos de antibióticos son muy escasos y resulta difícil enjuiciar su potencial utilidad. Los que contienen minociclina-rifampicina parecen prevenir sólo las infecciones por grampositivos 76. La experiencia con los dispositivos recubiertos de hidrogel-sales de plata es mucho más extensa, pero sigue habiendo discrepancias respecto a su eficacia debido a la escasa calidad de muchos de los estudios destinados a evaluarla. Globalmente, podrían reducir en torno a un tercio la incidencia de bacteriuria nosocomial. En cualquier caso, la utilidad de estos dispositivos en las indicaciones de cateterismo transitorio que puedan presentarse en el ámbito comunitario está por definir.
Los estudios preliminares destinados a evaluar la posible eficacia del arándano rojo sugieren que no previene las IU en lesionados medulares 78, ni tiene efecto inhibitorio alguno sobre la formación de incrustaciones en biopelículas de P. mirabilis 79.
Otra medida profiláctica que se está evaluando en la actualidad se basa en el concepto de interferencia bacteriana, es decir, la posibilidad de que la colonización por determinados organismos avirulentos prevenga el establecimiento de otros con mayor patogenicidad. En estudios preliminares llevados a cabo en lesionados medulares portadores de SU permanente, la instilación vesical de la cepa de E. coli 83972 produce una colonización persistente asintomática en el 60% de los pacientes y parece reducir la incidencia de IU sintomática respecto a los valores basales 80. In vitro, la inoculación previa de la superficie de catéteres urinarios con E. coli 83972 reduce significativamente la adherencia a los mismos de otras especies como Providencia, E. coli uropatógeno, enterococo y Candida albicans.
Tratamiento
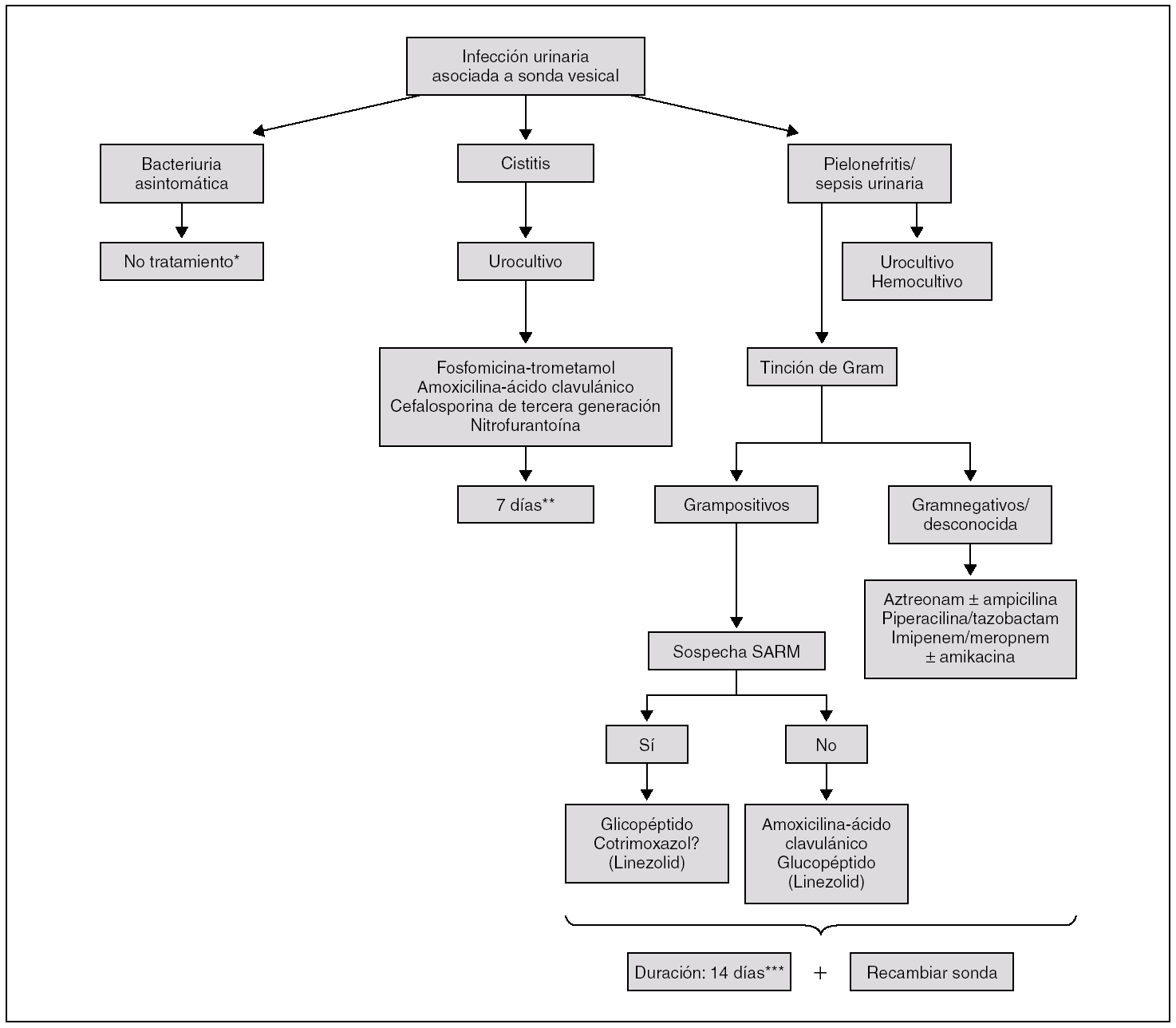
Como norma general, el paciente sondado con BA, tenga o no piuria asociada, no requiere tratamiento antibiótico (fig. 1) ya que: a) el riesgo de desarrollar una IU sintomática es bajo; b) la BA recurrirá a los pocos días; c) el tratamiento de la BA no reduce a largo plazo el porcentaje de episodios febriles de origen urinario con respecto a los pacientes no tratados, y d) la administración de antibióticos condicionará la selección de microorganismos resistentes, lo cual dificultará en un futuro el tratamiento de una IU sintomática.
Figura 1. Algoritmo de actuación en la infección urinaria asociada a catéter vesical. SARM: Staphylococcus aureus resistente a la meticilina (cloxacilina). *Excepto: cirugía urológica, embarazadas, recambio de sonda si hay riesgo de endocarditis, bacteriuria persistente tras la retirada de la sonda. **Considerar el recambio de la sonda. ***Si hay sepsis tras la manipulación, la duración puede acortarse a 5-7 días.
Los pacientes con IU sintomática han de recibir antibióticos y, dado el espectro de agentes causales, la práctica totalidad de los que presenten fiebre u otros signos sistémicos de infección requerirán ingreso en el hospital. El espectro antimicrobiano del tratamiento empírico debe abarcar a P. aeruginosa y Enterococcus faecalis y, por lo tanto, puede realizarse con piperacilina-tazobactam, imipenem, meropenem o la combinación de ampicilina con una cefalosporina anti-P. aeruginosa (o amikacina si no existe insuficiencia renal y el riesgo de nefrotoxicidad se considera aceptable). El ertapenem carece de actividad contra P. aeruginosa y enterococos, por lo que no tiene indicación en el tratamiento empírico de estos pacientes. No obstante, mantiene la excelente actividad de los carbapenems contra las enterobacterias, incluidas las productoras de BLEE, y constituye una opción terapéutica de primer orden frente a las IU causadas por estos últimos organismos. En el alérgico a la penicilina puede utilizarse una combinación de vancomicina y aztreonam. La adición de un aminoglucósido a una pauta de betalactámicos probablemente sólo está justificada si el paciente presenta shock séptico. Excepto en situaciones de sepsis grave, el uso sistemático de carbapenems para tratar una eventual enterobacteria productora de BLEE no está justificado porque su frecuencia es aún baja y resulta poco probable que el tratamiento inicial "inadecuado" afecte al pronóstico 81. Conviene recordar que el imipenem presenta una actividad modesta contra P. mirabilis y que la actividad de los carbapenems frente a P. aeruginosa puede verse ligeramente comprometida en pacientes portadores de catéteres de látex siliconizado.
La administración de antibióticos dirigidos contra S. aureus resistente a la cloxacilina posiblemente es obligada en pacientes previamente colonizados y puede considerarse en ancianos institucionalizados con lesiones cutáneas crónicas.
Si se dispone de la tinción de Gram, la pauta terapéutica empírica podrá simplificarse siguiendo el esquema de la figura 1. Si la tinción muestra gramnegativos, no es necesario añadir ampicilina al tratamiento antiseudomónico. En las IU por grampositivos, la amoxicilina/ácido clavulánico puede ser una buena opción terapéutica, ya que cubre tanto al enterococo como a S. aureus.
Cualquier pauta antibiótica empírica se ha de ajustar a los hallazgos microbiológicos en cuanto se disponga del resultado de los cultivos. El tratamiento puede completarse por vía oral si se dispone de antibióticos activos en cuanto el paciente se encuentre estabilizado y la ingestión sea posible.
En los pacientes que presenten sólo signos de IU baja puede iniciarse un tratamiento por vía oral, aunque ninguno de los fármacos disponibles garantiza una cobertura completa. La amoxicilina-ácido clavulánico, las cefalosporinas de tercera generación, la nitrofurantoína o una dosis de 3 g de fosfomicina-trometamol, hasta disponer 48 h después del resultado del urinocultivo, pueden ser opciones adecuadas. En nuestro medio desaconsejamos la utilización empírica de fluorquinolonas por las elevadas tasas de resistencia de las enterobacterias a estos antibióticos, especialmente en el paciente sondado (50% de los casos) y si el paciente los ha recibido recientemente. Si se emplea fosfomicina-trometamol, su eliminación urinaria prolongada (> 72 h) aconseja administrar 2 dosis separadas 3 días (días 1 y 4).
La duración de la terapia antibiótica no está bien establecida. En la cistitis se recomiendan 7 días. Si existe clínica (dolor lumbar, puñopercusión positiva) o sospecha de afectación del parénquima renal (pielonefritis), se aconsejan 14 días de tratamiento (fig. 1). En los pacientes que presentan una sepsis urinaria después de la manipulación de la vía urinaria (p. ej., recambio de sonda) y si no existe evidencia de pielonefritis o prostatitis, el tratamiento podría acortarse a 5-7 días si la fiebre se resuelve en las primeras 24 h 6. En individuos con vejiga neurógena secundaria a lesiones medulares no sometidos a cateterización permanente y con síntomas exclusivos de infección urinaria baja, la administración de ciprofloxacino durante 14 días ha demostrado ser significativamente más eficaz que una pauta de 3 días para prevenir tanto las recaídas microbiológicas como clínicas 82.
En pacientes con sonda vesical permanente e IU sintomática, un pequeño estudio prospectivo y de asignación aleatorizada demostró que la sustitución del catéter previo por otro nuevo antes de iniciar el tratamiento antibiótico se asoció con una menor duración de la fiebre, una mejora de la situación clínica a las 72 h y una menor frecuencia de recaída clínica a los 28 días de concluido el tratamiento 57. De acuerdo con esta experiencia, el recambio del catéter parece plenamente justificado, aunque esta práctica no debe motivar nunca el retraso en la administración de un tratamiento empírico adecuado, sobre todo en el paciente gravemente enfermo. En esta última situación pueden obtenerse los cultivos directamente del catéter, iniciar el tratamiento antibiótico y proceder posteriormente al recambio de la sonda.
Correspondencia:
J.A. Martínez.
Servicio de Enfermedades Infecciosas. Hospital Clínic.
Villarroel, 170. 08036 Barcelona. España.
Correo electrónico: jamarti@clinic.ub.es