Sr. Editor: Entre las micobacterias no tuberculosas (MNT), son las pertenecientes al complejo Mycobacterium avium complex (MAC) las que con más frecuencia ocasionan enfermedad en humanos. Producen infecciones diseminadas en pacientes con inmunodepresión celular, sobre todo en el sida, y enfermedad pulmonar, especialmente lesiones fibrocavitarias de lóbulos superiores, en pacientes con factores predisponentes1. También, se han descrito neumonitis por hipersensibilidad en individuos expuestos a aerosoles de agua caliente contaminados por MAC. Más recientemente, se ha reconocido una nueva manifestación de enfermedad pulmonar por MAC, consistente en la aparición de micronódulos pulmonares y bronquiectasias multifocales, sobre todo, en mujeres sin factores predisponentes para infección pulmonar por MNT. Esta entidad clínica ha sido descrita por algunos autores como "síndrome de Lady Windermere"2,3. Debido a la escasa documentación bibliográfica en España, hemos considerado interesante presentar un caso de enfermedad pulmonar por MAC en una paciente sin factores predisponentes.
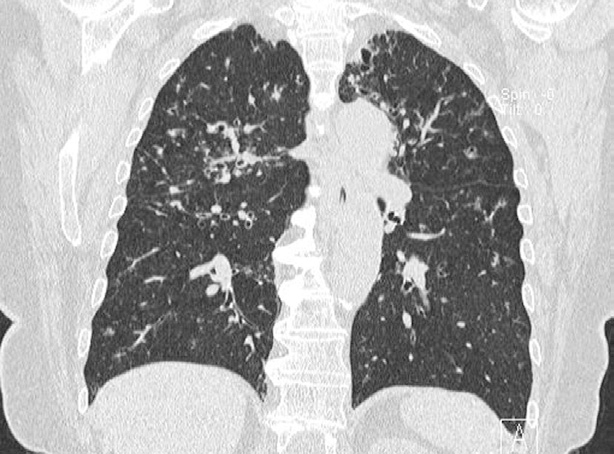
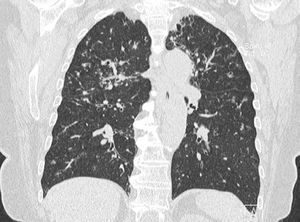
Mujer de 74 años, no fumadora, cuya radiografía de tórax mostraba un infiltrado intersticial. Refería crisis de tos seca y sibilancias, preferentemente en invierno, durante los últimos 4 años. La radiografía de tórax 3 años antes ya informaba de posible patrón pulmonar intersticial. Tenía antecedentes de HTA, que controlaba con dosis bajas de tiazidas, y no refería antecedentes de tuberculosis ni infecciones respiratorias previas, hasta que comenzaron los síntomas respiratorios referidos. En la exploración física se apreciaba: obesidad (IMC: 33,6 kg/m2), PA: 160/85 mmHg e hipoventilación pulmonar global a la auscultación como únicas alteraciones. La VSG, hemograma, perfil bioquímico, ANA, ANCA, factor reumatoide, proteinograma, inmunoglobulinas (IgG, IgA, IgM e IgE), TSH y linfocitos CD4 fueron normales. La serología de VIH era negativa. El estudio inmunológico, tras estimulación de linfocitos con mitógenos, no revelaba deficiencias en la vía IL-12-IFN-g y TNF-a en macrófagos. En la TC torácica de alta resolución (TCAR) se apreciaron bronquiectasias cilíndricas periféricas acompañadas de nodulillos y lesiones ramificadas centrolobulillares, lesiones de árbol en gemación y nódulos acinares, con mayor afectación de los lóbulos superiores (fig. 1). La espirometría demostró un patrón obstructivo leve, a expensas de afectación de la pequeña vía aérea (FEV1: 88%, MMEF75/25: 20%), con difusión pulmonar normal. La paciente siguió presentando episodios recurrentes de tos y sibilancias que mejoraban con tratamiento broncodilatador. El aislamiento de MAC en más de tres muestras de esputo de días diferentes y la progresión de las lesiones pulmonares en una TC de control, llevaron al diagnóstico de infección pulmonar por MAC. Se inició tratamiento con azitromicina (250 mg/día), rifampicina (600 mg/día) y etambutol (800 mg/ día), con la adición de amikacina (500 mg 3 veces/semana) durante los primeros 2 meses, hasta completar 18 meses. En las visitas de control posteriores, se evidencia mejoría clínico-radiológica y negativización del cultivo de esputo para micobacterias. A los 6 meses de completar el tratamiento antimicobacteriano, la paciente se encuentra clínicamente estable, no se aprecia progresión radiológica de las lesiones pulmonares y los cultivos de esputo para micobacterias persisten negativos.
Figura 1. Reconstrucción coronal de TCAR.
Actualmente, se distinguen 2 cuadros clínicos diferentes de la enfermedad pulmonar por MNT: enfermedad fibro-cavitaria de lóbulos superiores y la forma caracterizada por la aparición de micronódulos pulmonares y bronquiectasias. La primera es la forma tradicional mejor conocida de infección pulmonar por MNT, ha sido descrita en varones ancianos con enfermedad pulmonar previa y se caracteriza por la aparición de lesiones fibrocavitarias, sobre todo, en lóbulos superiores o segmentos superiores de lóbulos inferiores, que puede ser indistinguible de la tuberculosis pulmonar1. La segunda forma clínica, ha sido descrita más recientemente en mujeres inmunocompetentes, no fumadoras y mayores de 50 años, sin enfermedad pulmonar predisponerte; está definida por la aparición de micronódulos pulmonares y bronquiectasias multifocales y el MAC es responsable de la mayoría de los cuadros2,3. Esta enfermedad, tiene un curso clínico insidioso y los síntomas, bastante inespecíficos, pueden estar presentes por meses o años antes de diagnosticarse. En ocasiones, presentan síntomas constitucionales: fiebre, sudoración, astenia, anorexia y adelgazamiento, sobre todo, en pacientes con tinción de esputo positiva, aunque con menor frecuencia que en la tuberculosis2.
La imagen radiológica típica se caracteriza por la presencia de infiltrados micronodulares o reticulonodulares multifocales, especialmente en el lóbulo medio y língula, siendo rara la aparición de derrame pleural. En la TCAR, aparecen imágenes de bronquiolitis (múltiples nódulos < 5 mm y estructuras nodulares centrolobulares ramificadas o patrón de árbol en gemación tree in bud) y bronquiectasias, ambas de distribución multifocal y bilateral. También se pueden observar atelectasias, consolidaciones y opacidades en vidrio deslustrado. Los cambios anteriormente descritos son sugestivos, pero no específicos de infección por MNT, ya que diferentes estudios encuentran que, en pacientes con este patrón radiológico, sólo se aíslan micobacterias entre un tercio y la mitad de los casos4.
En los pacientes con esta enfermedad, se pueden aislar diferentes cepas a lo largo de su evolución, lo que sugiere una susceptibilidad del huésped al microorganismo, que permite la reinfección5. La patogenia de las lesiones no ha sido claramente definida, pero podría ser debida a un defecto en el drenaje o aclaramiento mucociliar de las secreciones respiratorias, especialmente del lóbulo medio y la língula. Reich y Jonson3 postulan la hipótesis de que este síndrome se produciría, en algunos pacientes, por la incapacidad de aclarar las secreciones respiratorias, debido a una supresión voluntaria de la tos, que conduciría a infección por MAC y bronquiectasias, y lo describen con el nombre de la protagonista de una obra de Oscar Wilde: Lady Windermere. Otros autores han encontrado como posible explicación un déficit en la liberación de citocinas (IFN-ϒ, IL-12 y TNF-α), en respuesta al estímulo con antígenos de MAC2.
El diagnóstico de la enfermedad pulmonar por MNT es difícil y se realiza a menudo con retraso, debido a que los síntomas y los hallazgos radiológicos que suelen acompañarla son inespecíficos, siendo en ocasiones difícil distinguir colonización de infección. Para ayudar a su diagnóstico, la American Thoracic Society (ATS) propuso en 1997 unos criterios clínicos, radiológicos y microbiológicos, entre los que se requiere el aislamiento repetido de MNT en muestras respiratorias1. La escasez de microorganismos en la forma nodular, conduce a que la tinción de esputo sea frecuentemente negativa o sólo positiva de forma intermitente, mientras que el cultivo de micobacterias en esputo muestra con frecuencia falsos negativos para infección por MNT, lo que indicaría en estos casos la conveniencia de realizar una broncoscopia con lavado bronquioalveolar o biopsia para llegar al diagnóstico1,2. El tratamiento óptimo no ha sido establecido, pero el pronóstico ha mejorado notablemente desde la introducción de los nuevos macrólidos. La ATS recomienda un mínimo de 3 fármacos (claritromicina/azitromicina, rifampicina/rifabutina y etambutol) que habrá que mantener hasta, al menos, un año después del último cultivo de esputo negativo. Se aconseja añadir un aminoglucósido durante los primeros 2 meses de tratamiento1.
La paciente que presentamos, refería síntomas respiratorios de unos 3 años de evolución y, con anterioridad, no mencionaba síntomas respiratorios recurrentes. En los estudios practicados, no se detectaron otras patologías predisponentes para infección pulmonar por MAC; cumplía los criterios clínico, radiológico y microbiológico de la ATS y mejoró con tratamiento anti-MAC. Por ello, parece razonable asumir que la infección por MAC es responsable de su patología pulmonar.
En España, se ha encontrado una menor incidencia de infecciones por MNT, que en otros países con menor incidencia de tuberculosis, lo que podría estar en relación con la posible presencia de inmunidad cruzada entre M. tuberculosis y otras micobacterias6. Aunque existen series españolas de infecciones pulmonares por MNT7-10, en la revisión bibliográfica que hemos realizado (Medline de 1966 a 2006, empleando los descriptores: "environmental mycobacteria", "non tuberculous mycobacteria", "mycobacterial disease" y "MAC lung disease"), no hemos encontrado ningún caso, descrito en España, de infección pulmonar por MAC en pacientes sin factores predisponentes, y patrón radiológico de micronódulos pulmonares y bronquiectasias (síndrome de Lady Windermere). El caso que presentamos, pone de manifiesto la importancia de pensar en esta entidad, en presencia de un patrón clínico-radiológico característico, al tratase de una enfermedad que en el futuro podría aumentar su incidencia y que, dejada a su libre evolución, puede tener consecuencias catastróficas para el paciente.