La incidencia de las enfermedades provocadas por micobacterias no tuberculosas (MNT) y su morbimortalidad están aumentando en las últimas décadas1. Existen varios factores predisponentes para el desarrollo de infecciones por MNT, como la enfermedad pulmonar obstructiva crónica, haber padecido una tuberculosis, las bronquiectasias, las inmunodeficiencias, el cáncer o la diabetes mellitus, aunque en una proporción significativa de pacientes no se identifican factores de riesgo2,3. Aunque el pulmón es el órgano que se afecta con mayor frecuencia, las MNT también pueden infectar huesos, ganglios linfáticos, articulaciones o la piel4. La mayor parte de las infecciones pulmonares por MNT se diagnostican mediante el examen y cultivo del esputo5. Si la MNT no puede aislarse en las secreciones expectoradas, se suele progresar a la realización de un lavado broncoalveolar (LBA) o, incluso, de una biopsia pulmonar1,5. Presentamos el caso de un paciente inmunocompetente con una infección multifocal (vertebral y pulmonar) por Mycobacterium avium complex (MAC) en el que se logró la primera confirmación microbiológica tras la instilación percutánea (con control radiológico) de una lesión cavitada pulmonar y la provocación de un «esputo inducido».
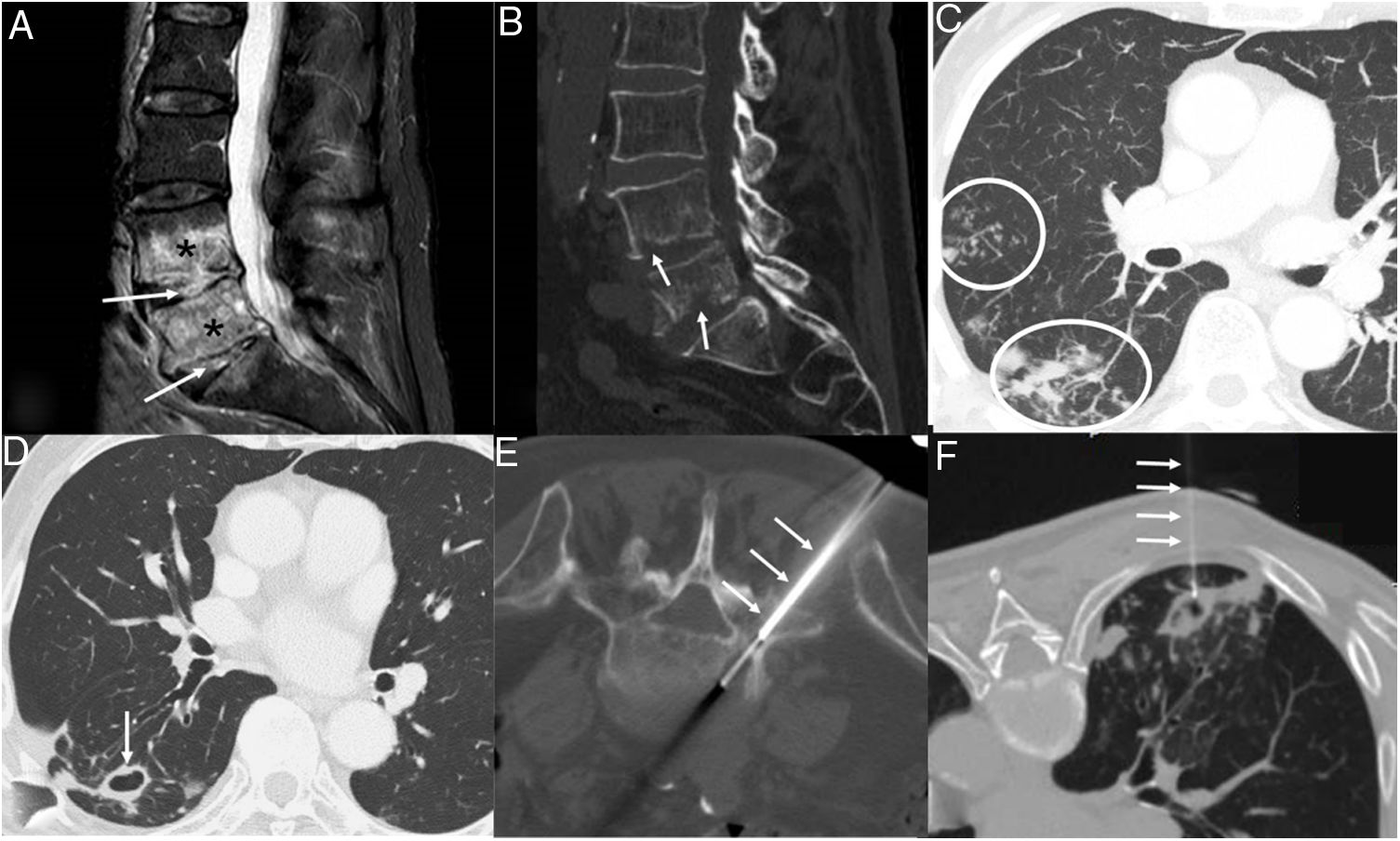
Se trata de un varón de 75 años con antecedentes de hipertensión arterial, dislipemia y fibrilación auricular (pero sin ninguno de los factores predisponentes reseñados en el párrafo anterior) que consultó por astenia, tos seca y dolor lumbar progresivo de cinco meses de evolución, en el que una resonancia magnética (RM) y una tomografía computarizada (TC) de columna lumbar demostraron signos de una espondilodiscitis de los espacios intervertebrales L4-L5 y L5-S1 (figs. 1 A y B). En una radiografía de tórax se observaron opacidades de aspecto infeccioso en pulmón derecho, destacando algunas lesiones cavitadas en lóbulo inferior derecho (LID). Una TC de tórax confirmó la presencia de nódulos centrolobulillares y signos de bronquiolitis infecciosa (fig. 1C), así como varias lesiones cavitadas en LID, sugiriendo una infección activa por Mycobacterium tuberculosis (M. tuberculosis) (fig. 1D). Un LBA y varios esputos inducidos (tras la inhalación de soluciones de suero salino hipertónico) no demostraron la presencia de bacterias ácido-alcohol resistentes (BAAR) mediante tinción de auramina ni de material genético de M. tuberculosis mediante amplificación de ácidos nucleicos (Xpert® MTB/RIF Ultra, Cepheid). Se decidió realizar una biopsia percutánea con control radiológico del disco intervertebral L5-S1 (fig. 1E), con resultados igualmente negativos. Ante la ausencia de confirmación microbiológica, y en espera del resultado de los cultivos específicos para micobacterias (VersaTREK®, Thermo Fisher Scientific), se decidió realizar una punción-aspiración percutánea (con control radiológico mediante TC) de una de las lesiones cavitadas en LID (fig. 1F) tras la instilación de unos 10 mL de suero salino en una de las lesiones cavitadas, pero apenas se pudo aspirar 1 mL de líquido hemorrágico. Al finalizar el procedimiento, el paciente expectoró un esputo abundante (15 mL) y espeso sobre un paño estéril (utilizado para colocar el material empleado durante el procedimiento de instilación) y no hubo complicaciones en el control radiológico realizado inmediatamente después del procedimiento. Dicho esputo fue aspirado con una jeringa estéril e introducido en un tubo de ensayo para su procesamiento microbiológico inmediato, confirmándose la presencia de 1.500 BAAR/100 campos en la tinción de auramina. La tinción de la pequeña cantidad de líquido aspirado de la lesión cavitada, así como la detección de material genético de M. tuberculosis en ambas muestras fueron negativas. El crecimiento de MAC a los 16 días de incubación en el esputo obtenido tras este procedimiento confirmó el agente etiológico. El diagnóstico microbiológico se confirmó tras el posterior crecimiento tardío de MAC en una de las muestras respiratorias obtenidas previamente (el LBA); el cultivo de la biopsia vertebral y del resto de muestras respiratorias fue negativo. El paciente fue tratado con claritromicina, etambutol y rifampicina, respondiendo favorablemente al tratamiento tanto la espondilodiscitis como la infección pulmonar.
A) Imagen sagital de RM de columna lumbar (secuencia STIR) en la que se identifica una marcada alteración en la intensidad de señal de los discos intervertebrales L4-L5 y L5-S1 (flechas) y de los platillos vertebrales adyacentes (asteriscos). B) Reconstrucción sagital de TC de columna lumbar (ventana de hueso) en la que se aprecian las erosiones óseas de los platillos vertebrales (flechas). C) y D) Imágenes axiales de TC de tórax (ventana de pulmón) en las que se observan nódulos pulmonares centrolobulillares e imágenes de «árbol en brote» (C, círculos) y una lesión cavitada dominante de paredes finas (D, flecha). E) Imagen axial de TC de columna lumbar (ventana de hueso, paciente colocado en decúbito prono) que muestra el procedimiento de biopsia percutánea (flechas) de los focos de infección discal. F) Imagen axial de TC de tórax (ventana de pulmón, paciente colocado en decúbito prono) en la que se observa el procedimiento de instilación de suero salino en una lesión cavitada pulmonar (flechas). Tras la instilación de 10 ml de suero salino, sólo pudo aspirarse 1 mL de líquido, pero al finalizar el procedimiento, el paciente expectoró un esputo abundante (15 mL).
La demostración microbiológica de infecciones pulmonares por MNT no es fácil, y con frecuencia su detección no implica necesariamente la obligatoriedad de instaurar un tratamiento6. Entre las técnicas diagnósticas más habituales se encuentran el estudio del esputo (espontáneo o inducido), el LBA, la biopsia pulmonar (transbronquial o quirúrgica), y la aspiración percutánea de una lesión pulmonar cavitada6–8. La aspiración percutánea con control radiológico de lesiones pulmonares cavitadas es una técnica diagnóstica rentable en la detección y cultivo de múltiples agentes microbiológicos, y permite diferenciar infecciones fúngicas o abscesos bacterianos de infecciones por micobacterias9–11. En nuestro caso se instilaron 10 mL de suero salino en una lesión pulmonar cavitada, pero apenas se aspiró 1 mL del líquido instilado, ya que el líquido introducido era drenado por los bronquios comunicantes con la cavidad pulmonar. Afortunadamente, el paciente expectoró el suero instilado percutáneamente al finalizar el procedimiento, permitiendo la detección directa de BAAR mediante tinción y confirmación posterior de infección por MAC mediante cultivo, varios días más tarde se confirmó el crecimiento de MAC en una de las muestras respiratorias obtenidas inicialmente. No hemos encontrado en la literatura científica la demostración microbiológica de una infección por MNT en un esputo «inducido» provocado tras la instilación percutánea (con control radiológico) de suero salino en una lesión cavitada pulmonar, existe una publicación en la que se instiló suero salino en una lesión pulmonar cavitada y se realizó, a continuación, una aspiración del suero instilado a través de la misma aguja y un LBA, confirmándose en ambas muestras (el líquido aspirado directamente de la lesión cavitada y en el LBA) el microorganismo causante de la infección12. Creemos que esta técnica de inducción «percutánea» de esputo puede ser útil en determinados pacientes con lesiones pulmonares cavitadas en los que otros métodos diagnósticos más convencionales (inducción de esputo, LBA) no han logrado una confirmación microbiológica.