En este trabajo se evalúan y comparan dos métodos inmunocromatográficos para la detección simultánea de Giardia duodenalis y Cryptosporidium spp. en muestras de heces.
MétodosSe han analizado 254 muestras de heces con dos métodos inmunocromatográficos, Crypto-Giardia (CerTest Biotec) y Stick Crypto-Giardia (Operon).
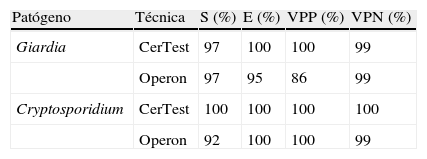
ResultadosEn el diagnóstico de G. duodenalis, la sensibilidad y especificidad fueron del 97 y el 100%, respectivamente, para CerTest; y del 97 y el 95% para Operon. En el diagnóstico de Cryptosporidium spp., la sensibilidad obtenida con el método de CerTest fue del 100%, frente a la sensibilidad del 92% obtenida con Operon. No hubo falsos positivos con ninguna de las dos técnicas.
ConclusionesAmbos métodos presentan buenas sensibilidad y especificidad, por lo que son de utilidad para el diagnóstico rápido de G. duodenalis y Cryptosporidium spp. Las ventajas de los métodos inmunocromatográficos son su rapidez y que no necesitan de personas expertas en microscopia ni de equipos especiales.
To assess and compare the performance of two immunochromatographic tests for the simultaneous detection of Giardia duodenalis and Cryptosporidium spp. in faeces.
Materials and methodsIn this study 254 faeces samples were tested using the two immunochromatography strips Cryto-Giardia (CerTest Biotec) and Stick Crypto-Giardia (Operon).
ResultsIn the diagnosis of G. duodenalis, the sensitivity and specificity of the kits were 97% and 100%, respectively for the CerTest; and 97% and 95% for Operon. In the diagnosis of Cryptosporidium spp. Certest strip rendering a sensitivity of 100%, compared to with a sensitivity of 92% using Operon. There were no false positives using either technique.
ConclusionsBoth methods yielded good sensitivity and specificity values and are thus useful tools for a rapid diagnosis of G. duodenalis and Cryptosporidium spp. The benefits of immunochromatography methods are that there is no requirement for expert microscopists or special equipment.
La infección por el protozoo flagelado Giardia duodenalis es muy común en todo el mundo. Tradicionalmente, el diagnóstico parasitológico de G. duodenalis se realiza por el examen microscópico de las heces. La sensibilidad de la técnica depende en gran medida del número de muestras examinadas, del uso de técnicas de concentración y de la destreza y experiencia del microscopista, por lo cual el diagnóstico de laboratorio de la infección por G. duodenalis suele ser laborioso y costoso.
Cryptosporidium spp. es un protozoo coccidio considerado de importancia emergente como causa de infecciones gastrointestinales, que afecta principalmente a niños y personas inmunodeficientes. Con frecuencia suele originar brotes, principalmente en guarderías, aunque en ocasiones se han descrito brotes de carácter masivo por contaminación hídrica1. El método tradicional de diagnóstico es la microscopia tras tinción por Ziehl-Neelsen por lo que, al igual que en el diagnóstico de G. duodenalis, el tiempo de realización de la técnica es largo y necesita de expertos microscopistas.
En los últimos años se han desarrollado técnicas de detección rápida de antígenos parasitarios, con el objetivo de ofrecer a los laboratorios clínicos métodos diagnósticos alternativos más sencillos.
En este trabajo, se comparan dos métodos comerciales inmunocromatográficos con el examen microscópico para la detección de G. duodenalis y Cryptosporidium spp. en muestras de heces, y se utiliza una técnica basada en la PCR como método de confirmación.
Material y métodosEl estudio se realizó en tres hospitales de Madrid a lo largo de 2 meses. Se analizaron 254 muestras de heces con las tiras inmunocromatográficas comerciales, Crypto-Giardia (CerTest Biotec, Zaragoza, España) y Stick Crypto-Giardia (Operon, Zaragoza, España), siguiendo estrictamente las recomendaciones del fabricante. Se incluyeron en el estudio heces diarreicas y, además, heces de pacientes con VIH positivo y de niños menores de 5 años. También se incluyeron como control muestras de heces en las que se habían observado quistes de G. duodenalis y ooquistes de Cryptosporidium spp.
El examen microscópico de las muestras de heces se realizó tras el método de concentración de Ritchie y posterior observación con tinción no permanente de lugol. Para la visualización de los ooquistes de Cryptosporidium spp. se realizó una tinción de Ziehl-Neelsen modificada.
En los casos de discordancia entre alguna de las técnicas y en los casos positivos, se realizó una técnica molecular de PCR como método confirmatorio, que se consideró como el método de referencia para el diagnóstico de las parasitosis.
Las heces se enviaron congeladas al laboratorio de Parasitología del Centro Nacional de Microbiología para realizar el diagnóstico molecular de G. duodenalis y Cryptosporidium spp. Las heces se conservaron a –20°C hasta la extracción del ADN, para lo cual se utilizó el método comercial DNA Stool Mini Kit (QIAGEN, Hilden, Alemania) siguiendo las instrucciones del fabricante, excepto una modificación ya que se elevó la temperatura de lisis a 95°C para romper la pared del quiste de los parásitos a estudio.
Para el diagnóstico de G. duodenalis se realizó una PCR en tiempo real que empleó como diana el gen SSUrDNA del parásito. Los cebadores y las sondas utilizados fueron los descritos previamente por Verweij2. Las reacciones se realizaron en un volumen final de 25μl, utilizando como buffer de PCR TaqMan Gene Expression Master Mix (Applied Biosystems, Reino Unido), 0,5μmol de cada iniciador, 0,2μmol de sonda (TaqMan MGB, Applied Biosystems) y 3μl del ADN obtenido, empleando el equipo ABI PRISM 7500 (Applied Biosystems) y las siguientes condiciones 2min a 50°C, 15min a 95°C, seguido de 45 ciclos de 15s a 95°C y 1min a 60°C.
El diagnóstico molecular de Cryptosporidium spp. se llevó a cabo mediante una nested-PCR que amplificó un fragmento de 516 pb del gen COWP descrita por Pedraza-Díaz et al.3.
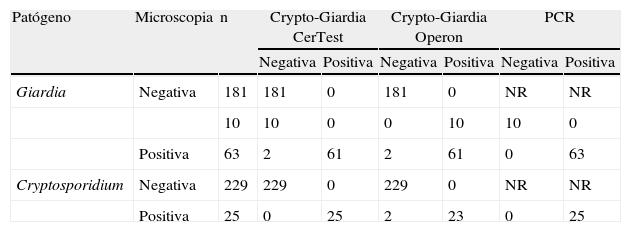
ResultadosDe las 254 muestras analizadas, 166 fueron negativas y 88 fueron positivas mediante el examen microscópico. Todos los casos positivos fueron confirmados mediante la técnica de PCR. De las 88 heces positivas, 63 lo fueron para G. duodenalis y 25 para Cryptosporidium. En cuanto al diagnóstico mediante las tiras antigénicas (tabla 1), el método de CerTest presentó dos falsos negativos para G. duodenalis (61/63) y ningún falso positivo, mientras que la técnica de Operon ofreció dos falsos negativos para G. duodenalis (61/63) y 10 falsos positivos (181/191), ya que la PCR en tiempo real fue, además de la microscopia, negativa en esas 10 muestras. La sensibilidad y especificidad se muestran en la tabla 2.
Comparación de los resultados obtenidos entre dos técnicas inmunocromatográficas y microscopia en la detección de Giardia duodenalis y Cryptosporidium spp. La PCR en tiempo real se usó como técnica de confirmación.
| Patógeno | Microscopia | n | Crypto-Giardia CerTest | Crypto-Giardia Operon | PCR | |||
| Negativa | Positiva | Negativa | Positiva | Negativa | Positiva | |||
| Giardia | Negativa | 181 | 181 | 0 | 181 | 0 | NR | NR |
| 10 | 10 | 0 | 0 | 10 | 10 | 0 | ||
| Positiva | 63 | 2 | 61 | 2 | 61 | 0 | 63 | |
| Cryptosporidium | Negativa | 229 | 229 | 0 | 229 | 0 | NR | NR |
| Positiva | 25 | 0 | 25 | 2 | 23 | 0 | 25 | |
En el diagnóstico de Cryptosporidium spp., las 25 muestras en las que se habían observado ooquistes en la tinción de Ziehl-Neelsen fueron positivas con el método de CerTest (sensibilidad del 100%). Mientras que con el método de Operon, 23 fueron las muestras positivas (sensibilidad del 92%). No hubo falsos positivos con ninguna de las dos técnicas (tabla 2).
DiscusiónLos dos ensayos inmunocromatográficos para la detección de antígenos de Giardia spp. y Cryptosporidium spp. evaluados en este trabajo son fáciles de realizar, rápidos y no requieren personal con experiencia ni equipos especiales, al contrario que el examen microscópico que es una técnica que consume mucho tiempo y necesita de personal experto en microscopia.
Los resultados de sensibilidad y especificidad de los dos métodos comerciales analizados son similares a los obtenidos en trabajos con otros métodos comerciales4. Sin embargo, en otros estudios obtienen unos valores de sensibilidad muy bajos5, lo que indica que hay grandes diferencias entre los distintos métodos inmunocromatográficos comercializados6 por lo que es interesante seleccionar un método cuya sensibilidad y especificidad hayan sido contrastadas.
El método inmunocromatográfico de CerTest para la detección de Giardia spp. mostró una alta especificidad, por lo que un resultado positivo por este método no necesita ser confirmado. No así con el de Operon, en el que se observaron 10 falsos positivos, no se confirmaron ni por microscopia ni por PCR en tiempo real, en el diagnóstico de G. duodenalis. En cuanto a los 4 falsos negativos (2 con CerTest y 2 con Operon), 3 se dieron en muestras de heces que tenían abundantes quistes del parásito, sólo en un falso negativo con CerTest la muestra tenía pocos quistes.
Respecto a la detección de Cryptosporidium spp., los dos métodos presentaron una alta especificidad, la sensibilidad de la técnica de CerTest fue del 100%, mientras que la de Operon disminuyó al 92% por 2 falsos negativos, estas muestras presentaban una baja carga parasitaria por microscopia.
En cuanto a los valores predictivos positivos y negativos obtenidos en este estudio, deben ser valorados con reservas dado que están en relación con la prevalencia del patógeno buscado. Si la prevalencia de G. duodenalis y Cryptosporidium spp. fuese menor, el VPP podría decaer significativamente.
Estos métodos pueden ser muy útiles en el caso de brotes producidos por alguno de estos dos parásitos, ya que es una forma muy rápida y sencilla de analizar un elevado número de muestras.
En conclusión, los métodos de Certest y Operon evaluados en este trabajo presentan buenas sensibilidad y especificidad, por lo que son de utilidad para el diagnóstico rápido de G. duodenalis y Cryptosporidium spp., aunque el método de Certest demuestra una mayor especificidad en la detección de Giardia y una mayor sensibilidad para la detección de Cryptosporidium. No obstante, las técnicas de referencia como la microscopia y la PCR muestran una mayor fiabilidad diagnóstica, por lo que deben utilizarse en casos dudosos como técnicas confirmatorias.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.