Los inconvenientes de la administración indefinida del tratamiento antirretroviral y el enorme número de personas infectadas convierten la cura del VIH en un objetivo primordial de salud pública. El VIH puede persistir en el organismo por al menos cuatro mecanismos: un reservorio celular latentemente infectado, la replicación persistente a pesar del tratamiento, los santuarios anatómicos y la disfunción inmunológica. Se han desarrollado estrategias para erradicar el VIH haciendo frente a estos mecanismos. Hasta el momento, se ha conseguido la erradicación completa del virus en un paciente mediante el trasplante de progenitores hematopoyéticos resistentes a la infección y existen casos de curación funcional de modo natural (controladores de élite) o tras tratamiento antirretroviral (controladores postratamiento). Sin embargo, ninguna estrategia ha conseguido disminuir el reservorio, ni lograr remisiones de modo constante y uniforme. El fracaso de las estrategias aisladas sugiere que la combinación de varias de ellas sea la solución futura.
The disadvantages of the long-term administration of antiretroviral therapy as well as the huge number of affected persons have placed the cure of HIV as a primary goal of Public Health. HIV may persist in the organism by at least four mechanisms: a latently infected cellular reservoir, the persistent replication of HIV in spite of ART, anatomic sanctuaries, and the immune dysfunction. Several strategies directed against these mechanisms have been developed. With all this, a complete eradication of HIV has been achieved in a patient using the transplantation of haemopoietic stem cells that were resistant to HIV-infection, and there are examples of functional cure either spontaneously (elite controllers) or after antiretroviral therapy (post-treatment controllers). However, no strategies have been successful in reducing the reservoir size, nor in achieving constant, uniform remissions. The failure of isolated strategies makes it likely that the combination of several of them may be the future solution.
Con justicia se ha dicho que el tratamiento antirretroviral (TAR) constituye uno de los avances más importantes de la medicina moderna. Desde su incorporación, la combinación de fármacos antirretrovirales ha evitado la muerte y el sufrimiento de millones de personas en todo el mundo, ha logrado frenar la expansión logarítmica de la epidemia y, mediante el acceso a medicamentos genéricos, ha extendido sus beneficios a los países con escasos recursos, donde la necesidad es mayor.
Sin embargo, el TAR no logra eliminar por completo el VIH del organismo infectado. De modo prácticamente universal, cuando se suspende el TAR el virus reaparece en sangre a los pocos días o semanas de la interrupción. Ello obliga a mantenerlo durante toda la vida de la persona infectada. Este hecho asocia importantes inconvenientes: el uso prolongado de TAR da lugar a efectos secundarios graves, el virus puede desarrollar resistencias a los fármacos antirretrovirales, aun con un control adecuado con TAR persiste un estado de inflamación crónica que lleva al desarrollo de complicaciones severas y, a pesar de que ha aumentado el acceso al TAR, se está lejos de la cobertura deseable en los países más necesitados. En 2015, se estimó que solo 17 millones de personas infectadas recibían tratamiento, lo que supone un 46% de población mundial infectada, mientras que el resto, pertenecientes a áreas de renta baja o media, no podía acceder al tratamiento1. No menos importante, el coste del TAR es muy elevado.
Por estos motivos, se justifica la búsqueda de estrategias que permitan la curación del VIH. Durante la última década se han realizado esfuerzos extraordinarios en este sentido y se han producido algunos avances significativos. Se han identificado las principales barreras que impiden la curación del VIH con el tratamiento antirretroviral, se ha avanzado en el conocimiento de las dianas terapéuticas a las que podrían dirigirse los fármacos potencialmente erradicadores, se han propuesto estrategias integradoras y se han iniciado ensayos clínicos con diversas alternativas. Esta revisión pretende ser una puesta al día de los principales avances, insistiendo especialmente en los obstáculos para la erradicación del VIH y en las diversas estrategias que se han propuesto, alguna de las cuales se están poniendo a prueba.
Obstáculos para la erradicación del VIHSe han identificado al menos tres barreras que impiden la curación del VIH con las armas actualmente disponibles: el denominado reservorio celular latente, la replicación persistente del VIH a pesar del tratamiento antirretroviral adecuado y el alojamiento del virus en reservorios anatómicos. Aunque su importancia relativa puede ser desigual, nadie cuestiona que una estrategia erradicadora debe contemplar la eliminación de cada uno de estos obstáculos. Además, la incapacidad del sistema inmunológico para reconocer y eliminar las células infectadas por VIH se constituye en un obstáculo adicional a contemplar (tabla 1).
Mecanismos de persistencia del VIH
| 1. Persistencia de VIH en los linfocitos T CD4+ en reposo |
| 2. Activación de linfocitos T CD4+ latentemente infectados e infección de nuevas células |
| 3. Replicación persistente de bajo grado |
| 4. Expansión clonal inducida por VIH |
| 5. Homeostasis normal sin replicación mediada por citoquinas (IL-2, IL-7, IL-15) |
El reservorio celular es actualmente el principal obstáculo para lograr la erradicación de la infección por VIH-1. Está compuesto fundamentalmente por linfocitos TCD4+de memoria en reposo latentemente infectados que llevan el ADN del VIH-1 integrado y transcripcionalmente silente. Dentro de esta población, se estima que las células que albergan VIH latente son principalmente los LT CD4 de memoria central (expresan CD27 y CCR7) y los LT CD4 de memoria transicionales (expresan CD27, pero no CCR7). También parece que, aunque de modo limitado, las células T naive y, menos probablemente, las células progenitoras multipotentes en médula ósea podrían formar parte del reservorio celular latente. Se han identificado, por último, las llamadas células madre de memoria T (Tscm, LT memory stem cells), que representan el estadio más temprano y de mayor duración de las células T memoria2. Las células latentemente infectadas se encuentran ampliamente diseminadas en el organismo, tanto en pacientes sin tratamiento antirretroviral como en pacientes tratados y con carga viral suprimida. La presencia de las células se ha detectado tanto en sangre periférica como, especialmente, en tejido linfoide.
Hay otras células que podrían formar parte del reservorio3. Los macrófagos y, probablemente, los monocitos parecen ser los principales reservorios de células no T para el VIH-1. Menos claro es el papel que desempeñan las células dendríticas, las células T reguladoras, las células NK, las células T CD8 o las células epiteliales en el desarrollo de la latencia, en el contexto de una infección por VIH-1 no tratada4.
Como característica común, las células latentemente infectadas tienen una mínima expresión de los genes de VIH-1 o de sus proteínas, y no son reconocidas por el sistema inmune al no tener en la superficie ninguna proteína ni marcador que lo identifique como células infectadas. Un problema importante es que no existen marcadores específicos que permitan identificar las células latentemente infectadas, dado que además gran parte del DNA proviral detectado en estas células carece de capacidad replicativa. Se ha visto que las células latentemente infectadas tienen altos niveles de CD25 y, más recientemente, se ha identificado CD32a como un marcador específico de células T CD4+ latentemente infectadas con virus con capacidad replicativa6.
Establecimiento y mantenimiento de la latencia del VIHEl VIH-1 infecta más fácilmente a los linfocitos T CD4 activados que a los linfocitos T CD4 de memoria y naive, dado que los linfocitos naive no poseen correceptores CCR5 y los linfocitos T CD4 de memoria tiene una expresión disminuida de este correceptor. La expresión del correceptor CCR5 es directamente proporcional al grado de activación de la célula, por lo que el VIH-1 puede infectar directamente células con densidad de CCR5 suficiente, entre ellas los linfocitos T CD4 en reposo, aunque no llega a integrarse en el núcleo.
El reservorio se establece durante la infección primaria y es muy estable. Tras entrar en la células, el VIH-1 se transcribe a ADN complementario, se trasloca al núcleo y se integra en el genoma de la célula infectada. Mientras el LT CD4 esté activado, este DNA proviral se transcribirá iniciando nuevos ciclos de replicación. El DNA proviral se integra en zonas transcripcionalmente activas y también cerca de los genes que codifican para los factores transcripcionales del hospedador7. En este último caso, se confiere una ventaja selectiva para la expansión clonal. Sin embargo, en algunas células se establece un estado de latencia, y dado que la infección directa de las células T memoria no progresa hasta la integración, la única vía de formación del reservorio latente es el paso desde el estado de activación de los LT CD4 infectados al estado de memoria en reposo, evitando la muerte celular8. Se estima que el índice de células en reposo que se han convertido a partir de LT CD4 activados es de uno por millón de LT CD4 y que, en sangre periférica, una de cada millón de LT CD4 de memoria en reposo alberga virus con replicación competente, siendo probablemente un número mayor en ciertos tejidos4.
En el mantenimiento del reservorio celular latentemente infectado se implican, al menos, tres mecanismos9:
- 1)
Represión de la transcripción. Actualmente se acepta que la latencia se mantiene en gran medida por la falta de niveles suficientes, en el núcleo de las células T CD4 en reposo, de factores de transcripción del hospedador, que son dependiente de activación, como NF-KB y NFAT, de proteínas Tat viral y de factores del hospedador asociados a Tat, también dependientes de activación. Es igualmente importante el papel en el silenciamiento del provirus de las histonas deacetilasas e histonas metiltransferasas, del factor de elongación de la transcripción positiva (p-TEFb) y los micro-ARN9.
- 2)
Proliferación homeostática. En el momento de la activación celular se liberan varias interleucinas, como la IL-7, que favorece la división celular. De esta manera, tras la división se generan dos células, de las cuales una entra en apoptosis y la otra, conteniendo el provirus en su genoma, se mantiene viva y sigue desarrollando sus funciones habituales. Estudios recientes muestran que las células con expansión clonal contienen virus con replicación competente10,11.
- 3)
Reguladores negativos de la activación de células T. Hay varias vías de regulación de la transcripción que se ponen en marcha cuando se produce la activación del linfocito. Estudios recientes han demostrado que células con los receptores en superficie PD-1, CTLA-4, TIGIT, TIM-3, LAG3, CD160 y CD2B4 tienen más probabilidad de estar en estado de latencia, por una regulación negativa de la replicación12.
El TAR es altamente efectivo en el control de la replicación viral. Sin embargo, en la mayoría de los pacientes tratados correctamente con TAR, mediante técnicas de detección ultrasensibles, se detectan niveles muy bajos de ARN viral. Tradicionalmente se sostiene que la viremia de bajo grado se origina por reactivación de la pequeña población latente y no por la existencia de replicación viral constante. La ausencia de evolución viral en los aislados de pacientes sometidos a TAR a largo plazo se ha utilizado como principal argumento en contra de replicación vírica persistente13.
Sin embargo, existen argumentos que apoyan la existencia de nuevos ciclos de replicación en, al menos, algunos grupos de personas que reciben TAR supresivo. En un estudio de intensificación con raltegravir se demostró la persistencia de la replicación viral al observarse durante el mismo un aumento de los niveles de DNA episómico circular con 2-LTR lo que traducía inhibición de la replicación14. Se sabe, mediante modelos que miden la dinámica de replicación viral, que los haplotipos de los virus hallados en nódulos linfoides y en la sangre son muy parecidos aunque con alguna variación genética sustancial, en respuesta a fuerzas selectivas intensas. De esta manera la replicación viral en las células infectadas en los tejidos linfoides, donde el TAR no llega a concentraciones adecuadas, podría establecer el reservorio viral y el tráfico a la sangre y a otros tejidos linfoides15. En un estudio se demostró que el virus no genera inevitablemente resistencia al TAR porque las bajas concentraciones del antirretroviral en santuarios anatómicos no son suficientes para conferir ventajas defensivas contra el fármaco16.
También se ha demostrado que el linfocito T CD4 folicular (LT helper en el ganglio linfático) es inaccesible al linfocito T CD8 activado, lo que ayuda a perpetuar la replicación viral residual en los nódulos linfáticos. De hecho, el folículo de células B es el sitio con mayor replicación viral activa, dado que la ausencia de LTCD8 permite la replicación del VIH por la falta de respuesta eficiente de LT en esta región17.
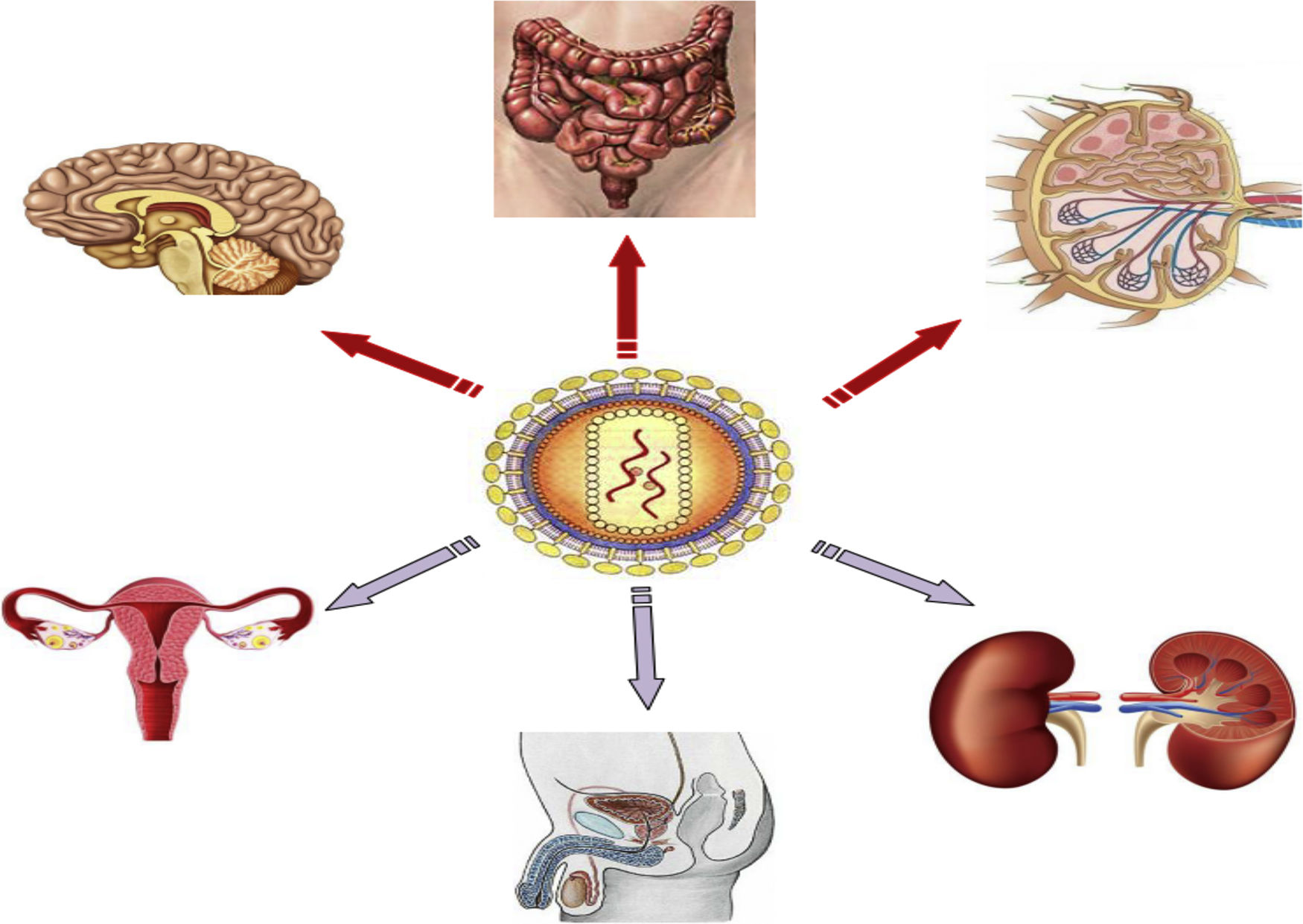
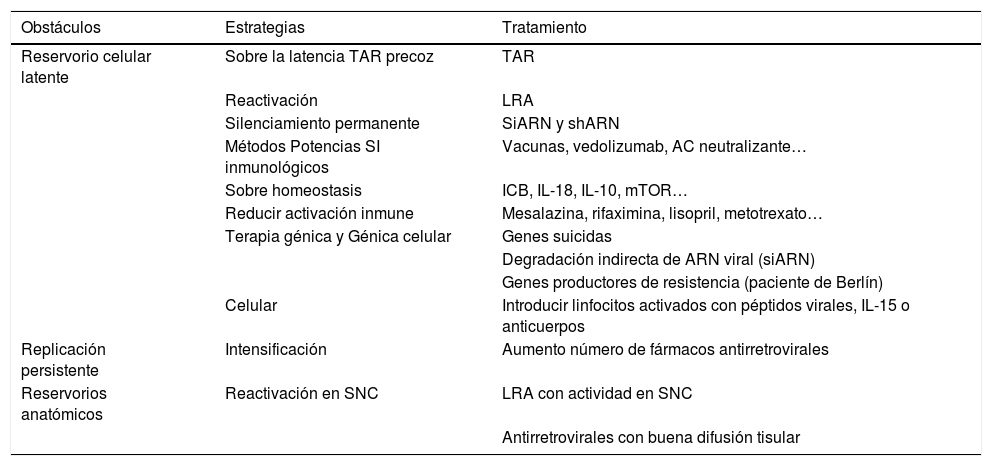
Santuarios anatómicosLos principales reservorios anatómicos de células infectadas comprenden el tejido linfoide, como el localizado en el tracto genital, pulmones y el asociado al tracto gastrointestinal (GALT, por sus siglas en inglés), y órganos no linfoides, como el SNC y los riñones (fig. 1). Es importante saber que el número de LT CD4 que hay en sangre periférica solo representa el 2% del total de linfocitos del cuerpo, mientras que él alberga el 60% de los linfocitos, de los cuales un 40% son LT CD418. El GALT representa el santuario anatómico más importante puesto que por sus características no permite alcanzar una concentración adecuada y homogénea de TAR en toda la extensión de su tejido. En los ganglios linfáticos también se hallan LT CD4 y se ha medido una concentración de ARN y ADN del VIH superior a las encontradas en sangre periférica. El papel de otros lugares anatómicos (cerebro, tracto genital masculino y femenino, riñones, hígado) como reservorio del VIH es más dudoso19.
Estrategias de erradicación del VIHEstrategias para eliminar el reservorio celular latenteActuaciones sobre el VIH latentea. Disminución del establecimiento del reservorio o su tamaño: inicio precoz del tratamiento antirretroviralLa propuesta de iniciar precozmente el TAR para ayudar en la curación del VIH se fundamenta en la potencial capacidad de disminuir la activación de las células T, de aumentar la capacidad del sistema inmune para controlar la replicación viral y reducir los reservorios virales20.
Varios estudios en animales han demostrado que se consigue reducir el reservorio celular latente al administrar el TAR durante la primoinfección. Sin embargo, el TAR no puede evitar el establecimiento de la latencia21,22. En humanos, varios estudios apoyan estas observaciones en animales. El tiempo de instauración del reservorio en humanos es todavía incierto. Es ilustrativo el hecho de que la administración de TAR en las primeras h tras la exposición al VIH (por ejemplo, por el pinchazo con una aguja en un trabajador de la salud) reduce notablemente el riesgo de adquirir la infección por VIH-1, lo que sugiere que el TAR es capaz de erradicar las primeras células infectadas después de la exposición viral20. Al mismo tiempo se ha demostrado que el inicio de TAR a los 10 días de la aparición de los síntomas de la infección primaria por VIH-1 no previene la generación de la latencia a pesar de un control eficaz de la viremia plasmática o que el TAR precoz, particularmente previo a la detección de inmunoglobulina M del VIH, logra reducir el número de LTCD4 memoria central de larga vida, pero aquellos que están infectados de modo latente siguen persistiendo23.
La necesidad de un tratamiento muy precoz para limitar la dimensión del reservorio celular latente se extrae de algunos estudios. En un estudio tailandés, se confirmó que entre los pacientes con infección aguda tratados precozmente con TAR, solo se consiguieron reducciones significativas en los niveles de DNA proviral durante la fase más temprana de la infección aguda24 en comparación con las etapas posteriores de infección primaria25.
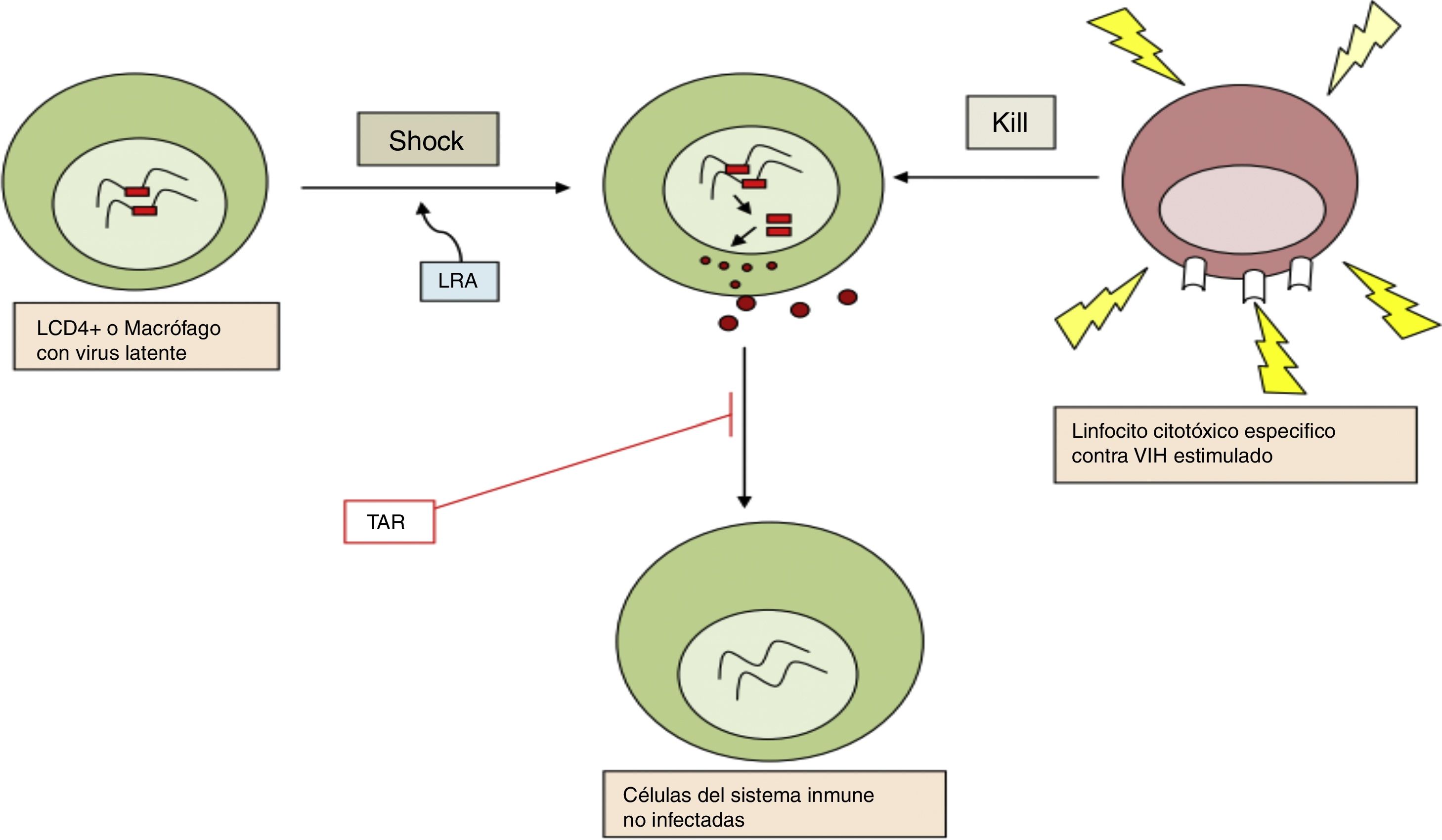
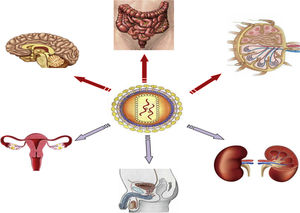
b. Reversión de la latencia establecida: reactivación farmacológicaTiene como objetivo activar la replicación viral y producir la división celular en células infectadas en latencia. Esto constituye la primera parte de la estrategia llamada «shock and kill»: según esta estrategia primero se reactivan las células infectadas en latencia («shock») para que de esta manera, siendo ahora los antígenos virales reconocidos por el sistema inmune, se puedan eliminar esas células infectadas reactivadas («kill») (fig. 2). Se había asumido que tras la activación celular se produciría la apoptosis de la célula infectada, pero estudios realizados in vitro han demostrado que los LT CD4 en reposo no se someten al proceso de apoptosis11.
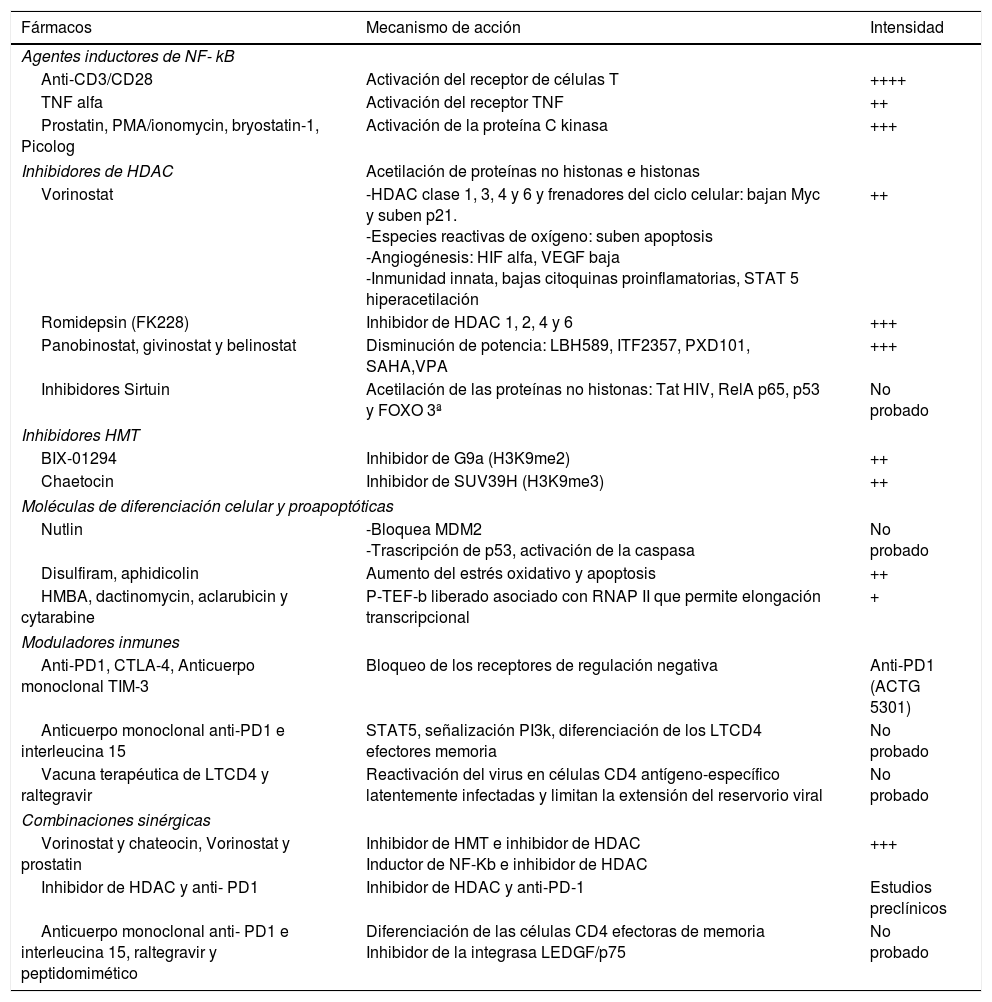
Los fármacos reactivadores de la latencia pueden hacerlo por varias vías de señalización (tabla 2)26. Globalmente, la potencia de los fármacos antilatencia actuales es probablemente insuficiente para reducir el reservorio. En los ensayos clínicos llevados a cabo en humanos, la administración de fármacos aislados no tuvo efecto en la frecuencia de las células infectadas latentes27. Se propone por ello el uso de terapias combinadas de activadores de la latencia, ya que la reactivación de la latencia podría estar gobernada por mecanismos estocásticos (algunos genes permanecen silenciados incluso cuando hay una estimulación mitógena máxima). El efecto sinérgico entre los inhibidores de histona deacetilasa, inhibidores de metilación, inhibidores de histona metiltransferasa, activadores de NF-k B e IL-7, ha sido demostrado in vitro, pero aún se requieren más estudios28.
Agentes reactivadores de la latencia. Mecanismos de acción e intensidad reactivadora
| Fármacos | Mecanismo de acción | Intensidad |
|---|---|---|
| Agentes inductores de NF- kB | ||
| Anti-CD3/CD28 | Activación del receptor de células T | ++++ |
| TNF alfa | Activación del receptor TNF | ++ |
| Prostatin, PMA/ionomycin, bryostatin-1, Picolog | Activación de la proteína C kinasa | +++ |
| Inhibidores de HDAC | Acetilación de proteínas no histonas e histonas | |
| Vorinostat | -HDAC clase 1, 3, 4 y 6 y frenadores del ciclo celular: bajan Myc y suben p21. -Especies reactivas de oxígeno: suben apoptosis -Angiogénesis: HIF alfa, VEGF baja -Inmunidad innata, bajas citoquinas proinflamatorias, STAT 5 hiperacetilación | ++ |
| Romidepsin (FK228) | Inhibidor de HDAC 1, 2, 4 y 6 | +++ |
| Panobinostat, givinostat y belinostat | Disminución de potencia: LBH589, ITF2357, PXD101, SAHA,VPA | +++ |
| Inhibidores Sirtuin | Acetilación de las proteínas no histonas: Tat HIV, RelA p65, p53 y FOXO 3ª | No probado |
| Inhibidores HMT | ||
| BIX-01294 | Inhibidor de G9a (H3K9me2) | ++ |
| Chaetocin | Inhibidor de SUV39H (H3K9me3) | ++ |
| Moléculas de diferenciación celular y proapoptóticas | ||
| Nutlin | -Bloquea MDM2 -Trascripción de p53, activación de la caspasa | No probado |
| Disulfiram, aphidicolin | Aumento del estrés oxidativo y apoptosis | ++ |
| HMBA, dactinomycin, aclarubicin y cytarabine | P-TEF-b liberado asociado con RNAP II que permite elongación transcripcional | + |
| Moduladores inmunes | ||
| Anti-PD1, CTLA-4, Anticuerpo monoclonal TIM-3 | Bloqueo de los receptores de regulación negativa | Anti-PD1 (ACTG 5301) |
| Anticuerpo monoclonal anti-PD1 e interleucina 15 | STAT5, señalización PI3k, diferenciación de los LTCD4 efectores memoria | No probado |
| Vacuna terapéutica de LTCD4 y raltegravir | Reactivación del virus en células CD4 antígeno-específico latentemente infectadas y limitan la extensión del reservorio viral | No probado |
| Combinaciones sinérgicas | ||
| Vorinostat y chateocin, Vorinostat y prostatin | Inhibidor de HMT e inhibidor de HDAC Inductor de NF-Kb e inhibidor de HDAC | +++ |
| Inhibidor de HDAC y anti- PD1 | Inhibidor de HDAC y anti-PD-1 | Estudios preclínicos |
| Anticuerpo monoclonal anti- PD1 e interleucina 15, raltegravir y peptidomimético | Diferenciación de las células CD4 efectoras de memoria Inhibidor de la integrasa LEDGF/p75 | No probado |
ACTG: AIDS Clinical Trial Groups; CTLA-4: antígeno 4 del linfocito T citotóxico; HDAC: histona desacetilasa; HIF: factor inducible por hipoxia; HMBA: hexa metil biacetamida; HMT: histona metiltransferasas; LTCD4: linfocitos T CD4; MDM2: doble minuto murino 2; PD1: factor de muerte programada 1; RNAP II: polimerasa 2 de ARN; STAT: traductor de señal y activador de la transcripción; TNF: factor de necrosis tumoral; VEGF: factor de crecimiento endotelial vascular.
Además de los fármacos que actúan sobre las citadas dianas, se han identificado otros que actúan por mecanismos diferentes. Recientemente se ha demostrado que la administración de agonistas de TLR 7 produce la activación de la latencia del VIH y depleciona los reservorios en un modelo animal29. A nivel postranscripcional, la modulación de algunos micro-ARN ha sido también eficaz en la reactivación del virus latente. La galectina 9 puede también reactivar el VIH-1 latente mediante su unión a receptores inespecíficos de la membrana y, además, puede mejorar la actividad CTL mediante su unión al receptor TIM-330.
c. Silenciamiento permanente del VIH latenteEsta estrategia alternativa se separa del «shock and kill» al tratar de suprimir total e irreversiblemente la trascripción del VIH. De esta manera se lograría un silenciamiento permanente y una detención de la producción de virus tras la interrupción del TAR. Se ha logrado dirigir los siARN o shARN (short hairpin RNA) hacia el promotor del VIH-1 induciendo el silenciamiento transcripcional de genes del virus mediante inducción de cambios epigenéticos estables en el genoma viral31.
Métodos inmunológicosa. Aumentar la capacidad del sistema inmune para eliminar o controlar el VIHLa inducción de la transcripción del provirus latente por LRA originaría la expresión de antígenos VIH-1 que mejoraría la capacidad del sistema inmune para poder identificar las células infectadas y eliminarlas11,32,33. Sin embargo, podría no ser suficiente para eliminar las células infectadas latentes solo por el efecto citopático viral.
Se sabe que la estimulación antigénica constante durante la infección por VIH-1 lleva a una activación inmune crónica y posteriormente a un agotamiento inmunológico. Las células con respuesta específica contra el VIH disminuyen o se vuelven disfuncionales perdiendo la función antiviral y la capacidad proliferativa34. De esta manera la infección por VIH acaba disminuyendo la función citopática de los LTCD8 y el agotamiento de los LB provocando una inadecuada respuesta por anticuerpos. De esta manera los mecanismos celulares para la eliminación del virus pueden ser insuficientes.
Se ha demostrado la importancia de la inmunidad celular en el control del tamaño del reservorio. Los LTCD8 Gag-específicos del VIH aislados de los controladores de élite (personas que controlan la replicación del VIH de modo natural), pero no de los controladores postratamiento (aquellos que controlan la replicación del VIH tras la discontinuación del tratamiento antirretroviral, en general, iniciado de modo muy precoz), son capaces de matar a LTCD4 latentemente infectados en los cuales el VIH se reactivó tras la administración de vorinostat, en un estudio ex-vivo11. Por otro lado, se ha descubierto que los LTCD8 citotóxicos con alta multifuncionalidad que van dirigidos a las regiones vulnerables en Gag son decisivas en la limitación de la diversidad y reservorio viral en pacientes infectados por VIH que tienen protección de los alelos de HLA clase I35.
Vacunas terapéuticasLa vacunación terapéutica tendría como objetivo aumentar la capacidad de respuesta del sistema inmune de un paciente ya infectado. Algunas vacunas han demostrado mejorar la respuesta inmune específica frente a VIH-1, pero ninguna ha permitido mantener la interrupción del TAR. Se ha empezado a usar, en modelos de primates no humanos, el CMV vivo como vector manipulado para estimular una respuesta a epítopos nuevos y no inmunodominantes, consiguiendo buenos resultados36. Aún está en investigación el uso de péptidos anfifílicos para dirigir antígenos a los ganglios linfáticos e inducir una respuesta inmune simultánea a dos o más regiones de vulnerabilidad inmunológica del VIH37. Las vacunas basadas en células dendríticas que contienen antígenos específicos (antigen-pulsed autologous dendritic cells)38 podrían aumentar la activación efectiva de los LTCD8.
Anticuerpos neutralizantesLos anticuerpos podrían disminuir el grado de la inflamación crónica o dirigirse contra células latentemente infectadas que continúan expresando antígenos espontáneamente o después de la inducción con LRA. El uso de algunos anticuerpos monoclonales específicos neutralizantes (mAbs) ha logrado una importante supresión de la viremia e incluso una importante reducción de DNA proviral en sangre periférica, ganglios linfáticos y mucosa gástrica en animales, sin producirse un rebrote viral39.
Se ha empezado a usar, en modelos preclínicos, anticuerpos biespecíficos que estimulan la producción viral y simultáneamente reconocen y eliminan células que expresan virus. Aunque aún no se han usado en la clínica, se debe reconocer su potencial para causar daño40. También se podrían usar mAbs para reactivar la citoxicidad celular dependiente de anticuerpos, que mediante su respuesta inmune no dependiente de MHC podría reconocer y eliminar células infectadas reactivadas. Los mAbs citoxicidad celular dependiente de anticuerpos específicos de VIH se une a los antígenos virales de la superficie de la célula infectada y activa la respuesta inmune innata de las células natural killer o monocitos mediante el receptor Fc41.
Bloqueo de los checkpoints inmunológicos (ICB)Esta estrategia también tiene como objetivo aumentar el control inmunológico del huésped. Los receptores inmunológicos más conocidos en este campo son PD-1, CTLA-4, LAG-3, TIM-3, TIGIT y 2B4, que resultan ser marcadores del agotamiento funcional. Su expresión se da sobre todo en las células T activadas.
El mejor conocido es el PD-1, cuyos ligandos son PDL-1 y PDL-2, extensamente expresados en los tejidos. PD-1 es la proteína encargada de la muerte celular programada, siendo importante su papel en el agotamiento inmune. Al unirse PD-1 con PDL-1 se produce una señal inhibidora en los receptores antígenos dependientes, por lo que se impide la señal necesaria para la proliferación, función efectiva y la replicación del VIH. Los bloqueadores de PD-1 o de PDL-1 consiguen liberar esa señal de inhibición sobre los receptores de activación de los LT y permiten aumentar la sensibilidad de los receptores a los antígenos. Se ha investigado los anticuerpos frente a PD-1. Un ensayo clínico en fase I que se llevó a cabo con este fin tuvo que ser interrumpido prematuramente por la aparición de efectos adversos severos, fundamentalmente relacionados con fenómenos autoinmunitarios, en consonancia con la toxicidad grave observada en un modelo animal42.
Otras estrategiasVedolizumab es un análogo humano de un anticuerpo monoclonal dirigido contra la forma heterodimérica de la integrina α4β7, usado en el tratamiento de enfermedades inflamatorias intestinales al impedir el paso de linfocitos al tejido gastrointestinal43. Se ha descubierto que tanto el VIH-1 como el SIV tienen preferencia por infectar a los LTCD4 con mayor nivel de integrina α4β744. Un ensayo clínico en macacos Rhesus usando un anticuerpo monoclonal recombinante contra la integrina α4β7mostró la ausencia de rebrote viral dos años después de su administración, con la curación aparente de los animales18,45. El mecanismo por el que se logró este efecto sigue siendo una incógnita. En la actualidad se está realizando un ensayo clínico con vedolizumab en humanos con infección crónica por VIH-1.
Las inmunotoxinas son proteínas quiméricas bifuncionales formadas por una porción dirigida, como un anticuerpo o un ligando, y una toxina eferente dominante. La administración de inmunotoxina 3B3-PE38 junto al TAR mostró reducir los niveles tisulares de ARN en modelos humanizados de ratones46 más que la reducción conseguida con TAR únicamente.
b. Actuar sobre la homeostasis y disfunción de las células TTiene el objetivo de revertir la inflamación crónica, con lo que se podría contribuir a una curación o a una remisión, que podría conseguirse bloqueando o estimulando diversas vías, como los checkpoints inmunológicos (PD-1, CLTA-4, TIGIT y otros), indolamina- pirrol 2,3 dioxigenasa (IDO), interleucina 18, mTOR, JAK/STAT, IL-10 y TGF-B y otros. La activación y proliferación de los LT están controlados por un gran número de vías de señalización, como por ejemplo mTOR (diana de rapamicina en células de mamíferos), traductor de señal y activador de trascripción 5a (STAT5a) o O3a (caja forkhead)47, por lo que la inhibición de estas vías podrían hacer permanente la latencia o reducir el tamaño del reservorio. Es el caso del inmunosupresor sirolimus (rapamicina), que utilizado como fármaco único, ha logrado bajos niveles de ADN del VIH asociado a células.
c. Reducción de la activación inmuneEl objetivo de esta estrategia es impedir el paso de células T CD4 activadas al estado de reposo, por lo que se disminuiría la probabilidad de que la latencia aumente. Se lograría añadiendo inmunosupresores al TAR48. En ensayos clínicos se han usado fármacos como mesalamina, rifaximina, lisinopril y metotrexato, aunque los resultados no han resultado alentadores.
Terapia génica y celulara) Terapia génicaLa aplicación más evaluada de la terapia génica tiene como objetivo sustituir las células infectadas con una nueva población de células resistentes al VIH-1. La población celular ideal donde intervenir serían las células madre. La prueba de concepto se demostró con un trasplante de médula ósea usando células madre de un donante compatible homocigótico para la deleción CCR5-delta 32. Se consiguió remisión completa, sin rebrote viral desde 2007 en ausencia de TAR. Este paciente, conocido como el «paciente de Berlín», se ha convertido en el primer y único ejemplo de erradicación del VIH49. Aunque la curación pudo producirse por la combinación de factores diversos (régimen de condicionamiento pretransplante, enfermedad de injerto frente a huésped), la resistencia de las células a infectarse por VIH debido a la ausencia del correceptor CCR5 desempeñó sin duda un papel importante. De hecho, falló el intento posterior de lograr la curación en dos pacientes sometidos a trasplante alogénico de médula ósea procedente de donantes heterocigóticos para la deleción delta 32, los llamados «pacientes de Boston»50. En un nuevo paciente sometido a trasplante alogénico de células hemotopoyéticas CCR5-Delta32, se ha logrado la eliminación de datos sugestivos de infección viral, pero aún está pendiente de la interrupción del tratamiento antirretroviral para valorar su curación definitiva (paciente de Düsseldorf)51.
Motivados por el éxito del paciente de Berlín, se empezó a realizar modificaciones genéticas en las células propias del individuo para dotar a esas células de resistencia frente al VIH. Las nuevas técnicas buscan inhibir o eliminar la expresión de CCR5 usando el silenciamiento génico (knock down) de CCR5 mediante tres tipos diferentes de enzimas: nucleasas de dedos de cinc (ZFN), nucleasas efectoras con función activador de transcripción (transcription activator-like effector nuclease) y endonucleasas celulares (clustered regularly interspaced short palindromic repeats [CRISPR-Cas9/])52.
La terapia génica se ha utilizado también para potenciar los LT para eliminar células infectadas por VIH. En estudios oncológicos se ha usado la modificación genética para expresar receptores antigénicos quiméricos con una especificidad antigénica mejorada. Esto mismo se ha adaptado en las estrategias contra el VIH, modificando genéticamente las células de sangre periférica para que tuvieran un TCR (receptor de linfocito T) clonado molecularmente que dirija la célula al reconocimiento del antígeno viral53. Aún se desconoce el potencial tóxico de estas estrategias.
b) Terapias celularesConsiste en transferir CTL específicos para VIH-1. Se ha observado que los CTL estimulados con Gag son mucho más efectivos, en modelos celulares de latencia, que los LTCD8 no estimulados11. Muchos estudios han demostrado que exponer los LT a múltiples péptidos de diferentes antígenos del VIH-1 les capacita para incrementar la eliminación de células infectadas latentes que se han reactivado ex vivo54.
Existen también otras células inmunes citotóxicas que podrían usarse para eliminar células infectadas y que actúan por mecanismos diferentes a las CTL, como son las células natural killer, células killer activadas mediante linfoquinas y células T. Se suele usar la IL-1555 o los anticuerpos monoclonales para mejorar la respuesta efectora de las células, y en el caso de las natural killer se usa la vía citoxicidad celular dependiente de anticuerpos56.
Estrategias para eliminar la replicación vírica persistente: intensificación del tratamiento antirretroviralLa intensificación consiste en aumentar la dosis del TAR establecido o añadir agentes más potentes al régimen de TAR con el objetivo de reducir el tamaño del reservorio mediante la supresión completa de la replicación vírica. Se intenta alcanzar una concentración terapéutica en los santuarios anatómicos, donde persiste una replicación viral residual. Aunque globalmente el tratamiento de intensificación no ha mostrado reducir el tamaño del reservorio o prevenir el rebrote viral tras la supresión del TAR57, se han publicado algunos resultados que apoyan que esta estrategia pueda contribuir a la eliminación del reservorio. Se han usado con este fin el inhibidor de la integrasa del VIH-1, raltegravir14 y el antagonista del correceptor CCR5, maraviroc58.
Estrategias para eliminar los reservorios anatómicosÚnicamente el sistema nervioso central ha sido motivo de investigación en este sentido. Se estima que el cerebro actúa como un reservorio de VIH aislado e independiente del resto de reservorios durante el TAR59. Se han sugerido potenciales peligros que la reactivación del virus latente en el SNC pudiera tener. El incremento de la activación del sistema inmune en el cerebro podría originar una reactivación de los reservorios latentes seguido de una respuesta inflamatoria exacerbada y dañina incluso en presencia de TAR. Teniendo en cuenta que el SNC presenta macrófagos con replicación competente persistente, la monitorización de la activación viral en LCR y la viremia residual podría ser clave a la hora de aplicar estrategias de erradicación60.
Curación funcional frente a erradicación del VIHEn la actualidad, se consideran dos enfoques distintos para la curación de la infección por VIH y se debe distinguir entre la denominada curación funcional y la erradicación. En un paciente que no recibe TAR, la curación funcional se define como la ausencia de replicación viral detectable de modo indefinido o durante un periodo de tiempo limitado. Se trata de un control de la replicación viral mediado por el huésped, con lo que, en ausencia de TAR, se lograría restablecer y estabilizar la función inmune, reducir la inflamación inducida por el VIH-1 y mantener la carga viral en plasma a niveles muy bajos reduciendo el riesgo de transmisión del virus. En este escenario, aunque persistiera la replicación competente de VIH, el paciente sería capaz de interrumpir el TAR sin riesgos. La curación funcional ha quedado bien documentada de modo natural en los controladores de élite y, mediante TAR, en los controladores postratamiento, así como en los ejemplos de curación parcial: «niña de Mississippi» y «pacientes de Boston».
Por su parte, la erradicación o curación «esterilizante» se define como la eliminación completa de todos los virus con replicación competente en pacientes infectados. Dado este contexto, la posibilidad de un rebrote viral cuando el TAR se suspenda es nula27. Aunque este tipo de curación se logró en el «paciente de Berlín», se considera un objetivo menos viable.
La tabla 3 muestra el conjunto de estrategias, analizadas en los apartados previos, que se han propuesto para lograr la curación funcional de la infección por VIH.
Estrategias propuestas para superar los obstáculos identificados en la curación funcional de la infección por VIH
| Obstáculos | Estrategias | Tratamiento |
|---|---|---|
| Reservorio celular latente | Sobre la latencia TAR precoz | TAR |
| Reactivación | LRA | |
| Silenciamiento permanente | SiARN y shARN | |
| Métodos Potencias SI inmunológicos | Vacunas, vedolizumab, AC neutralizante… | |
| Sobre homeostasis | ICB, IL-18, IL-10, mTOR… | |
| Reducir activación inmune | Mesalazina, rifaximina, lisopril, metotrexato… | |
| Terapia génica y Génica celular | Genes suicidas | |
| Degradación indirecta de ARN viral (siARN) | ||
| Genes productores de resistencia (paciente de Berlín) | ||
| Celular | Introducir linfocitos activados con péptidos virales, IL-15 o anticuerpos | |
| Replicación persistente | Intensificación | Aumento número de fármacos antirretrovirales |
| Reservorios anatómicos | Reactivación en SNC | LRA con actividad en SNC |
| Antirretrovirales con buena difusión tisular |
ICB: bloqueantes de dianas inmunológicas; LRA: agente reactivador de la latencia; siARN: ARN de interferencia corto; shARN: short hairpin ARN; SNC: sistema nervioso central; TAR: tratamiento antirretroviral.
Se han establecido los obstáculos para la curación y se ha documentado la insuficiencia de las estrategias hasta ahora adoptadas. Pero también se ha mostrado que la curación es posible y que, de modo natural o con tratamientos diversos, se puede lograr la remisión de la enfermedad en ausencia de TAR.
La comunidad científica se plantea como objetivos de resolución urgente, entre otros, métodos de laboratorio que permitan cuantificar el tamaño del reservorio celular e identificar las células latentemente infectadas. Solo de este modo se puede conocer la capacidad erradicadora de cualquier estrategia que se quiera probar. En su ausencia, solo la interrupción del tratamiento antirretroviral permanece como el modo de comprobar el éxito de las diferentes modalidades terapéuticas.
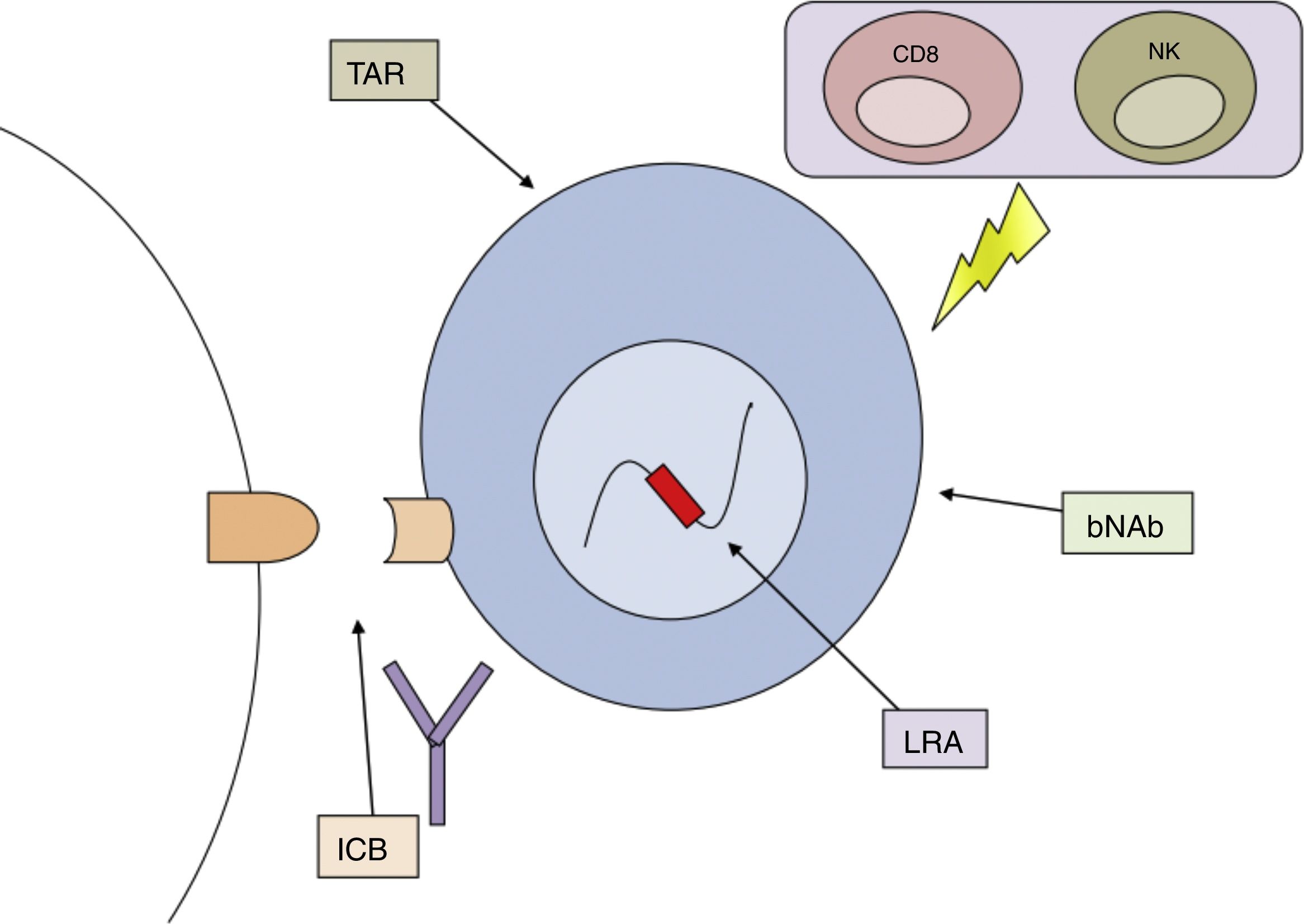
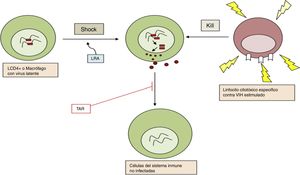
Por otro lado, aún no se ha identificado ningún método que de modo consistente haya logrado la reducción del reservorio o haya logrado remisión parcial o completa. El fracaso de diferentes medidas aisladas ha llevado a proponer el uso combinado o secuencial de varias estrategias, dirigidas frente a diferentes mecanismos que permiten la persistencia del VIH en el organismo, como la mejor propuesta para lograr la curación de esta enfermedad (fig. 3).
Combinación de estrategias potencialmente útiles para la curación funcional/erradicación de la infección por VIH. bNAb: anticuerpos neutralizantes de amplio espectro; ICB: bloqueadores de dianas inmunológicas; LRA, agentes reactivadores de la latencia; NK: células natural killer; TAR: tratamiento antirretroviral.
Este trabajo ha sido financiado por el proyecto Red de Investigación en SIDA (RIS) RD16/0025/0001, integrado en el Plan Nacional de I+D+I y cofinanciado por el ISCIII-Subdirección General de Evaluación y el Fondo Europeo de Desarrollo Regional (FEDER).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.