La efectividad del tratamiento antirretroviral de gran actividad (TARGA) en la reducción del tiempo al primer evento definitorio de sida ha sido demostrada por diversos estudios observacionales, pero el efecto en eventos recurrentes de sida no es tan evidente.
Material y métodosSe dispone de 1.938 sujetos seroconvertores al VIH de la cohorte GEMES. Se ha utilizado una extensión del modelo de Cox para analizar el tiempo desde la seroconversión a cada evento sida, que tiene en cuenta el tiempo entre sucesivos eventos y que permite que el riesgo de referencia cambie con el número de paciente con sida previos. El calendario se dividió en tres períodos coincidiendo con la disponibilidad de diferentes regímenes de terapia antirretroviral.
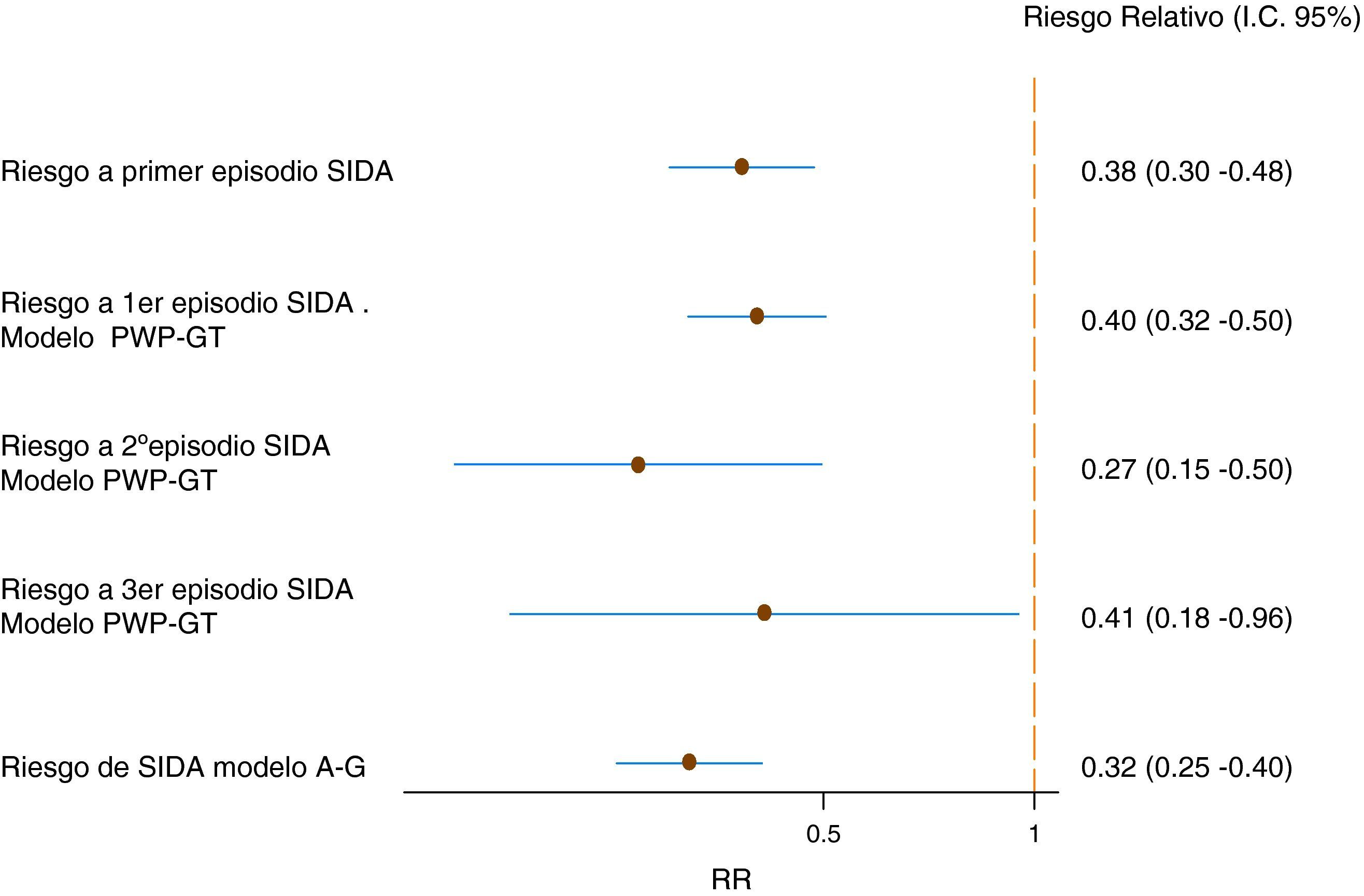
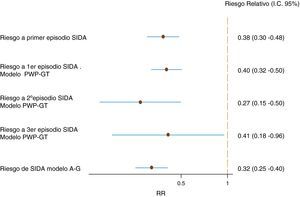
ResultadosDurante el seguimiento 1.524 (78,6%), 259(13,4%), 83 (4,3%) y 72 (3,7%) sujetos desarrollaron 0, 1, 2 y 3 o más eventos definitorios de sida, respectivamente. Después de ajustar por sexo, edad a la seroconversión y categoría de exposición, el riesgo de sida para el período TARGA fue RR=0,38 (IC del 95%, 0,30-0,48) en comparación con el período 1992–1995.Teniendo en cuenta el número de sujetos con sida previos, se observó un RR de 0,40 (IC del95%, 0,32-0,50) para el primer evento sida, RR=0,27 (IC del 95%, 0,15-0,50) para el segundo y 0,41 (IC del 95%, 0,18-0,96) para el tercero. Considerando todos los eventos de sida, se obtiene un riesgo RR=0,32 (IC del 95%, 0,125-0,40). Los usuarios de drogas por vía parenteral tienen un riesgo mayor de desarrollar un primer episodio de sida que los homosexuales, RR=2,14 (IC del 95%, 1,48-3,10).
ConclusionesLos resultados obtenidos muestran un efecto protector de la terapia al primer sida, manteniéndose el efecto para posteriores eventos. La inclusión en el análisis de todos los eventos recurrentes de sida permite obtener estimaciones del riesgo más precisas.
Several observational studies support the protective effect of combined antiretroviral therapy (cART) on time to first AIDS-defining event, but the effect on multiple AIDS defining illnesses remains unclear.The aim of this study is to analyse whether the protective effect of cART persists beyond the first AIDS-defining illness.
Material and methodsA total of 1938 subjects from GEMES seroconverter cohort have been included. To analyse cART effectiveness, calendar time has been divided into three periods according to antiretroviral availability. A population-averaged proportional hazard model with staggered entries that counted the gap time, and had event-specific baseline risks, was fitted.
ResultsDuring follow-up, 1524 (78.6%), 259 (13.4%), 83 (4.3%) and 72 (3.7%) subjects incurred 0, 1, 2, and 3 or more AIDS-defining illnesses, respectively. After adjustment for sex, age at seroconversion and exposure category, the Relative Risk (RR) of AIDS in the cART period was 0.38 (95%CI 0.30-0.48) compared with the 1992-95 period. The RR of the first, second and third AIDS-defining illness in the cART period were 0.40 (95% CI: 0.32-0.50), 0.27 (95% CI: 0.15-0.50) and 0.41 (95% CI: 0.18-0.96) respectively, relative to the reference calendar period when we allowed the odds ratios to vary by the number of prior AIDS-defining events. The relative risk of AIDS, taking all events into account, was 0.32 (95% CI: 0.25-0.40). Intravenous drug users have a higher risk of developing a first episode of AIDS than homosexuals, RR: 2.14 (95% CI: 1.48-3.10).
ConclusionsResults indicate that the relative effect of cART appears to be both protective and stable over multiple AIDS-defining illnesses. Analysis of multiple AIDS-defining illnesses improves the precision of the estimated relative risk.
El riesgo de desarrollar una primera enfermedad definitoria de sida en los años posteriores al tratamiento antirretroviral de gran actividad (TARGA) es aproximadamente una tercera parte del riesgo asociado al período previo1-4. Este efecto protector del TARGA ha sido descrito tanto en ensayos clínicos como en estudios observacionales5-9. Sin embargo, no hay tanta literatura sobre el efecto del TARGA en la disminución de episodios recurrentes de sida, es decir, en aquellos que suceden después de un primer diagnóstico de sida. Uno de los pocos trabajos que ha evaluado este efecto ha sido llevado a cabo en el marco de una cohorte formada por homosexuales infectados por VIH de 4 ciudades de Estados Unidos1 y pone de manifiesto que el efecto protector desde la introducción del TARGA para una segunda o tercera enfermedad definitoria de sida es el mismo que para la primera10.
Diversos factores pueden influir en la efectividad del TARGA a largo plazo. Así, a pesar de la universalidad y gratuidad del tratamiento en España, la exclusión social y los diferentes estilos de vida de algunas de las personas que viven con el VIH, como los usuarios de drogas por vía parenteral (UDVP), podrían dificultar el acceso y la adhesión a los tratamientos. Por ello, la disminución del riesgo de un primer episodio definitorio de sida tras la aparición del TARGA podría ser diferente del riesgo de desarrollar un segundo o un tercer episodio definitorio de sida en aquellos grupos con peor accesibilidad y adhesión al tratamiento.
Es difícil disponer de la información necesaria para elaborar este tipo de estudios, ya que habitualmente no se recogen los sucesivos episodios definitorios de sida posteriores al diagnóstico inicial. En el marco del proyecto GEMES ha sido posible evaluar la efectividad poblacional del TARGA para el desarrollo del primer episodio definitorio de sida2,3 y para mejorar la supervivencia, aunque no se ha estudiado si esta efectividad se mantiene en los episodios recurrentes de sida.
La efectividad poblacional19 compara la incidencia de la enfermedad observada en una población en la que algunos individuos, generalmente los más enfermos, reciben tratamiento con la incidencia en una población en la que prácticamente ningún sujeto recibe tratamiento. Puesto que tanto la disponibilidad de un tratamiento como su introducción en una población están relacionadas con el período calendario, la estimación de la efectividad poblacional se realiza comparando la incidencia de la enfermedad en distintos períodos calendario en los que están disponibles diferentes tratamientos, asumiendo que éstos son recibidos por los sujetos que los necesitan.
El objetivo de este estudio es analizar si la efectividad poblacional de la introducción de TARGA persiste para episodios posteriores al primer diagnóstico de sida en la cohorte de seroconvertores al VIH del proyecto GEMES. Como objetivo secundario analizaremos si la efectividad de TARGA es diferente en UDVP en comparación con personas infectadas de VIH por otras vías de transmisión.
Material y métodosPoblación de estudioSe analizaron los datos de los 1.938 sujetos procedentes de las cohorte de seroconvertores al VIH incluidas en GEMES (Grupo de Estudio Multicéntrico Español de Seroconvertores al VIH) y disponibles en el momento de efectuar este estudio.
GEMES está compuesto por cohortes procedentes de diferentes centros que han identificado a los seroconvertores al VIH, tanto retrospectiva como prospectivamente, desde finales de 1980 hasta la actualidad y se les ha seguido a lo largo del tiempo. Todos los sujetos incluidos en el estudio cumplieron los criterios de seroconvertor al VIH, definido como un individuo para el que se disponía de una prueba negativa frente al VIH anterior al primer resultado VIH positivo. La fecha de seroconversión al VIH se estimó como el punto medio entre la última prueba VIH negativa y la primera positiva. Una descripción más completa de GEMES puede encontrarse en la literatura11.
Se dispone de información relativa a características sociodemográficas (edad, sexo y categoría de exposición), así como de variables clínicas e inmunológicas, como el número y el tipo de enfermedades relacionadas con el sida, prescripción de tratamiento antirretroviral (monoterapia, biterapia y TARGA), recuento de linfocitos CD4, carga viral del VIH y estatus vital. La información relativa al seguimiento de pacientes seroconvertores al VIH se actualiza anualmente. Cada una de las cohortes integrantes de GEMES sigue a los pacientes seroconvertores y cruza la información con el registro local/nacional de sida y con el registro de mortalidad.
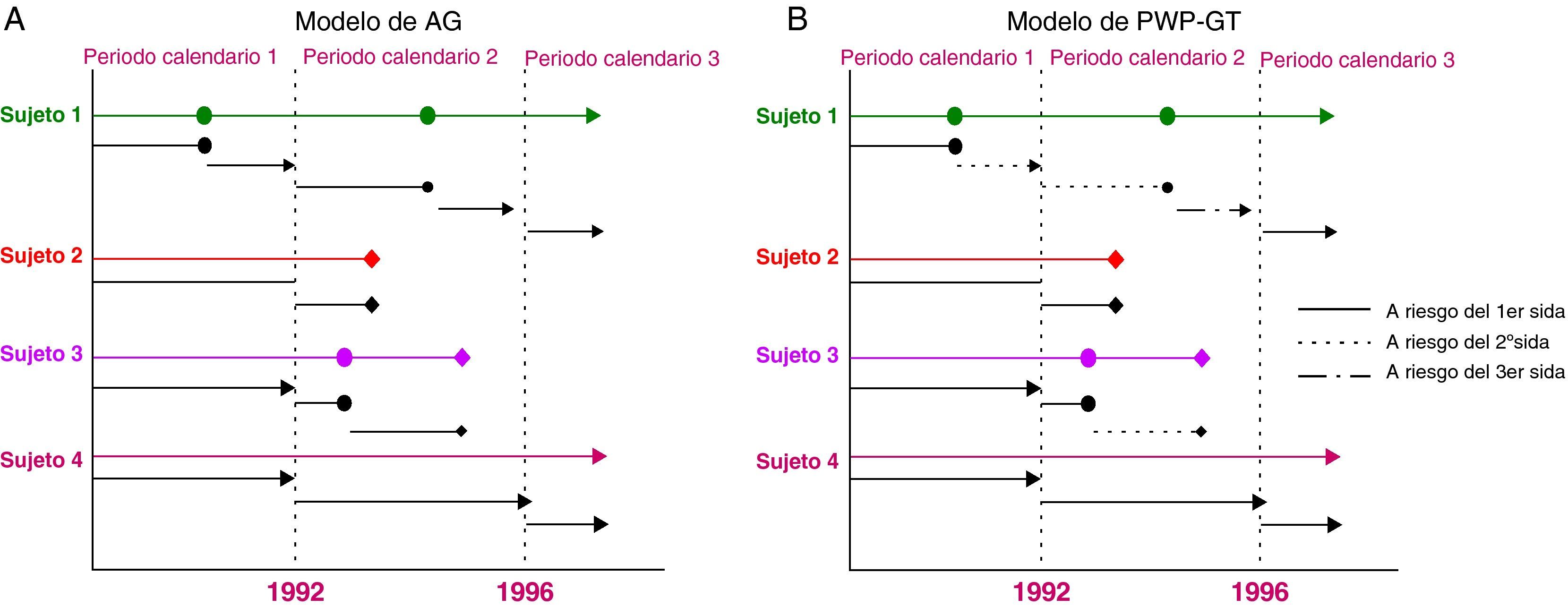
Métodos estadísticosSe han propuesto varias extensiones de los modelos de supervivencia basadas en el enfoque de riesgos proporcionales de Cox para el manejo de eventos múltiples12. En el presente trabajo se emplean dos metodologías para alcanzar el objetivo del estudio: el modelo de Andersen-Gill (AG)13 y el de Prentice-William-Peterson gap time (PWP-GT)14. El AG es un modelo condicional que define el intervalo de riesgo utilizando procesos de conteo, con un conjunto no restringido (se incluye a todos los sujetos) de personas a riesgo y que asume un riesgo basal común a todos los eventos12,15-17. Cuando el conjunto de personas de riesgo no está restringido, todos los intervalos de riesgo de un sujeto pueden contribuir al riesgo establecido para cualquier evento, independientemente del número de acontecimientos vividos por cada sujeto. En particular, el tiempo a un segundo evento de un paciente dado puede contribuir igual que lo hace el tiempo de riesgo del primer evento de otro sujeto. El PWP-GT es un modelo condicional que define el intervalo de riesgo utilizando procesos de conteo, con un conjunto de sujetos a riesgo restringido (se incluye a todos los sujetos que no han tenido el evento k pero han experimentado el k-1) y asume un riesgo basal especifico para cada evento (estratificando por el evento k-ésimo), permitiendo de esta forma un aumento o disminución del riesgo subyacente (underlying hazard). El tiempo de desfase gap time se calcula como el tiempo desde un evento hasta el siguiente, es decir, «el contador se pone a cero» después de cada evento (fig. 1).
El interés de este estudio se centra en el tiempo desde la seroconversión hasta la fecha de la primera enfermedad definitoria de sida y el tiempo entre los sucesivos eventos diagnósticos de sida. Cuando un sujeto fue diagnosticado con más de una enfermedad definitoria de sida en la misma visita, se contempló en los análisis como un único evento. Se consideró la variable «número de episodios definitorios de sida» agrupada en 4 categorías: ningún episodio (sujetos de riesgo del primer episodio definitorio de sida), 1 episodio de sida (sujetos de riesgo de un segundo episodio de sida), 2 episodios (sujetos de riesgo de un tercer episodio de sida) y 3 o más episodios de sida (sujetos de riesgo de 4 o más episodios de sida). Aquellos sujetos con más de 3 eventos definitorios de sida fueron censurados después del tercer evento. Se censuraron a los sujetos en el momento de la muerte y los que seguían vivos al final del estudio fueron censurados a fecha 21 de agosto de 2008.
Se revisó con especial interés a los sujetos con un diagnóstico de sida que volvían a presentar ese mismo diagnóstico de manera recurrente. En estos casos, resulta difícil saber si se trata del mismo episodio registrado erróneamente de manera duplicada, de un nuevo episodio o de una recurrencia del mismo. Por ello, se tomaron las siguientes decisiones: 5 sujetos tuvieron varios diagnósticos de neumonía por Pneumocystis jirovecci (PCP) en un período inferior a 6 meses. En estos casos sólo se tuvo en cuenta el primer evento de sida, ya que podría tratarse del mismo diagnóstico de PCP registrado en más de una ocasión. De manera similar, 14 sujetos tuvieron varios diagnósticos de tuberculosis pulmonar, 6 de tuberculosis extrapulmonar y 2 de toxoplasmosis cerebral en un período inferior a 6 meses, para los que sólo se tuvo en cuenta el primer diagnóstico.
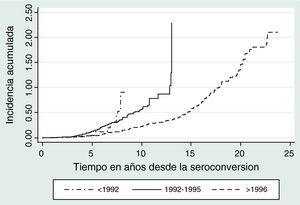
El tiempo calendario se dividió en tres períodos que reflejan la disponibilidad de diferentes regímenes de terapia antirretroviral en España: antes de 1992 (sin tratamiento); de enero de 1992 a diciembre de 1995 (terapia combinada) y de enero de 1996 a agosto de 2008 (época TARGA). En el análisis, el período calendario se trató como una variable externa cambiante en el tiempo, donde cada registro se divide según el período de calendario en el que transcurre el seguimiento, y por el estatus respecto al evento de interés que se tiene al final del seguimiento en ese período9 (fig. 2).
Ejemplo hipotético para 4 sujetos con eventos recurrentes. Estructura de los datos para los modelos PWP-GT y AG. Las observaciones comienzan al mismo tiempo; ¿ es un evento (desarrollo de sida); ♦ es una muerte y ¿ es censura de la observación al final del seguimiento (A). Se divide cada sujeto en tantos registros como períodos o riesgos de eventos se disponga y se realiza un análisis para datos truncados (B). Los datos se dividen como se ha indicado en (A) pero permitiendo que varíe el riesgo. Así estratificamos los registros de cada individuo en función de si están en riesgo del primer, segundo o tercer sida. El análisis es de nuevo para datos truncados pero estratificando por el número de sida al que se está en riesgo.
Se calcularon el número de personas-tiempo de riesgo y el número de episodios de sida para cada estrato del período calendario y para el episodio de sida al que se estaba a riesgo. Se estimó el riesgo de desarrollar sida en cada uno de los tres períodos del calendario. Se compararon los riesgos relativos utilizando como período de referencia el 1992-1995. Se ajustó por edad en el momento de la seroconversión, sexo y categoría de transmisión al VIH. La edad a la seroconversión fue modelizada utilizando un spline cúbico, puesto que permite una mayor flexibilidad en la modelización. La variable categoría de transmisión fue agrupada en cuatro categorías: homosexual, heterosexual, usuario de drogas inyectadas y otras. La escala de tiempo utilizada es el tiempo desde la seroconversión con entrada retardada a la primera visita VIH-positiva al centro de reclutamiento. Así, todos los sujetos que estamos comparando tienen una duración similar de la infección por VIH. Los análisis fueron llevados a cabo con STATA versión 9 (StataCorp, Collage Station, TX, USA).
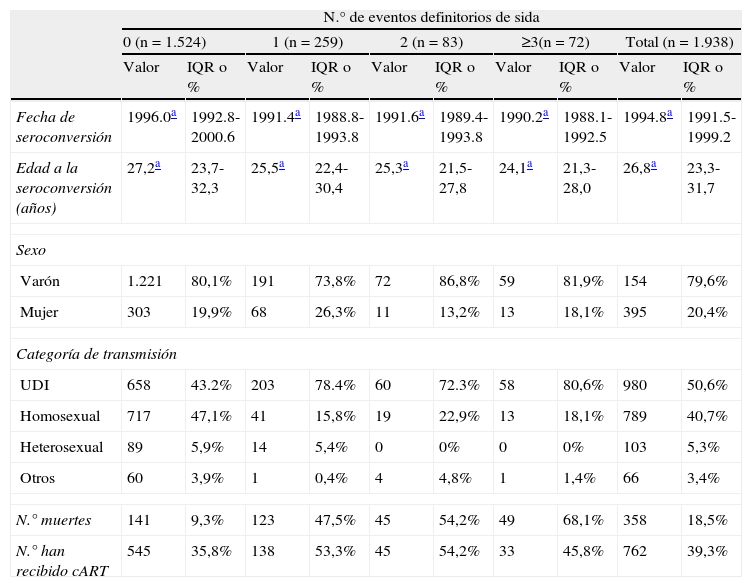
ResultadosLos pacientes en estudio fueron 1.938 sujetos seroconvertores al VIH, entre los que la mediana para la fecha de seroconversión fue octubre de 1994 (IQR julio de 1991-marzo de 1999) y la edad (mediana) a la seroconversión fue de 26,8 años (IQR 23,3-31,7). Aproximadamente, el 79% de los sujetos eran varones y 980 (50,6%) eran UDVP (tabla 1).
Características de 1.938 seroconvertores al VIH seguidos en la cohorte GEMES, para la aparición de uno o más episodios definitorios de sida.
| N.° de eventos definitorios de sida | ||||||||||
| 0 (n=1.524) | 1 (n=259) | 2 (n=83) | ≥3(n=72) | Total (n=1.938) | ||||||
| Valor | IQR o % | Valor | IQR o % | Valor | IQR o % | Valor | IQR o % | Valor | IQR o % | |
| Fecha de seroconversión | 1996.0a | 1992.8-2000.6 | 1991.4a | 1988.8-1993.8 | 1991.6a | 1989.4-1993.8 | 1990.2a | 1988.1-1992.5 | 1994.8a | 1991.5-1999.2 |
| Edad a la seroconversión (años) | 27,2a | 23,7-32,3 | 25,5a | 22,4-30,4 | 25,3a | 21,5-27,8 | 24,1a | 21,3-28,0 | 26,8a | 23,3-31,7 |
| Sexo | ||||||||||
| Varón | 1.221 | 80,1% | 191 | 73,8% | 72 | 86,8% | 59 | 81,9% | 154 | 79,6% |
| Mujer | 303 | 19,9% | 68 | 26,3% | 11 | 13,2% | 13 | 18,1% | 395 | 20,4% |
| Categoría de transmisión | ||||||||||
| UDI | 658 | 43.2% | 203 | 78.4% | 60 | 72.3% | 58 | 80,6% | 980 | 50,6% |
| Homosexual | 717 | 47,1% | 41 | 15,8% | 19 | 22,9% | 13 | 18,1% | 789 | 40,7% |
| Heterosexual | 89 | 5,9% | 14 | 5,4% | 0 | 0% | 0 | 0% | 103 | 5,3% |
| Otros | 60 | 3,9% | 1 | 0,4% | 4 | 4,8% | 1 | 1,4% | 66 | 3,4% |
| N.° muertes | 141 | 9,3% | 123 | 47,5% | 45 | 54,2% | 49 | 68,1% | 358 | 18,5% |
| N.° han recibido cART | 545 | 35,8% | 138 | 53,3% | 45 | 54,2% | 33 | 45,8% | 762 | 39,3% |
Al final del seguimiento se observaron 358 (18,5%) muertes y 1.524 (78,6%) pacientes no habían desarrollado sida. De los sujetos que desarrollaron sida, 259 (62.6%) pacientes mostraron una única enfermedad definitoria, 83(20,05%) tuvieron 2 enfermedades definitorias de sida y 72 (17,39%) tuvieron 3 o más. El porcentaje de muertes en el grupo de sujetos que no desarrollaron sida (9,25%) fue marcadamente inferior que en el resto de los grupos (47,49%, entre los que desarrollaron un episodio definitorio de sida, 54,22% entre los que desarrollaron 2 y 68,06% entre los que desarrollaron 3 o más episodios).
La proporción de UDVP entre los sujetos que habían desarrollado uno o más eventos definitorios de sida fue mayor que entre aquellos que no desarrollaron sida (tabla 1). No obstante, hay que señalar que la mediana de edad a la seroconversión al VIH de los UDVP es 25,32, inferior a la del resto de las categorías de transmisión.
El grupo de los sujetos que no desarrollaron sida durante el seguimiento tenía una fecha mediana de seroconversión ligeramente posterior al resto de los grupos y una mayor edad a la seroconversión.
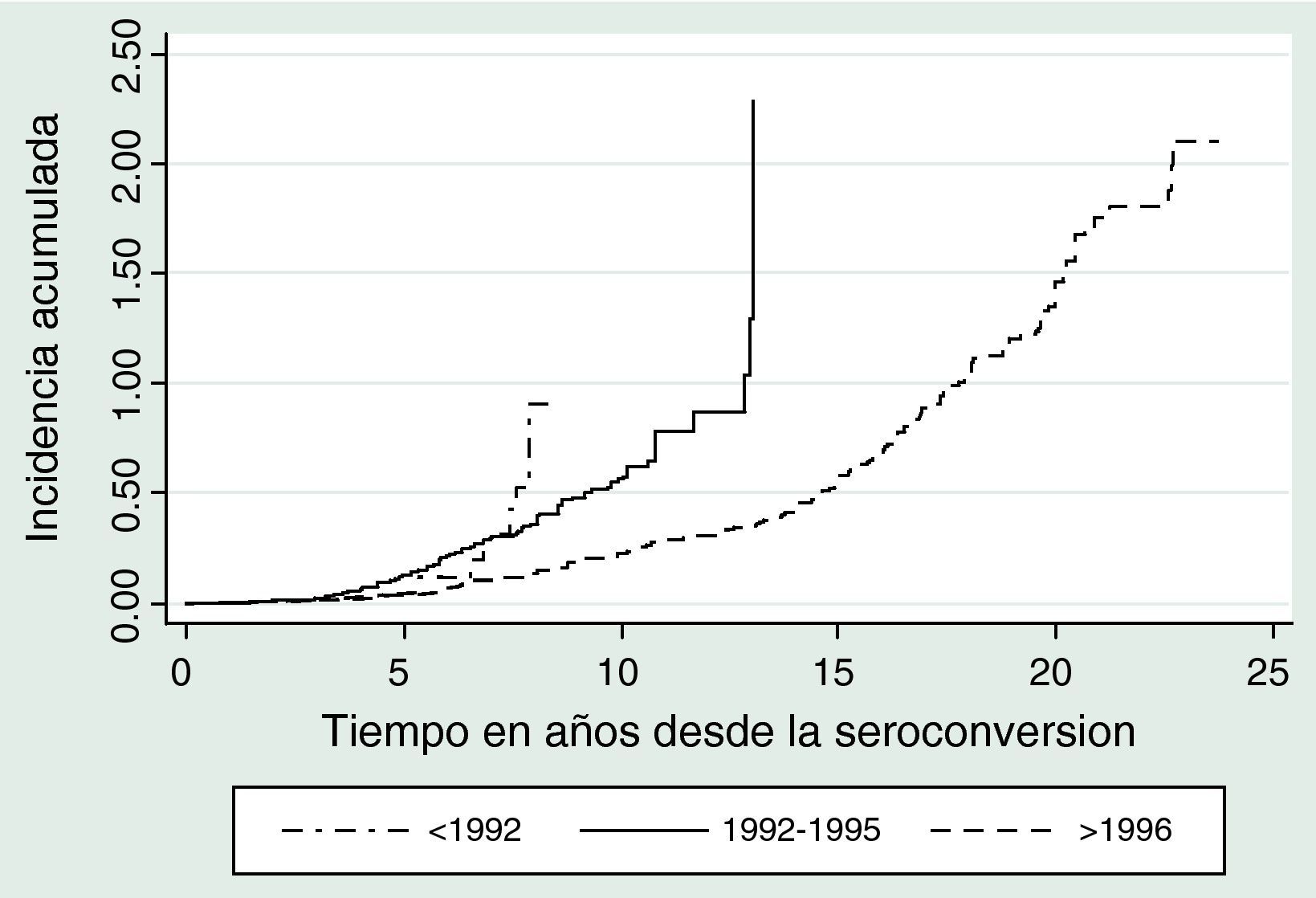
La figura 1 muestra la reducción de la incidencia de sida en el período 1997–2008 en comparación con el período 1992–1995 para uno o varios episodios de sida. Así, si únicamente se tiene en cuenta el primer episodio definitorio de sida, la efectividad del TARGA, medida como la disminución de la incidencia de los episodios de interés para el período 1996–2008 comparado con el período de referencia (1992–1995), fue de un 62% (HR=0,38 (IC del 95%, 0,27-0,53). Los UDVP tienen un riesgo significativamente mayor de desarrollar un primer episodio de sida que los homosexuales (RR=2,14; IC del 95%, 1,48-3,10) y las mujeres un menor riesgo que los varones (RR=0,84; IC del 95%, 0,65-1,07). Sin embargo, también para los UDVP y para los varones se observó una disminución del riesgo a sida en el período 1996-2008.
Empleando la técnica PWP, es decir, permitiendo que el riesgo basal sea diferente en cada uno de los períodos, se observa que los riesgos relativos al primer, segundo y tercer evento sida son, respectivamente, 0,39 (IC del 95%, 0,32-0,50), 0,27 (IC del 95%, 0,15-0,50) y 0,41 (IC del 95%, 0,18-0,96) para el período 1996–2008 en comparación con el período de referencia (fig. 3). Como sucedía en el caso al primer episodio de sida, los UDVP tienen un mayor riesgo de contraer un sida posterior, al igual que las mujeres tienen un riesgo menor.
Puesto que no existen diferencias estadísticamente significativas en los RR arriba descritos (p de homogeneidad=0,42), podemos utilizar la técnica de AG, que asume que el riesgo basal de los diferentes eventos es el mismo.
De este modo, se estima que el riesgo de desarrollar sida, ya sea como enfermedad definitoria o como episodio recurrente, en el período TARGA es aproximadamente un tercio que en el período de referencia (RR=0,32; [IC del 95%, 0,25-0,41]). Los UDVP tienen un riesgo de desarrollar un episodio definitorio de sida de, aproximadamente, el doble (RR=1,76 [IC del 95%, 1,27-2,45]) que los varones homosexuales.
En el presente trabajo, al evaluar conjuntamente la aparición de segundos y terceros eventos de sida, se ha reducido el error estándar de las estimaciones en un 33% aproximadamente(1-0,04/0,06) al comparar con el análisis en el que sólo se tiene en cuenta el primer evento definitorio de sida.
DiscusiónLos resultados de este estudio muestran una disminución del riesgo en la era TARGA en el tiempo al primer evento definitorio de sida de aproximadamente un tercio del efecto obtenido para el período de referencia. Este mismo efecto se mantiene para los posteriores episodios de sida, por lo que la efectividad de TARGA para sucesivos episodios definitorios de SIDA se mantiene. Aunque los UDVP presentan mayor riesgo de desarrollar sida, también en este grupo se observa una disminución de eventos recurrentes de sida en el período donde el TARGA estaba disponible.
Los hallazgos observados son similares a los descritos en otros trabajos. En cuanto al riesgo de primer sida, Cain et al10 encuentran también un efecto protector del TARGA, aunque ligeramente inferior en magnitud. Cuando se permite la variación en el riesgo basal los resultados son similares a los obtenidos en el trabajo anteriormente mencionado y lo mismo ocurre cuando se consideran todos los eventos definitorios de sida.
Disponer de datos en los que se observan eventos múltiples en un individuo es frecuente en la investigación biomédica15-17. Estos datos provienen de estudios donde en un mismo sujeto pueden tener lugar uno o más eventos, como es el caso de los eventos recurrentes de sida. Los estudios longitudinales que registran múltiples episodios definitorios de sida nos permiten conocer mejor la evolución de la enfermedad. Si únicamente se analiza el tiempo al primer evento que define la enfermedad, ignorando eventos posteriores, se pierde información relevante sobre el efecto del tratamiento y la profilaxis en segundos y terceros episodios de sida.
En este trabajo se muestra la efectividad poblacional de la implantación de las diferentes terapias frente al VIH, no tanto la eficacia individual, que ya es conocida por los ensayos clínicos18–20. Este análisis permite evaluar cómo la introducción, desde 1996, de las terapias frente al VIH ha mejorado claramente la progresión de la infección de VIH a diferentes eventos de sida. No se han utilizado variables de tratamiento individual sino el período calendario como variable cambiante en el tiempo con el fin de evaluar la efectividad poblacional de la inclusión del tratamiento. Así, un individuo que tuviera un tratamiento con dos nucleósidos a finales de 1995, pero que rápidamente pasa a TARGA en 1996, sería asignado al período de biterapia en el tiempo de seguimiento antes de 1996 y en período de inclusión del TARGA posteriormente. Para evaluar la efectividad poblacional el interés se centra en el tipo de medidas que se aplican en general a la población, sabiendo que hay diferencias individuales. Por lo tanto, no contribuiría a la mejora en el período de la terapia dual.
La ventaja de disponer de una cohorte de sujetos como los que integran el GEMES es la capacidad de poder ajustar por la duración de la infección controlando el sesgo de supervivencia, comparando el riesgo del evento de interés en diferentes períodos calendario entre individuos con la misma duración de la infección.
Deben mencionarse algunas limitaciones en este estudio. En primer lugar, las restricciones en el posible número de eventos definitorios de sida en el primer período calendario. La escala de tiempo utilizada en el análisis es tiempo desde la seroconversión para asegurar que los sujetos comparados tienen el mismo tiempo de infección. Sin embargo, los sujetos que contribuyen al primer período calendario tienen menos riesgo de desarrollar sida, particularmente un segundo o tercer episodio definitorio por el tiempo transcurrido desde la seroconversión y esto repercute en el tiempo al primer sida y en el tiempo a posteriores episodios.
En segundo lugar, la dificultad de asegurar si se trata o no de un mismo episodio de sida cuando la diferencia de tiempo entre dos eventos sucesivos es pequeña. En el análisis se consideró que se trataba del mismo evento cuando el tiempo transcurrido era inferior a 6 meses. En la práctica clínica no es extraño observar que los UDVP no finalizan el tratamiento recomendado cuando son dados de alta tras presentar una enfermedad definitoria de sida. Esto podría hacer que estuviéramos infraestimando el número de episodios recurrentes de sida y, por tanto, el riesgo de sida.
En este estudio se han considerado las muertes como una censura no informativa, es decir, se asume que si los sujetos no se hubieran muerto habrían desarrollado los subsiguientes sidas con igual probabilidad que aquellos que permanecieron en el estudio21. Esto puede no ser necesariamente cierto, ya que probablemente aquellos que murieron, si no hubieran muerto habrían desarrollado con mayor facilidad otros eventos de sida, con lo cual los efectos estudiados pudieran estar infraestimados.
Este trabajo nos ha permitido estimar el efecto del TARGA en múltiples eventos de sida como contraposición al análisis clásico de riesgo al primer sida. Los resultados muestran un claro efecto protector de la terapia al primer sida, manteniéndose el efecto para los posteriores eventos. La inclusión en el análisis de todos los eventos recurrentes de sida nos permite obtener estimaciones del riesgo más precisas que muestran la efectividad poblacional de la incorporación de los tratamientos.
FinanciaciónEste trabajo ha sido financiado con ayuda de la Fundación para la Investigación y Prevención del Sida en España (FIPSE) (número de expediente 36781/08). También ha recibido fondos del CIBERESP.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.