El diagnóstico serológico de las infecciones en fase aguda implica la detección de la respuesta IgM específica, marcador eficaz de infección primaria, aunque con menos validez en las reactivaciones o reinfecciones. El objetivo de este artículo es proporcionar una visión actualizada del diagnóstico rápido en serología mediante la detección del isotipo IgM y revisar sus aplicaciones y limitaciones. Se analizan especialmente ensayos Point-of-Care (PoC) utilizados en áreas geográficas donde las pruebas tradicionales son inaccesibles, y en otras circunstancias donde su empleo acerca el diagnóstico a la población diana, debido a que pueden efectuarse en centros no sanitarios. Asimismo, su empleo disminuye el tiempo transcurrido entre la toma de muestra y el diagnóstico, facilitando al clínico la toma de decisiones. Los ensayos PoC han probado su coste-efectividad, especialmente en la prevención de la transmisión vertical de la sífilis y en la infección por el VIH.
Serological diagnosis of acute phase infections implies the detection of IgM specific response, an effective marker of primary infection, but with less clinical significance in reactivations or reinfections. The aim of this article is to provide an updated view of the rapid diagnosis in serology by detecting the IgM isotype and reviewing its applications and limitations. Point-of-care (PoC) tests are analyzed. PoC tests are used in geographical areas where traditional tests are not available, as well as in other circumstances where their use brings the diagnosis directly to the target population. Likewise, their use reduces the response time between taking the sample and the diagnosis, making it easier to make clinical decisions. PoC assays have proven cost-effective, especially in preventing vertical transmission of syphilis and HIV infection.
El diagnóstico microbiológico de las infecciones en fase aguda implica la detección del microorganismo por métodos directos, como el cultivo y los métodos moleculares, o utilizando métodos indirectos, como la serología. Si se recurre a los métodos serológicos, la forma más rápida de orientar el diagnóstico etiológico es la detección de la respuesta IgM específica, marcador eficaz en la infección primaria, aunque con menos valor en las reactivaciones y reinfecciones debido a la fugacidad y a la baja intensidad de su presentación. No obstante, demostrar la seroconversión proporciona el diagnóstico definitivo, aunque retrasa el diagnóstico en el tiempo al requerir el estudio en paralelo de muestras obtenidas en la fase aguda y en la convalecencia.
Las muestras clínicas en las que principalmente se basan los estudios serológicos son suero o plasma, en general en fase líquida, aunque también se emplea sangre inmovilizada en papel de filtro. También se utilizan otros fluidos corporales, como líquido cefalorraquídeo (en infecciones del sistema nervioso central), saliva y orina.
Técnicas serológicasLas técnicas serológicas clásicas (neutralización, fijación del complemento e inhibición de la hemaglutinación, entre otras) detectan anticuerpos totales, por lo que no proporcionan un diagnóstico rápido. En general, requieren de procesos preanalíticos para eliminar reactantes inespecíficos, y no están automatizadas, por lo que no son técnicas de rápida ejecución. Por otra parte, las técnicas en fase sólida, como el inmunoanálisis enzimático (ELISA), la inmunofluorescencia (IF), la inmunoquimioluminiscencia (IQL) o la inmunocromatografía (IC), permiten la identificación de anticuerpos específicos de clase, lo que las habilita para el diagnóstico rápido, mediante la detección de IgM. Los ensayos de ELISA e IQL están disponibles en formatos automáticos que requieren equipamiento costoso.
Diagnóstico rápido en serología. Detección de IgMSe realiza mediante ensayos indirectos y de captura. En los primeros, los anticuerpos específicos del suero se unen al antígeno inmovilizado en la fase sólida. El isotipo IgM es reconocido mediante un antisuero anti-IgM, conjugado con el indicador correspondiente al ensayo, revelándose la reacción. En los ensayos de captura, la IgM de la muestra se une a un antisuero anti-IgM. Si la muestra tiene IgM específica, es reconocida mediante la adición de un antígeno conjugado, o de un antígeno viral junto con, o seguido de, un antisuero conjugado. En ambos casos, la intensidad de la señal generada es directamente proporcional a la concentración de IgM específica.
Limitaciones de la detección de IgMLa validez de la IgM como indicador de infección reciente se puede ver condicionada por reactividades que no están directamente relacionadas con la infección1.
La presencia de factor reumatoide2, en individuos con IgG específica. El factor reumatoide es un autoanticuerpo IgM con especificidad anti-IgG. La eliminación de la IgG de la muestra elimina esta reactividad. En la actualidad, la mayoría de los métodos comerciales para la detección de IgM incluyen una incubación previa en presencia de un antisuero anti-IgG, o recomiendan su uso como opción.
Ciertos virus pertenecientes al mismo grupo comparten determinantes antigénicos, lo que se expresa en forma de reactividad cruzada al medir IgM3. Esta situación es importante cuando se produce entre agentes infecciosos que pueden producir cuadros clínicos similares, como el virus Epstein Barr (VEB) y el citomegalovirus (CMV) en la mononucleosis infecciosa (MI).
La reactividad múltiple frente a varios antígenos, por estimulación policlonal de linfocitosB de memoria, da lugar a reactividad IgM no relacionada con infección aguda4. Se manifiesta como reactividad IgM frente a patógenos que han infectado previamente al paciente, lo que origina problemas de diagnóstico diferencial.
Las infecciones secundarias (reinfección exógena o reactivación de virus latente) cursan frecuentemente con presencia de IgM. Esta circunstancia plantea problemas importantes en determinadas situaciones, como es la infección por virus dengue o la infección por CMV en el embarazo; en este caso, la infección primaria produce infección congénita más frecuentemente que la reactivación, siendo de gran interés caracterizar el tipo de infección en presencia de IgM específica5.
La persistencia de IgM origina igualmente problemas diagnósticos, como sucede en las infecciones por Toxoplasma gondii. Su detección en el control serológico del embarazo, implica diferenciar la respuesta IgM específica de la infección primaria aguda debido al riesgo que supone para el feto6.
Por último, la ausencia de respuesta IgM es posible en infecciones en pacientes con algún tipo de inmunodepresión, entre las que se puede considerar la infección congénita7.
Todas estas circunstancias requieren ensayos que permitan confirmar o excluir la respuesta IgM, o relacionarla con un tipo de infección (primaria o secundaria), como son el establecimiento de perfiles de anticuerpos o los ensayos de avidez de IgG; este último marcador es un buen indicador de infección primaria.
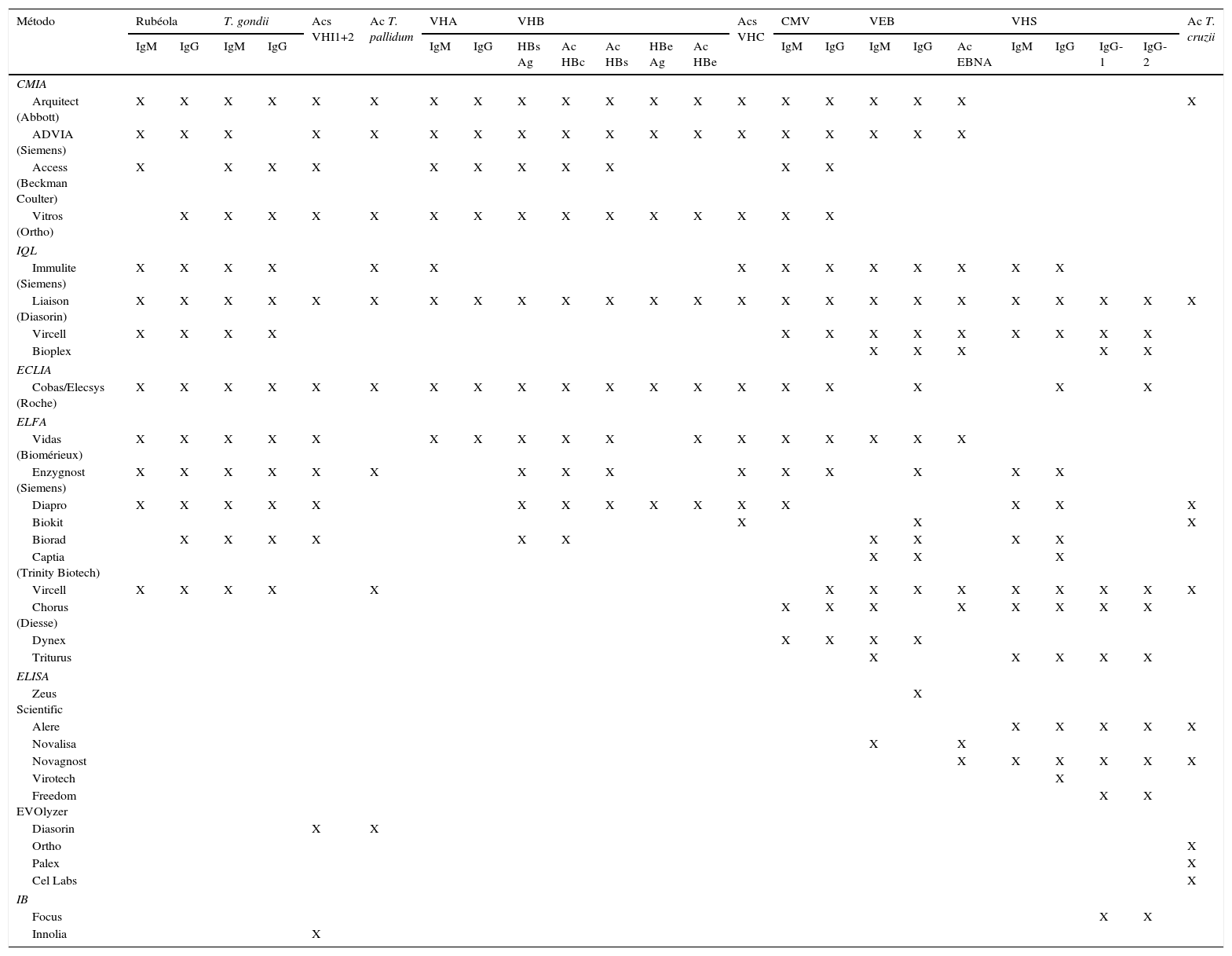
Técnicas rápidas en serologíaTécnicas automatizadasGran parte de las determinaciones serológicas están disponibles en formatos automatizados, siendo especialmente útiles para determinaciones de gran requerimiento. Sus ventajas son el aumento del rendimiento, la exactitud, la reducción del tiempo de respuesta, la trazabilidad y menor trabajo manual; en definitiva, son coste-efectivas. Por otra parte, las desventajas son el alto coste, tanto de equipos como de reactivos, y los problemas técnicos y de comunicación con los sistemas de gestión de muestras. En la tabla 1 se presentan, sin ánimo de que la relación sea exhaustiva, ensayos automáticos empleados por laboratorios españoles, según información de la SEIMC (https://www.seimc.org/controldecalidadseimc/).
Ensayos comerciales automatizados empleados en España
| Método | Rubéola | T. gondii | Acs VHI1+2 | Ac T. pallidum | VHA | VHB | Acs VHC | CMV | VEB | VHS | Ac T. cruzii | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IgM | IgG | IgM | IgG | IgM | IgG | HBs Ag | Ac HBc | Ac HBs | HBe Ag | Ac HBe | IgM | IgG | IgM | IgG | Ac EBNA | IgM | IgG | IgG-1 | IgG-2 | |||||
| CMIA | ||||||||||||||||||||||||
| Arquitect (Abbott) | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | ||||
| ADVIA (Siemens) | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | ||||||
| Access (Beckman Coulter) | X | X | X | X | X | X | X | X | X | X | X | |||||||||||||
| Vitros (Ortho) | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | |||||||||
| IQL | ||||||||||||||||||||||||
| Immulite (Siemens) | X | X | X | X | X | X | X | X | X | X | X | X | X | X | ||||||||||
| Liaison (Diasorin) | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X |
| Vircell | X | X | X | X | X | X | X | X | X | X | X | X | X | |||||||||||
| Bioplex | X | X | X | X | X | |||||||||||||||||||
| ECLIA | ||||||||||||||||||||||||
| Cobas/Elecsys (Roche) | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | |||||
| ELFA | ||||||||||||||||||||||||
| Vidas (Biomérieux) | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | |||||||
| Enzygnost (Siemens) | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | |||||||||
| Diapro | X | X | X | X | X | X | X | X | X | X | X | X | X | X | X | |||||||||
| Biokit | X | X | X | |||||||||||||||||||||
| Biorad | X | X | X | X | X | X | X | X | X | X | ||||||||||||||
| Captia (Trinity Biotech) | X | X | X | |||||||||||||||||||||
| Vircell | X | X | X | X | X | X | X | X | X | X | X | X | X | X | ||||||||||
| Chorus (Diesse) | X | X | X | X | X | X | X | X | ||||||||||||||||
| Dynex | X | X | X | X | ||||||||||||||||||||
| Triturus | X | X | X | X | X | |||||||||||||||||||
| ELISA | ||||||||||||||||||||||||
| Zeus Scientific | X | |||||||||||||||||||||||
| Alere | X | X | X | X | X | |||||||||||||||||||
| Novalisa | X | X | ||||||||||||||||||||||
| Novagnost | X | X | X | X | X | X | ||||||||||||||||||
| Virotech | X | |||||||||||||||||||||||
| Freedom EVOlyzer | X | X | ||||||||||||||||||||||
| Diasorin | X | X | ||||||||||||||||||||||
| Ortho | X | |||||||||||||||||||||||
| Palex | X | |||||||||||||||||||||||
| Cel Labs | X | |||||||||||||||||||||||
| IB | ||||||||||||||||||||||||
| Focus | X | X | ||||||||||||||||||||||
| Innolia | X | |||||||||||||||||||||||
CMIA: inmunoanálisis quimioluminiscente en micropartículas; ECLIA: electroinmunoquimioluminiscencia; ELFA: ensayo fluorescente ligado a enzima: ELISA: inmunoanálisis enzimático; IB: inmunoblot; IQL: inmunoquimioluminiscencia.
https://www.seimc.org/contenidos/ccs/analisisderesultados/2015/ccs-ar-t2015-3-Serologia3b.pdf
https://www.seimc.org/contenidos/ccs/analisisderesultados/2015/ccs-ar-t2015-3-Serologia3a.pdf
https://www.seimc.org/contenidos/ccs/analisisderesultados/2015/ccs-ar-t2015-2-Serologia.pdf
https://www.seimc.org/contenidos/ccs/analisisderesultados/2015/ccs-ar-t2015-1-Serologia1b.pdf
https://www.seimc.org/contenidos/ccs/analisisderesultados/2014/ccs-ar-t2014-3-SerologiaA.pdf
Los ensayos Point-of-Care (PoC) son los que se realizan fuera del laboratorio central, próximos al paciente, con material y equipamiento fácilmente transportable y cuyos resultados se encuentran disponibles en minutos o en menos de una hora. No necesitan personal especialmente entrenado para su realización ni para su lectura e interpretación. Su aplicación es mayor en países en vías de desarrollo, en donde han probado su coste-efectividad en la prevención de la transmisión vertical de la sífilis y la infección por el virus de la inmunodeficiencia humana (VIH), pero también tienen su espacio en nuestro medio, debido a que acercan el diagnóstico a la población diana y pueden realizarse en centros no sanitarios.
En la actualidad, las técnicas de IC, también llamadas de flujo lateral, se utilizan para la detección de anticuerpos IgM e IgG. La reacción se produce en un filtro de nitrocelulosa o de nailon, por el que fluye la muestra. En la zona de reacción se encuentran inmovilizados los antígenos frente a los que se quiere detectar anticuerpos; si estos existen, se quedan fijados. La muestra fluye a la zona del conjugado (antisuero frente al isotipo que interese) con oro coloidal, evidenciándose la presencia de anticuerpos por desarrollo de color. Suelen incluir una zona de control, para verificar que la reacción ha tenido lugar de forma adecuada. Los resultados se obtienen en 15-30min.
Mononucleosis infecciosaEn el adulto joven y en el adolescente inmunocompetente, la manifestación clínica más frecuente de la infección primaria por el VEB es la MI. El diagnóstico microbiológico se realiza por métodos serológicos, mediante la detección de anticuerpos heterófilos (AH) o por la demostración de anticuerpos específicos frente al VEB, permitiendo diferenciar el cuadro clínico asociado al VEB del producido, entre otros, por el CMV, VIH o T.gondii.
Los AH detectados en la fase aguda de la enfermedad confirman el diagnóstico de MI por VEB, ya que no suelen aparecer en los casos de otra etiología y generalmente se negativizan en 2 o 3meses. Aparecen en el 80-90% de los pacientes con MI mayores de 10años, aunque por debajo de esa edad el porcentaje de positividad es menor del 50%, principalmente en menores de 3años.
Existen muchas pruebas comercializadas que detectan AH: variantes del test Paul-Bunnell, técnicas de aglutinación de partículas de látex e IC. La sensibilidad oscila entre el 80 y el 95%, dependiendo de los grupos de edad en que se realiza la prueba, y la especificidad es cercana al 100%8. Los falsos positivos de AH son raros, pudiendo encontrarse en enfermedades autoinmunes, en pacientes con leucemia y en casos de infección por CMV, rubéola o VIH, entre otros. La determinación de AH suele realizarse de forma manual, pero hay sistemas automatizados de detección múltiple que detectan conjuntamente AH e IgM frente al antígeno de la cápside del VEB (viral capsid antigen [VCA]) con buena concordancia respecto a las técnicas tradicionales9,10.
En los pacientes con AH negativos es imprescindible investigar la respuesta específica, principalmente la IgM frente al VCA, que es la primera en aparecer y permanece detectable menos de 6meses, frente a la respuesta IgG anti-VCA, que perdura toda la vida, y los anticuerpos contra el antígeno nuclear del VEB (Epstein Barr nuclear antigen [EBNA]) no detectables en la fase aguda. No obstante, en un 10% de los niños con infección primaria aguda la IgM anti-VCA es indetectable, por lo que se confirma la infección por la presencia de IgG anti-VCA en ausencia de reactividad anti-EBNA. Ante una sospecha de MI con AH negativos, la realización de los 3 marcadores específicos permitirá realizar el diagnóstico en más del 90% de los casos. Deben considerarse las reactividades cruzadas con CMV, VHH-6, parvovirus B19 y virus de la rubéola, entre otros.
En la mayor parte de los laboratorios de microbiología las técnicas de ELISA, de IQL y de fluorescencia ligada a enzima han sustituido a la IF, utilizada clásicamente como técnica de referencia. Muestran buenos valores de sensibilidad y especificidad, tanto para el análisis de marcadores individuales como para establecer perfiles de anticuerpos11,12.
Hay pruebas rápidas de inmunofiltración que permiten detectar IgM frente a la proteína ZEBRA (BamHI Z EBV replication activator) del VEB junto con la IgM anti-VCA. Los resultados se obtienen en menos de 3min y su sensibilidad oscila entre el 75 y el 90%, con una especificidad del 95-100%13. El mismo formato está disponible para la detección conjunta de los anticuerpos IgG anti-VCA y anti-EBNA-1.
SífilisEl diagnóstico serológico de la sífilis se realiza utilizando la combinación de una prueba no treponémica (PnT), principalmente Rapid Plasma Reagin (RPR) o Venereal Disease Research Laboratory (VDRL), y una treponémica (PT), generalmente realizada por técnicas de ELISA o IQL. Las PnT determinan la actividad de la infección y tradicionalmente se han utilizado como pruebas de cribado. Las PT son más específicas, detectan infección pasada, latente o presente, sin diferenciarlas, ya que permanecen positivas después del tratamiento. En los últimos años se ha introducido el denominado cribado inverso, que supone comenzar el estudio con una PT. Esta opción permite detectar casos de sífilis latente en poblaciones con baja prevalencia de la infección que no serían diagnosticados utilizando el cribado tradicional.
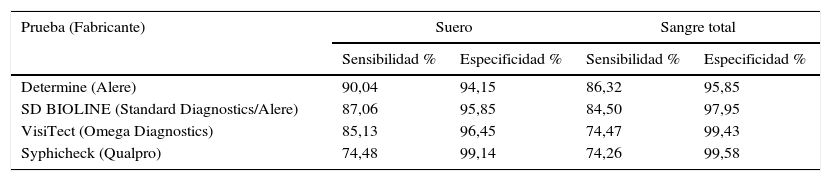
La mayor parte de los ensayos PoC utilizados para el cribado de la sífilis detectan solo anticuerpos frente a los antígenos treponémicos (AT). Son ensayos de IC que utilizan la tecnología de flujo lateral y uno o más AT recombinantes (TpN15, TPN17, TpN47). Pueden detectar IgM, IgG e IgA. Se realizan en suero y plasma, y algunas también utilizan sangre completa y fluidos orales. Según estudios realizados en diferentes áreas geográficas, presentan buena sensibilidad y especificidad, aunque la sensibilidad es mayor en suero14,15. En la tabla 2 se muestran los datos de sensibilidad y especificidad recogidos de un metaanálisis reciente16.
Sensibilidad y especificidad de las pruebas rápidas más utilizadas para el diagnóstico de sífilis en muestras de suero y sangre total
| Prueba (Fabricante) | Suero | Sangre total | ||
|---|---|---|---|---|
| Sensibilidad % | Especificidad % | Sensibilidad % | Especificidad % | |
| Determine (Alere) | 90,04 | 94,15 | 86,32 | 95,85 |
| SD BIOLINE (Standard Diagnostics/Alere) | 87,06 | 95,85 | 84,50 | 97,95 |
| VisiTect (Omega Diagnostics) | 85,13 | 96,45 | 74,47 | 99,43 |
| Syphicheck (Qualpro) | 74,48 | 99,14 | 74,26 | 99,58 |
Adaptada de Jafari et al.16.
Nuevos ensayos pretenden mejorar el diagnóstico rápido. Unos detectan conjuntamente anticuerpos frente a AT y antígenos no treponémicos (AnT) y otros detectan varias infecciones en el mismo dispositivo, generalmente VIH y virus de la hepatitis C (VHC). Los primeros buscan diferenciar la infección activa de la pasada, para evitar tratamientos innecesarios. La prueba Dual Path Platform (DPP) Syphilis Screen & Confirm test (Chembio Diagnostic Systems Inc, Medford, Nueva York) es el único ensayo comercial que permite detectar ambos tipos de anticuerpos simultáneamente empleando AT recombinantes (líneaT1) y AnT sintéticos (líneaT2). Ha sido evaluada por los Centros de Control y Prevención de Enfermedades de Estados Unidos, utilizando como técnicas de referencia Treponema pallidum particle agglutination (TPPA) y RPR, respectivamente17. La reactividad frente a AnT presentó una concordancia del 98,4% en muestras con título RPR>1:2, y del 98,6% cuando no había reactividad. Respecto a los anti-AT (T1), las concordancias fueron del 96,5% cuando había reactividad y del 95,5% en muestras negativas. Se ha intentado mejorar la sensibilidad de este ensayo mediante un lector electrónico que mide la densidad de las líneas de lectura, pudiendo ser la base de un nuevo ensayo cuantitativo.
Estudios de coste efectividad demuestran la utilidad de DPP para el cribado de la sífilis en mujeres embarazadas en países en vías de desarrollo y en poblaciones de alto riesgo, recomendando su uso en centros de atención primaria y en zonas con recursos limitados en donde la infección sea prevalente y las posibilidades de diagnóstico y seguimiento de los pacientes, escasas18.
Evaluado clínicamente, el ensayo DPP, identifica correctamente el 93% de las infecciones activas, el 28% de las infecciones pasadas y en el 78% de los casos descarta la infección. La sensibilidad de la línea T2 parece estar relacionada con los títulos de RPR. La concordancia global entre el DPP y los ensayos serológicos de referencia es mayor en los casos de infección activa y cuando el título de RPR es ≥1:16, disminuyendo en los casos de infección pasada y con título bajo de anticuerpos. Asimismo, es válida para diagnosticar otras treponematosis19,20.
Respecto a los ensayos múltiples, los más utilizados son los que detectan conjuntamente sífilis e infección por el VIH, debido a la relación sinérgica entre los dos patógenos. La sensibilidad y la especificidad son buenas para ambos microorganismos21,22.
Virus de la inmunodeficiencia humanaLa infección por el VIH afecta a más de 40 millones de personas en el mundo, de los cuales el 85% viven en países en vías de desarrollo, especialmente en el África subsahariana. En Europa y Estados Unidos se estima que entre el 15 y el 30% de las personas infectadas por el virus desconocen su situación. El control de la infección por el VIH tiene dos grandes retos: reducir la transmisión, producida principalmente en las primeras semanas de la infección, cuando la carga viral plasmática es mayor, y disminuir el tiempo transcurrido entre la obtención del resultado y su notificación al médico y al paciente.
El diagnóstico de la infección por el VIH se realiza generalmente por la detección de anticuerpos específicos. Los ensayos serológicos pueden ser de cribado y de confirmación. Con objeto de mejorar el diagnóstico de las infecciones agudas se han diseñado ensayos de cribado que detectan conjuntamente la presencia de anticuerpos VIH-1, VIH-2 y el antígeno p24 del VIH-1 (cuarta generación). Estos formatos acortan el período ventana e intentan identificar la infección antes de que el Western Blot sea positivo. Se realizan por técnicas de ELISA o IQL automatizadas y poseen alta sensibilidad (99,9-100%), con especificidad superior al 99%23,24. Recientemente se ha comercializado un ensayo de detección múltiple que detecta y diferencia simultáneamente el antígeno p24 de VIH-1 y los anticuerpos específicos frente al VIH-1 (gruposM y O) y VIH-2 en muestras de suero o plasma, con sensibilidad del 100% y especificidad del 99,5%25.
Las técnicas de confirmación a realizar si la prueba de cribado es positiva dependerán del algoritmo elegido: tradicional o Clinical and Laboratory Standards Institute26,27. Actualmente está disponible un sistema de confirmación y diferenciación rápida e individualizada de anticuerpos anti-VIH-1 y anti-VIH-2. Es una prueba de IC que incluye antígenos recombinantes o péptidos sintéticos específicos para el VIH-1 (gp160, gp41, p31, p24) y para el VIH-2 (gp140, gp36)28. Su lectura e interpretación puede ser visual, pero está automatizada y permite una lectura objetiva. Se obtienen resultados en menos de 30min. Tiene un buen nivel de discriminación entre el VIH-1 y el VIH-2, reduce el número de indeterminados y en general discrimina mejor que el LIA29.
La administración de la profilaxis antirretroviral posterior a una exposición ocupacional a sangre o fluidos, la necesidad de proporcionar resultados en situaciones de urgencia o durante el parto, así como en entornos no clínicos, han motivado la aparición de ensayos PoC. La Organización Mundial de la Salud recomienda el uso de ensayos PoC en entornos de recursos limitados. Estudios realizados en el África subsahariana han demostrado que comenzar el tratamiento en la primera visita, el mismo día que se realiza el diagnóstico, aumenta en un 36% la aceptación de la terapia antirretroviral y en un 26% la supresión viral30. La sensibilidad y la especificidad de estas pruebas son buenas, pero inferiores a los inmunoanálisis utilizados actualmente en el diagnóstico convencional, aunque emplean antígenos similares. Su sensibilidad es menor en las infecciones agudas, pudiendo dar resultados negativos falsos debido a que todavía no se han desarrollado anticuerpos específicos. Un metaanálisis reciente refiere que los ensayos PoC realizados en países en vías de desarrollo tienen una sensibilidad del 97,4% comparada con las técnicas de amplificación de ácidos nucleicos y del 98,8% si la referencia era un inmunoanálisis de cuarta generación, siendo la especificidad superior al 99,6% en ambos casos31.
Las pruebas PoC se pueden realizar en fluido oral, sangre capilar recogida mediante punción digital, y en suero o plasma. La sensibilidad en saliva es aproximadamente un 2% más baja que en sangre, aunque la especificidad es similar32. En los últimos años se han comercializado ensayos PoC de cuarta generación. Se estima que son menos sensibles que la prueba combinada estándar. Son válidos para detectar la infección establecida, tanto por el VIH-1 como por el VIH-233, pero su sensibilidad es baja en las infecciones agudas, ya que al analizar sus componentes separadamente, la sensibilidad para detectar el antígeno p24 VIH-1 es del 12,3%, mientras que la sensibilidad global para la detección de anticuerpos es del 97,3%34.
Un resultado positivo en una prueba PoC debe confirmarse. En los países en vías de desarrollo, cada estrategia implantada debe buscar su propio control de calidad con los recursos a su alcance.
HepatitisDe los virus con tropismo primario por el tejido hepático, solo se hará referencia al virus de la hepatitis B (VHB), al VHC y al virus de la hepatitis E (VHE) debido a las implicaciones clínicas derivadas de realizar un diagnóstico rápido. En nuestro medio existen muchos sistemas comerciales para el diagnóstico serológico de las hepatitis virales en muestras de plasma o suero. Utilizan diferentes métodos y plataformas y su sensibilidad y especificidad son muy buenas. Asimismo, existen pruebas rápidas, la mayoría de ellas basadas en ensayos de inmunoadherencia por IC o inmunofiltración con obtención de resultados en pocos minutos. Estas últimas tienen una especificidad buena, pero su sensibilidad es variable y siempre inferior a la obtenida con ensayos fluorescentes, de ELISA o de IQL35. Las pruebas PoC, en nuestro entorno, generalmente se utilizan como «pruebas de urgencia»; sin embargo, pueden ser de gran utilidad en los países no industrializados.
Virus de la hepatitis B. El antígeno de superficie del VHB (HBsAg) es un marcador muy precoz. Puede ser detectable ya en el período de incubación, y principalmente en las fases aguda y crónica de la infección, siendo la diana de elección de las técnicas rápidas. La cuantificación del HBsAg puede ser útil para identificar a los verdaderos portadores inactivos de la infección, para la monitorización de la progresión de la enfermedad y en la predicción de la respuesta al tratamiento con interferón.
La calidad de un ensayo diseñado para determinar el HBsAg se basa, entre otros factores, en la capacidad de detectar, al menos, 0,25ng/ml de esta proteína. Los inmunoanálisis comerciales de IQL o ELISA pueden alcanzar un límite de detección <0,13UI/ml (equivalente a <0,5ng/ml), mientras que en la mayor parte de las pruebas rápidas el límite bajo de detección oscila entre 0,5-2UI/ml (1-3ng/ml). Asimismo, varían en su capacidad para detectar las nuevas cepas mutantes del virus; por todo ello, es importante conocer las características analíticas de la prueba rápida a elegir36,37. Generalmente se realizan en muestras de sangre total, suero o plasma. En un metaanálisis reciente, la sensibilidad obtenida de las diferentes PoC comercializadas es muy variable (43,5-99,8%). Los estudios realizados en los países desarrollados muestran mayor homogeneidad que los realizados en países en vías de desarrollo. Respecto a la especificidad, los valores son más homogéneos (90-100%)38.
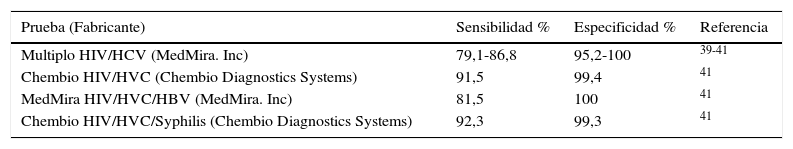
Virus de la hepatitis C. Los ensayos PoC son métodos de IC que generalmente utilizan antígenos recombinantes de la región del core y de las regiones no estructurales NS3 y NS4, aunque algunos de ellos incorporan también NS5. Los ensayos pueden realizarse en sangre, suero, plasma y saliva. Su sensibilidad varía según la prueba utilizada y el tipo de muestra, siendo más baja en saliva, aunque no parece depender del genotipo infectante. Según un metaanálisis reciente39 y otros estudios40-42, la prueba OraQuick (OraSure Technologies, EE.UU.) es la que presenta mayor sensibilidad y especificidad y ha sido aprobada por la Food and Drug Administration de Estados Unidos como prueba rápida para el cribado de anticuerpos anti-VHC en muestras de sangre obtenida por venopunción o punción digital en personas mayores de 15años. También hay disponibles ensayos de detección múltiple que detectan y diferencian conjuntamente anticuerpos frente al VHC y otros patógenos como el VIH, VHB o T.pallidum (tabla 3). Su sensibilidad y especificidad son similares o ligeramente inferiores a las obtenidas en los ensayos que detectan solamente anti-VHC, aunque la especificidad es alta. Pueden ser de interés en programas de cribado de infecciones de transmisión sexual, aunque debe tenerse en cuenta que se han comunicado falsos negativos en personas infectadas por el VIH, por lo que son menos útiles en áreas donde la prevalencia de esta infección es alta43.
Virus de la hepatitis E. El isotipo IgM específico es el marcador de infección aguda y confirma la infección. Los ensayos comerciales para el diagnóstico serológico del VHE permiten detectar las infecciones producidas por los 4 genotipos: genotipos1-2 en países en vías de desarrollo y3-4 en países industrializados, aunque su eficiencia puede variar según el genotipo infectante. Son ensayos de ELISA y de IC basados en péptidos de la región ORF2/ORF3 o antígenos recombinantes del VHE.
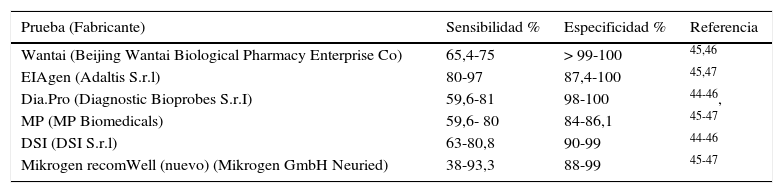
Las pruebas de ELISA que detectan IgM presentan una sensibilidad variable incluso utilizando la misma técnica, y dependiendo del grupo de población estudiada, ya que en pacientes con algún tipo de inmunodepresión la sensibilidad es menor. La especificidad oscila entre el 84 y el 100% (tabla 4)44-47. Recientemente se ha descrito un ensayo de ELISA diseñado para detectar el antígeno de la cápside del VHE. Presenta buena concordancia con la detección del ARN-VHE, por lo que puede ser de utilidad para detectar la infección aguda tanto en pacientes inmunocompetentes como en inmunodeprimidos48. Los ensayos PoC han sido desarrollados para detectar anticuerpos IgM anti-VHE en muestras de sangre total, suero o plasma. Han mostrado su validez en áreas endémicas y no endémicas, aunque su sensibilidad también es menor en pacientes inmunodeprimidos46,49.
Sensibilidad y especificidad de pruebas de ELISA para detectar IgM anti-VHE
| Prueba (Fabricante) | Sensibilidad % | Especificidad % | Referencia |
|---|---|---|---|
| Wantai (Beijing Wantai Biological Pharmacy Enterprise Co) | 65,4-75 | > 99-100 | 45,46 |
| EIAgen (Adaltis S.r.l) | 80-97 | 87,4-100 | 45,47 |
| Dia.Pro (Diagnostic Bioprobes S.r.I) | 59,6-81 | 98-100 | 44-46, |
| MP (MP Biomedicals) | 59,6- 80 | 84-86,1 | 45-47 |
| DSI (DSI S.r.l) | 63-80,8 | 90-99 | 44-46 |
| Mikrogen recomWell (nuevo) (Mikrogen GmbH Neuried) | 38-93,3 | 88-99 | 45-47 |
Entre los arbovirus transmitidos por mosquitos, el virus dengue (VDEN) y el virus Zika (VZIK) (Flaviviridae), junto con el virus Chikungunya (VCHIK) (Togaviridae), son los que plantean problemas en nuestro medio, por varias razones: comparten como vector especies del género Aedes, del cual está presente en España (región mediterránea) A.albopictus, producen cuadros clínicos similares (síndrome febril, exantema y dolores articulares) y son endémicos en las mismas áreas geográficas, por lo que su diagnóstico supone un reto para los laboratorios clínicos.
A partir de los 7 primeros días del inicio de los síntomas, la serología es el método de elección para realizar el diagnóstico microbiológico. En el diagnóstico de la fase aguda de la infección por métodos serológicos hay que tener en consideración las reacciones cruzadas existentes entre VDEN, VZIK y otros flavivirus, como el virus de la fiebre amarilla. Para la identificación inequívoca de la respuesta serológica se requiere efectuar técnica de neutralización.
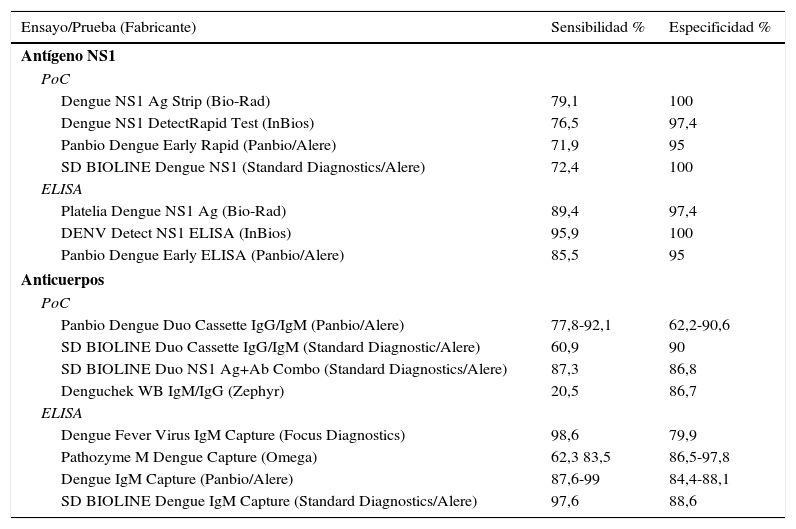
Virus dengue. El dengue es la enfermedad viral transmitida por mosquitos más frecuente en el mundo. Existen 4 serotipos diferentes: VDEN1 a 4. La inmunidad resultante de la infección es serotipo-específica y no protege al individuo frente a otros serotipos. La sensibilidad de las pruebas para realizar el diagnóstico microbiológico del dengue depende del tiempo de evolución, del tipo de infección (primaria o secundaria) y del virus infectante. Durante la fase virémica la detección del ARN viral o de la proteína no estructural NS1 son los principales métodos para el diagnóstico de la enfermedad. El antígeno NS1 es una glucoproteína altamente conservada en todos los serotipos del VDEN y detectable en suero en la fase temprana de la enfermedad; su detección es eficaz en los primeros 2-4días después del comienzo de los síntomas y orienta el diagnóstico de infección aguda, por su buena especificidad. Existen diferentes métodos comerciales de ELISA y de IC que detectan el antígeno NS1 en suero o plasma (tabla 5)50. En la infección primaria por VDEN el isotipo IgM puede ser detectable a partir del tercer día del comienzo de la fiebre cuando la viremia inicia su descenso. Sin embargo, en la infección secundaria se produce una rápida elevación de IgG tras la aparición de los síntomas, produciéndose una respuesta baja o indetectable de IgM. El establecimiento de la ratio IgM:IgG por ELISA permite clasificar la infección como primaria o secundaria51.
Virus dengue: sensibilidad y especificidad de pruebas rápidas y de ELISA para detectar NS1 y anticuerpos
| Ensayo/Prueba (Fabricante) | Sensibilidad % | Especificidad % |
|---|---|---|
| Antígeno NS1 | ||
| PoC | ||
| Dengue NS1 Ag Strip (Bio-Rad) | 79,1 | 100 |
| Dengue NS1 DetectRapid Test (InBios) | 76,5 | 97,4 |
| Panbio Dengue Early Rapid (Panbio/Alere) | 71,9 | 95 |
| SD BIOLINE Dengue NS1 (Standard Diagnostics/Alere) | 72,4 | 100 |
| ELISA | ||
| Platelia Dengue NS1 Ag (Bio-Rad) | 89,4 | 97,4 |
| DENV Detect NS1 ELISA (InBios) | 95,9 | 100 |
| Panbio Dengue Early ELISA (Panbio/Alere) | 85,5 | 95 |
| Anticuerpos | ||
| PoC | ||
| Panbio Dengue Duo Cassette IgG/IgM (Panbio/Alere) | 77,8-92,1 | 62,2-90,6 |
| SD BIOLINE Duo Cassette IgG/IgM (Standard Diagnostic/Alere) | 60,9 | 90 |
| SD BIOLINE Duo NS1 Ag+Ab Combo (Standard Diagnostics/Alere) | 87,3 | 86,8 |
| Denguchek WB IgM/IgG (Zephyr) | 20,5 | 86,7 |
| ELISA | ||
| Dengue Fever Virus IgM Capture (Focus Diagnostics) | 98,6 | 79,9 |
| Pathozyme M Dengue Capture (Omega) | 62,3 83,5 | 86,5-97,8 |
| Dengue IgM Capture (Panbio/Alere) | 87,6-99 | 84,4-88,1 |
| SD BIOLINE Dengue IgM Capture (Standard Diagnostics/Alere) | 97,6 | 88,6 |
La sensibilidad de las pruebas de ELISA para la detección de IgM es mayor que la de los ensayos de IC que detectan el mismo anticuerpo. Se recomiendan los ensayos de captura por mejorar la sensibilidad, especialmente en el dengue secundario. Las pruebas de IC no son eficaces, debido a su baja sensibilidad (6,4-65,3%)52. En todos los casos, la sensibilidad aumenta con los días transcurridos después de aparecer los síntomas. Con objeto de mejorar el diagnóstico de las infecciones por VDEN se han diseñado pruebas rápidas que utilizan anticuerpos monoclonales que detectan conjuntamente los anticuerpos IgM e IgG y algunas incorporan el antígeno NS1. La sensibilidad y especificidad globales, en muestras obtenidas entre los 4-14 primeros días después de aparecer los síntomas, son más elevadas y mejoran su utilidad diagnóstica, principalmente en áreas con difícil acceso a las pruebas de referencia53,54. En la tabla 5 se muestran la sensibilidad y la especificidad de estos ensayos.
En otras muestras clínicas, saliva u orina, los métodos aplicados muestran buena especificidad, pero carecen de la sensibilidad necesaria para ser una buena alternativa diagnóstica.
Virus Chikungunya. Las pruebas rápidas disponibles de IC detectan el isotipo IgM en muestras de suero o plasma. Los trabajos realizados con estas pruebas en zonas de alta prevalencia de la infección refieren una sensibilidad muy inferior (1,9-50%) respecto a los ensayos de referencia con los que se comparan, especialmente en la fase aguda de la enfermedad, y para ser aplicadas tanto en zonas endémicas como no endémicas deben ser mejoradas55. Los estudios realizados con anticuerpos monoclonales frente a la glucoproteínaE de la envuelta del VCHIK ofrecen resultados prometedores y pueden sustituir en un futuro próximo a los antígenos recombinantes utilizados en la actualidad56.
Virus Zika. Existen ensayos de IF que permiten la detección simultánea de anticuerpos frente a VZIK, VDEN y VCHIK y que sirven para poner de manifiesto las reacciones cruzadas para VZIK y VDEN. Un ensayo de ELISA que emplea la proteína NS1 mejora la especificidad. Existe comercializado un ensayo de IC con marcado CE diseñado para la detección cualitativa y simultánea de anticuerpos IgM e IgG de VZIK; las características de funcionamiento del ensayo deben ser establecidas57.
Enfermedad de Chagas (tripanosomiasis americana)La enfermedad de Chagas afecta a más de 10 millones de personas en América Latina, y debido a los movimientos migratorios está presente en zonas no endémicas como Europa, América del Norte, Asia y Australia. En nuestro medio generalmente nos enfrentamos al diagnóstico de la fase crónica de la enfermedad. En esta situación, el diagnóstico se realiza por métodos serológicos mediante la detección de los anticuerpos específicos IgG anti-Trypanosoma cruzi. El diagnóstico serológico de certeza continúa definiéndose como la concordancia de al menos dos técnicas de principio y antígenos diferentes. En caso de discrepancia se debe realizar otra prueba para confirmar y descartar otras infecciones que pueden dar lugar a reacciones falsamente positivas58.
Los métodos convencionales emplean como antígeno el parásito completo. Son muy sensibles, pero presentan reacciones cruzadas con otras infecciones (malaria, leishmaniasis, sífilis, toxoplasmosis, hepatitis, MI, esquistosomiasis), y también en enfermedades autoinmunes. Para aumentar la especificidad se han diseñado nuevos métodos serológicos que utilizan antígenos recombinantes o péptidos sintéticos y son los empleados en los ensayos PoC. Su sensibilidad y especificidad son variables, como lo demuestra un estudio multicéntrico, realizado con muestras bien caracterizadas frente a T.cruzi, en laboratorios de referencia de áreas endémicas y no endémicas59. El estudio concluye que la mayor parte de las pruebas evaluadas son válidas para realizar el diagnóstico de esta infección, aunque observa que las sensibilidades y especificidades obtenidas son algo más bajas que las publicadas en otros estudios o las que refieren los fabricantes. En la tabla 6 se reflejan las características de los ensayos estudiados59.
Sensibilidad y especificidad en diferentes muestras de las pruebas rápidas comercializadas para detectar IgG anti-T. cruzi
| Prueba (Fabricante) | Formato | Muestra | Sensibilidad % | Especificidad % |
|---|---|---|---|---|
| OnSite Chagas AB Rapid test (CTK Biotech) | IC/cassette | ST, S, P | 90,1 | 91 |
| WL Chek Chagas (Wiener) | IC/cassette | ST, S, P | 88,7 | 97 |
| Chagas Instantest (Silanes) | IC/cassette | S, P | 76,6 | 79 |
| Trypanosoma Detect Rapid test (InBios Inc) | IC/tira | ST, S | 92,9 | 94 |
| Chagas Quick test (Cypress Diagnostic) | IC/tira | ST, S | 92,9 | 93,2 |
| Chagas Stat-Pack assay (Chembio) | IC/cassette | ST, S, P | 87,2 | 93,2 |
| Immune-Sure Chagas (Millenium Biotech) | IC/cassette | ST, S, P | 10,6 | 97 |
| SD BIOLINE Chagas Ab Rapid (Standard Diagnostics/Alere) | IC/cassette | ST, S, P | 90,7 | 94 |
| Simple Chagas WD (Operon) | IC/cassette | ST, S, P | 84,9 | 70,7 |
| Serodia Chagas (Fujirebio Inc) | Aglutinación en tarjeta | S, P | 94,2 | 94,7 |
| ImmunoComb II Chagas AB (Orgenics) | EIA | S, P | 97,2 | 94 |
P: plasma; S: suero; ST: sangre total.
Adaptada de Sánchez-Camargo et al.59.
Las técnicas moleculares y la serología son los métodos más utilizados para realizar el diagnóstico etiológico de las infecciones del tracto respiratorio inferior producidas por Mycoplasma pneumoniae. En la actualidad la serología continúa siendo un método muy utilizado para realizar el diagnóstico etiológico y el único con fines epidemiológicos.
Las técnicas de ELISA son las más empleadas en la mayor parte de los laboratorios de microbiología por su sensibilidad, su capacidad de discriminar las respuestas IgM e IgG y su posibilidad de automatización. Los métodos de IQL se han incorporado al diagnóstico con formatos que permiten la realización del ensayo de forma unitaria. Con las técnicas de ELISA la mejor sensibilidad diagnóstica se obtiene con el estudio en paralelo de las muestras obtenidas en fase aguda y convaleciente. En pacientes pediátricos la detección de la IgM específica en una muestra obtenida en la semana siguiente del comienzo de los síntomas es eficaz para el diagnóstico de la infección por M.pneumoniae; en adultos la aparición de IgM es débil y efímera. En niños, la sensibilidad de estos ensayos es variable, oscilando entre el 77 y el 92%, aunque puede ser menor según la presentación comercial elegida60,61. La sensibilidad obtenida con los ensayos de IgM puede variar en función de la técnica de referencia con que se compare, siendo más baja con las técnicas moleculares que con la fijación de complemento. La especificidad de estos ensayos es superior al 95%. Existen formatos en soporte de membrana que permiten detectar IgM de forma cualitativa, son de presentación unitaria y permiten un diagnóstico rápido, con buena sensibilidad (90%) y especificidad (93-96%)62,63. Son útiles como pruebas de urgencia y aplicables en laboratorios con pocas muestras.
La calidad y el diagnóstico serológico rápidoLa aplicación de la norma UNE-EN-ISO 15189:2013, que establece los requisitos relativos a la competencia y calidad de los laboratorios clínicos, garantiza que los ensayos se realicen con dichos criterios. Lo primero a considerar son las características (sensibilidad y especificidad) del ensayo para lograr el objetivo para el que se aplican. En los equipos de los ensayos con marcado CE el fabricante proporciona la evaluación pertinente, aunque cada laboratorio usuario debería establecer las condiciones de funcionamiento propias y verificar que en su aplicación se cumplen las características validadas. Para la acreditación se deben considerar aspectos preanalíticos, analíticos y postanalíticos de las determinaciones. En los ensayos PoC, dado su carácter manual, la principal fuente de error radica en la identificación de la muestra y/o en la emisión de resultados; este problema se minimiza en los ensayos automatizados (siempre que incluyan un sistema automático de identificación de muestras). Uno de los aspectos críticos para la acreditación de los ensayos es la participación en intercomparaciones; para algunos de los marcadores serológicos realizados en los laboratorios de diagnóstico clínico no existen ensayos de intercomparación emitidos con la frecuencia adecuada y que cuenten con la participación de un número suficiente de laboratorios.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.