Las infecciones osteoarticulares son procesos poco frecuentes asociados a un difícil tratamiento medicoquirúrgico y a numerosas complicaciones. Su diagnóstico requiere un abordaje multidisciplinar y la interpretación conjunta de las pruebas radiológicas, de medicina nuclear, de las determinaciones bioquímicas, de los estudios de anatomía patológica y de los resultados microbiológicos. En este sentido, el manejo clínico de estas infecciones requiere un diagnóstico rápido y preciso, que permita instaurar precozmente el tratamiento adecuado para disminuir las complicaciones que se pueden derivar del diagnóstico y tratamiento tardíos. Para ello, es necesario el aislamiento de los microorganismos responsables en cultivo y la determinación de sus patrones de sensibilidad.
El diagnóstico microbiológico de las infecciones osteoarticulares tiene limitaciones encabezadas por la escasa sensibilidad de la tinción de Gram y seguidas por la dificultad de la interpretación de los resultados de los cultivos, sobre todo cuando se emplean medios de enriquecimiento, que por otro lado son necesarios al ser en muchas ocasiones infecciones con baja carga microbiana.
Although infrequent, bone-joint infections are associated with difficult clinical and surgical management and severe complications. Diagnosis of bone-joint infections requires a multidisciplinary analysis of the biochemistry, radiology, nuclear medicine, microbiology, and histopathology results.
Diagnosis must be rapid and correct so that appropriate medical and surgical treatment can be administered and serious complications avoided. Microbiology studies are indispensable when determining the causal agents and their antimicrobial susceptibility patterns.
Microbiological diagnosis of bone-joint infections is limited by the low sensitivity of Gram staining and difficult interpretation of culture results, particularly when enrichment broth is used (low number of microorganisms present in some infections).
Las infecciones osteoarticulares (IOA) engloban distintos tipos de procesos que afectan al hueso de forma primaria, como en el caso de las osteomielitis de origen hematógeno o las artritis sépticas, o bien tras cirugía con o sin implantación de material de osteosíntesis o prótesis articulares. En los últimos años parece haber un descenso de las infecciones primarias del hueso (con excepción de las asociadas a pie diabético o úlceras por presión), mientras que las infecciones asociadas a implantes están aumentando debido, sobre todo, al incremento de procedimientos quirúrgicos asociados a traumatismos o con implantación de prótesis articulares1.
Las IOA requieren un abordaje urgente, ya que sin un tratamiento antimicrobiano optimizado y temprano (asociado o no al tratamiento quirúrgico) pueden dar lugar a importantes complicaciones que afectan la calidad de vida del paciente y que conllevan elevados costes sanitarios, al requerirse tratamientos muy prolongados y numerosas reintervenciones1.
Aunque en general son procesos muy diferentes, tienen en común la necesidad de realizar un abordaje multidisciplinar para llegar a un diagnóstico y tratamiento correcto. En la mayoría de los casos se requiere la evaluación conjunta de pruebas radiológicas, de medicina nuclear, de determinaciones bioquímicas, de anatomía patológica y de los resultados microbiológicos.
Las IOA pueden estar causadas por diferentes tipos de microorganismos, lo que hace difícil la elección de un tratamiento empírico que cubra todas las posibilidades; es decisivo, por tanto, el diagnóstico microbiológico, que culmina con el aislamiento del agente etiológico en cultivo, su identificación y la determinación de su patrón de sensibilidad a los antibióticos2. Sin embargo, hay que tener en cuenta que el diagnóstico microbiológico de las IOA tiene una serie de limitaciones que se comentarán posteriormente.
Consideraciones clínicasArtritis sépticasLa artritis séptica es la infección de la articulación nativa por microorganismos piógenos (fundamentalmente bacterias), que llegan a la articulación por inoculación directa o, con mayor frecuencia, por vía hematógena, que da lugar a la destrucción rápida del espacio articular y por ello requiere un diagnóstico y tratamiento urgente.
Tradicionalmente, se han clasificado en gonocócicas y no gonocócicas, pero esta clasificación ha perdido vigencia al descender los casos de artritis causados por Neisseria gonorrhoeae. Se calcula que tiene una incidencia de 7,8/100.000 personas por año. Puede aparecer en todos los grupos de edad, pero es más frecuente en mayores de 65 años y con factores de riesgo como diabetes, inmunodepresión o anomalías articulares, como la artritis reumatoide. La mortalidad asociada oscila entre el 5–7%, incluso en casos de tratamiento antibiótico correcto, y se asocia sobre todo con el microoganismo causante, principalmente con Staphylococcus aureus.
Las manifestaciones clínicas son muy variables y dependen, como en el resto de las infecciones óseas, de las características del paciente y del microorganismo causante. Los síntomas más frecuentes son fiebre, dolor, calor e inflamación local y restricción de los movimientos de la articulación afectada. Se puede ver afectada cualquier articulación, pero es más frecuente en la rodilla, seguida del hombro y la cadera1.
OsteomielitisSe define como una infección de la cortical, la médula o ambas estructuras del hueso. Aunque existen varias clasificaciones, la más empleada las clasifica en agudas o crónicas según la duración de los síntomas, y en hematógenas, por contigüidad o asociadas a insuficiencia vascular según el mecanismo de la infección3,4.
La osteomielitis hematógena es la forma predominante en niños y afecta a huesos largos, mientras que en adultos la presentación más frecuente es la vertebral. En los últimos años ha disminuido mucho su incidencia5. La osteomielitis por contigüidad, desde un foco infeccioso adyacente o por inoculación directa tras traumatismo o cirugía (con o sin la presencia de implantes), es la forma más prevalente en la actualidad, junto con la osteomielitis asociada a pie diabético5.
Las manifestaciones clínicas de la osteomielitis pueden ser muy variables y dependen del tipo de hueso afectado, del agente causal y del tiempo de evolución. En las osteomielitis hematógenas de los niños es frecuente la fiebre con escalofríos y malestar general con dolor e inflamación de la región afectada. En adultos tiene en general una evolución crónica y presenta síntomas larvados en los que predomina el dolor local con o sin fiebre. En las osteomielitis por contigüidad, la sintomatología suele tener un comienzo agudo en el primer mes tras la inoculación y se presenta con fiebre o febrícula, dolor, supuración o fístula e inflamación de las partes blandas adyacentes.
Infección relacionada con prótesis articularesLas complicaciones asociadas con la implantación de una prótesis articular son poco frecuentes, la principal es la movilización aséptica, seguida de la infección, que es la complicación más grave, ya que requiere tratamientos medicoquirúrgicos largos y complejos asociados a una elevada morbilidad y elevados costes sanitarios6.
En una excelente revisión de las infecciones asociadas con prótesis articulares (IPA)7 se describe que en nuestro país se realizan unas 30.000 artroplastias/año y que la incidencia media de infección es del 3–4%. El riesgo de infección de la prótesis tras presentar una bacteriemia es bajo en general y se ha calculado en un 0,3%; sin embargo, si la bacteriemia es por S. aureus el riesgo se incrementa hasta el 30%.
Se han sugerido distintas clasificaciones de la IPA según la ruta posible de adquisición de la infección (hematógenas, por contigüidad o perioperatorias) y el tiempo de aparición desde la cirugía (precoces, intermedias o tardías), pero la más aceptada es la establecida por Tsukayama et al que tiene sobre todo en cuenta el tiempo de aparición de la infección tras la colocación de la prótesis8 y que las clasifica en:
- •
Infección posquirúrgica precoz: los primeros síntomas de infección aparecen en el primer mes desde la implantación de la prótesis (algunos autores consideran un periodo de 3 meses). Las manifestaciones clínicas aparecen de forma aguda y se caracterizan por inflamación local de la articulación, dolor, infección de la herida quirúrgica con supuración y a veces celulitis y fiebre.
- •
Infección posquirúrgica tardía: aparece de forma crónica después de los dos meses de la cirugía. Los síntomas principales suelen ser el dolor y la movilización de la prótesis. Aparecen de forma larvada, lo que hace más difícil su diferenciación con la movilización aséptica. La fiebre suele estar presente sólo en la mitad de los casos.
- •
Infección hematógena: puede aparecer de forma precoz o tardía y se asocia a una bacteriemia previa que da lugar a una «siembra» del implante. Normalmente da lugar a manifestaciones clínicas agudas.
- •
Infección diagnosticada por cultivos intraoperatorios positivos: se define cuando el paciente llega a la cirugía de revisión de su prótesis sin sospecha clara de IPA, pero los cultivos de las muestras tomadas durante el acto quirúrgico son positivos. Suelen ser infecciones subclínicas y normalmente se descubren cuando ya se ha realizado el recambio de la articulación. En estos casos es muy importante diferenciar si los cultivos son verdaderamente positivos o se deben a una contaminación en la obtención o manipulación de la muestra.
Algunos autores reconocen un tipo de infección intermedia que se produce entre el segundo mes y los dos años después de la cirugía. En este caso, muy posiblemente microorganismos «poco virulentos» llegan a la articulación durante la cirugía, pero sus manifestaciones clínicas se producen de forma tardía.
Infección relacionada con material de osteosíntesisEl uso creciente de diversos tipos de implantes en cirugía osteoarticular (tornillos, placas, clavos intramedulares, fijadores externos, etc.) ha mejorado de forma considerable el tratamiento de múltiples enfermedades del hueso (fracturas, tumores, etc.) y evita muchas de las secuelas asociadas a estas. Sin embargo, su uso ha condicionado la aparición de infecciones relacionadas con estos materiales, con una prevalencia variable entre el 3–25% y distinta gravedad según el tipo de paciente, el tipo de implante y cirugía empleados, su localización y el microorganismo causante de la infección9,10. El porcentaje de infección es lógicamente mayor si se emplean fijadores externos que cuando se emplean fijaciones intramedulares.
El cuadro clínico causado por la infección relacionada con materiales de osteosíntesis varía también en función del material empleado y su localización. Clásicamente, se suele presentar de forma precoz como una infección aguda relacionada con la cirugía (en particular cuando se asocia a fijadores externos). En el caso de las fijaciones intramedulares, el cuadro clínico suele aparecer varias semanas después de su implantación y se manifiesta esencialmente como un fallo en la consolidación de la fractura o en la regeneración de los tejidos blandos relacionados. Los síntomas que se presentan son inflamación de tejidos blandos circundantes, fiebre y escalofríos. La presencia de fístulas que comunican el implante con el exterior es sugestiva de infección.
Un concepto que se ha relacionado con la infección ósea asociada a implantes, tanto prótesis articulares como material de osteosíntesis, es el crecimiento de los microorganismos que los infectan englobados en biopelículas. La presencia de biopelículas es fundamental en la patogenia de este tipo de infecciones y tiene gran importancia a la hora de abordar el diagnóstico microbiológico y el tratamiento medicoquirúrgico11.
Una biopelícula es una comunidad de microorganismos adheridos a una superficie, englobados por una matriz compuesta por material extracelular sintetizado por los propios microorganismos asociada con sustancias procedentes del huésped11. Estas biopelículas tienen una estructura compleja que permite a los microorganismos comportarse como una comunidad interrelacionada y les protege del medio que les rodea, de modo que el tratamiento antibiótico no penetra adecuadamente y no se consigue la erradicación de la infección sin la retirada del propio implante y la biopelícula que lleva adherida12.
La importancia de las biopelículas en el diagnóstico microbiológico de las IOA asociadas a implantes radica, sobre todo, en que suelen ser infecciones en las que los microorganismos se encuentran en recuentos bajos y además adheridos al implante de modo que, para conocer exactamente lo que está ocurriendo en la zona periimplante, no suele ser suficiente la obtención de biopsias de los tejidos que le rodean, sino que suele ser necesaria la separación de los microorganismos mediante sonicación que facilite su recuperación en cultivo12.
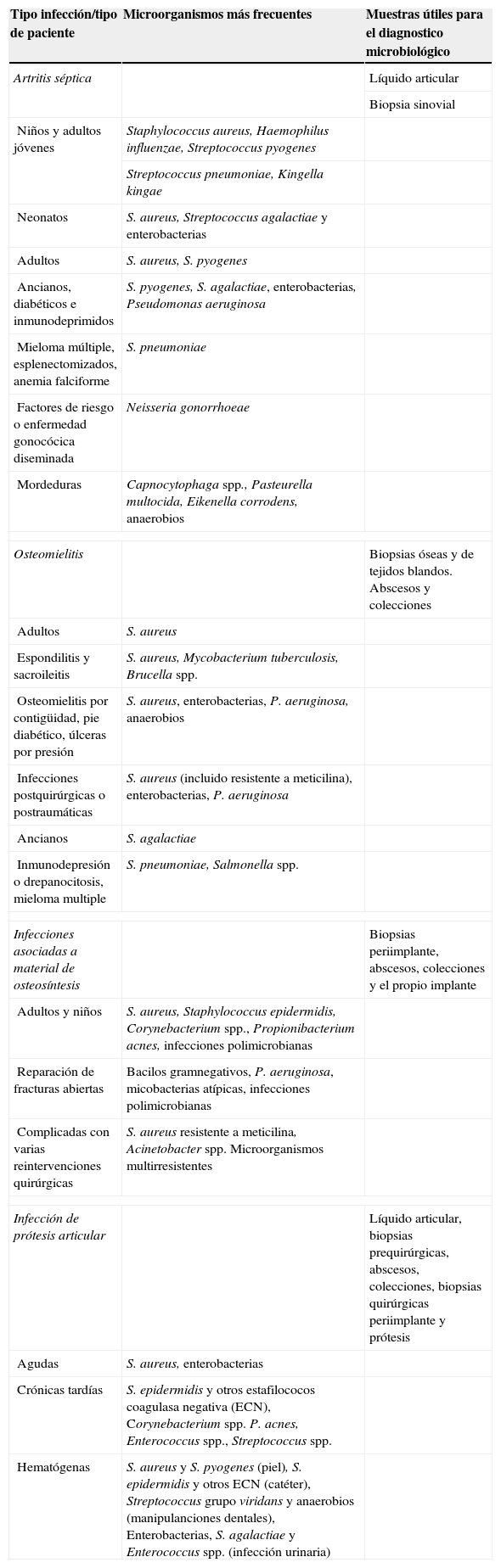
EtiologíaLos principales microorganismos relacionados con los distintos tipos de IOA se describen en la tabla 1.
Microorganismos implicados con mayor frecuencia en los distintos tipos de infecciones osteoarticulares
| Tipo infección/tipo de paciente | Microorganismos más frecuentes | Muestras útiles para el diagnostico microbiológico |
| Artritis séptica | Líquido articular | |
| Biopsia sinovial | ||
| Niños y adultos jóvenes | Staphylococcus aureus, Haemophilus influenzae, Streptococcus pyogenes | |
| Streptococcus pneumoniae, Kingella kingae | ||
| Neonatos | S. aureus, Streptococcus agalactiae y enterobacterias | |
| Adultos | S. aureus, S. pyogenes | |
| Ancianos, diabéticos e inmunodeprimidos | S. pyogenes, S. agalactiae, enterobacterias, Pseudomonas aeruginosa | |
| Mieloma múltiple, esplenectomizados, anemia falciforme | S. pneumoniae | |
| Factores de riesgo o enfermedad gonocócica diseminada | Neisseria gonorrhoeae | |
| Mordeduras | Capnocytophaga spp., Pasteurella multocida, Eikenella corrodens, anaerobios | |
| Osteomielitis | Biopsias óseas y de tejidos blandos. Abscesos y colecciones | |
| Adultos | S. aureus | |
| Espondilitis y sacroileitis | S. aureus, Mycobacterium tuberculosis, Brucella spp. | |
| Osteomielitis por contigüidad, pie diabético, úlceras por presión | S. aureus, enterobacterias, P. aeruginosa, anaerobios | |
| Infecciones postquirúrgicas o postraumáticas | S. aureus (incluido resistente a meticilina), enterobacterias, P. aeruginosa | |
| Ancianos | S. agalactiae | |
| Inmunodepresión o drepanocitosis, mieloma multiple | S. pneumoniae, Salmonella spp. | |
| Infecciones asociadas a material de osteosíntesis | Biopsias periimplante, abscesos, colecciones y el propio implante | |
| Adultos y niños | S. aureus, Staphylococcus epidermidis, Corynebacterium spp., Propionibacterium acnes, infecciones polimicrobianas | |
| Reparación de fracturas abiertas | Bacilos gramnegativos, P. aeruginosa, micobacterias atípicas, infecciones polimicrobianas | |
| Complicadas con varias reintervenciones quirúrgicas | S. aureus resistente a meticilina, Acinetobacter spp. Microorganismos multirresistentes | |
| Infección de prótesis articular | Líquido articular, biopsias prequirúrgicas, abscesos, colecciones, biopsias quirúrgicas periimplante y prótesis | |
| Agudas | S. aureus, enterobacterias | |
| Crónicas tardías | S. epidermidis y otros estafilococos coagulasa negativa (ECN), Corynebacterium spp. P. acnes, Enterococcus spp., Streptococcus spp. | |
| Hematógenas | S. aureus y S. pyogenes (piel), S. epidermidis y otros ECN (catéter), Streptococcus grupo viridans y anaerobios (manipulanciones dentales), Enterobacterias, S. agalactiae y Enterococcus spp. (infección urinaria) | |
En general, entre un 60–80% de los casos están causados por cocos grampositivos principalmente S. aureus y las distintas especies de estreptococos (Streptococcus del grupo viridans, Streptococcus pneumoniae y Streptococcus pyogenes), aunque el tipo de microorganismos que se pueden encontrar depende en gran medida de las características del paciente. Los bacilos gramnegativos aerobios están involucrados en alrededor de un 20–25% de los casos (sobre todo en niños, ancianos, inmunodeprimidos o usuarios de drogas por vía intravenosa). En los últimos años se ha descrito un aumento de casos causados por Kingella kingae diagnosticados mediante métodos moleculares. N. gonorrohoeae suele producir artritis en adultos jóvenes, aunque su incidencia se ha reducido en nuestro país. Las infecciones articulares polimicrobianas y las causadas por anaerobios no son demasiado frecuentes (5–10% y 5%, respectivamente) y suelen ser la consecuencia de un traumatismo o de la extensión de una infección abdominal.
La incidencia de infecciones óseas causadas por Mycobacterium tuberculosis y Brucella spp. ha disminuido en nuestro medio en las últimas décadas. Ambos patógenos pueden producir casos de artritis, sobre todo en niños y pacientes jóvenes.
OsteomielitisComo en el caso de las artritis sépticas, los principales microorganismos que producen infección ósea son los cocos grampositivos, sobre todo S. aureus. En los últimos años se ha registrado un incremento de casos producidos por S. aureus resistente a la meticilina en pacientes con ingresos hospitalarios previos. En general, los estreptococos y los enterococos son poco comunes como causa de osteomielitis o de artritis primaria, excepto S. pneumoniae y Streptococcus agalactiae que se han asociado a osteomielitis en pacientes con mieloma múltiple o drepanocitosis y a infecciones óseas en las edades extremas de la vida y pacientes inmunodeprimidos, respectivamente. Las enterobacterias y Pseudomonas aeruginosa producen generalmente osteomielitis posquirúrgicas o postraumáticas, de evolución crónica o adquisición nosocomial, son frecuentes en las osteomielitis asociadas a pie diabético y en las que afectan a los huesos del pie tras heridas punzantes o traumatismos.
Otras bacterias, como Brucella spp., M. tuberculosis y Salmonella spp., son poco frecuentes en la actualidad. Las primeras suelen causar espondilodiscitis crónicas en adultos y Salmonella spp. se suele presentar en pacientes con inmunodepresión o drepanocitosis.
La osteomielitis por anaerobios se considera poco frecuente y habitualmente aparece en infecciones polimicrobianas. Suele afectar huesos de la cara, pie diabético o encontrarse en lesiones asociadas a mordeduras o úlceras por presión. Es posible que la prevalencia de las bacterias anaerobias en la infección ósea no esté bien estimada debido a una incorrecta toma y procesamiento de las muestras.
Infecciones asociadas con material de osteosíntesisLos microorganismos que causan este tipo de infecciones suelen ser los comensales habituales de la piel (Staphylococcus spp., Propionibacterium spp., Corynebacterium spp., etc.), pero también pueden aparecer microorganismos procedentes del medio ambiente, en particular en el caso de reparación de fracturas abiertas (bacilos gramnegativos no fermentadores, micobacterias atípicas, etc.). En aquellos casos que requieren reintervenciones o ingresos prolongados pueden aparecer patógenos nosocomiales, como es el caso de S. aureus resistente a la meticilina, P. aeruginosa o Acinetobacter spp. Es de destacar la elevada frecuencia de infecciones polimicrobianas, en comparación con otros tipos de infecciones óseas, como las asociadas a prótesis articulares.
Infección de prótesis articularEn principio, casi cualquier microorganismo puede causar una IPA. El tipo de microorganismos asociados varía en función del tipo y localización de la prótesis, del tiempo transcurrido desde la cirugía de implantación y de los factores de riesgo del paciente.
En general, hay un claro predominio de los cocos grampositivos y, dentro de ellos, de los estafilococos, que causan alrededor del 60% de los casos (30–40% los estafilococos coagulasa negativa y 12–23% S. aureus). Los estreptococos, los enterococos y los bacilos gramnegativos (incluida P. aeruginosa) representan en torno al 10% de los casos. La proporción de anaerobios es baja (2–4%), siendo el principal Propionibacterium acnes. Se ha descrito que cerca de un 10% son infecciones mixtas y en el 11% de los casos sorprendentemente no se aísla ningún microorganismo en cultivo13. En las infecciones hematógenas la bacteriemia que da lugar a la infección de la prótesis puede tener un origen en la piel (S. aureus y S. pyogenes), en catéteres (Staphylococcus epidermidis), en infecciones o manipulaciones odontológicas (Streptococcus del grupo viridans y anaerobios) o en infecciones urinarias o gastrointestinales (Escherichia coli, Enterococcus spp., S. agalactiae, y anaerobios).
Las IPA causadas por otro tipo de bacterias, hongos o micobacterias son más raras. El bajo porcentaje de bacterias anaerobias y la elevada proporción de casos en los que no se obtiene ningún microorganismo son muy posiblemente, el reflejo de las limitaciones de los métodos microbiológicos empleados en los distintos trabajos o el reflejo de que la toma de muestras se ha realizado durante el tratamiento antibiótico.
Diagnóstico microbiológicoLa obtención de una muestra de calidad es el paso inicial del que va a depender la calidad de los resultados microbiológicos que se obtengan. La toma y manipulación de las muestras se debe realizar siguiendo las recomendaciones estándar14. La manipulación de este tipo de muestras en el laboratorio implica el cumplimiento de las normas generales de calidad que se emplean para el manejo de muestras ordinariamente estériles14.
A la hora de abordar el diagnóstico microbiológico de las IOA, existen una serie de limitaciones que hay que tener en cuenta2. 1) Es fundamental evitar la contaminación de las muestras con la microbiota de la piel. Muchos de los microorganismos comensales de la piel pueden ser causa de este tipo de infecciones, sobre todo si están asociadas a implantes. 2) La tinción de Gram es por el momento el único método microbiológico de diagnóstico rápido, pero tiene muy baja sensibilidad, aunque gran especificidad. 3) Los resultados de los cultivos de los exudados de fístulas no representan la realidad de lo que ocurre en el interior del hueso, sólo han demostrado tener cierto valor en las osteomielitis causadas por S. aureus15. En caso de utilizarse, se deben obtener las muestras mediante la aspiración con aguja y evitar el uso de torundas. Los resultados de los cultivos de fístulas deben interpretarse con precaución. 4) Sólo un bajo porcentaje de las IOA son bacteriémicas (excepto en las osteomielitis hematógenas), por tanto, la utilidad del hemocultivo es limitada, aunque lógicamente se sigue recomendando su empleo. 5) Los implantes retirados se deben enviar para cultivo en caso de sospecha de infección. No hay recomendaciones claras sobre cómo realizar el cultivo de prótesis y material de osteosíntesis. La ventaja de cultivar los implantes radica en que se analiza directamente del lugar de la infección. Los últimos trabajos publicados han demostrado la utilidad de la sonicación y posterior siembra del sonicado para aumentar el rendimiento de los cultivos al liberar el biofilm que recubre el implante. El principal inconveniente de este método es su laboriosidad y la facilidad de contaminación, que muchas veces está causada por el difícil manejo de los implantes. La interpretación de los resultados de los cultivos debe ser cuidadosa y realizarse considerando los resultados obtenidos para el resto de las muestras del mismo paciente16.
Obtención, transporte y conservaciónA la hora de obtener y conservar las muestras que se van a emplear en el diagnóstico de las IOA se deben seguir normas microbiológicas convencionales14 con algunas consideraciones. 1) Se debe evitar la recogida de muestras de líquido articular y exudados periimplante con torundas2. 2) En general, todas las muestras se deberían tomar antes del inicio del tratamiento antibiótico y si este ha comenzado se debería interrumpir (si es posible) 2 días antes de la toma de muestras, y en el caso de las IPA hasta 15 días antes. Cuando las muestras se tomen durante una intervención quirúrgica que requiera profilaxis antibiótica ésta se debe posponer, en la medida de lo posible, hasta que se hayan tomado las muestras para cultivo. 3) Las muestras se deben obtener en las mayores condiciones de asepsia posible, realizando una correcta desinfección de la piel y manipulándolas lo menos posible. 4) Las muestras líquidas se deben inocular en un medio de transporte adecuado, como recipientes con medio de transporte de anaerobios (tipo portagerm o similar) o frascos de hemocultivos en el caso de líquidos claros, siempre conservando una alícuota para la tinción de Gram. En el caso de muestras escasas se podrán enviar en la propia jeringa, con el aire extraído, sin aguja y convenientemente tapadas con tapón estéril. 5) Las muestras de biopsias se deben enviar sumergidas en suero salino para evitar la desecación.
El envío de las muestras al laboratorio debe ser inmediato. Su procesamiento se debe realizar lo antes posible y si se tiene que retrasar (máximo 24h) las muestras se deben conservar refrigeradas entre 2–8°C. En el caso de sospecha de infección por N. gonorrhoeae, las muestras se deben inocular inmediatamente en medios selectivos. Las muestras en medio de transporte de anaerobios se deben mantener a temperatura ambiente o en estufa. En ningún caso se pueden congelar las muestras destinadas al cultivo.
Líquido articularLa obtención del líquido sinovial se puede realizar por tres procedimientos: punción y aspiración con aguja (artrocentesis), drenaje por artroscopia o artrotomía (drenaje quirúrgico abierto).
Si se obtiene un volumen suficiente de líquido sinovial se debe transferir al menos 1ml en un tubo con anticoagulante para prevenir la coagulación y facilitar el recuento de leucocitos. Para el estudio microbiológico hay que evitar el uso de anticoagulantes, pero en caso de necesidad son preferibles la heparina sódica o el polianetolsulfonato sódico al EDTA (ácido etilendiaminotetraacético) o al citrato.
BiopsiasLa obtención de biopsias de la membrana sinovial se realiza por artroscopia o artrotomía. La artroscopia es el sistema de elección siempre que sea posible.
Las muestras de biopsia ósea se pueden obtener de forma percutánea o mediante cirugía abierta. La biopsia abierta es preferible a la percutánea, que debe ser guiada por una técnica de imagen. Habitualmente, será el traumatólogo quien obtenga las muestras de biopsias.
Para facilitar la interpretación de los resultados de los cultivos y poder detectar el crecimiento de microorganismos contaminantes es recomendable el envío de más de una muestra, particularmente en las IPA en las que se deben enviar entre 5–6 muestras17. Se debe recomendar al traumatólogo el empleo de diferentes bisturís para cada muestra.
Abscesos y exudados periimplanteEn el caso de los abscesos óseos cerrados pueden no existir signos externos y su punción debe ser guiada por una prueba de imagen.
ImplantesLos implantes retirados en quirófano se deben introducir en contenedores herméticos estériles y se enviarán rápidamente al laboratorio de Microbiología para su cultivo y sonicación, en caso de estar disponible. No se añadirá ningún medio de transporte ni conservante. Dada la dificultad de procesamiento y manejo de algunos implantes, es conveniente ponerse en contacto con el laboratorio de Microbiología.
Criterios de aceptación y rechazoEn general son los considerados para otro tipo de muestras17.
ProcesamientoTodas las muestras deberán procesarse en una cabina de bioseguridad siguiendo las recomendaciones habituales del laboratorio de Microbiología Clínica18.
De forma general, a todas las muestras se les realizará tinción de Gram y se sembrarán para bacterias aerobias y anaerobias. Según la sospecha clínica, el tipo de paciente, el tipo de infección, la cantidad de muestra recibida y las peticiones del servicio solicitante, las muestras se procesarán además para hongos o micobacterias con los métodos adecuados19,20.
Al tratarse en general de infecciones graves y muestras de difícil obtención, es recomendable conservar una porción de las muestras refrigeradas durante unos 7 días por si se necesitan estudios posteriores.
Las muestras de líquido articular se deben centrifugar cuando el volumen recibido lo permita para hacer extensiones para tinciones de Gram, Ziehl-Neelsen, etc., y para la inoculación en los medios de cultivo a partir del sedimento.
Las muestras de biopsias se deben cortar en varios fragmentos en una placa de Petri estéril y se deben homogenizar en un mortero estéril con una pequeña cantidad de solución salina o caldo de enriquecimiento. En el caso de sospecha de infección por hongos filamentosos se deben cortar las muestras en pequeños fragmentos que se colocarán directamente en los medios de cultivo para hongos (sin trituración). Las extensiones para tinciones pueden realizarse mediante impronta sobre el porta o bien a partir de la muestra homogeneizada.
Las muestras muy pequeñas y las biopsias óseas duras pueden inocularse directamente en caldos de enriquecimiento.
Las muestras recibidas en recipientes para anaerobios se extraerán con jeringa previa desinfección del tapón con povidona yodada. Se deberá tener la precaución de no introducir aire en el recipiente.
El procesamiento de implantes es más complejo, se debe añadir en el contenedor una cantidad variable de tampón PBS estéril, nunca superior a 400ml ni inferior a 50ml. El contenedor se cerrará herméticamente y se introducirá en un sonicador de baño con agua destilada estéril suficiente para cubrir el recipiente, sin que éste llegue a flotar. Una vez introducido, se sonicará la muestra a 40kHz durante 5min. Tras retirar la muestra, se centrifugará el sonicado a 3.000×g durante 20min. Posteriormente, se decantará el sobrenadante y el sedimento se resuspenderá en 1/10 del volumen centrifugado de PBS estéril. Una vez resuspendido, se procederá a la siembra del mismo de forma cuantitativa. Los laboratorios que no disponen de sonicador pueden realizar una siembra similar tras agitación del recipiente en un «vortex» durante 5min.
Medios de cultivo y condiciones de incubaciónLa inoculación directa de las muestras de líquido sinovial, homogenizados de biopsias y exudados debe realizarse en medios sólidos convencionales para bacterias aerobias (agar sangre, agar chocolate), anaerobias (agar Brucella o agar Schaedler) y medios selectivos para aislamiento de bacilos Gram negativos (agar McConkey o similar). Si se considera necesario y hay muestra suficiente se sembrarán también medios selectivos para estreptococos (CNA agar sangre-colistina-nalidixico. Además, se inoculará un medio caldo de enriquecimiento tipo BHI (brain-heart-infusion), TSB (tryptone-soya-broth) o tioglicolato.
Las botellas de hemocultivos inoculadas con líquidos articulares se introducirán en el sistema automatizado que disponga cada laboratorio.
Para el cultivo de N. gonorroheae se inoculará además una placa de medio Thayer-Martin y se incubará en atmósfera con 5% de CO2.
Las temperaturas y atmósferas de incubación serán las convencionales para cada tipo de medio de cultivo17.
El tiempo de incubación de las placas será de 2–7 días y el de las botellas de hemocultivo y los caldos de enriquecimiento de 7–10 días. En caso de sospecha de microorganismos de crecimiento lento, este período se alargará convenientemente.
Precauciones e interpretación de resultadosDado que todas las muestras que se procesan para el diagnóstico de la IOA proceden de sitios habitualmente estériles, se debe dar valor a cualquier microorganismo que se visualice en la tinción de Gram. Se debe visualizar la extensión completa ya que en este tipo de infecciones los microorganismos suelen estar en cantidades bajas. Si se visualizan microorganismos que se considera que no pueden crecer en los medios habituales se añadirán los medios de cultivo adecuados para su crecimiento. Se valorará la presencia de leucocitos polimorfonucleares que indican la presencia de reacción inflamatoria.
Se comprobará diariamente el crecimiento de microorganismos tanto en los medios sólidos como líquidos. Si se observa crecimiento en los medios sólidos se intentará realizar una identificación presuntiva del microorganismo aislado mediante tinción de Gram, catalasa, staphslide, etc., y si se considera relevante se avisará al clínico del hallazgo. En IOA es muy importante una evaluación minuciosa de los cultivos, buscando diferentes morfotipos, sobre todo en el caso del aislamiento de posibles contaminantes de la piel (S. epidermidis, estafilococos coagulasa negativa, etc.). Se procurará realizar una interpretación conjunta de todas las muestras del mismo paciente. Si se obtienen cultivos mixtos se realizarán los subcultivos necesarios para obtener los microorganismos en cultivo puro. Si no hay crecimiento se reincubarán todas las placas.
En muestras de pacientes portadores de implantes se deben valorar como significativos los aislados de microorganismos que en otras circunstancias se considerarían como microbiota normal de la piel (S. epidermidis, estafilococos coagulasa negativa, Corynebacterium spp., P. acnes, Streptococcus del grupo viridans, etc.). En otro tipo de muestras se deben considerar como causantes de la infección si se aíslan en cultivo puro. La interpretación de su papel en la infección dependerá en gran medida de los resultados de otras muestras del mismo paciente.
Tanto si hay crecimiento en las placas de cultivo primario como si no hay crecimiento y el caldo está turbio, se realizará tinción de Gram y según los microorganismos que se observen se realizarán subcultivos en los medios generales y selectivos adecuados para su aislamiento. Cuando las muestras se han inoculado sólo en caldos de enriquecimiento, es conveniente realizar al final del periodo de incubación un pase «de salida» a medios sólidos, aunque no se haya observado turbidez. En la valoración de los cultivos negativos se debe tener en cuenta la posibilidad de que el paciente haya recibido tratamiento antibiótico previo a la obtención de la muestra.
Se identificarán todos los aislados y se realizarán las pruebas de sensibilidad a los antibióticos según los medios disponibles en cada laboratorio. Si se registra aparentemente crecimiento del mismo microorganismo en distintas muestras del mismo paciente se realizará la identificación y pruebas de sensibilidad a todos ellos, para facilitar la interpretación del papel de los microorganismos aislados en la infección, especialmente en muestras de pacientes portadores de prótesis articulares21. En los microorganismos anaerobios no suele estar recomendada la realización de pruebas de sensibilidad a todos los aislados.
Los cultivos de los implantes se deben interpretar de forma cuantitativa16,17.
Se recomienda guardar las placas de la siembra directa hasta que se tengan los resultados definitivos del cultivo, por si fuera necesario realizar pruebas adicionales.
Se informarán todos los microorganismos presentes en la tinción de Gram, siempre que las muestras hayan sido recogidas y conservadas convenientemente. La presencia de leucocitos polimorfonucleares se podrá informar como escasa, moderada o abundante (no se realizan tinciones cuantitativas).
Cualquier información sobre los cultivos que pueda tener significado clínico y pueda reconducir la actitud terapéutica debe ser notificada con la mayor rapidez posible al clínico responsable del paciente mediante informes provisionales escritos o telefónicos.
Antes de emitir los informes de resultados se tratará de evaluar de forma conjunta los resultados de todas las muestras de un mismo paciente, sobre todo en caso de sospecha de IPA. Se tendrán en cuenta los resultados de la tinción de Gram y su concordancia con los resultados de los cultivos. Se considerará si el mismo microorganismo (biotipo y antibiotipo) está en más de una muestra. En el informe de resultados deberán constar todos los microorganismos aislados y la sensibilidad a los grupos de antibióticos que determine cada laboratorio.
Los aislados pertenecientes a la microbiota normal de la piel (Corynebacterium, estafilococos coagulasa negativa, etc.) se informarán como flora de contaminación cutánea en el caso de muestras de pacientes con artritis séptica y osteomielitis. En el caso de infecciones asociadas a implantes se informarán siempre con su sensibilidad a los antibióticos y se destacará si su aislamiento se ha realizado solamente en el caldo de enriquecimiento y si se han aislado únicamente tras cultivo prolongado.
Observaciones y procedimientos no aceptablesEl laboratorio debe ser estricto en la valoración microbiológica de los aislados que pueden formar parte de la microbiota de la piel o ser contaminantes y con el modo en que se emite la información de los resultados de los cultivos. De un modo muy general, un informe con el aislamiento e identificación y determinación de la sensibilidad a los antimicrobianos de uno o más microorganismos se suele interpretar como diagnóstico de infección, lo que puede provocar que se administre tratamiento antimicrobiano innecesariamente. Se debe tener especial cautela con los resultados de los cultivos de los implantes.
Si sólo se remiten botellas de hemocultivos inoculadas con líquido articular no se podrá realizar la tinción de Gram. La interpretación de los resultados de los cultivos de muestras de biopsias periprotésicas es difícil si no se envían al menos 3 muestras21. Se desaconseja rotundamente la toma de líquido articular y exudados periprotésicos con torundas (mayor contaminación, volumen insuficiente de muestra para los cultivos, inhibición de ciertos patógenos y menor supervivencia de las bacterias)2. No está indicado el procesamiento de muestras obtenidas a través de tubos de drenaje colocados durante más de 2 días, por la gran probabilidad de contaminación con la microbiota de la piel. No se deben procesar las muestras remitidas con conservantes tipo formol.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.