Mujer de 38 años que consulta por dolor abdominal y fiebre. Había sido usuaria de drogas por vía parenteral (UDVP) y tenía una infección por VIH (nadir de linfocitos CD4: 22 cél/μl, [2,44% de linfocitos totales]). Cinco años antes fue diagnosticada en otro hospital de neumonía por Pneumocystis jiroveci, sarcoma de Kaposi, leishmaniasis cutánea e infección pulmonar por Mycobacterium fortuitum, que se resolvieron con tratamiento. No había seguido profilaxis secundaria de leishmaniasis. Estaba en tratamiento con RGV (400mg vo/12h), TDF (245mg vo/24h) y FTC (200mg vo/24h) y, desde un año antes de la consulta, tomaba prednisona (10-15mg/día) e hidroxicloroquina por poliartritis simétrica seronegativa.
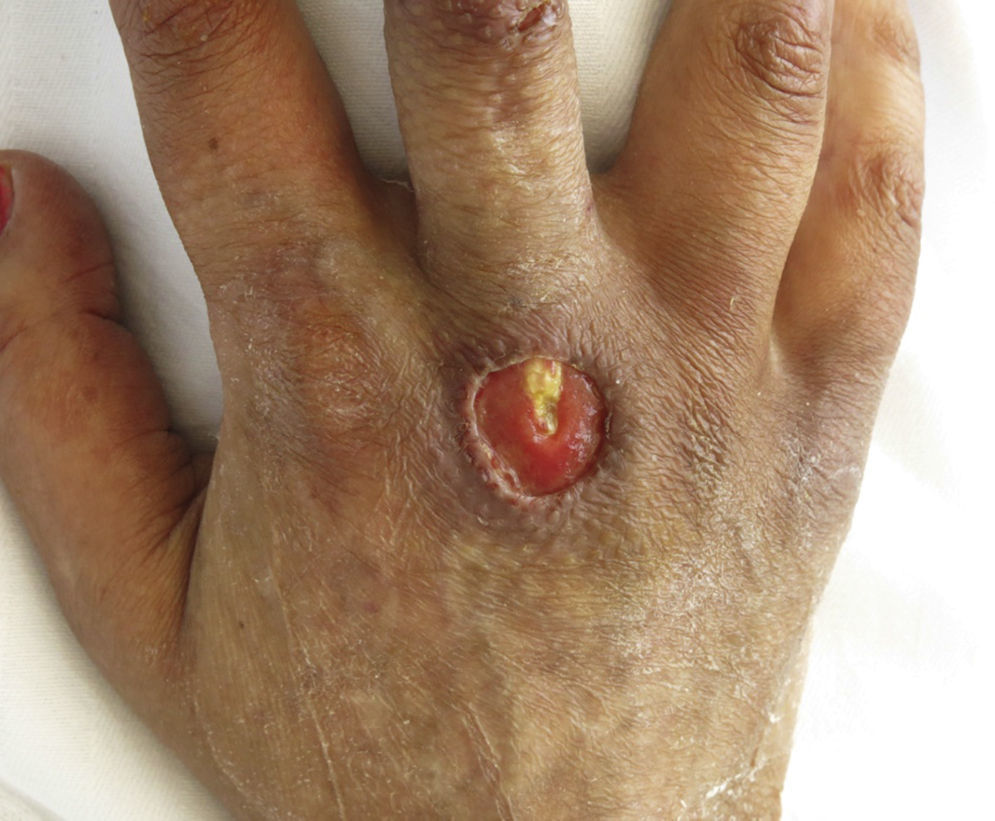
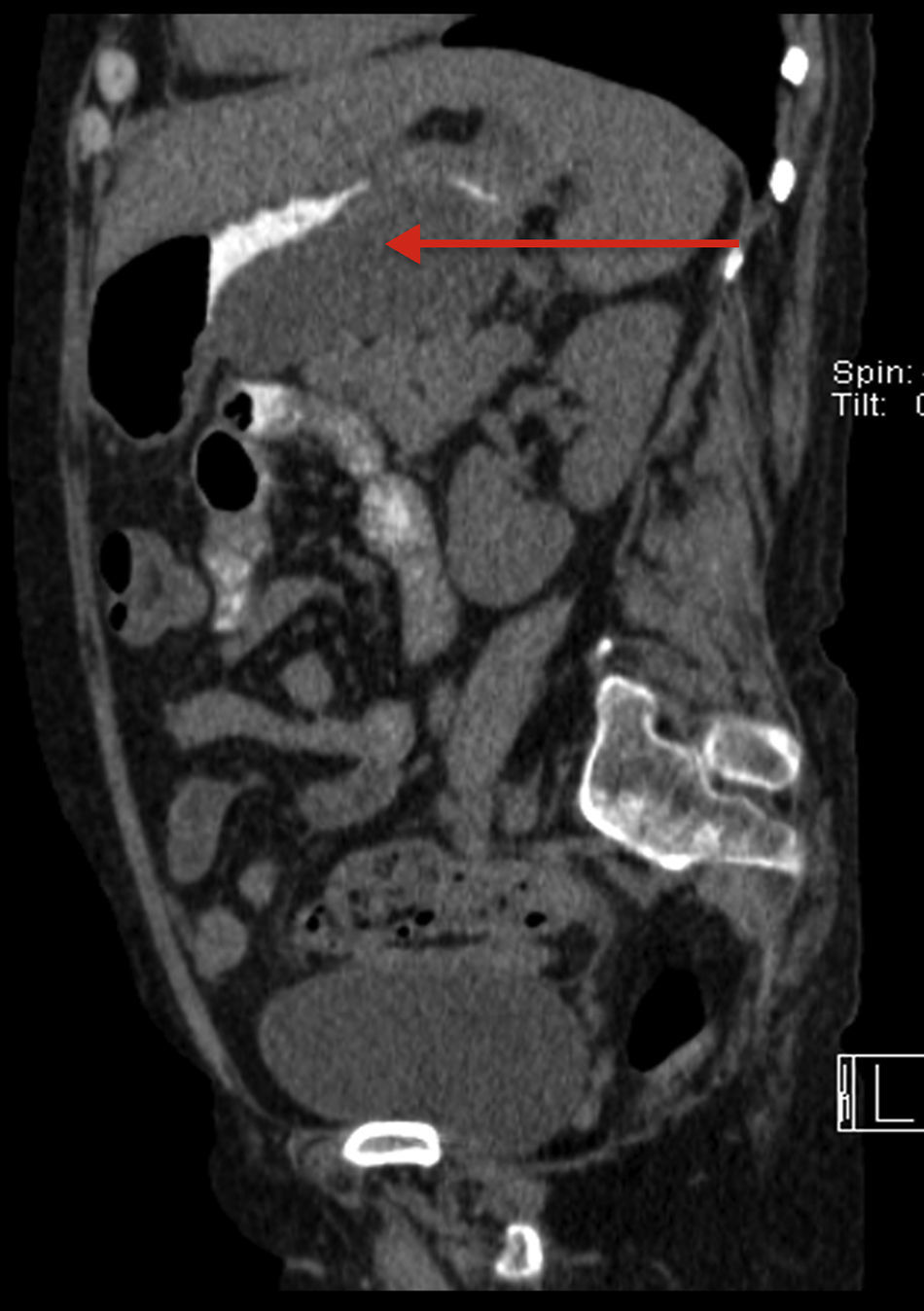
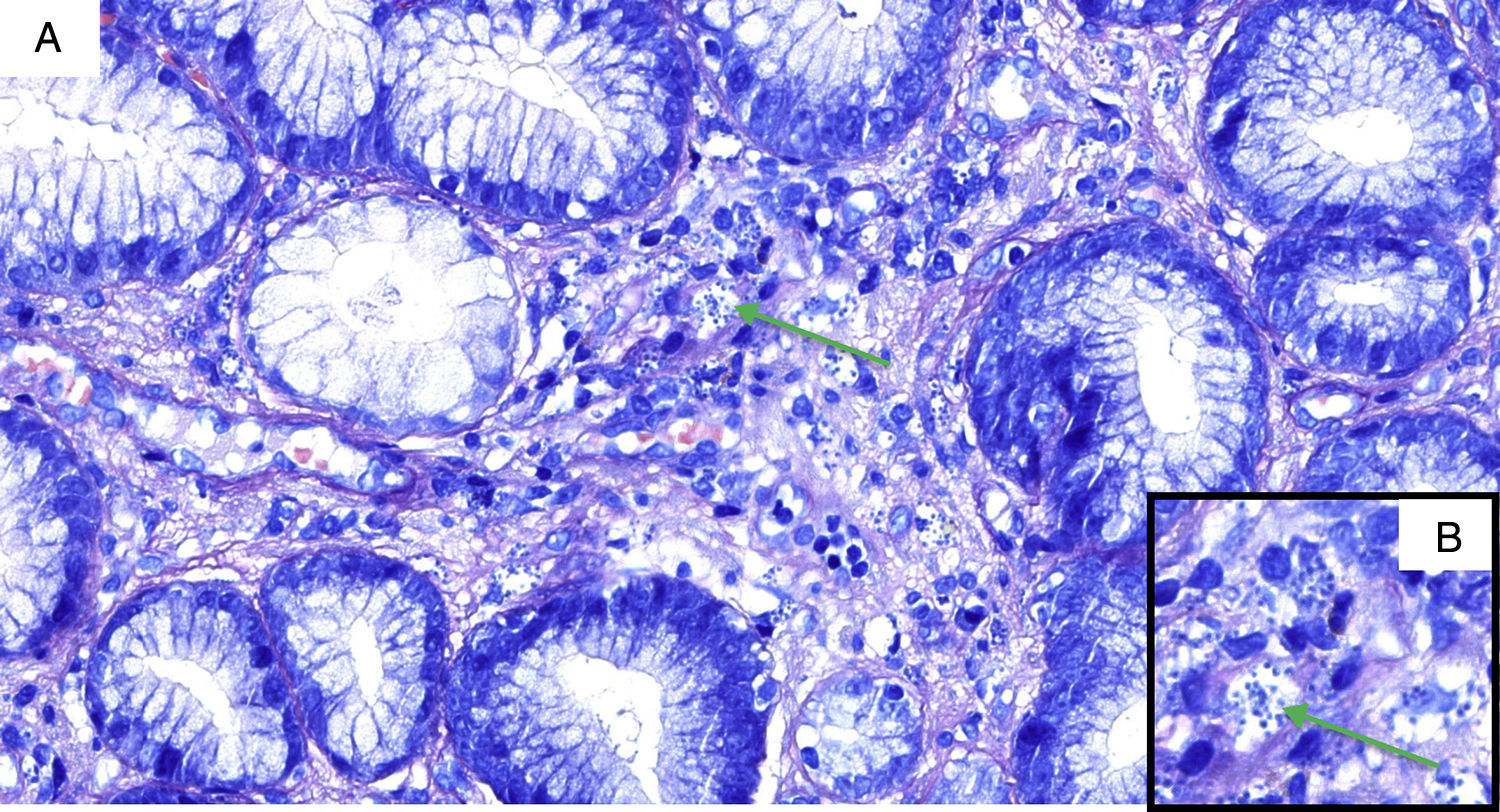
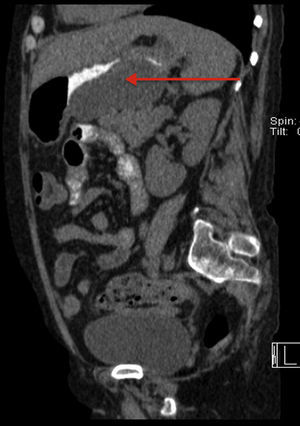
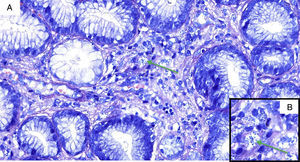
El cuadro comienza un mes antes de ingresar con dolor en epigastrio que empeora con la ingesta, náuseas y vómitos, seguido de fiebre alta. En la exploración física: T.ª 38,5°C, tiene rasgos cushingoides, se observa una úlcera sobre cabeza de tercer metacarpiano derecho (fig. 1) y presenta dolor a la palpación en epigastrio, sin signos de irritación peritoneal. Entre las determinaciones de laboratorio que se solicitan al ingreso: Hb 9,4g/dl, VCM 101fl, leucocitos y fórmula son normales, y plaquetas 104.000/μl; en el perfil bioquímico general destaca: GOT 70UI/l, GPT 45UI/l, FA 283UI/l, GGT 626UI/l y proteína C reactiva: 31mg/l; amilasa y procalcitonina fueron normales. La carga viral de VIH era de 54 copias/ml y la cifra de linfocitos CD4 de 353cél/μl (20,9%). En un TAC abdominal se visualiza una colección retrogástrica que comprime la curvatura mayor (fig. 2). En la gastroscopia se observa una lesión ulcerada de 1,5cm de longitud. En las biopsias de estómago (figs. 3A y B), piel y médula ósea se identifican amastigotes de Leishmania.
EvoluciónSe pauta tratamiento con piperacilina/tazobactam (4g/500mg iv/6h), que se mantiene durante 15 días y se realiza drenaje percutáneo de la colección abdominal. Tras el diagnóstico de leishmaniasis diseminada, se retiran progresivamente los glucocorticoides y se inicia tratamiento con anfotericina B liposómica (2mg/kg/día, dosis total: 40mg/kg), observándose mejoría de la sintomatología y resolución de la colección intraabdominal. Los hemocultivos y el cultivo del aspirado de la colección fueron negativos para bacterias, micobacterias y hongos. No se realizó serología de Leishmania y en el aspirado de la colección intraabdominal no se realizaron tinciones ni cultivo para Leishmania. Tras el alta se remite al hospital de su lugar de residencia para continuar con el tratamiento.
ComentarioLa leishmaniasis es una enfermedad infecciosa crónica causada por un grupo de protozoos intracelulares del género Leishmania. En la cuenca mediterránea, la especie patógena es Leishmania infantum, el reservorio habitual (huésped principal) es el perro y el vector la hembra del mosquito Phlebotomus1. En UDVP se ha descrito un mecanismo de transmisión artificial, al compartir jeringuillas de pacientes infectados2. Es endémica en algunos países tropicales y de clima templado, subendémica en el sur de Europa y sensible a cambios ecológicos y climáticos: recientemente se ha descrito un brote epidémico en municipios del sur de Madrid, asociado a un nuevo reservorio en lepóridos3 y en las próximas décadas se prevé un aumento de su incidencia en Europa4.
La infección intracelular por el protozoo puede persistir de por vida y, aunque los determinantes de progresión a la enfermedad no están totalmente aclarados, algunos defectos en la respuesta inmune o enfermedades debilitantes desencadenan las manifestaciones clínicas5. La enfermedad se presenta en 3 formas principales: visceral (conocida como kala-azar), cutánea y mucocutánea. La leishmaniasis visceral es letal sin tratamiento y suele cursar con una combinación de fiebre prolongada, hepato-esplenomegalia y pancitopenia1,6; en algunos casos, su sintomatología puede ser confundida con enfermedades autoinmunes7.
Para establecer el diagnóstico de leishmaniasis visceral se requiere la visualización de amastigotes o aislamiento del protozoo por cultivo, de una muestra del órgano afectado (habitualmente bazo, médula ósea y ganglio). Existen varios test serológicos que en presencia de un cuadro clínico compatible sugieren el diagnóstico. También se han desarrollado diversas técnicas moleculares de elevada sensibilidad y especificidad8. El tratamiento de elección en Europa es la anfotericina B liposómica6,9.
La coinfección con VIH incrementa el riesgo de progresión de la forma asintomática a enfermedad activa y la leishmaniasis acelera la progresión de la infección por VIH. En presencia de infección por VIH, la infección por Leishmania tiende a ser más grave, con mayor mortalidad y son más frecuentes las manifestaciones atípicas (afectación cutánea, gastrointestinal, peritoneal y pulmonar), sobre todo, cuando la cifra de linfocitos CD4 es inferior a 200cél/μl. En estos pacientes, las técnicas serológicas tienen menor sensibilidad y el tratamiento se asocia con una elevada tasa de fracasos, mayor toxicidad farmacológica y tendencia a las recidivas. Para mejorar los resultados, los pacientes deben recibir tratamiento combinado anti-Leishmania y antirretroviral; los que presentan recidivas, requieren tratamiento antiparasitario supresor crónico, al menos, hasta una adecuada recuperación inmunológica9–11.
En nuestra paciente, se observa una recidiva de leishmaniasis con manifestaciones atípicas (colección abdominal secundaria a úlcera gástrica perforada), 5 años después del primer episodio, a pesar de conseguir una recuperación inmunológica razonable con tratamiento antirretroviral. Probablemente, la inmunosupresión asociada al tratamiento crónico con glucocorticoides fuera corresponsable de la reactivación clínica del protozoo5.
A los servicios de dermatología, de anatomía patológica y de radiología.