En España algunos pacientes con VIH no reciben tratamiento antirretroviral (TAR), aun teniendo indicaciones para ello. Nuestro objetivo es identificar las barreras de inicio del TAR en pacientes con indicación para recibirlo.
MétodosEncuesta transversal en 19 hospitales en España en 2012, incluyendo todos los pacientes que no recibían tratamiento y tenían al menos una indicación según las recomendaciones de Gesida/2011. Las posibles barreras se agruparon así (categorías no excluyentes): a) el médico considera que la indicación no es absoluta; b) el paciente no quiere iniciarlo; c) el médico considera que debe iniciarlo pero existe alguna limitación o contraindicación; y d) el paciente tiene viremia indetectable en ausencia de tratamiento.
ResultadosSe incluyeron 256 pacientes de los 784 programados; 84% hombres, mediana de edad 39 años; 57% homosexuales, 24% heterosexuales, 16% UDI. Mediana de tiempo desde el diagnóstico: 3 años, CD4: 501 células/mm3, carga viral 4,4 log. Indicaciones de TAR más frecuentes: CD4<500 células/mm3 (48%), pareja sexual no infectada (28%), coinfección con virus de la hepatitis C (23%). Las barreras para el inicio del TAR fueron dependientes del médico en el 55% de los casos, del paciente en el 28%, otras limitaciones: 23%, viremia indetectable: 6%.
ConclusionesLa mayoría de los pacientes con indicación de TAR lo estaban recibiendo. El motivo más frecuente en quienes no lo recibían fue que el médico pensaba que la indicación no era absoluta, y prefería esperar, lo que sugiere la necesidad de enfatizar en los beneficios de iniciar el TAR en estos casos.
In Spain, HIV treatment guidelines are well known and generally followed. However, in some patients there are no plans to initiate ART despite having treatment indications. The current barriers to ART initiation are presented.
MethodsA cross-sectional survey including every HIV infected patient in care in 19 hospitals across Spain in 2012, with ≥1 indication to start ART according to 2011 national treatment guidelines, who had not been scheduled for ART initiation. Reasons for deferring treatment were categorized as follows (non-exclusive categories): a) The physician thinks the indication is not absolute and prefers to defer it; b) The patient does not want to start it; c) The physician thinks ART must be started, but there is some limitation to starting it, and d) The patient has undetectable viral load in absence of ART.
ResultsA total of 256 patients, out of 784 originally planned, were included. The large majority (84%) were male, median age 39 years, 57% MSM, 24% heterosexuals, and 16% IDUs. Median time since HIV diagnosis was 3 years, median CD4 count, 501 cells/mm3, median viral load 4.4 log copies/ml. Main ART indications were: CD4 count <500 cells/mm3, 48%; having an uninfected sexual partner, 28%, and hepatitis C coinfection, 23%. Barriers due to, the physician, 55%; the patient, 28%; other limitations, 23%; and undetectable viral load, 6%.
ConclusionsThe majority of subjects with ART indication were on it. The most frequent barriers among those who did not receive it were physician-related, suggesting that the relevance of the conditions that indicate ART may need reinforcing.
En la actualidad el cuidado de las personas con infección por el VIH se ve cada vez más como un continuum en el que todas las fases del proceso son determinantes para el resultado final que se busca, es decir, la supervivencia y bienestar de los sujetos y el cuidado de la comunidad, minimizando tanto las consecuencias individuales de la infección como la incidencia de casos nuevos y sus implicaciones en el ámbito de la salud pública. Este continuum consta de varias etapas que deben funcionar bien, además de estar bien coordinadas entre sí: acceso y oferta de la prueba, acceso y permanencia en los servicios sanitarios y de consejo y apoyo, acceso y adherencia al tratamiento antirretroviral (TAR) y mantenimiento a largo plazo de la supresión viral y la calidad de vida1. Cada una de estas etapas tiene una serie de puntos críticos y posibles barreras que pueden limitar sus resultados, de manera que, por ejemplo en Estados Unidos en 2010, se estimaba que solo el 28% de todos los adultos con infección por el VIH tenía la carga viral indetectable2.
En cuanto al acceso y adherencia al TAR las barreras principales suelen estar relacionadas con la disponibilidad de un sistema sanitario universal y asequible, punto que en España está resuelto. Sin embargo, incluso teniendo acceso libre y gratuito al TAR, no todos los pacientes que lo requieren lo están recibiendo, o tardan en acceder a él3,4. En España el Grupo de estudio del sida (GeSIDA) y el Plan nacional sobre el sida emiten un documento de consenso sobre el TAR en adultos, que se actualiza anualmente y que es bien conocido y seguido en el ámbito del manejo clínico del VIH. Estas guías detallan, entre otros aspectos, las indicaciones sobre cuándo iniciar el TAR, las opciones/combinaciones preferentes y las alternativas de inicio, las estrategias de simplificación, intensificación u otros cambios, etc. El grado de cumplimiento de estas guías ha sido evaluado en varias ocasiones, encontrándose una gran concordancia entre las recomendaciones expuestas en las mismas y la práctica clínica. Suárez Lozano et al.5 evaluaron el cumplimiento de las guías en la cohorte VACH entre 2003 y 2006, encontrando que la mayoría de los casos se ajustaban a las recomendaciones, y que en el 17% de ellos había alguna discrepancia entre el tratamiento prescrito y el recomendado. Por otra parte, el estudio de El Omeri et al.4, que evaluó el grado de cumplimiento de las guías en la cohorte CoRIS entre 2004 y 2008, encontró que el 18% de los 1.180 pacientes que no recibían tratamiento ya cumplían criterios para iniciarlo. Más recientemente, el estudio PICNIT3, llevado a cabo en 12 hospitales españoles entre 2009-2010 y diseñado para describir las características de los pacientes diagnosticados de infección por el VIH que no reciben TAR, halló que el 26,4% de los 865 sujetos naïve incluidos en el estudio tenían al menos una indicación para iniciar el TAR, pero no lo recibían todavía ni lo tenían programado para la siguiente visita. Ante estos hallazgos, el objetivo de este estudio es investigar las razones por las cuales los pacientes con al menos una indicación de iniciar tratamiento no lo reciben todavía, teniendo en cuenta que en España el acceso al TAR es universal y gratuito para todas las personas que lo necesiten dentro del Sistema Nacional de Salud.
MétodosEl estudio Bridgap es una encuesta transversal, llevada a cabo en 19 hospitales de 5 comunidades autónomas españolas durante 2012. Se invitó a participar a todos los sujetos adultos que cumplieran los siguientes criterios de inclusión: infección por el VIH confirmada, estar en seguimiento activo en el hospital (al menos una visita durante los años 2011-2012), tener al menos una indicación para iniciar el TAR, según las guías de Gesida/Plan nacional sobre el sida de enero de 20116, ser naïve para el TAR y no tener programado iniciarlo en la siguiente consulta. Aquellos pacientes que aceptaron participar firmaron el consentimiento específico. El estudio fue aprobado por el Comité Ético del Hospital de la Santa Creu i Sant Pau (Barcelona). Los centros participantes fueron hospitales universitarios de alto nivel, con amplia experiencia clínica y de investigación, localizados en las comunidades autónomas con mayor número de casos de VIH (Andalucía, Cataluña, Comunidad de Madrid, Comunidad Valenciana y Galicia).
Durante una única visita de rutina al hospital se registró en un cuestionario on-line la información sociodemográfica y clínica de los pacientes, y las indicaciones de tratamiento identificadas en esa visita. Se realizó una encuesta diseñada ad hoc para identificar las razones por las que los pacientes no recibían TAR, según el criterio del médico. Las posibles respuestas estaban clasificadas de la siguiente manera (categorías no excluyentes):
A. El médico considera que la indicación para iniciar el TAR no es absoluta y prefiere esperar (en adelante, barreras del médico).
B. El paciente no quiere iniciar el TAR. Dentro de esta opción las razones que se indagaban eran las siguientes: quiere evitar toxicidades, considera que no es útil, tiene creencias culturales que se lo impiden u otras (en adelante, barreras del paciente).
C. El médico considera que hay indicación para iniciar el TAR, pero existe alguna limitación para hacerlo (en adelante, limitaciones). Las razones podían ser de varios tipos: el paciente no estaba preparado, había barreras lingüísticas o un nivel cultural o intelectual muy bajo, había alguna contraindicación médica para iniciarlo, se estimaba que el paciente probablemente no sería adherente por tener problemas con el alcohol o las drogas, síntomas depresivos u otras comorbilidades psiquiátricas, carecer de apoyo social o familiar u otras razones, o aspectos administrativos, como la existencia de restricciones administrativas o presupuestarias en el hospital.
D. Posible progresor lento o no progresor (long term non progressor o LTNP). Esta categoría se creó a posteriori debido al hallazgo de varios casos de pacientes con carga viral indetectable y recuentos altos de CD4 a pesar de no recibir tratamiento, y dado que podría considerarse que no estaba indicado el TAR. Se incluyeron aquellos pacientes que estaban previamente identificados como LTNP, o que tenían carga viral ≤50 copias/ml en ausencia de tratamiento. Los pacientes incluidos en esta categoría están excluidos de las 3 primeras.
Las indicaciones para iniciar tratamiento contempladas en este estudio son las que proponía GeSIDA/Plan nacional sobre el sida en enero de 20116, según las cuales se recomienda iniciar el TAR en los siguientes supuestos:
- -
Infección sintomática (eventos B o C, independientemente del recuento de linfocitos CD4).
- -
Infección asintomática: iniciar TAR siempre si el recuento de CD4 es inferior a 350cél/μl. Iniciar si está entre 350 y 500 cél/μl, aunque en este caso se puede diferir en determinadas circunstancias, como tener un nivel estable de linfocitos CD4, carga viral baja o poca predisposición por parte del paciente.
- -
Cuando el nivel de linfocitos CD4 es superior a 500cél/μl se recomienda diferir el TAR, excepto cuando hay alguna de las siguientes comorbilidades: cirrosis hepática, hepatitis crónica por virus C, hepatitis B con indicación de tratamiento, CVP>100.000copias/ml, proporción de CD4<14%, edad>55 años, riesgo cardiovascular elevado (>20% en la puntuación de Framingham a 10 años) o nefropatía por VIH.
- -
Parejas serodiscordantes con riesgo de transmisión del VIH.
Se hizo una estimación del tamaño muestral basándose en una prevalencia de las barreras de inicio del 50%, con el fin de maximizar la «n», y con una precisión del 3,5% y un riesgo alfa del 0,05. Con estos parámetros el tamaño muestral previsto era de 784 sujetos. Sin embargo, tras el periodo de reclutamiento programado y debido a que no hubo más sujetos que cumplieran los criterios de inclusión en los hospitales participantes, solo fue posible reclutar a 256 sujetos, con lo que la precisión del estudio, con los mismos parámetros, fue del 6,1%.
Se describen las características sociodemográficas y clínicas de la población, las indicaciones para iniciar tratamiento y las barreras para hacerlo según la indicación. Se presentan los valores absolutos y las proporciones de las variables cualitativas, y la comparación entre hombres y mujeres mediante la Chi cuadrado de Pearson o el test exacto de Fisher, así como las medianas con rangos intercuartílicos de las variables cuantitativas, que se comparan con métodos no paramétricos. Los análisis se realizaron con el paquete estadístico SPSS versión 14,0.
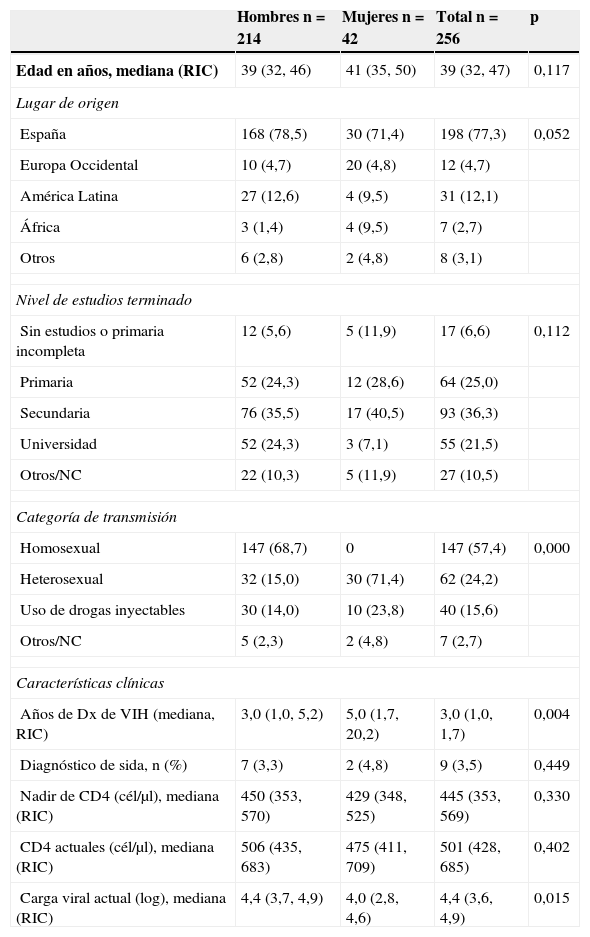
ResultadosSe incluyeron 256 pacientes cuyas características sociodemográficas y clínicas se describen en la tabla 1. La mayoría de los participantes fueron hombres, españoles, con un nivel de educación alto (secundaria o universidad) y con infecciones adquiridas por vía sexual. Aunque las diferencias no siempre alcanzan la significación estadística el perfil de las mujeres es diferente, con una mayor proporción de inmigrantes, un nivel educativo más bajo, mayor proporción de usuarias de drogas inyectables y un mayor tiempo de diagnóstico del VIH.
Características sociodemográficas por sexo
| Hombres n=214 | Mujeres n=42 | Total n=256 | p | |
|---|---|---|---|---|
| Edad en años, mediana (RIC) | 39 (32, 46) | 41 (35, 50) | 39 (32, 47) | 0,117 |
| Lugar de origen | ||||
| España | 168 (78,5) | 30 (71,4) | 198 (77,3) | 0,052 |
| Europa Occidental | 10 (4,7) | 20 (4,8) | 12 (4,7) | |
| América Latina | 27 (12,6) | 4 (9,5) | 31 (12,1) | |
| África | 3 (1,4) | 4 (9,5) | 7 (2,7) | |
| Otros | 6 (2,8) | 2 (4,8) | 8 (3,1) | |
| Nivel de estudios terminado | ||||
| Sin estudios o primaria incompleta | 12 (5,6) | 5 (11,9) | 17 (6,6) | 0,112 |
| Primaria | 52 (24,3) | 12 (28,6) | 64 (25,0) | |
| Secundaria | 76 (35,5) | 17 (40,5) | 93 (36,3) | |
| Universidad | 52 (24,3) | 3 (7,1) | 55 (21,5) | |
| Otros/NC | 22 (10,3) | 5 (11,9) | 27 (10,5) | |
| Categoría de transmisión | ||||
| Homosexual | 147 (68,7) | 0 | 147 (57,4) | 0,000 |
| Heterosexual | 32 (15,0) | 30 (71,4) | 62 (24,2) | |
| Uso de drogas inyectables | 30 (14,0) | 10 (23,8) | 40 (15,6) | |
| Otros/NC | 5 (2,3) | 2 (4,8) | 7 (2,7) | |
| Características clínicas | ||||
| Años de Dx de VIH (mediana, RIC) | 3,0 (1,0, 5,2) | 5,0 (1,7, 20,2) | 3,0 (1,0, 1,7) | 0,004 |
| Diagnóstico de sida, n (%) | 7 (3,3) | 2 (4,8) | 9 (3,5) | 0,449 |
| Nadir de CD4 (cél/μl), mediana (RIC) | 450 (353, 570) | 429 (348, 525) | 445 (353, 569) | 0,330 |
| CD4 actuales (cél/μl), mediana (RIC) | 506 (435, 683) | 475 (411, 709) | 501 (428, 685) | 0,402 |
| Carga viral actual (log), mediana (RIC) | 4,4 (3,7, 4,9) | 4,0 (2,8, 4,6) | 4,4 (3,6, 4,9) | 0,015 |
Dx: diagnóstico; NC: no consta; RIC: rango intercuartílico.
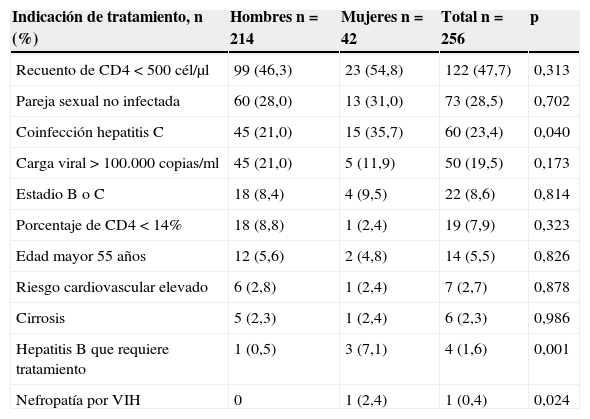
Las indicaciones para iniciar tratamiento en hombres y mujeres se presentan en la tabla 2. Globalmente, la indicación de tratamiento más frecuente en ambos sexos es el recuento de CD4 inferior a 500cél/μl. En los hombres la segunda indicación más frecuente es tener una pareja sexual no infectada, seguida de la coinfección con el virus de la hepatitis C o tener la carga viral superior a 100.000copias/ml. En las mujeres, en cambio, la indicación de tratamiento por coinfección con el VHC ocupa el segundo lugar de frecuencia (35,6%), siendo significativamente más frecuente que en los hombres. El 66% de los pacientes tienen una única indicación de TAR, el 27% tienen 2 indicaciones y el 7% tienen entre 3 y 6 indicaciones de tratamiento.
Indicación de tratamiento por sexo
| Indicación de tratamiento, n (%) | Hombres n=214 | Mujeres n=42 | Total n=256 | p |
|---|---|---|---|---|
| Recuento de CD4 <500 cél/μl | 99 (46,3) | 23 (54,8) | 122 (47,7) | 0,313 |
| Pareja sexual no infectada | 60 (28,0) | 13 (31,0) | 73 (28,5) | 0,702 |
| Coinfección hepatitis C | 45 (21,0) | 15 (35,7) | 60 (23,4) | 0,040 |
| Carga viral>100.000 copias/ml | 45 (21,0) | 5 (11,9) | 50 (19,5) | 0,173 |
| Estadio B o C | 18 (8,4) | 4 (9,5) | 22 (8,6) | 0,814 |
| Porcentaje de CD4 <14% | 18 (8,8) | 1 (2,4) | 19 (7,9) | 0,323 |
| Edad mayor 55 años | 12 (5,6) | 2 (4,8) | 14 (5,5) | 0,826 |
| Riesgo cardiovascular elevado | 6 (2,8) | 1 (2,4) | 7 (2,7) | 0,878 |
| Cirrosis | 5 (2,3) | 1 (2,4) | 6 (2,3) | 0,986 |
| Hepatitis B que requiere tratamiento | 1 (0,5) | 3 (7,1) | 4 (1,6) | 0,001 |
| Nefropatía por VIH | 0 | 1 (2,4) | 1 (0,4) | 0,024 |
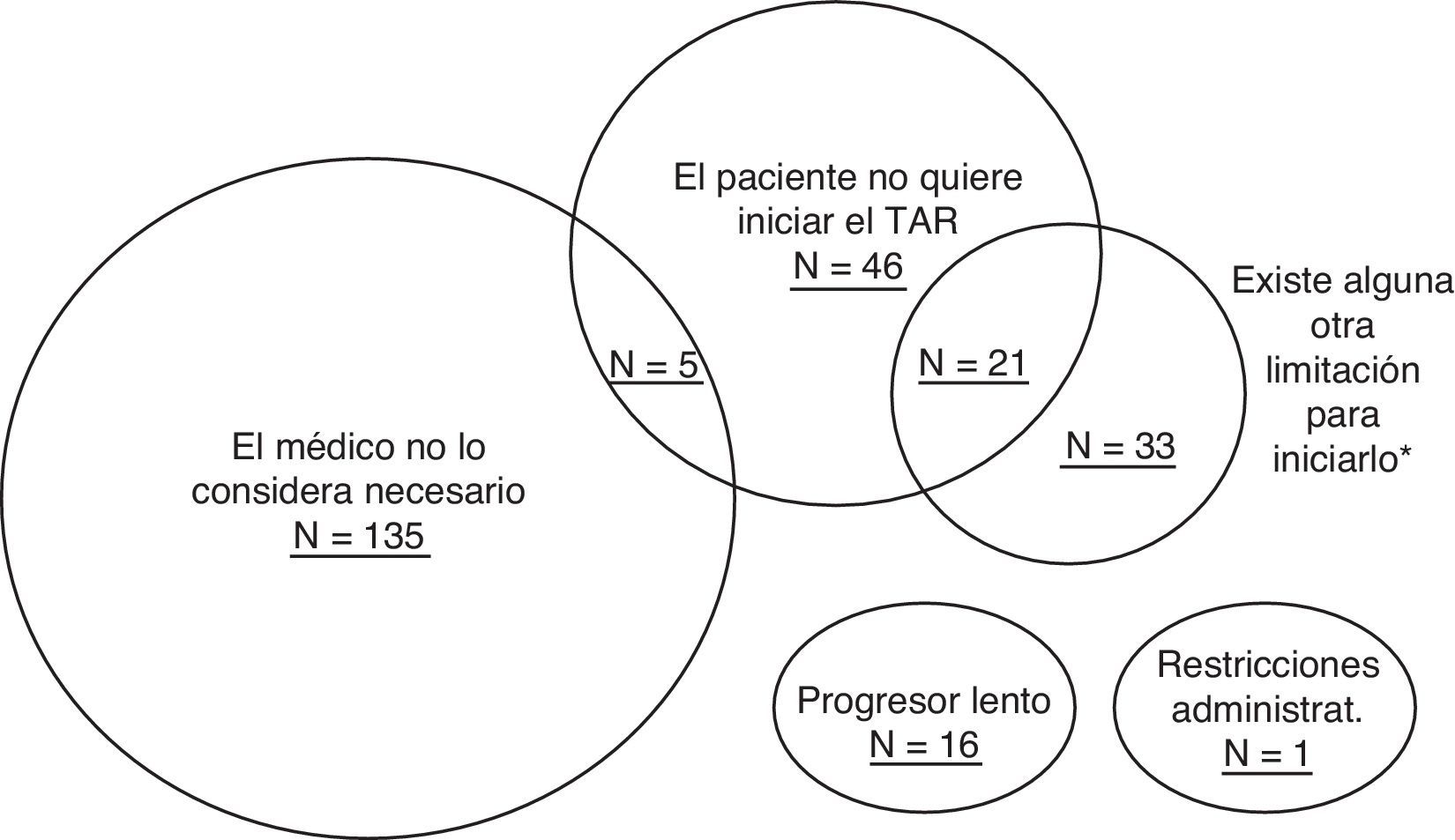
Los motivos de no inicio del TAR se presentan en la figura 1. Se identificaron 16 pacientes que estaban previamente diagnosticados como LTNP, y/o que tenían la carga viral por debajo de 50copias/ml en ausencia de tratamiento. Estos pacientes se describen en una categoría independiente (posibles LTNP), y se excluyen de las demás categorías de las barreras de inicio.
Excluyendo a los posibles LTNP la causa más frecuente de no inicio del TAR es que el médico considera que la indicación no es absoluta y prefiere diferirlo en 140 casos (54,7%). El paciente no quiere iniciar el TAR en 72 (28,1%) casos, en 5 de los cuales el médico tampoco considera que deba iniciarlo. En 54 pacientes el médico considera que hay indicación, pero hay alguna limitación para iniciarlo; 21 de estos pacientes tampoco desean recibir tratamiento.
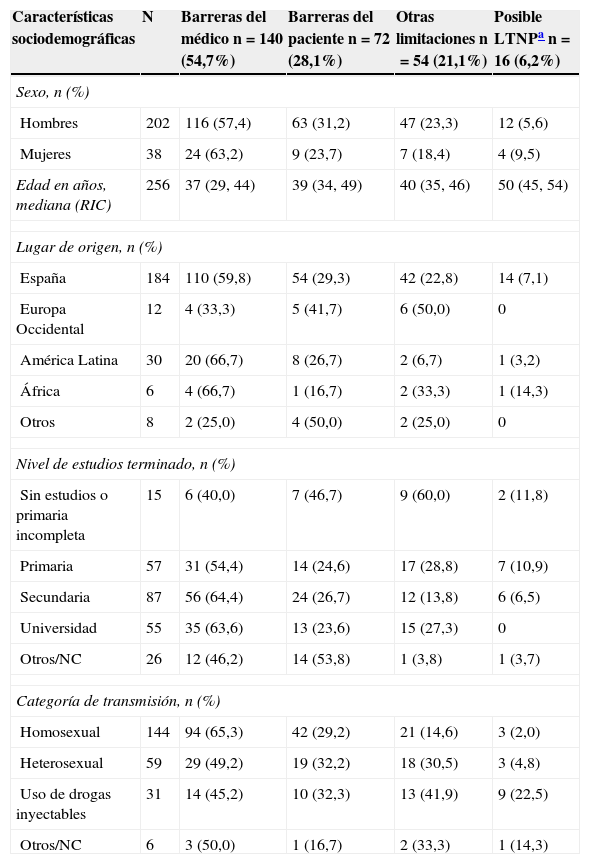
En la tabla 3 se presentan las diferentes barreras de inicio según las características sociodemográficas de los pacientes, y en la tabla 4 según la indicación de tratamiento. La opinión del médico fue la barrera más frecuente en los sujetos con nivel educativo alto y categoría de transmisión homosexual, así como entre quienes tenían como indicación de tratamiento tener pareja sexual no infectada (60,3%), carga viral superior a 100.000copias/ml o infecciones sintomáticas (estadio B o C). Entre los 72 pacientes que no quieren iniciar tratamiento 37 (51%) desean evitar la toxicidad del TAR, 19 (26%) piensan que no es útil, 3 (4%) tienen creencias culturales o religiosas que se lo impiden y 30 (42%) argumentan otros motivos, fundamentalmente el miedo al tratamiento y a lo que este implica para su vida cotidiana.
Barreras al tratamiento según las características sociodemográficas
| Características sociodemográficas | N | Barreras del médico n=140 (54,7%) | Barreras del paciente n=72 (28,1%) | Otras limitaciones n=54 (21,1%) | Posible LTNPa n=16 (6,2%) |
|---|---|---|---|---|---|
| Sexo, n (%) | |||||
| Hombres | 202 | 116 (57,4) | 63 (31,2) | 47 (23,3) | 12 (5,6) |
| Mujeres | 38 | 24 (63,2) | 9 (23,7) | 7 (18,4) | 4 (9,5) |
| Edad en años, mediana (RIC) | 256 | 37 (29, 44) | 39 (34, 49) | 40 (35, 46) | 50 (45, 54) |
| Lugar de origen, n (%) | |||||
| España | 184 | 110 (59,8) | 54 (29,3) | 42 (22,8) | 14 (7,1) |
| Europa Occidental | 12 | 4 (33,3) | 5 (41,7) | 6 (50,0) | 0 |
| América Latina | 30 | 20 (66,7) | 8 (26,7) | 2 (6,7) | 1 (3,2) |
| África | 6 | 4 (66,7) | 1 (16,7) | 2 (33,3) | 1 (14,3) |
| Otros | 8 | 2 (25,0) | 4 (50,0) | 2 (25,0) | 0 |
| Nivel de estudios terminado, n (%) | |||||
| Sin estudios o primaria incompleta | 15 | 6 (40,0) | 7 (46,7) | 9 (60,0) | 2 (11,8) |
| Primaria | 57 | 31 (54,4) | 14 (24,6) | 17 (28,8) | 7 (10,9) |
| Secundaria | 87 | 56 (64,4) | 24 (26,7) | 12 (13,8) | 6 (6,5) |
| Universidad | 55 | 35 (63,6) | 13 (23,6) | 15 (27,3) | 0 |
| Otros/NC | 26 | 12 (46,2) | 14 (53,8) | 1 (3,8) | 1 (3,7) |
| Categoría de transmisión, n (%) | |||||
| Homosexual | 144 | 94 (65,3) | 42 (29,2) | 21 (14,6) | 3 (2,0) |
| Heterosexual | 59 | 29 (49,2) | 19 (32,2) | 18 (30,5) | 3 (4,8) |
| Uso de drogas inyectables | 31 | 14 (45,2) | 10 (32,3) | 13 (41,9) | 9 (22,5) |
| Otros/NC | 6 | 3 (50,0) | 1 (16,7) | 2 (33,3) | 1 (14,3) |
LTNP: long term non progressor; NC: no consta; RIC: rango intercuartílico.
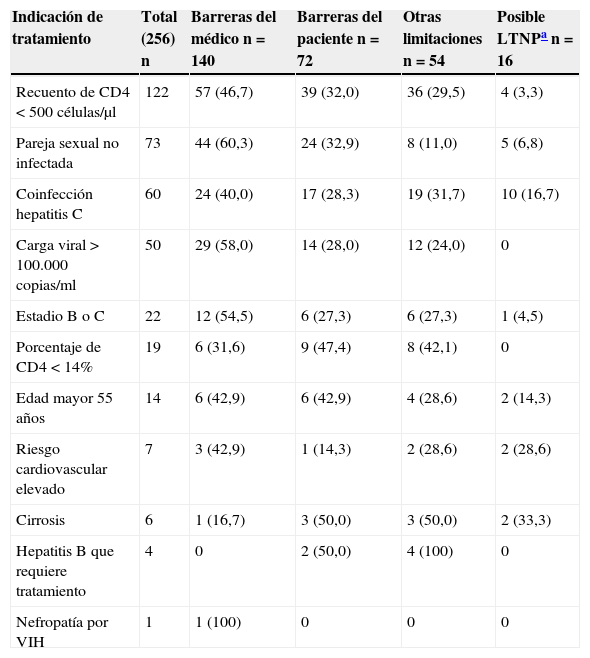
Barreras de inicio de tratamiento según la indicación del mismo
| Indicación de tratamiento | Total (256) n | Barreras del médico n=140 | Barreras del paciente n=72 | Otras limitaciones n=54 | Posible LTNPa n=16 |
|---|---|---|---|---|---|
| Recuento de CD4<500 células/μl | 122 | 57 (46,7) | 39 (32,0) | 36 (29,5) | 4 (3,3) |
| Pareja sexual no infectada | 73 | 44 (60,3) | 24 (32,9) | 8 (11,0) | 5 (6,8) |
| Coinfección hepatitis C | 60 | 24 (40,0) | 17 (28,3) | 19 (31,7) | 10 (16,7) |
| Carga viral >100.000 copias/ml | 50 | 29 (58,0) | 14 (28,0) | 12 (24,0) | 0 |
| Estadio B o C | 22 | 12 (54,5) | 6 (27,3) | 6 (27,3) | 1 (4,5) |
| Porcentaje de CD4<14% | 19 | 6 (31,6) | 9 (47,4) | 8 (42,1) | 0 |
| Edad mayor 55 años | 14 | 6 (42,9) | 6 (42,9) | 4 (28,6) | 2 (14,3) |
| Riesgo cardiovascular elevado | 7 | 3 (42,9) | 1 (14,3) | 2 (28,6) | 2 (28,6) |
| Cirrosis | 6 | 1 (16,7) | 3 (50,0) | 3 (50,0) | 2 (33,3) |
| Hepatitis B que requiere tratamiento | 4 | 0 | 2 (50,0) | 4 (100) | 0 |
| Nefropatía por VIH | 1 | 1 (100) | 0 | 0 | 0 |
LTNP: long term non progressor.
De los 54 casos en que el médico piensa que está indicado iniciar el tratamiento, pero hay alguna limitación para hacerlo, en 41 (76%) se estima que el sujeto no está preparado todavía para iniciar el TAR. En 4pacientes (7%) hay contraindicaciones médicas para el TAR (nefropatía en estudio, pancreatitis aguda, insuficiencia hepática y hepatitis tóxica) y en 18 (33%) se estima que la adherencia no va a ser óptima, fundamentalmente por dependencia alcohólica. En 3 casos (6%) hay problemas lingüísticos que limitan el inicio del tratamiento.
Solo en un caso se encontraron restricciones administrativas para el acceso al TAR (un paciente inmigrante), y no hubo ningún caso identificado como de limitaciones presupuestarias.
DiscusiónEn este estudio analizamos las razones por las que 256 pacientes con infección por el VIH y con indicación de recibir TAR no lo estaban recibiendo, mientras estaban en seguimiento hospitalario en España en 2012. El principal hallazgo se deriva de la imposibilidad para reclutar la muestra diseñada originalmente (784 sujetos), lo que indicaría que la mayoría de los sujetos que tenían indicación de tratamiento en el momento del estudio lo estaban recibiendo, y por tanto que el seguimiento de las guías de tratamiento es en general adecuado en este aspecto.
Entre quienes tenían indicación pero no recibían TAR la indicación más frecuente en nuestro estudio era el recuento de CD4 inferior a 500cél/μl en casi la mitad de los casos. El umbral de CD4 para el inicio del TAR ha ido aumentando en los últimos años, pasando de las 200cél/μl en las primeras guías7 a 350 cél/μl en presencia de comorbilidades en 20088; ya en 20099 se incluyó el umbral de 500cél/μl en presencia de comorbilidades. En 20116 se recomendaba iniciar TAR siempre por debajo del umbral de 500cél/μl, excepto casos muy seleccionados en los que se podía diferir el tratamiento, y en 201310 ya se recomienda iniciar siempre con recuentos inferiores a 500cél/μl. Esta evolución se debe a la creciente evidencia acerca de los beneficios de iniciar el TAR más precozmente para la obtención de una mejor respuesta al tratamiento, la preservación de la función inmunológica, disminución de la morbilidad por eventos definitorios de sida y no-sida tales como la enfermedad cardiovascular, nefro y hepatopatías, complicaciones neurológicas y tumores. Una serie de grandes colaboraciones internacionales de cohortes (ART Collaboration11, NA-ACCORD12, HIV Causal13, CASCADE14), con más de 65.000 pacientes en total, han demostrado los beneficios en términos de morbimortalidad de iniciar el TAR con niveles de CD4 entre 350 y 450/500cél/μl en comparación con recuentos inferiores a 350cél/μl: el riesgo relativo de progresión a sida y/o muerte que han encontrado oscila entre 1,28 y 1,69, con intervalos de confianza estadísticamente significativos. Es posible que esta rápida evolución de las recomendaciones explique que haya pacientes que no han iniciado tratamiento a pesar de tener menos de 500CD4/μl, aunque llama más la atención que haya 29 pacientes (11% del total) que tienen un nivel de CD4 inferior a 350cél/μl, y que en 6 de ellos la razón para no iniciarlo sea que el médico opine que la indicación no es absoluta (datos no presentados). Por otra parte, la dificultad para reclutar la totalidad de la muestra prevista en este estudio también reflejaría el seguimiento de las guías y de sus actualizaciones por parte de los servicios clínicos encargados del cuidado de los pacientes con infección por VIH.
La segunda indicación más frecuente en los pacientes del estudio es tener una relación estable con una pareja no infectada, en el 28% de los casos, aunque es la indicación más frecuente (más del 60% de los casos) cuando la barrera de inicio es que el médico piensa que la indicación no es absoluta. Esta indicación se incluyó en las guías en 2010, y es uno de los temas más candentes en la actualidad, cuando se sabe que la mejor estrategia de prevención de la transmisión es el tratamiento eficaz de las personas infectadas, especialmente en parejas serodiscordantes, con impacto tanto a nivel individual15–19 como comunitario20. El estudio HPTN 05216 se publicó en agosto de 2011 con datos preliminares por recomendación del comité de evaluación, debido a la gran diferencia de transmisiones virológicamente relacionadas entre las ramas. En este gran ensayo clínico internacional de parejas serodiscordantes (n=1.763 parejas), los sujetos se aleatorizaban a recibir TAR precoz (con niveles de CD4 entre 350 y 550 cél/μl) o tardío (cuando el recuento cayera por debajo de 250 cél/μl o hubiera un evento clínico grave), además de recibir consejo preventivo y preservativos. Se documentaron 28 transmisiones entre los miembros de las parejas participantes: una de ellas en el grupo precoz y 27 en el grupo tardío, lo que significa una reducción del riesgo del 96% (HR: 0,04; IC 95%: 0,01, 0,27) atribuible al uso precoz del TAR16. En nuestro entorno se han documentado resultados similares; en la cohorte de 648 parejas serodiscordantes del Centro Sanitario Sandoval17, en Madrid, la prevalencia de infección por VIH en la visita basal en la pareja de personas sin TAR fue de 9,2%, en comparación con 0% en parejas de personas bajo TAR (p<0,001). Durante el seguimiento de 424 parejas hubo 5 casos de transmisión y 50 embarazos entre quienes no recibían TAR y ninguna transmisión y 47 embarazos entre quienes sí lo recibían. Una revisión Cochrane15 de otros 7 estudios en parejas serodiscordantes encontró que el riesgo relativo de transmisión cuando se usaba TAR era de 0,16 (IC 95%: 0,007-0,35), siendo una estrategia claramente protectora. La mayoría de la información sobre parejas serodiscordantes se refiere a parejas heterosexuales, la evidencia sobre parejas homosexuales es más escasa y menos categórica21,22, aunque también apunta a que el TAR precoz tendría un impacto positivo en la transmisión tanto a nivel comunitario20 como individual18.
Aunque el TAR puede relacionarse con toxicidad hepática, por ejemplo hepatitis tóxica aguda, esteatosis, esteatohepatitis, fibrosis hepática o hipertensión portal, en los casos de coinfección VIH-VHC su uso se asocia con una progresión más lenta de la fibrosis y un mejor pronóstico de la función hepática23, por lo que las principales guías de tratamiento del VIH10,24,25 consideran la coinfección como indicación de tratamiento, independientemente del recuento de CD4 o de la gravedad de la hepatopatía. Esta mejoría del pronóstico de la hepatitis parece depender de la disminución de la inflamación intrahepática que se obtiene al tratar el VIH, así como de la mejoría de la función inmune que permite un mejor control de la infección por VHC y una disminución de la fibrogénesis.
Uno de cada 5 pacientes analizados tenía una carga viral de más de 100.000 copias, indicación presente en el 58% de los casos en los que el médico no consideraba necesario iniciar el tratamiento. Si bien la carga viral elevada puede ser un marcador de infección reciente, y puede esperarse que disminuya espontáneamente en muchos casos, también se sabe que es uno de los predictores independientes de progresión de la enfermedad26, como ha vuelto a demostrar el ensayo HPTN 05216, en el que cada incremento de un logaritmo de la carga viral basal implicaba un incremento del riesgo de desarrollo de eventos clínicos del 65% (IC 95%: 1,24-2,20) y para muerte o evento clínico del 60% (IC 95%: 1,21-2,11).
En resumen, se puede concluir que en España el número de pacientes con indicación de tratamiento que no lo reciben no es muy amplio. Entre quienes sí cumplen los criterios de nuestro estudio, en la mayoría de los casos la razón de que los pacientes no recibieran tratamiento podía encontrarse en que el médico no consideraba su indicación como absoluta, a pesar de que en muchos casos se trataba de indicaciones muy bien justificadas por la experiencia y la investigación. La rápida evolución del conocimiento en este campo puede estar en la base de este hallazgo, y justificaría la necesidad de reforzar las recomendaciones oficiales con actividades de educación continuada y discusión activa de las mismas.
FinanciaciónFinanciación recibida de Gilead Sciences.
Conflicto de interesesPompeyo Viciana ha recibido aportaciones de MSD, Abbott, BMS, ViiV, Gilead por participación en asesorías y/o conferencias científicas.
Vicenç Falcó ha recibido honorarios por la presentación de ponencias en diversas reuniones de los laboratorios Gilead, Bristol-Myers-Squibb, Janssen-Cilag, ViiV, Merck, Boehringer.
Ignacio de los Santos ha recibido financiación para participar en charlas a través de Gilead, BMS, Abbott y Janssen.
Bonaventura Clotet ha sido consultor y participado en ensayos clínicos con BMS, Abbott, Gilead, Janssen, Merck (MSD) y ViiV.
Hernando Knobel ha recibido compensación económica por labores de consultoría y charlas de los laboratorios Abbott, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare.
Daniel Podzamczer ha recibido fondos para investigación y/o honorarios por asesorías y/o conferencias por parte de Boehringer Ingelheim, ViiV, BMS, Abbott, Gilead, Janssen y Merck.
Pere Domingo Pedrol ha sido consultor y recibido honorarios por asesorías y/o conferencias de Abbott, BMS, MSD, Gilead Sciences, Janssen & Cilag, Pfizer, ViiV Healthcare, Boehringer Ingelheim, Astra Zeneca, Ferrer Internacional y Theratechnologies.
Manuel Castaño, Julián Olalla, Asunción Hernando y Elisabet Deig declaran no tener ningún conflicto de intereses.
Agradecemos a Ana María Caro-Murillo su ayuda en la redacción del artículo y el análisis de los datos, y a todos los pacientes, médicos, enfermeras y gestores de datos por su participación en el estudio.
Pompeyo Viciana (Hospital Universitario Virgen del Rocío, Sevilla), Vicenç Falcó, Jordi Navarro (Hospital Universitario Vall d’Hebrón, Barcelona), Manuel Castaño (Hospital Universitario Carlos Haya, Málaga), Ignacio de los Santos (Hospital Universitario de la Princesa, Madrid), Julián Olalla, Alfonso del Arco, Javier de la Torre y José Luis Prada (Hospital Costa del Sol, Marbella), Pere Domingo, Mar Gutiérrez (Hospital de la Santa Creu i Sant Pau, Barcelona), Federico Pulido, Asunción Hernando y María Lagarde (Hospital Universitario 12 de Octubre, Madrid), Elisabet Deig (Hospital General de Granollers), Bonaventura Clotet (Hospital Universitario Germans Trias i Pujol, Badalona), Hernando Knobel (Hospital del Mar, Barcelona), Daniel Podzamczer (Hospital Universitari de Bellvitge, L’Hospitalet, Barcelona), María José Galindo (Hospital Clínico Universitario de Valencia, Valencia), Jesús Rodríguez Baño (Hospital Virgen Macarena, Sevilla), José López Aldeguer (Hospital Universitario La Fe, Valencia), Gabriel Gaspar (Hospital Universitario de Getafe, Getafe), Celia Miralles (Hospital CHUVI-Xeral Cíes, Vigo), José Ramón Arribas (Hospital Universitario la Paz, Madrid), Vicente Estrada (Hospital Clínico San Carlos, Madrid), Jesús Sanz (Hospital Universitario Príncipe de Asturias, Alcalá de Henares).