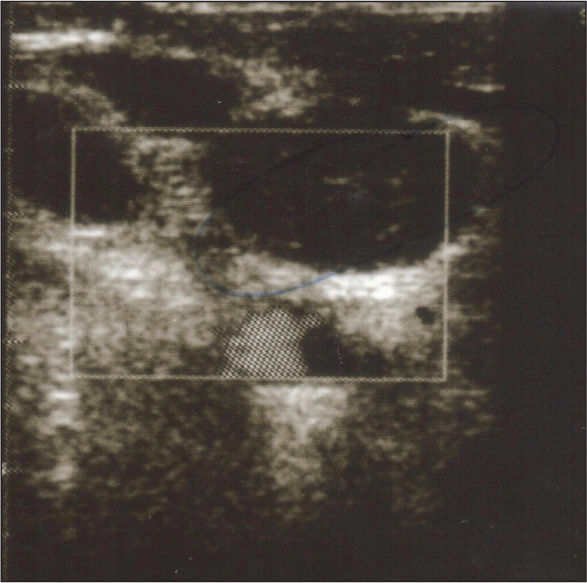
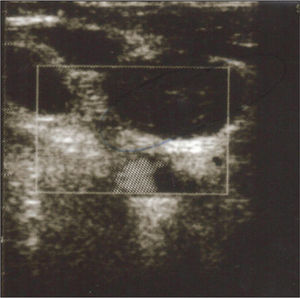
Varón de 71 años sin antecedentes patológicos que ingresó por pancreatitis aguda necrohemorrágica de etiología biliar. Al séptimo día se detectó colonización nasal y bacteriemia, asociada a catéter insertado en vena yugular interna, por Staphylococcus aureus resistente a meticilina (SARM). Se retiró el catéter y se inició vancomicina. A las 72 h, por persistencia de la bacteriemia, se añadió rifampicina. La tabla 1 muestra el resultado de los hemocultivos, el tratamiento y la sensibilidad antibiótica de la cepa. Persistió la bacteriemia por SARM y se documentó resistencia a rifampicina. La concentración inhibitoria mínima (CIM) a vancomicina fue de 2 μg/ml. Se aumentó la dosis de vancomicina a 1,25 g/12 h. Mediante eco-Doppler de vasos de cuello se diagnosticó trombosis suboclusiva de la vena yugular derecha (fig. 1).
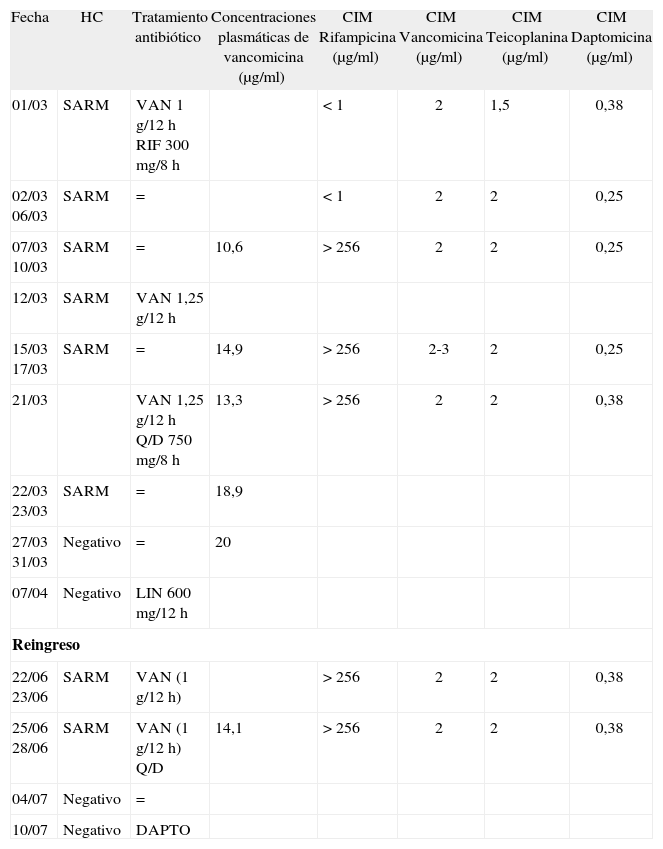
Hemocultivos, tratamiento antibiótico y concentración inhibitoria mínima de la cepa de Staphylococcus aureus resistente a meticilina
| Fecha | HC | Tratamiento antibiótico | Concentraciones plasmáticas de vancomicina (μg/ml) | CIM Rifampicina (μg/ml) | CIM Vancomicina (μg/ml) | CIM Teicoplanina (μg/ml) | CIM Daptomicina (μg/ml) |
| 01/03 | SARM | VAN 1 g/12 h RIF 300 mg/8 h | < 1 | 2 | 1,5 | 0,38 | |
| 02/03 06/03 | SARM | = | < 1 | 2 | 2 | 0,25 | |
| 07/03 10/03 | SARM | = | 10,6 | > 256 | 2 | 2 | 0,25 |
| 12/03 | SARM | VAN 1,25 g/12 h | |||||
| 15/03 17/03 | SARM | = | 14,9 | > 256 | 2-3 | 2 | 0,25 |
| 21/03 | VAN 1,25 g/12 h Q/D 750 mg/8 h | 13,3 | > 256 | 2 | 2 | 0,38 | |
| 22/03 23/03 | SARM | = | 18,9 | ||||
| 27/03 31/03 | Negativo | = | 20 | ||||
| 07/04 | Negativo | LIN 600 mg/12 h | |||||
| Reingreso | |||||||
| 22/06 23/06 | SARM | VAN (1 g/12 h) | > 256 | 2 | 2 | 0,38 | |
| 25/06 28/06 | SARM | VAN (1 g/12 h) Q/D | 14,1 | > 256 | 2 | 2 | 0,38 |
| 04/07 | Negativo | = | |||||
| 10/07 | Negativo | DAPTO | |||||
CIM: concentración inhibitoria mínima; DAPTO: daptomicina; HC: hemocultivo; LIN: linezolid; Q/D: quinupristina/dalfopristina; RIF: rifampicina; SARM: S. aureus resistente a meticilina; VAN: vancomicina.
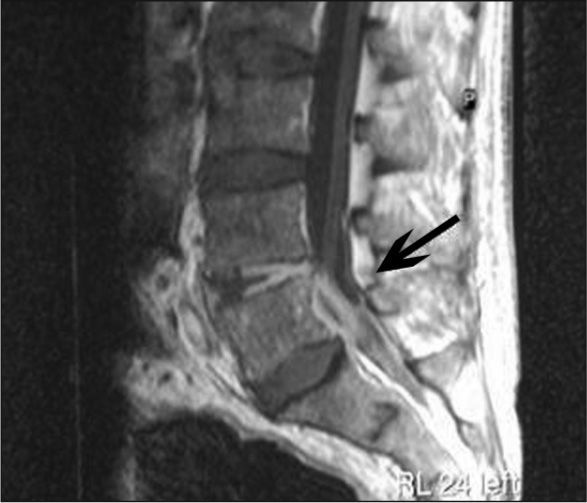
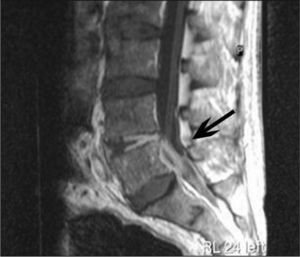
Con diagnóstico de tromboflebitis séptica, se combinó vancomicina y quinupristina/dalfopristina y se realizó trombectomía. Los cultivos de tejido venoso y trombo fueron negativos. Después de 7 días, se negativizaron los hemocultivos. La asociación de vancomicina en dosis altas y quinupristina/dalfopristina (CIM = 0,5 μg/ml) se mantuvo 19 días sin deterioro de la función renal. Continuó tratamiento con linezolid oral (CIM = 1 μg/ml), hasta completar 4 semanas desde los hemocultivos negativos. A las 8 semanas de finalizado el tratamiento, reingresó por bacteriemia por SARM secundaria a espondilodiscitis en L5 y absceso epidural anterior (fig. 2). La bacteriemia persistió 6 días, a pesar de altas dosis de vancomicina y concentraciones séricas adecuadas. Se descartó endocarditis. El perfil de resistencia antibiótica de la cepa era idéntico al episodio previo. Se consideró fracaso terapéutico y se cambió el tratamiento a daptomicina, como uso compasivo, durante 7 semanas desde la negatividad de los cultivos con buena tolerancia y sin alteración de la creatincinasa. La CIM a daptomicina no varió. Se confirmó la identidad clonal de los aislamientos. Al mes se objetivó mejoría de la lesión mediante resonancia magnética y al sexto mes persistió buena evolución clínica.
DiagnósticoBacteriemia persistente por Staphylococcus aureus resistente a meticilina.
ComentariosDestacaremos dos aspectos: uno de índole clínica, como es el tratamiento de la bacteriemia persistente por S. aureus, y otro de índole microbiológica, como es la dificultad relacionada con la resistencia a meticilina en la bacteriemia por S. aureus. La bacteriemia persistente por S. aureus obliga a descartar una complicación metastásica, o un problema local1, como se consideró en este caso, dado que a pesar de los cultivos negativos del trombo no se objetivó la presencia de otro foco infeccioso. La negatividad de estos cultivos puede atribuirse al tratamiento quinupristina/dalfopristina iniciado 72 h previo a la trombectomía. La tromboflebitis supurada es una complicación no infrecuente de la bacteriemia de catéter por S. aureus, que comporta elevada morbimortalidad. El tratamiento de la bacteriemia por SARM plantea una situación compleja; la vancomicina se considera el tratamiento de elección, pero es subóptimo. La probabilidad de fallos terapéuticos es elevada y se incrementa a medida que aumenta la CIM, incluso dentro del rango de sensibilidad2. Para hacer frente a esta situación existen diversas estrategias. El uso de dosis altas de vancomicina, para obtener concentraciones plasmáticas > 15 μg/ml, ha demostrado mejor respuesta terapéutica aún en cepas con CIM = 2 μg/ml, si bien comporta mayor nefrotoxicidad haciendo relevante la monitorización de concentraciones plasmáticas del fármaco3. En nuestro caso, al inicio del tratamiento dichas concentraciones no se midieron; sin embargo, hay que resaltar que es esencial adecuar la dosis de vancomicina según la titulación de éstos. La combinación de vancomicina con otros antibióticos es otra posible estrategia. La rifampicina es un agente antiestafilocócico de primera línea. No obstante, algunos estudios sugieren que la combinación con vancomicina puede tener efectos antagónicos4 y la emergencia de resistencias debido a su variable biodisponibilidad puede aparecer5,6, como en el caso descrito. La experiencia clínica con la asociación de vancomicina y quinupristina/dalfopristina es limitada; in vitro se ha demostrado sinergia frente a SARM7. El aclaramiento de la bacteriemia se consiguió en nuestro caso con dicha asociación antibiótica y la resección del foco. La recaída temprana podría deberse a la duración insuficiente del tratamiento antibiótico del episodio inicial, que fue de 3 semanas. La daptomicina puede ser una alternativa en el tratamiento de la bacteriemia por SARM, especialmente en cepas con sensibilidad alterada a glucopéptidos. La mayoría de las cepas de SARM con CIM a vancomicina ≤ 2 μg/ml conservan la sensibilidad a daptomicina8, si bien se ha descrito la emergencia de resistencia durante el tratamiento antibiótico9. En resumen, este caso ilustra tanto la imperativa necesidad de prevenir la bacteriemia de catéter, como la problemática de la bacteriemia complicada por SARM y la escasa disponibilidad de antibióticos eficaces en esta situación.