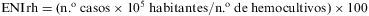la comercialización de la vacuna neumocócica conjugada (PCV-7) ha modificado la epidemiología de la enfermedad neumocócica invasiva (ENI). Nuestro objetivo fue conocer la epidemiología de la ENI antes y después de su uso.
Métodosse incluyeron todas las cepas de Streptococcus pneumoniae causantes de ENI de 2000 a 2006. Se realizó serotipado y antibiograma. Se compararon los datos obtenidos antes (2000–2001) y después (2004–2006) de la comercialización de PCV-7.
Resultadoshubo 241 casos de ENI. Ningún paciente menor de 2 años con ENI estaba vacunado. La cobertura vacunal en menores de 5 años fue del 48%. Hubo un incremento no significativo de ENI en niños (de 53,8 a 57,8 casos por 100.000 habitantes), manteniéndose invariable en adultos. Al corregir la incidencia según el número de hemocultivos, se observó un descenso no significativo, tanto en niños como en adultos. Tras la comercialización de PCV-7 hubo un descenso de los serotipos vacunales y un aumento de los no vacunales. Los serotipos emergentes tras la vacuna fueron: 3, 6A, 15 y 19A. La resistencia a penicilina descendió significativamente (p<0,001) desde el período prevacunal (87,3%) hasta 2003 (13,8%), y posteriormente aumentó (41,7% en 2006). La resistencia a eritromicina no varió durante el estudio.
Conclusionesla incidencia de ENI en menores de 2 años en Gran Canaria no ha disminuido a pesar de la vacuna PCV-7. Los casos debidos a serotipos vacunales han disminuido, así como la resistencia a penicilina. En cambio, han aumentado los casos debidos a serotipos no vacunales emergentes. La estrategia de vacunación universal y la adopción de nuevas vacunas polivalentes podrían potenciar estos efectos.
The introduction of pneumococcal conjugate vaccine (PCV-7) has modified the epidemiology of invasive pneumococcal disease (IPD). Our aim was to investigate the epidemiological features of IPD before and after implementing the use of PCV-7.
MethodsAll invasive Streptococcus pneumoniae strains isolated in our hospital from 2000 to 2006 were included. Serotypes were identified and antibiograms were performed in all cases. Data obtained before (2000–2001) and after (2004–2006) authorization of PCV-7 use in Spain were compared.
ResultsThere were 241 cases of IPD. None of the patients with IPD aged 2 years or younger had received PCV-7. PCV-7 coverage in children aged 5 or younger was about 48%. There was a non-significant increase in the incidence of IPD in children (from 53.8 to 57.8 cases/100 000 population), with no change in adults. When IPD incidence was adjusted by the number of blood samples collected, there was a non-significant decrease in both children and adults. Since PCV-7 came on the market, there has been a decrease in vaccine serotypes and an increase in non-vaccine serotypes. The emergent serotypes since that time include 3, 6A, 15, and 19A. Penicillin resistance decreased significantly (p<0.001) from the pre-vaccine period (87.3%) to 2003 (13.8%), and later rose from 2003 through 2006 (41.7%). Erythromycin resistance showed no changes during the study.
ConclusionsThe incidence of IPD in children aged 2 years and younger in Gran Canaria has not decreased despite the introduction of PCV-7. However, there has been a reduction in the number of cases related to vaccine serotypes and a significant decrease in penicillin resistance. In contrast, non-vaccine serotype IPD cases have increased. Universal vaccination and the use of new polyvalent vaccines may enhance these effects.
Streptococcus pneumoniae es responsable de una gran variedad de síndromes infecciosos. Los más graves se incluyen dentro del grupo denominado enfermedad neumocócica invasiva (ENI), constituido por bacteriemias (asociadas o no a neumonía), meningitis, pleuritis, artritis, peritonitis primarias y pericarditis. Estos procesos presentan una mayor morbimortalidad en las edades extremas de la vida y en pacientes inmunodeprimidos o con determinados procesos crónicos. Las tasas más altas de ENI se dan en niños menores de 2 años, en los que el síndrome más frecuente, la bacteriemia sin foco, puede alcanzar el 70%1. Con el éxito de las vacunas frente a Haemophilus influenzae serotipo b y Neisseria meningitidis serogrupo C, S. pneumoniae se ha convertido en la causa más común de meningitis bacteriana aguda en este grupo de población.
S. pneumoniae presenta hasta 40 serogrupos y 91 serotipos diferentes, de los que únicamente 10 son los causantes del 62% de los casos de ENI2. En la década de los sesenta, a pesar del uso de los antibióticos (penicilina y sulfamidas) y de no existir cepas resistentes a penicilina, la tasa de mortalidad de la ENI alcanzaba cifras en torno al 20%. Esta situación llevó a la necesidad de elaborar una vacuna neumocócica. En 1983 se comercializó una vacuna de 23 serotipos que cubría el 90% de los serotipos causantes de ENI en niños y adultos3. Sin embargo, esta vacuna demostró su utilidad únicamente en pacientes ancianos con neumonía y bacteriemia, con respuestas que oscilaban entre el 50 y el 80% en los países desarrollados4,5. Debido a la ineficacia de esta vacuna en pacientes menores de 2 años, grupo especialmente vulnerable a la ENI, se hizo necesaria la búsqueda de una vacuna alternativa. La obtención de un antígeno constituido por el polisacárido capsular y un transportador proteico capaz de inducir respuesta a las células T helper tipo 2, dio lugar a la aparición, en el año 2000 en Estados Unidos, de una vacuna neumocócica conjugada (PCV-7), constituida por los 7 serotipos más prevalentes en la epidemiología local (4, 6B, 9V, 14, 18C, 19F y 23F) (Prevnar, Wyeth), y se ha descrito hasta un 97% de eficacia en ENI en pediatría6. En junio de 2001 se comercializó en España (Prevenar, Wyeth).
La vacunación universal con PCV-7 en Estados Unidos y Canadá ha demostrado una clara disminución de la incidencia de ENI y otitis media aguda (OMA) en niños7. Asociado al uso de la vacuna se han observado otros fenómenos, como un posible reemplazamiento de los serotipos circulantes en OMA7,8, cambios en la incidencia de ciertos síndromes clínicos graves9, cambio de serotipos en portadores de S. pneumoniae10, disminución de la resistencia antibiótica11 y una posible protección indirecta, denominada «inmunidad de rebaño», en el resto de los grupos de población12. Se puede intuir que el uso a gran escala de la vacuna conjugada podría cambiar la epidemiología y la distribución de serotipos circulantes13.
El objetivo de nuestro trabajo fue conocer en nuestra área geográfica el impacto del uso de la vacuna PCV-7 en la incidencia de ENI, la evolución de los serogrupos y serotipos, la evolución de la resistencia antibiótica en S. pneumoniae, así como la posible protección de la población no vacunada.
MétodosPacientes y cepasEn nuestro estudio se incluyeron todas las cepas de S. pneumoniae (1 por paciente) aisladas a partir de muestras estériles en pacientes con ENI durante el período comprendido entre enero de 2000 y diciembre de 2006. Se revisaron de manera retrospectiva las historias clínicas de los pacientes, recogiendo datos clínicos y epidemiológicos: edad, síndrome, estado de vacunación en el momento de la enfermedad y complicaciones.
El servicio de Microbiología del Hospital Universitario de Gran Canaria Dr. Negrín cubre la asistencia de aproximadamente la mitad de la población adulta de la isla y la totalidad de la población pediátrica. Incluye tanto la demanda de atención primaria como la hospitalizada. Se recogieron los datos poblacionales anuales del área sanitaria a partir del Instituto de Estadística de Canarias (ISTAC), de 2000 a 2006. Se definieron 3 grupos de población: menores de 2 años, menores de 14 años y mayores de 14 años (adultos). Se definió la incidencia de ENI rectificada por hemocultivos (ENIrh) según la fórmula:
Identificación y serogrupadoLa identificación de S. pneumoniae se llevó a cabo por la observación de colonias alfahemolíticas umbilicadas o mucosas en agar sangre y sensibles a optoquina. En casos dudosos se identificó la especie por la determinación de la solubilidad en bilis y la aglutinación con partículas de látex revestidas de antisuero específico (Pneumo-Kit Slidex Test, bioMérieux, Marcy l’Etoile, Francia). El serogrupo se asignó mediante aglutinación con látex con antisueros específicos (Pneumotest-Latex, Statens Serum Institut, Glostrup, Dinamarca). Las cepas pertenecientes a los serogrupos 6, 19 y 23 se remitieron a un laboratorio de referencia para su serotipado. Los serotipos se clasificaron en vacunales (4, 6B, 9V, 14, 18C, 19F y 23F) y no vacunales. Por dificultades técnicas no fue posible realizar serogrupado ni serotipado de las cepas de los años 2002 y 2003. Por lo tanto, a efectos comparativos de la incidencia de la vacuna con respecto a la distribución de serogrupos y serotipos, se ha considerado como período prevacunal los años 2000-2001 y como período posvacunal los años 2004-2006.
Pruebas de sensibilidad antibióticaSe realizó antibiograma por E-test (AB Biodisk, Solna, Suecia) en agar de Müller-Hinton con sangre, para los siguientes antibióticos: penicilina G, cefotaxima, eritromicina, clindamicina, levofloxacino, vancomicina, rifampicina, quinupristina-dalfopristina y linezolid. Se realizó antibiograma por técnica de difusión con discos para cloranfenicol, cotrimoxazol y tetraciclina. Los resultados de sensibilidad se informaron siguiendo los criterios del CLSI14. Las cepas con resistencia a 3 o más antibióticos se definieron como multirresistentes.
EstadísticaLos paquetes informáticos utilizados para los análisis fueron SPSS para Windows (versión 14.0) y Epidat 3.1. Las comparaciones de las proporciones se hicieron mediante la prueba de la χ2 y el test exacto de Fisher. El intervalo de confianza (IC) del 95% de las frecuencias se estimó utilizando la distribución de Poisson. Todos los valores p se obtuvieron desde una comparación a 2 colas. Se consideraron significativos valores de p<0,05.
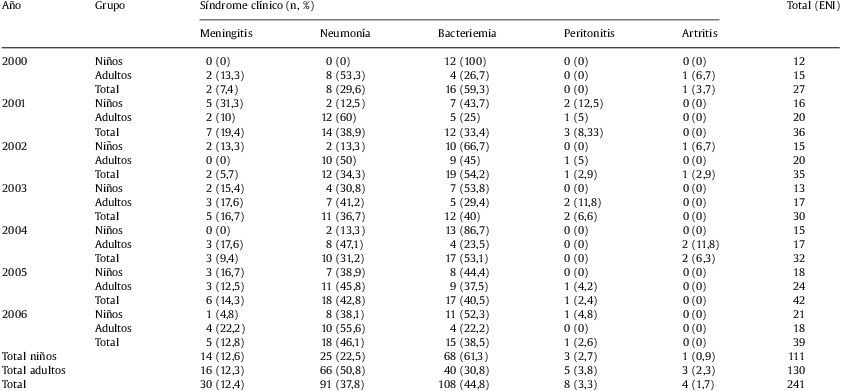
ResultadosEn el período de 7 años estudiados (2000–2006) se documentaron 241 episodios de ENI. Se distribuyeron de la siguiente manera (tabla 1): bacteriemias sin foco (44,8%), que predominaron en la edad pediátrica (63%, 68/108), neumonías con o sin afectación pleural (37,8%), que predominaron en adultos (72,5%, 66/91), meningitis (12,4%), peritonitis (3,3%) y artritis (1,7%). En los últimos 3 síndromes no hubo diferencias entre los 2 grupos. Las tasas más elevadas de incidencia de ENI se dieron en los meses de invierno (de enero a abril), con una media de 33 casos por 100.000 habitantes; por el contrario, las tasas más bajas se encontraron en los meses de verano (agosto y septiembre), con una media de 9 casos por 100.000 habitantes.
Distribución de síndromes clínicos (enfermedad neumocócica invasiva, ENI) en niños y adultos (2000–2006)
| Año | Grupo | Síndrome clínico (n, %) | Total (ENI) | ||||
| Meningitis | Neumonía | Bacteriemia | Peritonitis | Artritis | |||
| 2000 | Niños | 0 (0) | 0 (0) | 12 (100) | 0 (0) | 0 (0) | 12 |
| Adultos | 2 (13,3) | 8 (53,3) | 4 (26,7) | 0 (0) | 1 (6,7) | 15 | |
| Total | 2 (7,4) | 8 (29,6) | 16 (59,3) | 0 (0) | 1 (3,7) | 27 | |
| 2001 | Niños | 5 (31,3) | 2 (12,5) | 7 (43,7) | 2 (12,5) | 0 (0) | 16 |
| Adultos | 2 (10) | 12 (60) | 5 (25) | 1 (5) | 0 (0) | 20 | |
| Total | 7 (19,4) | 14 (38,9) | 12 (33,4) | 3 (8,33) | 0 (0) | 36 | |
| 2002 | Niños | 2 (13,3) | 2 (13,3) | 10 (66,7) | 0 (0) | 1 (6,7) | 15 |
| Adultos | 0 (0) | 10 (50) | 9 (45) | 1 (5) | 0 (0) | 20 | |
| Total | 2 (5,7) | 12 (34,3) | 19 (54,2) | 1 (2,9) | 1 (2,9) | 35 | |
| 2003 | Niños | 2 (15,4) | 4 (30,8) | 7 (53,8) | 0 (0) | 0 (0) | 13 |
| Adultos | 3 (17,6) | 7 (41,2) | 5 (29,4) | 2 (11,8) | 0 (0) | 17 | |
| Total | 5 (16,7) | 11 (36,7) | 12 (40) | 2 (6,6) | 0 (0) | 30 | |
| 2004 | Niños | 0 (0) | 2 (13,3) | 13 (86,7) | 0 (0) | 0 (0) | 15 |
| Adultos | 3 (17,6) | 8 (47,1) | 4 (23,5) | 0 (0) | 2 (11,8) | 17 | |
| Total | 3 (9,4) | 10 (31,2) | 17 (53,1) | 0 (0) | 2 (6,3) | 32 | |
| 2005 | Niños | 3 (16,7) | 7 (38,9) | 8 (44,4) | 0 (0) | 0 (0) | 18 |
| Adultos | 3 (12,5) | 11 (45,8) | 9 (37,5) | 1 (4,2) | 0 (0) | 24 | |
| Total | 6 (14,3) | 18 (42,8) | 17 (40,5) | 1 (2,4) | 0 (0) | 42 | |
| 2006 | Niños | 1 (4,8) | 8 (38,1) | 11 (52,3) | 1 (4,8) | 0 (0) | 21 |
| Adultos | 4 (22,2) | 10 (55,6) | 4 (22,2) | 0 (0) | 0 (0) | 18 | |
| Total | 5 (12,8) | 18 (46,1) | 15 (38,5) | 1 (2,6) | 0 (0) | 39 | |
| Total niños | 14 (12,6) | 25 (22,5) | 68 (61,3) | 3 (2,7) | 1 (0,9) | 111 | |
| Total adultos | 16 (12,3) | 66 (50,8) | 40 (30,8) | 5 (3,8) | 3 (2,3) | 130 | |
| Total | 30 (12,4) | 91 (37,8) | 108 (44,8) | 8 (3,3) | 4 (1,7) | 241 | |
No se han incluido los 4 casos de meningitis diagnosticados por PCR.
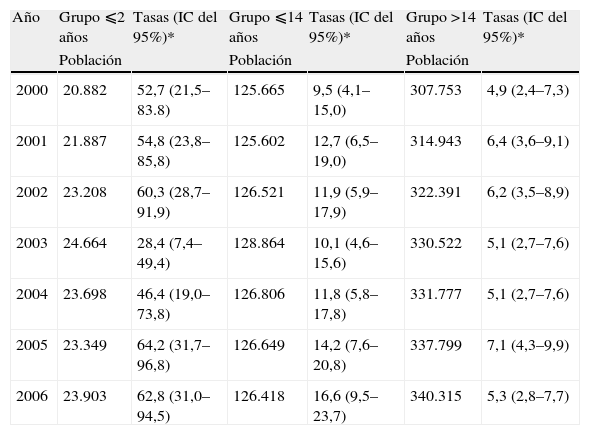
En la tabla 2 se expone la tasa de incidencia de ENI, distribuida por grupos de edad y sin corrección por hemocultivos realizados. En el año 2003 se observa, en el grupo de menores de 2 años, una disminución de la incidencia con respecto a la etapa prevacunal del 42,5% (p=0,23). Comparando la incidencia media de ENI de la etapa prevacunal (53,8 casos por 100.000 habitantes) con la incidencia de la etapa posvacunal en conjunto (57,8 casos por 100.000 habitantes), se observa un incremento del 7,4% (p=0,95). En el grupo de menores de 14 años la tasa de incidencia en la etapa prevacunal fue de 11,1 casos por 100.000 habitantes y en la etapa posvacunal de 14,2 casos por 100.000 habitantes, y se observa un incremento del 27,9% (p=0,7). Por último, en el grupo de mayores de 14 años, las tasas de incidencia no variaron después de la introducción de la vacuna (de 5,8 a 5,9 casos por 100.000 habitantes).
Tasa de incidencia de enfermedad neumocócica invasiva (ENI) por grupos de edad y año, en la isla de Gran Canaria
| Año | Grupo ⩽2 años | Tasas (IC del 95%)* | Grupo ⩽14 años | Tasas (IC del 95%)* | Grupo >14 años | Tasas (IC del 95%)* |
| Población | Población | Población | ||||
| 2000 | 20.882 | 52,7 (21,5–83.8) | 125.665 | 9,5 (4,1–15,0) | 307.753 | 4,9 (2,4–7,3) |
| 2001 | 21.887 | 54,8 (23,8–85,8) | 125.602 | 12,7 (6,5–19,0) | 314.943 | 6,4 (3,6–9,1) |
| 2002 | 23.208 | 60,3 (28,7–91,9) | 126.521 | 11,9 (5,9–17,9) | 322.391 | 6,2 (3,5–8,9) |
| 2003 | 24.664 | 28,4 (7,4–49,4) | 128.864 | 10,1 (4,6–15,6) | 330.522 | 5,1 (2,7–7,6) |
| 2004 | 23.698 | 46,4 (19,0–73,8) | 126.806 | 11,8 (5,8–17,8) | 331.777 | 5,1 (2,7–7,6) |
| 2005 | 23.349 | 64,2 (31,7–96,8) | 126.649 | 14,2 (7,6–20,8) | 337.799 | 7,1 (4,3–9,9) |
| 2006 | 23.903 | 62,8 (31,0–94,5) | 126.418 | 16,6 (9,5–23,7) | 340.315 | 5,3 (2,8–7,7) |
*Número de casos por 100.000 habitantes.
IC: intervalo de confianza.
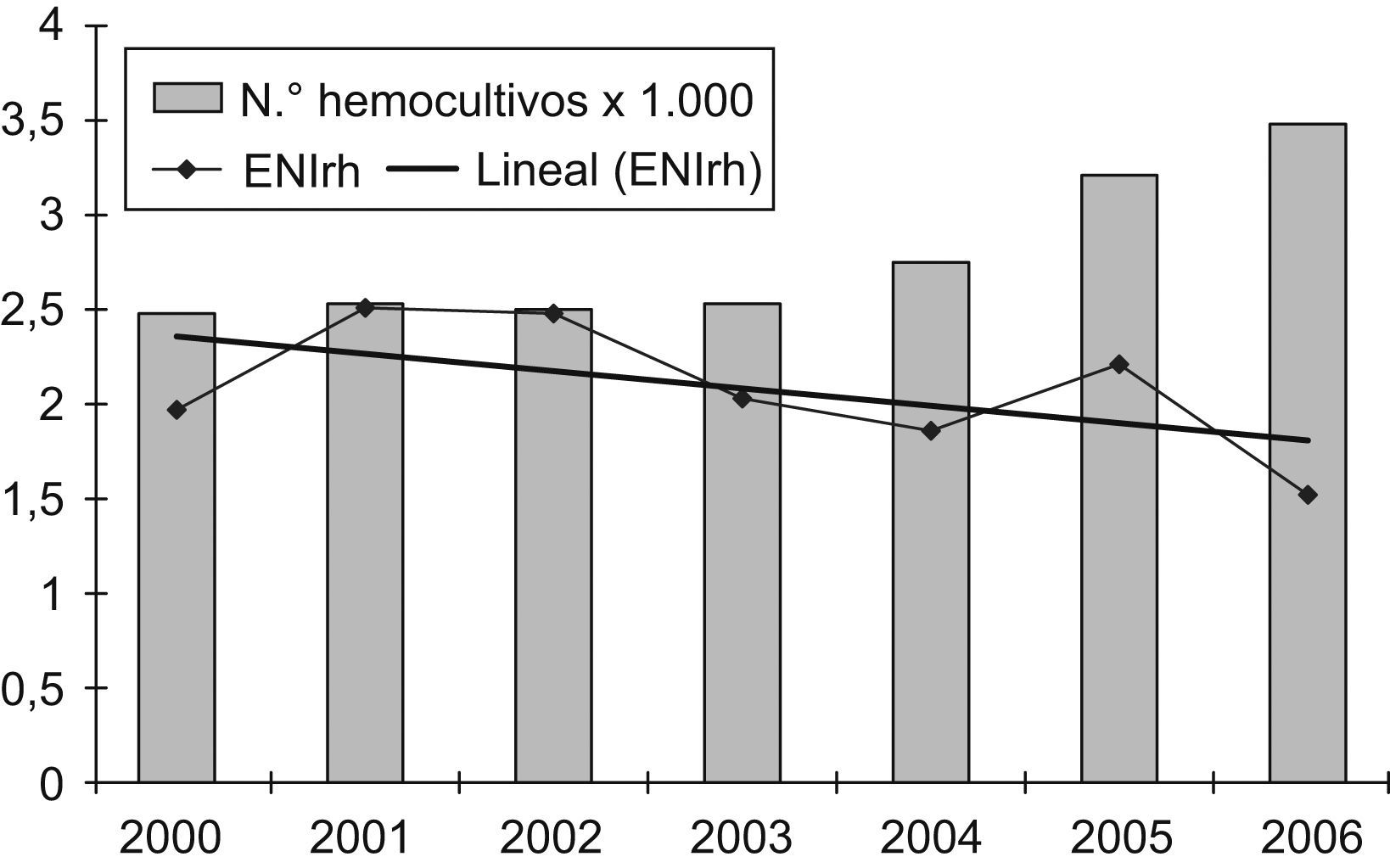
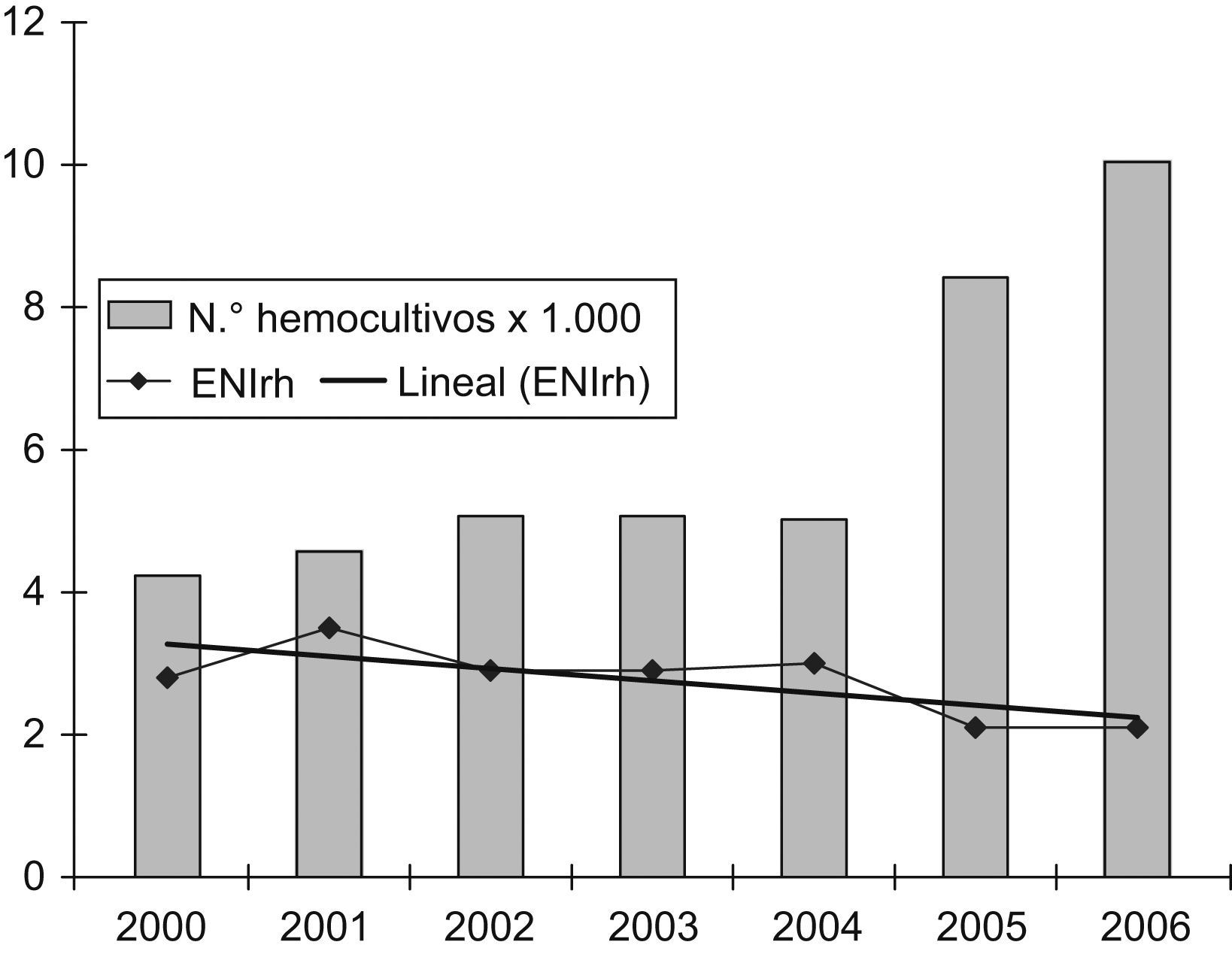
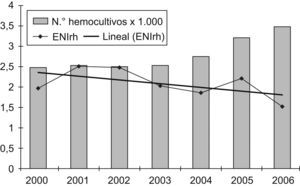
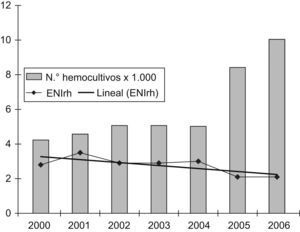
Debido a que una mayor demanda de hemocultivos puede incrementar el número de casos diagnosticados de ENI, se quiso conocer si hubo variación en la frecuencia de solicitud de hemocultivos, y cómo incidía dicha variación en la rentabilidad de los aislamientos de S. pneumoniae en las áreas de urgencias, tanto de pacientes adultos como pediátricos, por considerar que son las áreas «diana» para el diagnóstico de la ENI. En el caso del número de hemocultivos anuales realizados en urgencias de adultos, se observa un incremento de la demanda del 23,4% a partir del año 2005, con un descenso no significativo del 16,5% en los casos de ENIrh (p=0,9) entre el período prevacunal y los años 2005–2006 (fig. 1). En el caso de Urgencias de Pediatría observamos un incremento del 49,5% en el número de hemocultivos realizados para los años 2005–2006. Por el contrario, en el número de casos de ENIrh observamos un descenso no significativo del 50,9% (p=0,6) entre el período prevacuna y los años 2005-2006 (fig. 2).
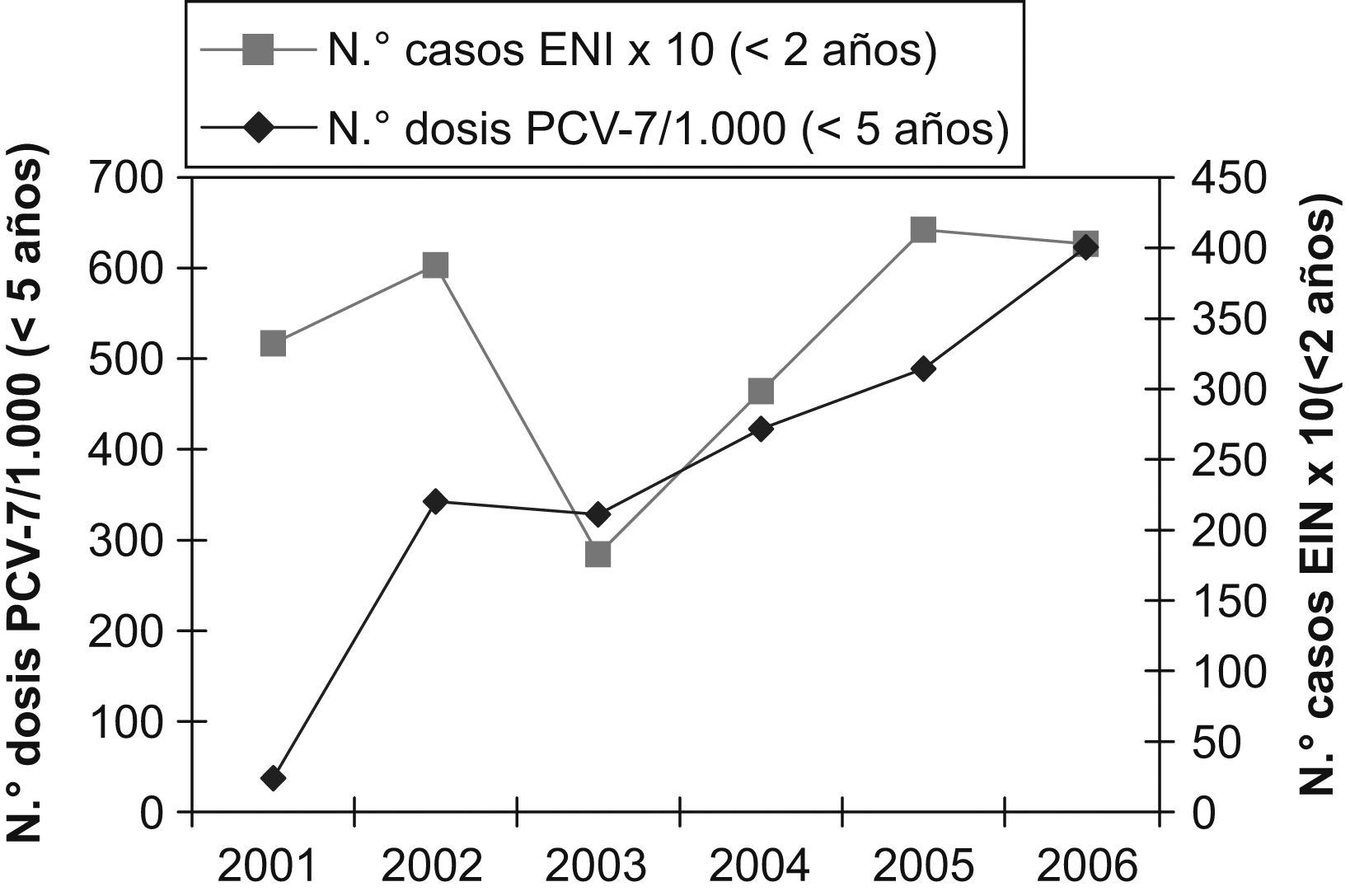
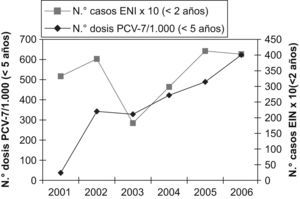
La comercialización de la vacuna neumocócica conjugada se inicia en nuestro país en junio de 2001, indicada especialmente para el grupo de menores de 2 años de edad. De acuerdo con los datos facilitados por Wyeth para la isla de Gran Canaria y los datos del ISTAC, se ha pasado de 23,9 unidades/1.000 menores de 5 años en el año 2001 a 400,7 unidades/1.000 menores de 5 años en el año 2006 (fig. 3), lo que implica que, según la administración de las dosis recomendadas por edad y teniendo en cuenta que la natalidad estimada para el año 2006 fue de 11.061 recién nacidos, el número máximo de unidades necesarias para cubrir la totalidad de la población diana sería 833 unidades/1.000 niños/año. Basándose en estos datos, la cobertura estimada para el año 2006 en Gran Canaria fue del 48%. La cobertura para el año 2003, del 25%, coincide con una disminución de la ENI en niños menores de 2 años (42,5%; p=0,23) (fig. 3).
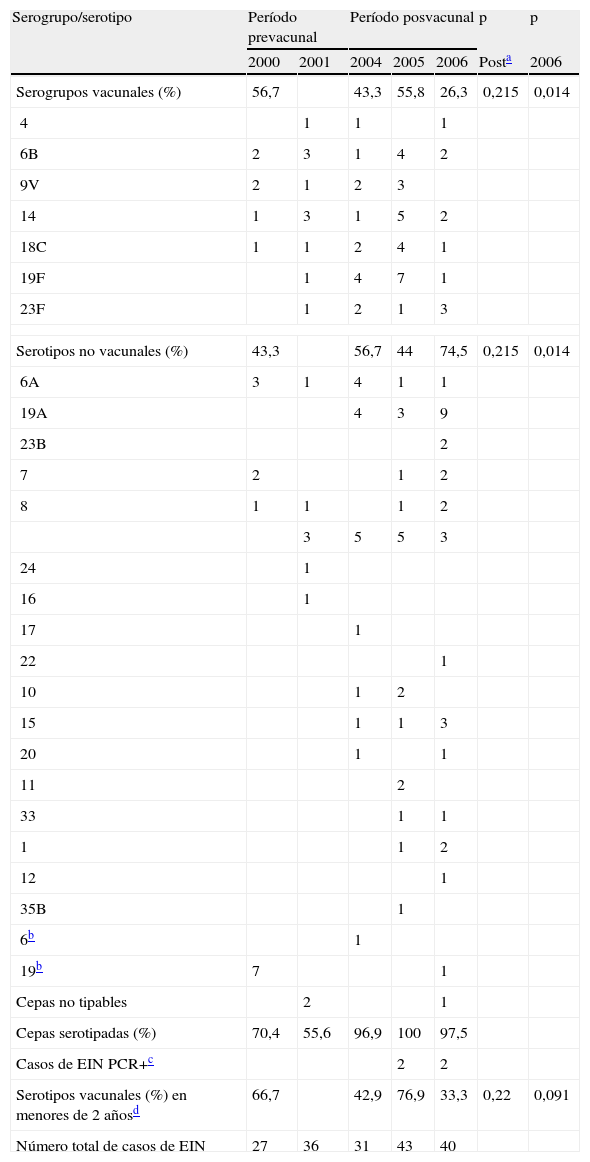
No fue posible determinar el serogrupo de todas las cepas causantes de ENI. En el período prevacunal se serotipó el 64% de las cepas, y en el periodo posvacunal el 98%. El 56,7% de los serotipos detectados en la etapa prevacunal estaba incluido en la PCV-7. En la etapa posvacunal, los serotipos incluidos en la PCV-7 disminuyeron significativamente hasta alcanzar el 26,3% en 2006 (p=0,014); sin embargo, para la etapa posvacunal en conjunto, la disminución no fue significativa (p=0,215) (tabla 2). En el grupo diana de la PCV-7, niños menores de 2 años, los serotipos vacunales detectados, a partir de ENI, en el período prevacunal fueron el 66,7%, y en el año 2006 fueron del 33,3% (descenso no significativo; p=0,091). Tampoco fue significativo cuando se comparó con el período posvacunal global (p=0,22). Para el grupo de serotipos no vacunales, frente al 43,3% del período prevacunal, se encontró un aumento significativo de hasta el 74,5% para el año 2006 (p=0,014), pero no para el período posvacunal en conjunto (58,4%; p=0,215). Desde la comercialización de PCV-7 se ha observado el incremento de ciertos serotipos no vacunales: 3, 6A, 15 y 19A (tabla 3).
Distribución de serotipos de S. pneumoniae aislados a partir de enfermedad neumocócica invasiva (ENI) en la isla de Gran Canaria durante los períodos prevacunal y posvacunal
| Serogrupo/serotipo | Período prevacunal | Período posvacunal | p | p | |||
| 2000 | 2001 | 2004 | 2005 | 2006 | Posta | 2006 | |
| Serogrupos vacunales (%) | 56,7 | 43,3 | 55,8 | 26,3 | 0,215 | 0,014 | |
| 4 | 1 | 1 | 1 | ||||
| 6B | 2 | 3 | 1 | 4 | 2 | ||
| 9V | 2 | 1 | 2 | 3 | |||
| 14 | 1 | 3 | 1 | 5 | 2 | ||
| 18C | 1 | 1 | 2 | 4 | 1 | ||
| 19F | 1 | 4 | 7 | 1 | |||
| 23F | 1 | 2 | 1 | 3 | |||
| Serotipos no vacunales (%) | 43,3 | 56,7 | 44 | 74,5 | 0,215 | 0,014 | |
| 6A | 3 | 1 | 4 | 1 | 1 | ||
| 19A | 4 | 3 | 9 | ||||
| 23B | 2 | ||||||
| 7 | 2 | 1 | 2 | ||||
| 8 | 1 | 1 | 1 | 2 | |||
| 3 | 5 | 5 | 3 | ||||
| 24 | 1 | ||||||
| 16 | 1 | ||||||
| 17 | 1 | ||||||
| 22 | 1 | ||||||
| 10 | 1 | 2 | |||||
| 15 | 1 | 1 | 3 | ||||
| 20 | 1 | 1 | |||||
| 11 | 2 | ||||||
| 33 | 1 | 1 | |||||
| 1 | 1 | 2 | |||||
| 12 | 1 | ||||||
| 35B | 1 | ||||||
| 6b | 1 | ||||||
| 19b | 7 | 1 | |||||
| Cepas no tipables | 2 | 1 | |||||
| Cepas serotipadas (%) | 70,4 | 55,6 | 96,9 | 100 | 97,5 | ||
| Casos de EIN PCR+c | 2 | 2 | |||||
| Serotipos vacunales (%) en menores de 2 añosd | 66,7 | 42,9 | 76,9 | 33,3 | 0,22 | 0,091 | |
| Número total de casos de EIN | 27 | 36 | 31 | 43 | 40 | ||
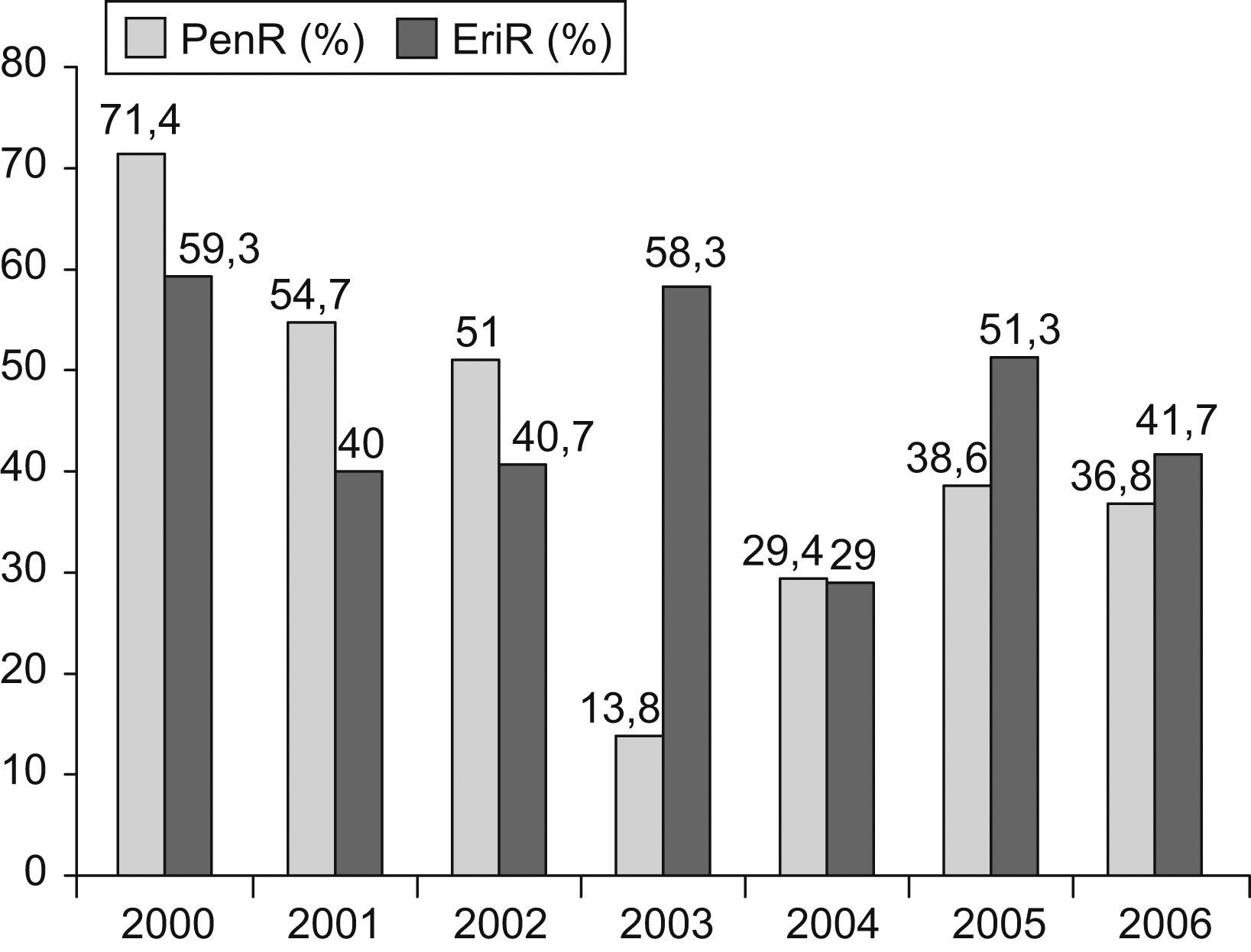
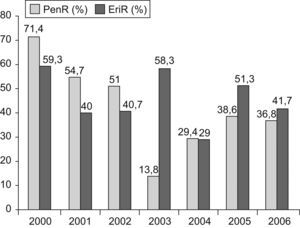
Se estudió la evolución de la resistencia a penicilina y eritromicina en las cepas invasivas de S. pneumoniae. Respecto a la resistencia a penicilina (CMI ⩾0,12μg/ml), se observó una disminución progresiva desde el 63,1% de las cepas en el bienio 2000–2001 hasta el 13,8% en el año 2003 (p<0,001). A partir de ese año, se observa una estabilización anual, entre un 30 y un 40%. Para eritromicina (CMI ⩾0,5μg/ml) la tasa de resistencia media en el período prevacunal fue del 49,7%, cifra que se ha mantenido estable durante el período posvacunal: 41,7% en el año 2006 (p=0,8) (fig. 4).
En la etapa posvacunal, el 54% (20/37) de las cepas pertenecientes a serotipos vacunales eran resistentes a penicilina, y el 17,5% (11/63) del grupo de serotipos no vacunales. De las 15 cepas multirresistentes, 10 (66,7%) pertenecían a serotipos vacunales y 5 (33,3%) a serotipos no vacunales, 3 de ellas al serotipo 19 A.
Hubo 23 casos de meningitis neumocócica entre los años 2003–2006, 4 de los cuales se diagnosticaron únicamente por detección de ADN por PCR (fragmento conservado del gen ply, que codifica la neumolisina). De las 19 meningitis restantes, 5 se diagnosticaron en pacientes menores de 2 años (1,25 casos/año), lo que supone una incidencia de 5,3 casos por 100.000 habitantes. Los serotipos implicados fueron 18C (2), 6B (1), 14 (1) y 19A (1). En la revisión de las historias clínicas de los pacientes menores de 2 años, no se encontró ningún paciente con ENI que se hubiera vacunado. En un niño menor de 2 años se aisló S. pneumoniae serotipo 1 a partir de un líquido pleural. Hubo 3 casos fatales que correspondieron con los serotipos 14, 18C y 9V. Otro paciente con ENI por serotipo 9V presentó secuelas neurológicas. Fuera del período estudiado (enero de 2007) nos parece interesante mencionar que hubo un caso fatal por una cepa del serogrupo 15 en un paciente que recibió correctamente la vacuna.
DiscusiónEn la actualidad conviven 2 estrategias en la implementación de la vacuna neumocócica conjugada: cobertura universal e inclusión en el calendario vacunal, como ocurre en Estados Unidos, y cobertura selectiva dirigida a grupos de riesgo, como en España15.
Ante la evidencia de la correlación entre la indicación de protección universal y la disminución de la ENI, en cifras que en ocasiones alcanzan hasta un 66–97% de cobertura6,7,16,17, recientemente algunos países de la Unión Europea (Alemania, Francia, Reino Unido y Países Bajos) han variado las indicaciones de la vacuna, modificando la estrategia selectiva por la universal en el sentido de recomendar la inclusión de la PCV-7 en el calendario vacunal. Por el momento, en España hay recomendaciones diferentes entre el Ministerio de Sanidad15 y determinadas consejerías de sanidad (Comunidad de Madrid), por un lado, y el Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAVAEP), por otro18.
En nuestro trabajo se ha querido reflejar cómo ha evolucionado la ENI en el período posvacunal en la isla de Gran Canaria, donde están vigentes las recomendaciones oficiales del Ministerio de Sanidad y donde los pediatras siguen mayoritariamente las recomendaciones del CAVAEP.
La cobertura vacunal en nuestro país oscila entre un 40 y un 50% (Gran Canaria, 48%), cifras similares a países de nuestro entorno con similar estrategia selectiva19,20. Estos datos contrastan con los países con recomendación de cobertura universal y su inclusión en el calendario vacunal, como el caso de Estados Unidos, con una cobertura general del 73%6,13. Es previsible que el impacto de la vacuna PCV-7 en la ENI sea cuantitativamente distinto en función de la estrategia de vacunación, por lo que resulta complicado comparar el impacto de la vacunación en países o regiones con estrategias diferentes.
En nuestra serie, no se encontró variación en la incidencia global de ENI entre las etapas prevacunal y posvacunal. En las series nacionales publicadas, no hay uniformidad en la metodología utilizada (grupo etario estudiado, años de estudio posvacunal, rectificación por demanda de hemocultivos, metodología estadística, síndromes incluidos en ENI), por lo que resulta conflictivo establecer algún tipo de comparación. Los resultados, con coberturas vacunales similares, han sido muy diversos. Aristegui et al19, en un estudio multicéntrico realizado en el País Vasco y Navarra acerca del impacto de la vacuna PCV-7 en ENI hasta el año 2003, encontraron en niños menores de 2 años una bajada de la incidencia del 37,5%, datos similares a los descritos por Barricarte et al20 en Navarra. Calbo et al21, en Tarrasa (Barcelona), en el período 2002–2004, encuentran un descenso de 5,7 casos por 100.000 habitantes. Muñoz-Almagro et al22, en Cataluña, en el período 2002–2006, encuentran un incremento del 58% de las ENI. Sin embargo, parece evidente que ninguna serie ha demostrado una disminución significativa de ENI en los casos en que la cobertura vacunal era selectiva. Esta disparidad no parece asociarse con diferencias en los serotipos implicados en la etapa prevacuna19–21 y sí parece haber diferencias con relación a los momentos de inicio y finalización de los estudios posvacunales. En población nativa de Alaska menor de 2 años, donde la cobertura vacunal es universal, Singleton et al23 observaron, tras una bajada inicial (2001–2003) de los casos de ENI del 67%, un incremento posterior (2004–2006) del 82%, a expensas de serotipos no vacunales.
Uno de los problemas para valorar el impacta de la vacuna en la incidencia de ENI es la idoneidad de la indicación de las técnicas diagnósticas, en especial en las bacteriemias sin foco y en las neumonías (con o sin bacteriemia). Rüggeberg et al24, en Alemania, calcularon que en un hospital universitario pediátrico se realizaron hemocultivos sólo en el 49% de los niños con neumonía y en el 48% de los niños con fiebre sin foco. Domínguez et al25 encontraron en Cataluña, en niños menores de 2 años, una incidencia de ENI de 59 casos por 100.000 habitantes, mientras que en el mismo período en Estados Unidos la incidencia fue de 166,9 casos por 100.000 habitantes, y la única diferencia observada fue el número de bacteriemias sin foco, concluyendo que los criterios de solicitud de hemocultivos eran distintos en Estados Unidos y en Europa, siendo más sistemática la investigación de bacteriemia oculta en Estados Unidos. En nuestro caso, 2 actuaciones tuvieron una incidencia significativa en la solicitud de hemocultivos a partir de 2005: la instauración de una guía clínica de neumonía adquirida en la comunidad en urgencias de adultos, y la solicitud sistemática de hemocultivos en síndromes febriles sin foco en urgencias de pediatría. Sin embargo, aplicando la ENIrh, tampoco se encontró una disminución significativa de la ENI.
Globalmente se ha detectado una disminución de la incidencia de los serotipos vacunales y un incremento de los serotipos no vacunales, que alcanza en ambos parámetros significación estadística en el último año del estudio (2006). Ambos hallazgos son comunes en las diversas series publicadas. El reemplazamiento de serotipos parece ser una consecuencia directa del uso de la vacuna PCV-7, común en la mayoría de los estudios21–23. Sin embargo, algunos autores han encontrado un incremento de los serotipos denominados «relacionados» (6B, 19A, 23B) y, por el contrario, no han obtenido diferencias en los serotipos no vacunales (resto de serotipos)26.
Se ha encontrado un aumento de los serotipos 19A, 3 y 15, tal como se ha descrito en otras series21–23,27,28. No obstante, en nuestro caso no está claro que el reemplazamiento de serotipos lleve implícita la disminución de la incidencia global de ENI. En la actualidad se prevé la comercialización de 2 vacunas neumocócicas polivalentes: una que cubre 13 serotipos (los de la vacuna PCV-7 más los serotipos 1, 3, 5, 6A, 19A y 7F) y otra que cubre 10 serotipos (los de la vacuna PCV-7 más los serotipos 1, 5 y 7F), desarrolladas por los laboratorios Wyeth y GSK, respectivamente. En el primer caso se cubriría el 56,7% (17/30) de los serotipos no vacunales del año 2006. En el caso de la vacuna de GSK, no se cubrirían 2 de los serotipos más prevalentes en la etapa posvacunal, el 3 y el 19 A; en este caso la cobertura sería del 13,4% (4/30).
Otro fenómeno relacionado con el uso de la vacuna PCV-7 ha sido la disminución de la resistencia a penicilina y eritromicina en S. pneumoniae, presumiblemente relacionada con 2 factores: por un lado, la disminución de la incidencia de clones multirresistentes derivados de serotipos vacunales, en especial el 9V, 23F, 6B y 1428–30, y por otro, la mayor sensibilidad, por el momento, de los serotipos no vacunales «emergentes». Nuestros datos verifican una disminución significativa de la resistencia a penicilina, tanto en la población general como en la población pediátrica. Por el contrario, en el caso de la resistencia a eritromicina, no se ha encontrado ninguna diferencia desde el uso de la vacuna PCV-7. Es importante destacar la dinámica por años de los datos de resistencia a penicilina, observando cómo después de 2 años de la comercialización de la vacuna, se obtienen las cifras menores de resistencia, y cómo, a partir de 2003, se inicia de nuevo un ascenso paulatino de la resistencia, estabilizándose por ahora en cifras entre un 40 y un 50%. Este incremento está relacionado con la persistencia de serotipos vacunales multirresistentes en pacientes no vacunados y con el aumento de la ENI debida al serotipo 19A multirresistente. Se podría especular que la disminución de la ENI asociada a una mayor sensibilidad de las cepas de los nuevos serotipos y a la acción de nuevas vacunas de mayor espectro, podría contribuir a disminuir la presión sobre el consumo de antibióticos, lo que a su vez alargaría el tiempo de aparición de clones multirresistentes en los nuevos serotipos.
La distribución de casos de ENI por síndrome clínico en Gran Canaria no ha experimentado variaciones importantes a lo largo de los años, ni de manera global ni dividiendo a la población en niños y adultos. Sin embargo, cuando se comparan los síndromes clínicos entre niños y adultos, llama la atención 2 situaciones: la bacteriemia sin foco es más frecuente en niños y la neumonía es más frecuente en adultos. La explicación a este hecho se puede deber a la presencia más habitual de síndromes febriles sin foco en los niños (en particular en el grupo de menores de 5 años), a la dificultad para diagnosticar la neumonía en los niños y a la obtención sistemática de hemocultivos en adultos con sospecha de neumonía comunitaria.
Nuestro estudio presenta ciertas limitaciones: se trata de un trabajo retrospectivo, no se pudieron serotipar las cepas de los años 2002 y 2003 por problemas técnicos, el criterio clínico de solicitud de hemocultivos varió a partir del año 2005 y, por último, la significación estadística podría estar condicionada por el tamaño muestral.
Como conclusión, en la isla de Gran Canaria, donde la cobertura vacunal por PCV-7 en menores de 2 años es del 48%, no se ha observado una disminución de la incidencia de ENI. Se ha detectado un reemplazamiento claro de serotipos, con una disminución significativa de los vacunales y un aumento de los no vacunales, especialmente los serotipos emergentes 19A, 3 y 15, así como una disminución de la resistencia a penicilina. Es importante destacar que ningún paciente menor de 2 años con ENI estaba vacunado. Parece razonable argumentar que, en la isla de Gran Canaria, la adopción del criterio de vacunación universal, asociado al uso de nuevas vacunas con mayor espectro de serotipos, potenciaría todos estos efectos, aunque no queda claro cuál sería su estabilidad en el tiempo. Es importante realizar una vigilancia estrecha y continuada de la ENI mediante estudios colaborativos de larga duración que incluyan una población mayor, con el fin de obtener resultados más concluyentes de la dinámica y la epidemiología de la ENI.
A la Dra. Asunción Fenoll, del Laboratorio de Referencia de Neumococos del Centro Nacional de Microbiología (Instituto de Salud Carlos III, Majadahonda, Madrid), por el serotipado de las cepas.
Al Dr. Julio Vázquez, del Laboratorio de Referencia de Neisseria del Centro Nacional de Microbiología (Instituto de Salud Carlos III, Majadahonda, Madrid), por la determinación de ADN específico de S. pneumoniae en líquido cefalorraquídeo de pacientes con sospecha clínica de meningitis y cultivo negativo.
A las técnicas especialistas de laboratorio Laura Cardona Reyes y Dunia Montesdeoca Molina, por su inestimable colaboración.