Existen nanopartículas con características antibacterianas destacables y aptámeros capaces de reconocer con gran afinidad y especificidad a determinadas bacterias patógenas. La combinación de ambos sistemas se ha utilizado en el diseño de métodos rápidos de detección bacteriana con excelentes límites de detección. Asimismo, la sinergia entre aptámeros y nanopartículas ha permitido optimizar la actividad antimicrobiana de antibióticos y otras nanoestructuras dotándolos de actividad bacteria-específica, convirtiéndolas en herramientas atractivas y prometedoras frente a las bacterias resistentes a múltiples antimicrobianos.
There are nanoparticles with remarkable antibacterial characteristics and aptamers able to recognize specific pathogenic bacteria with high affinity and specificity. The combination of both systems has been used to design rapid bacterial detection methods with excellent detection limits. Likewise, the synergism between aptamers and nanoparticles have allowed to optimize the antimicrobial activity of antibiotics and other nanostructures providing them with activity bacterium-specific, turning into attractive and promising tools to fight against bacteria resistant to multiple antimicrobials.
La morbimortalidad de las infecciones bacterianas ha aumentado debido al incremento en la frecuencia de bacterias resistentes a múltiples antimicrobianos (MDR)1,2, reduciendo la eficacia de las terapias de erradicación disponibles3 y estableciendo un importante problema de salud con graves secuelas económicas y sociales4,5.
Esta «crisis de resistencia a los antibióticos»6 ha sido generada principalmente por el uso extenso e inadecuado de antibióticos4, así como por el diagnóstico convencional realizado mediante cultivo y pruebas bioquímicas (método estándar), que identifica a los agentes infecciosos tras varios días, permitiendo la progresión de la infección. Por ello, es necesario desarrollar métodos rápidos para el diagnóstico bacteriano5, diseñar terapias que evadan los mecanismos de resistencia bacteriana3,6 y/o mejorar la acción de los antibióticos existentes, donde la nanotecnología parece ser una herramienta prometedora4.
AptámerosLos aptámeros son ácidos nucleicos monocatenarios cortos, seleccionados in vitro mediante un proceso denominado evolución sistemática de ligandos por enriquecimiento exponencial (SELEX) para reconocer blancos específicos diversos7,8.
El reconocimiento aptámero-blanco se consigue por compatibilidad estructural y combinación de diversas interacciones no covalentes9,10, estableciendo constantes de disociación usualmente en el rango de pico-nanomolar para dianas con peso molecular alto, y de nano-micromolar para blancos de peso molecular bajo9,11. Los aptámeros son capaces de discriminar entre enantiómeros y moléculas que estructuralmente difieren solamente en un grupo funcional12. Asimismo, su tamaño y peso molecular pequeño11, síntesis in vitro7,12, estabilidad bajo un rango amplio de condiciones8,9,11,12, y nula o baja toxicidad in vivo9, los han convertido en moléculas atractivas para el desarrollo de nuevas estrategias diagnósticas y terapéuticas para agentes infecciosos8,9,11,12.
Adicionalmente, estas biomoléculas se pueden modificar fácilmente para mejorar su bioestabilidad frente a nucleasas8,9,11,12, incrementar su biodisponibilidad, sus propiedades farmacocinéticas y su afinidad, así como para evadir la respuesta inmune9 e incluso acoplarlas con moléculas reporteras, grupos funcionales o nanopartículas (NPs) para incrementar su aplicabilidad7.
NanopartículasLas NPs son una gama de materiales pequeños con al menos una dimensión inferior a 100nm, cuyas propiedades dependen de su tamaño, forma, distribución y formulación química1,2,13. Su elevada relación superficie-volumen les confiere reactividad elevada e interacciones únicas con sistemas biológicos1. Adicionalmente, la resonancia de plasmones localizados en superficie (LSPR) manifestada comúnmente por NPs metálicas bajo estímulos fotónicos o electromagnéticos otorga propiedades ópticas equivalentes a 10 fluoróforos13, por lo que se podrían utilizar para el desarrollo de herramientas diagnósticas13.
Asimismo, existen NPs que a dosis no tóxicas para células humanas poseen cualidades antimicrobianas destacadas frente a diversos patógenos y sus variantes MDR1,13, donde las NPs metálicas figuran como prometedoras1 al producir especies reactivas de oxígeno, liberar constantemente cationes metálicos1,3,14 y poseer una carga generalmente positiva, favoreciendo su adhesión y acumulación en la membrana externa bacteriana3,14, disociándola y ocasionando la eliminación del gradiente de protones y la subsiguiente salida del contenido citoplasmático1,3,14.
Además, las NPs más pequeñas y los cationes metálicos pueden internalizarse en las bacterias1,3, añadiendo efectos antimicrobianos trascendentales, como la inhibición de enzimas cruciales para la replicación del ADN y la producción de ATP3,14.
También las NPs no antimicrobianas pueden ser útiles para diseñar estrategias diagnósticas y terapéuticas para infecciones bacterianas, al adecuarlas para el transporte-entrega de compuestos antimicrobianos en sitios específicos (nanoportadores)2,4, acumulando el compuesto sobre la superficie bacteriana y mejorando su farmacocinética3,4,13,15. En esta revisión abordaremos algunos ejemplos de aptámeros selectivos para especies bacterianas patógenas, que han sido utilizados junto con NPs para el diseño de estrategias diagnósticas y/o terapéuticas novedosas frente a patógenos bacterianos (tabla 1).
Empleo de aptámeros y nanopartículas utilizados para el diseño de estrategias diagnósticas y/o terapéuticas frente a patógenos bacterianos
| Nanoestructura | Elemento de reconocimiento | Bacteria diana | Utilidad potencial | Referencias |
|---|---|---|---|---|
| QD's | Aptámero | E. coli | Diagnóstica | |
| Aptámero | S. typhimurium | Diagnóstica | 17 | |
| Aptámero | B. subtilis | Diagnóstica | ||
| Aptámero | P. aeruginosa | Diagnóstica | 18 | |
| CD's | Aptámero | S. typhimurium | Diagnóstica | 10,19 |
| AuNPs | Aptámero | S. enteritidis | Diagnóstica | 10 |
| Aptámero | S. typhimurium | Diagnóstica | 7,10,19,20 | |
| Aptámero | E. coli | Diagnóstica | 7,10,19 | |
| Aptámero | S. aureus | Diagnóstica | 19,36 | |
| Aptámero | C. jejuni | Diagnóstica | 37 | |
| Aptámero | C. coli | Diagnóstica | 37 | |
| Aptámero | L. acidophilus | Diagnóstica | ||
| Au-sílica NPs | Aptámero | S. typhimurium | Diagnóstica | 12,21,22 |
| Aptámero | P. aeruginosa | Diagnóstica | ||
| MNPs | Aptámero | S. typhimurium | Diagnóstica | 23 |
| MBs y AuNPs | Aptámero | S. aureus | Diagnóstica | 7,19,21,24,25 |
| Aptámero | S. typhimurium | Diagnóstica | 10,26,27 | |
| MNPs y UCNPs | Aptámero | S. aureus | Diagnóstica | 10,26,27 |
| Aptámero | V. parahemolyticus | Diagnóstica | 10,27 | |
| MNPs | Aptámero marcado con FAM | S. typhimurium | Diagnóstica | 5,10 |
| MNPs y nano keepers unidos a oligonucleótidos marcados con FAM | Aptámero | S. aureus | Diagnóstica | 28 |
| MBs, AuNCs y vancomicina | Aptámero | S. aureus | Diagnóstica | 29 |
| MBs | Anticuerpo y aptámero marcado con FITC | SARM | Diagnóstica | 30 |
| SWNTs | Aptámero modificado con DNAzima | S. paratyphi A | Diagnóstica | 31 |
| FNPs | Aptámero | E. coli | Diagnóstica | 32 |
| Aptámero marcado con FAM | V. parahemolyticus | Diagnóstica | ||
| CNPs | Aptámero marcado con CY3 | S. aureus | Diagnóstica | 10,33 |
| Aptámero marcado con ROX | S. typhimurium | Diagnóstica | ||
| AuNCs, vancomicina y AuNPs | Aptámero | S. aureus | Diagnóstica | 34 |
| AuNPs y UCNPs unidos a ADNc del aptámero | Aptámero | E. coli | Diagnóstica | 35 |
| AgNPs | Aptámero modificado con con fGmH | S. aureus | Terapéutica | 40 |
| Nano keepers con vancomicina | Aptámero | S. aureus | Terapéutica | 41 |
| TiO2NPs | Tres aptámeros | E. coli | Terapéutica | 42 |
| AuNPs acoplados a A3-APOHis | Aptámero marcado con histidina | S. typhimurium | Terapéutica | 43 |
A3-APOHis: péptidos antimicrobianos marcados con hexahistidina; ADNc: ADN complementario; AgNPs: nanopartículas de plata; AuNCs: nano-agrupaciones de oro; AuNPs: nanopartículas de oro; CD's: carbon dots; CNPs: nanopartículas de carbono; CPX: ciprofloxacino; CY3: colorante 3 de cianina; FAM: carboxifluoresceína; fGmH: 2́-F-dG, 2́-OMe-dA/dC/dU; FITC: isotiocianato de fluoresceína; FNPs: nanopartículas fluorescentes; MBs: perlas magnéticas; MNPs: nanopartículas magnéticas; NPs: nanopartículas; QD's: quantum dots; ROX: 6-carboxi-X-rodamina; SARM: S. aureus resistentes a meticilina; SWNTs: nanotubos de carbono; TiO2NPs: nanopartículas de dióxido de titanio; UCNPs: nanopartículas de conversión ascendente.
En la actualidad se han seleccionado aptámeros dirigidos a especies bacterianas diversas1,7,8,10,12, principalmente usados como fase estacionaria de captura de moléculas, capaces de identificar bacterias en muestras ambientales y clínicas, con sensibilidades equivalentes o superiores a las de los cultivos convencionales8,12. La sinergia existente entre los aptámeros y las NPs ha evidenciado su potencial para ser empleados en biomedicina16, al incrementar la afinidad de un aptámero por su diana ocasionado por una densidad elevada de aptámeros sobre las NPs, acrecentando la cantidad de interacciones con el blanco por acción cooperativa (efecto multivalencia)7,16, que a su vez protege a los aptámeros de la digestión por nucleasas16.
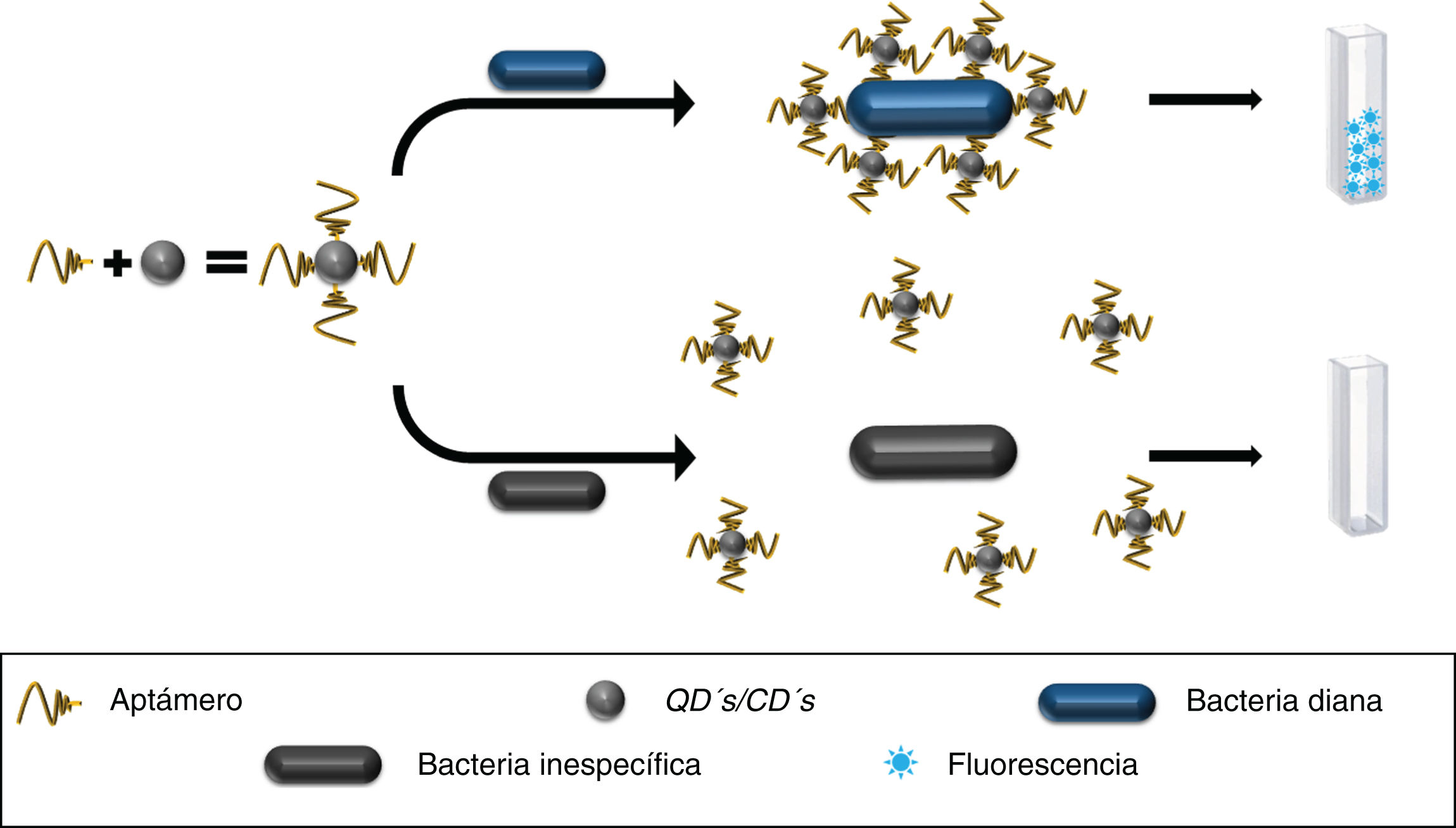
Detección bacteriana basada en aptámeros y quantum dotsLas quantum dots (QD's) son un tipo de NPs con propiedades fluorescentes destacables10,17. Se han utilizado en ensayos piloto para el desarrollo de un sistema de detección semicuantitativo para Escherichia coli, Salmonella typhimurium y Bacillus subtilis mediante la conjugación de aptámeros a QD's, demostrando ser capaces de reconocer a cada microorganismo mediante variaciones de fluorescencia de las QD's. La detección inicial se evaluó con ∼2,8×106 bacterias/mL y la intensidad fluorescente se modificó proporcionalmente al número de bacterias presentes17, evidenciando su potencialidad para el diagnóstico bacteriano18. También se ha utilizado un aptámero anti-Pseudomonas aeruginosa para desarrollar un método de detección de esta bacteria en agua potable. Mediante el marcaje de aptámeros con isotiocianato de fluoresceína (FITC) y aptámeros conjugados a QD's, se demostró que estos últimos tuvieron afinidades disminuidas respecto al aptámero marcado con FITC19, probando que la nanotecnología también puede presentar resultados desfavorables para moléculas de reconocimiento prometedoras.
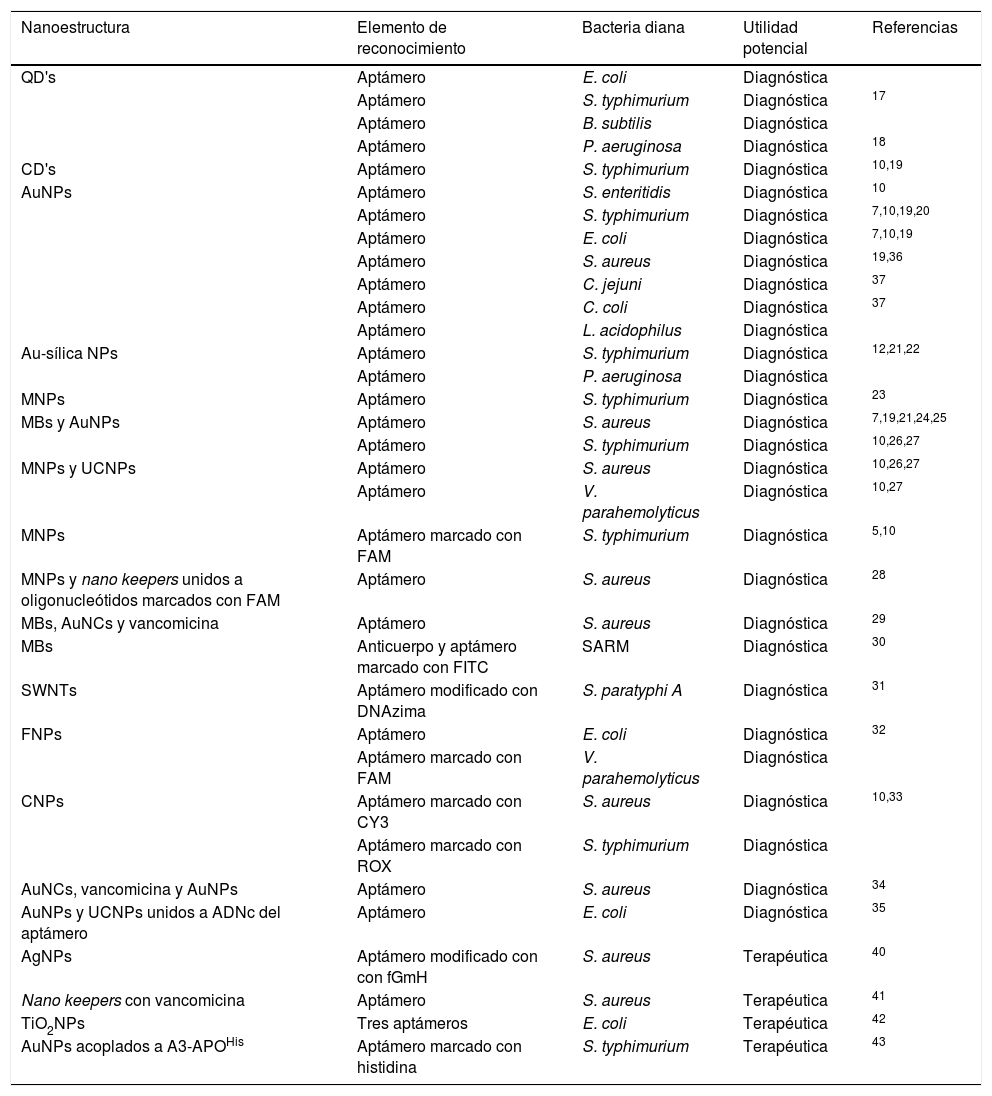
También se han utilizado las carbon dots (CD's), que tienen propiedades luminiscentes, tóxicas y de biocompatibilidad prometedoras10,20. Se han empleado en conjunto con aptámeros anti-S. typhimurium para desarrollar un método de detección basado en fluorescencia, mostrando límites de detección (LDD) de 50 unidades formadoras de colonias (UFC)/mL en 2h de incubación con cultivos bacterianos líquidos10,21,22 (fig. 1), confirmados por el método de recuento en placa22.
Detección bacteriana a través de aptámeros acoplados a nanopartículas metálicasActualmente, las NPs de oro (AuNPs) se utilizan ampliamente para la generación de biosensores bacterianos debido a las características electroquímicas, ópticas y de resonancia de plasmones, entre otras propiedades prometedoras que poseen21. Estas se han utilizado en conjunto con aptámeros para la detección de Salmonella enteritidis, conjugando aptámeros con AuNPs, para posteriormente inmovilizarlos sobre un electrodo de carbono. Esta prueba de concepto demostró que al introducir el electrodo en soluciones con la bacteria, la resistencia eléctrica se incrementó debido a la formación de complejos aptámero-bacteria, permitiendo su medición por espectroscopia de impedancia electroquímica con un LDD de 600UFC/mL10,23, sentando las bases para desarrollar nuevos métodos basados en este principio, para la detección de diversos microorganismos23.
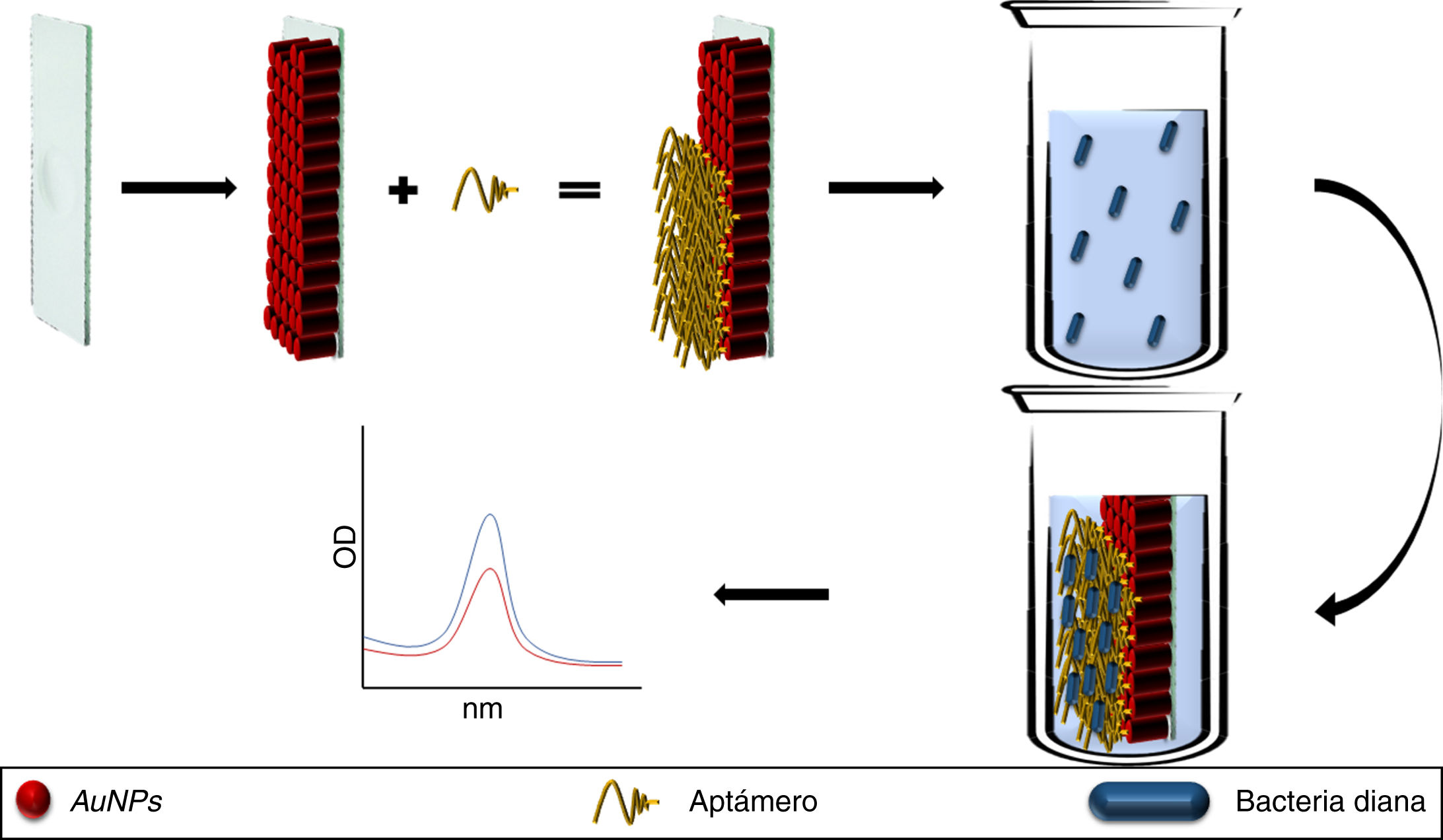
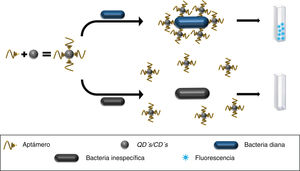
También se ha desarrollado un chip basado en la inmovilización de AuNPs acopladas a aptámeros anti-S. typhimurium, cuyo estudio piloto mostró su utilidad para detectar a este patógeno en líquidos procedentes de lavados de carne de cerdo. Así, al introducir el chip en el líquido, el aptámero adquiere un cambio estructural al ligar a la bacteria, modificando la absorbancia basal de la LSPR de las AuNPs que se detectó por espectrofotometría UV/visible (fig. 2). La principal limitación de este método es la necesidad de establecer matrices diferentes para los diferentes alimentos antes de comercializar este tipo de tecnología24.
Aptámeros conjugados a AuNPs e inmovilizados sobre una placa de vidrio (chip). El aptámero une a las bacterias diana modificando los picos de absorción de las AuNPs. En soluciones sin el patógeno los picos de absorción se mantienen idénticos al pico de absorción basal de las AuNPs.
AuNPs: nanopartículas de oro.
Del mismo modo, un estudio piloto basado en aptámeros inmovilizados sobre NPs de sílica cubiertas con oro (Au-sílica NPs) ha permitido desarrollar un sensor multiplex para Lactobacillus acidophilus, S. typhimurium y P. aeruginosa, logrando discriminar entre cada patógeno con un LDD de 3UFC por ensayo, gracias al reconocimiento de cada aptámero a su diana, alterando de manera particular la LSPR de las NPs para cada especie bacteriana12,25,26.
Aptámeros y moléculas magnéticas para la detección de bacteriasLas NPs magnéticas (MNPs) pueden ocasionar cambios de coloración de una solución en presencia de un sustrato colorimétrico como 3,3’,5,5’-tetrametilbencidina (TMB) y H2O2, de manera similar a la peroxidasa. Esta propiedad se ha utilizado para detectar S. typhimurium mediante un estudio de prueba de concepto, donde se observó que aptámeros anti-S. typhimurium en solución con MNPs inhibían la acción enzimática de estas últimas, pero al añadir 7,5×105UFC/mL de la bacteria, el aptámero se unió al patógeno desprotegiendo las MNPs y permitiendo su acción enzimática27.
Adicionalmente, las perlas magnéticas (MBs) y las MNPs se pueden usar en conjunto con los aptámeros para desarrollar métodos de captura-separación magnética de patógenos presentes en una muestra, para concentrarlos7,21,25,28–30 y posteriormente detectarlos por estrategias diversas, consiguiendo LDD de 1-682UFC/mL validados por el método de recuento en placa29,31–33, como sigue:
- (i)
A partir de la variación en la señal eléctrica ocasionada por la excitación fotónica de AuNPs acopladas a aptámeros anti-Staphylococcus aureus (S. aureus) al ligar a dicho patógeno7,25,28.
- (ii)
Por la medición de iones de plata (Ag+) en solución, producidos por NPs de plata (AgNPs) acopladas a aptámeros anti-S. aureus, donde la concentración de Ag+ es directamente proporcional a la densidad de la bacteria en una muestra21,29.
- (iii)
Mediante la detección de la fluorescencia específica de NPs de conversión ascendente (UCNPs) unidas a aptámeros específicos anti-S. typhimurium, anti-S. aureus y anti-Vibrio parahemolyticus10,30,31.
- (iv)
De manera similar, a partir de la detección de fluorescencia de aptámeros selectivos para S. typhimurium modificados con carboxifluoresceína (FAM)5,10,34.
- (v)
Por medio de la identificación de enzimas específicas producidas por un patógeno en particular, como las nucleasas micrococales (MN) de S. aureus, que mediante la adición de nano keepers, constituidos por oligonucleótidos marcados con FAM específicamente susceptibles a las MN, se inmovilizan en los poros de NPs de sílica mesoporosas (MSNs) para inhibir la fluorescencia de FAM, pero al estimular la producción de MN, los oligonucleótidos se degradan, permitiendo la emisión de fluorescencia32.
- (vi)
Mediante la interacción específica de antimicrobianos con patógenos concretos, como la vancomicina y S. aureus, comportamiento que ha sido útil para la detección de este patógeno mediante la incubación con nano-agrupaciones de oro (AuNCs) con propiedades fluorescentes, las cuales se inhiben por la vancomicina, pero en presencia de S. aureus, la vancomicina interactúa con el patógeno permitiendo la emisión de fluorescencia de las AuNCs33.
También hay evidencia del uso combinado de anticuerpos y aptámeros para la detección fluorométrica de determinados microorganismos, tales como S. aureus resistentes a meticilina (SARM) utilizando MBs cubiertas con anticuerpos anti-proteína A de S. aureus (SpA) para capturar al patógeno. El método consiste en lisar a la bacteria e incubarla en presencia de un aptámero anti-PBP2a (proteína específica de SARM) modificado con FITC e hibridado con tres ADNs cortos para eliminar la emisión de fluorescencia. Cuando el aptámero se une a la proteína PBP2a, se rehabilita la emisión de fluorescencia de FITC, logrando LDD de 1,38×103UFC/mL, confirmados por métodos microbiológicos convencionales35.
Detección bacteriana basada en aptámeros acoplados a nanoestructurasSe han utilizado aptámeros modificados con deoxiribozima (DNAzima) inmovilizados sobre nanotubos de carbono (SWNTs) para la detección de Salmonella paratyphi A, donde el complejo aptámero-S. paratyphi A genera un cambio conformacional del extremo modificado con DNAzima, permitiéndole formar complejos con heminas (adicionadas a la solución) que, en presencia de luminol (también adicionado al sistema), catalizan la generación de quimioluminiscencia en presencia de H2O2 con LDD de 103UFC/mL36.
Asimismo, se han diseñado sistemas más elaborados para la detección de patógenos, como la plataforma de optofluidos construida para detectar la señal fluorescente de aptámeros anti-E. coli acoplados a NPs fluorescentes (FNPs), donde el microflujo de cultivos a través del microcanal del sistema permitió identificar ∼100 células de E. coli por segundo mediante la señal fluorescente de las FNPs unidas a ellas, resultados que fueron confirmados por recuento en placa37.
También se han diseñado sistemas multiplex para la detección de patógenos, como la inmovilización de aptámeros anti-S. typhimurium, anti-V. parahemolyticus y anti-S. aureus modificados con fluorocromos diferentes (FAM, colorante 3 de cianina (CY3) y 6-carboxi-X-rodamina (ROX)) para detectar cada patógeno mediante fluorescencia. Los aptámeros fueron inmovilizados en NPs de carbono (CNPs) que permiten el ensamble de colorantes inhibiendo su fluorescencia, pero cuando los aptámeros reconocieron a su patógeno diana se disociaron de las CNPs resultando en la emisión y detección de fluorescencia10,38 con LDD de 50, 25 y 50UFC/mL, respectivamente, validados por recuento en placa38.
Por otro lado, también se ha utilizado la relación entre vancomicina y S. aureus para el estudio piloto de una estrategia de detección mediante la variación en la transferencia de energía de resonancia de fluorescencia (FRET), utilizando AuNCs conjugadas a la vancomicina como elemento donador de energía y aptámeros anti-S. aureus inmovilizados sobre AuNPs como elemento receptor de energía, constituyendo las unidades de reconocimiento dual basado en FRET (DRU-FRET). Ambos sistemas son atraídos en presencia del patógeno, ocasionando la variación de FRET y habilitando LDD de 10UFC/mL39.
Existen otras evidencias de estudios piloto sobre estrategias basadas en elementos donadores y receptores de energía, como el uso de aptámeros anti-E. coli inmovilizados sobre AuNPs (elemento receptor de energía) y UCNPs acoplados a un oligonucleótido de ADN complementario (ADNc) a la secuencia del aptámero (elemento donador de energía), los cuales al ser hibridados inhiben la producción de fluorescencia de las UCNPs, pero en presencia del patógeno, el aptámero lo liga disociando su interacción con las UCNPs y ocasionando la emisión de fluorescencia con LDD de 3UFC/mL40.
Estrategias de detección bacteriana basadas en aptámeros no acoplados a nanopartículasLos aptámeros y las NPs se pueden utilizar sin conjugar para la detección de microorganismos específicos. Algunas propiedades, tales como la interacción natural entre aptámeros y AuNPs, han sido útiles para diseñar métodos de detección para E. coli, S. typhimurium y S. aureus. Los estudios de pruebas de concepto han demostrado que los aptámeros libres inhiben la agregación de las AuNPs, pero en presencia de los patógenos blanco, los aptámeros ligan a las bacterias permitiendo la agregación de las AuNPs (produciendo cambio de coloración de la solución)7,10,21,41.
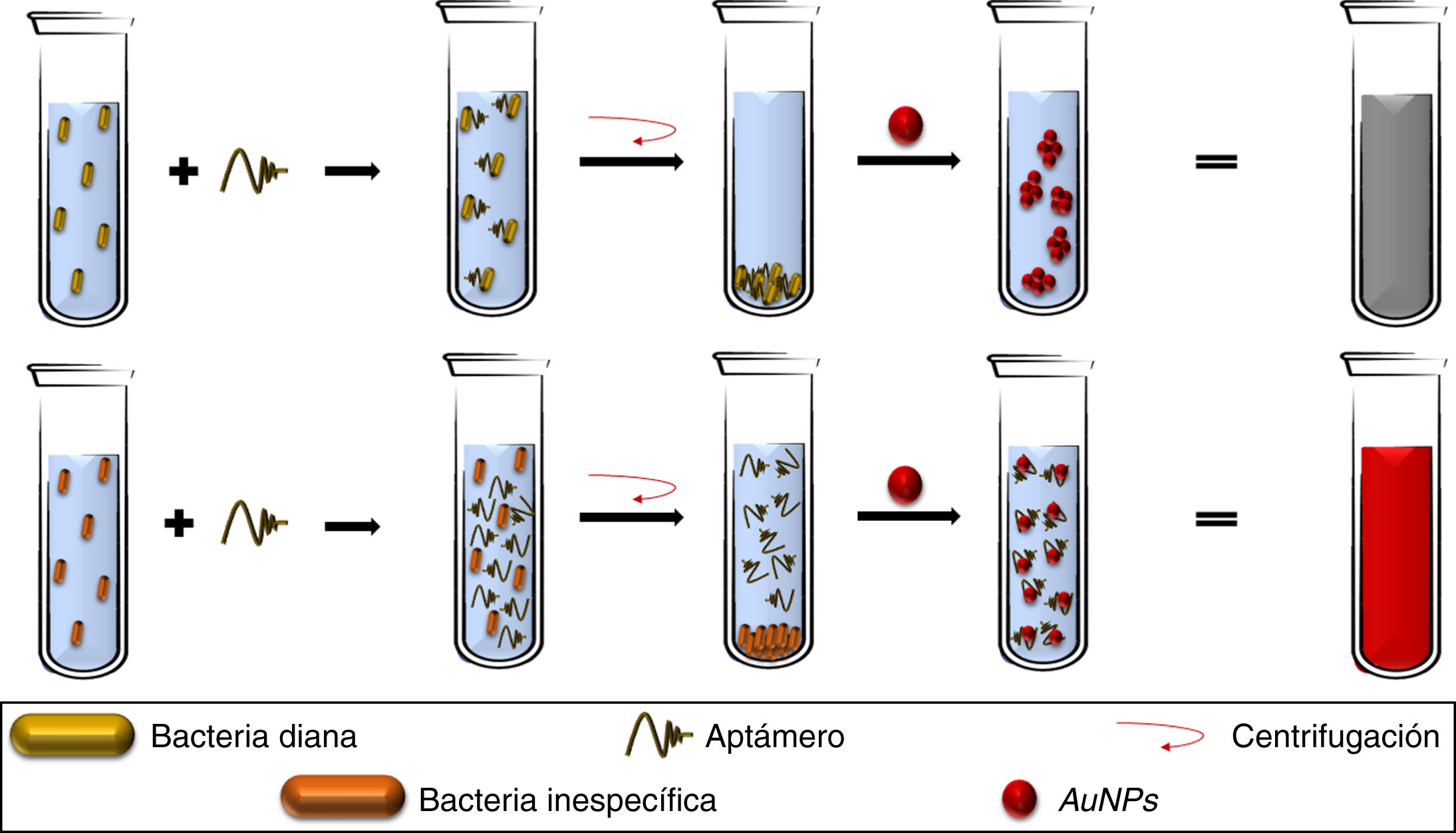
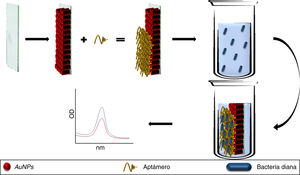
Así también, los aptámeros se pueden utilizar como elementos de reconocimiento y captura de microorganismos, como los métodos de detección descritos para S. aureus42, Campylobacter jejuni y Campylobacter coli43, donde al adicionar aptámeros a soluciones bacterianas, los aptámeros se unen específicamente a su patógeno objetivo, siendo eliminados al descartar el botón celular y permitiendo la agregación de las AuNPs (adicionadas al sobrenadante), obteniendo LDD de 5,6×105UFC/mL (fig. 3), con valores de sensibilidad y especificidad del 80,0% y 93,3%, respectivamente, validados por cultivos suplementados con tazobactam (método estándar)43, abriendo la oportunidad de usar plataformas similares para otras bacterias patógenas, pese a presentar dificultades para reconocer diferentes variantes morfológicas de una misma especie bacteriana43.
Los aptámeros adicionados a un caldo bacteriano ligan con especificidad a las bacterias diana, por lo que, al recuperar el botón celular mediante centrifugación, no hay aptámeros libres en la solución, permitiendo la agregación de AuNPs. Por otra parte, la ausencia de la bacteria específica permite la presencia de aptámeros libres, que mantienen dispersadas a las AuNPs.
AuNPs: nanopartículas de oro.
Pese a las prometedoras características antimicrobianas de las NPs y la especificidad de los aptámeros, estos no se han empleado ampliamente para desarrollar estrategias terapéuticas. Sin embargo, su uso como nanoportadores de fármacos ha sido una estrategia atractiva2,44,45 para incrementar la eficiencia de los antibióticos disponibles45.
Las NPs se pueden administrar por diversas vías44 y, actualmente, existen tratamientos antibacterianos como PolyMemSilver®, Acticoat™, SilvaSorb™ y Aquacel®Ag2, por mencionar algunos, donde las AgNPs figuran como actores principales.
Algunos estudios sugieren toxicidad de ciertas NPs frente a las células del huésped, aunque se pueden modificar para disminuir ese efecto desfavorable14, como su conjugación con aptámeros45 que, adicionalmente, abre la posibilidad de dirigir NPs y/u otros fármacos al sitio apropiado, a concentraciones y periodos de tiempo adecuados2, incrementando su poder antimicrobiano en rangos de 3-250 veces2,14, por lo que han sido útiles para el desarrollo de estrategias terapéuticas novedosas frente a diferentes tipos de cáncer15.
Estudios in vitro de estrategias potencialmente terapéuticasRespecto a la terapéutica frente a infecciones bacterianas basada en aptámeros y NPs existe evidencia escasa pero alentadora. Una de ellas es la modificación de un aptámero anti-SpA con fGmH (2’-F-dG, 2’-OMe-dA/dC/dU), dotándolo de resistencia a la hidrólisis alcalina y a nucleasas presentes en suero. Adicionalmente, los aptámeros se conjugan con AgNPs liberando su acción antimicrobiana específica frente a S. aureus de manera dependiente de SpA46.
El uso de nano keepers como nanoportadores de antibióticos ha mostrado su utilidad, como la inmovilización de vancomicina en los poros de MSNs y su posterior conjugación con un aptámero anti-S. aureus, depositando el fármaco en el sitio preciso, lo que disminuye su concentración inhibitoria mínima y reduce su toxicidad frente a otras especies relacionadas47.
Adicionalmente, el efecto antimicrobiano de las NPs se puede mejorar con el uso de diferentes aptámeros dirigidos frente al mismo patógeno, como lo descrito para E. coli donde la inmovilización de tres aptámeros sobre NPs de dióxido de titanio (TiO2NPs) desactivó al 99,9% de las bacterias en 30min, en contraste aTiO2NPs unidas a un aptámero y TiO2NPs en solitario que las desactivaron en 60min48.
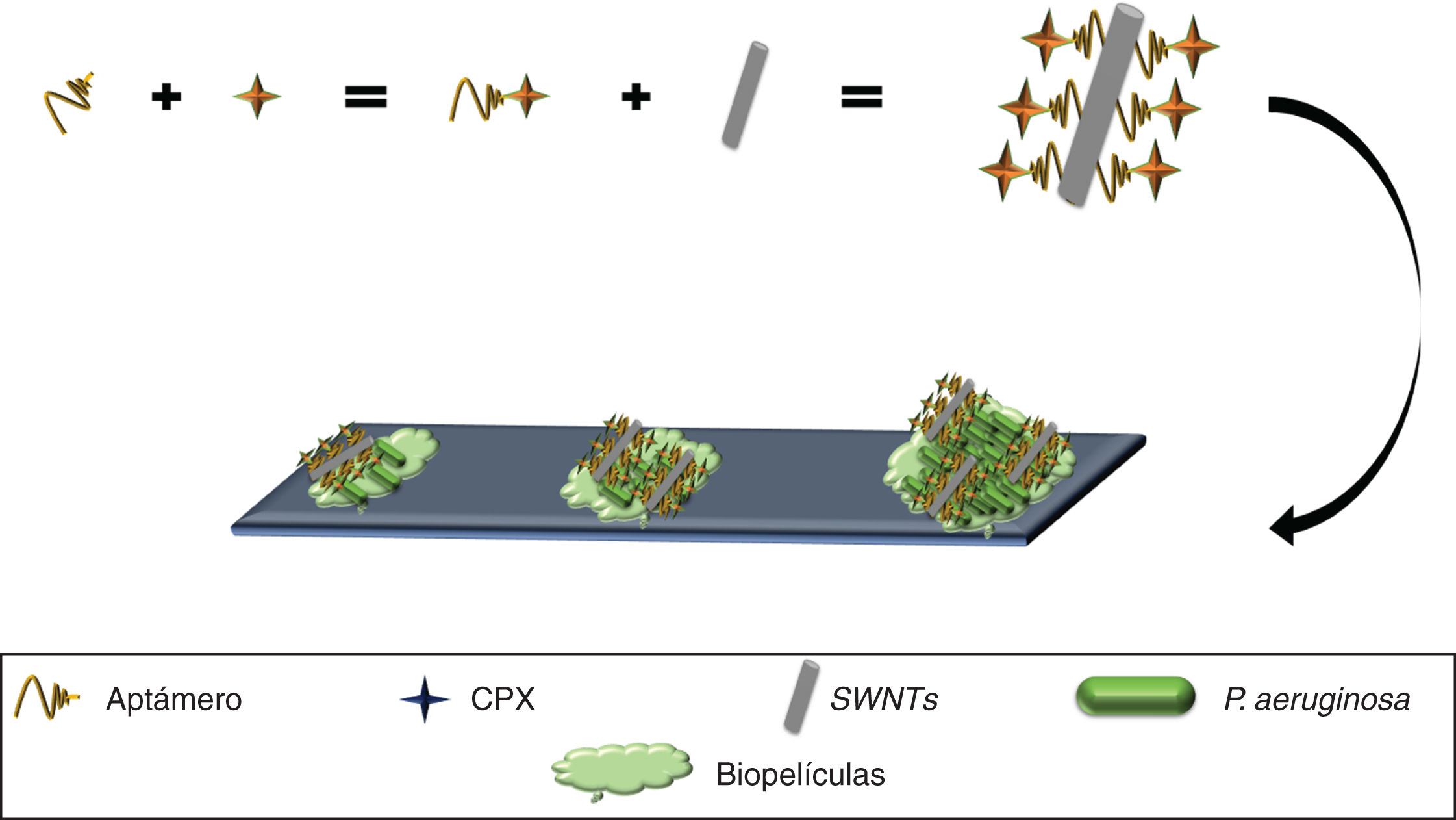
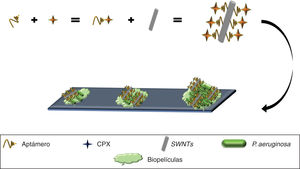
Asimismo, los SWNTs han demostrado poseer actividad frente a biopelículas49 (estrategia primaria utilizada por las bacterias para sobrevivir en distintos ambientes)50 y se han utilizado para desarrollar un nanocompuesto anti-biopelículas de P. aeruginosa, mediante el uso de un aptámero selectivo frente a esta bacteria conjugado con ciprofloxacino (Apt-CPX) y SWNTs (Apt-SWNTs). Adicionalmente se generó una molécula conformada por los tres elementos (Apt-CPX-SWNTs) que en ensayos in vitro logró disminuir en un 90% la formación de biopelículas y degradar ∼75% de biopelículas establecidas (fig. 4), indicando que estas herramientas se podrían emplear para el tratamiento eficaz de biopelículas49.
Aptámero anti-P. aeruginosa acoplado a CPX, complejo inmovilizado sobre SWNTs, mostrando el reconocimiento y unión a P. aeruginosa, inhibiendo el crecimiento bacteriano, formación de biopelículas e incluso la degradación de biopelículas establecidas.
CPX: ciprofloxacino; SWNTs: nanotubos de carbono.
De manera prometedora, se han utilizado aptámeros anti-S. typhimurium marcados con histidina y acoplados a AuNPs (AuNP-AptHis), complejo a su vez conjugado a péptidos antimicrobianos marcados con hexahistidina (A3-APOHis), para erradicar infecciones intracelulares por S. typhimurium, demostrando su funcionamiento in vitro, al liberar a A3-APOHis dentro de células HeLa infectadas con la bacteria. Asimismo, en ensayos in vivo realizados en ratones infectados con dosis que causaban la muerte del animal en 4-5 días, la molécula permitió su supervivencia, al erradicar al patógeno, hecho que se comprobó por la disminución del número de células bacterianas viables en un ∼93-98% en cultivos procedentes de los órganos infectados de cada ratón51, sugiriendo que el uso combinado de aptámeros, NPs e incluso otros compuestos antimicrobianos puede ser útil para el desarrollo de terapias eficaces frente a infecciones causadas por bacterias.
ConclusionesEn los últimos años, la biomedicina nanométrica ha venido posicionándose como una herramienta prometedora para el diagnóstico, prevención y tratamiento de diversas enfermedades, donde los aptámeros y las NPs han demostrado su aplicabilidad para el diagnóstico y tratamiento de diferentes enfermedades. En las infecciones bacterianas, las pruebas de concepto del uso combinado de ambos elementos han permitido detectar células bacterianas individuales de manera rápida y específica, por lo que la implementación en un futuro de esas metodologías podría traducirse en diagnósticos precisos, que mejorarían el pronóstico de los pacientes infectados al recibir terapias específicas y precoces para la erradicación del agente infectante. Asimismo, los estudios in vivo de nanoestructuras complejas constituidas por NPs, aptámeros e incluso otros compuestos antimicrobianos han demostrado que podrían constituir una herramienta poderosa frente a la «crisis de resistencia a los antibióticos», permitiendo erradicar infecciones con dosis bajas de antimicrobianos al depositarlos multivalentemente en el sitio adecuado y durante el periodo de tiempo preciso, constituyendo una terapia ideal que no afectaría al microbioma de órganos o tejidos ni a las células del huésped. Estos avances tecnológicos sugieren que próximamente podrían existir herramientas rápidas y específicas basadas en NPs y aptámeros para el diagnóstico y el tratamiento de las enfermedades infecciosas.
FinanciaciónJuan Carlos Gutiérrez Santana es beneficiado con el apoyo de beca 2018-000068-02NACF-28106 del Consejo Nacional de Ciencia y Tecnología (CONACyT), México, agradeciendo a este organismo su apoyo. Este trabajo está financiado por fondos federales, México, del Instituto Nacional de Pediatría, autorización 068/2019.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.