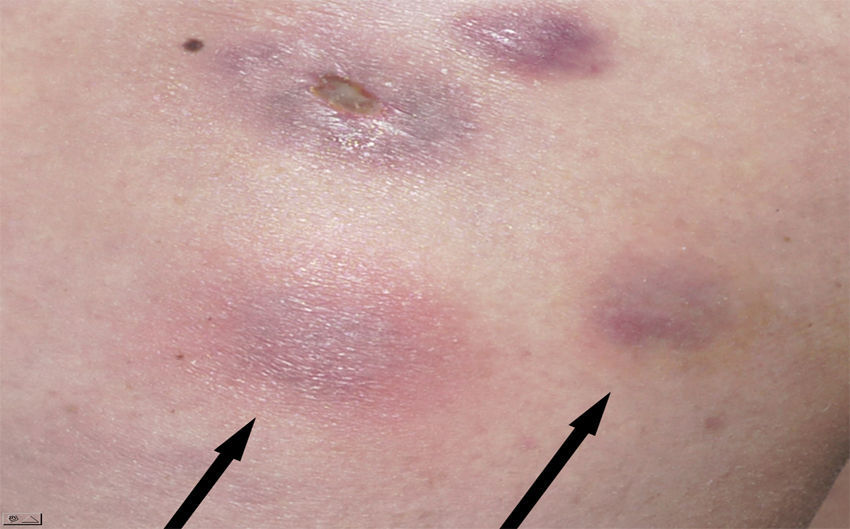
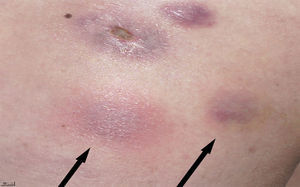
Una mujer de 39 años sin antecedentes de interés había sido sometida a mesoterapia con finalidad estética en la cara externa de ambos muslos por obesidad localizada con un producto que contenía vanadio, extracto de algas (fucus), extracto de plantas (hiedra) y un compuesto homeopático (graphites). Cuatro semanas después comenzaron a aparecer varias oleadas de nódulos subcutáneos eritematosos dolorosos con abscesificación y fistulización posterior eliminando exudado purulento (figs. 1 y 2). La paciente no refería fiebre, pérdida de peso, tos, expectoración ni presentaba adenopatías, esplenomegalia u otro hallazgo patológico en la exploración física. El hemograma, la bioquímica sanguínea y la radiografía de tórax fueron normales. La serología a VIH fue negativa. Inicialmente fue tratada con prednisona por vía oral en pauta descendente (dosis inicial 30mg) y amoxicilina/clavulánico 500/125mg/8h durante dos semanas sin mejoría. Una biopsia cutánea evidenció reacción granulomatosa con paniculitis sin la visualización de bacilos.
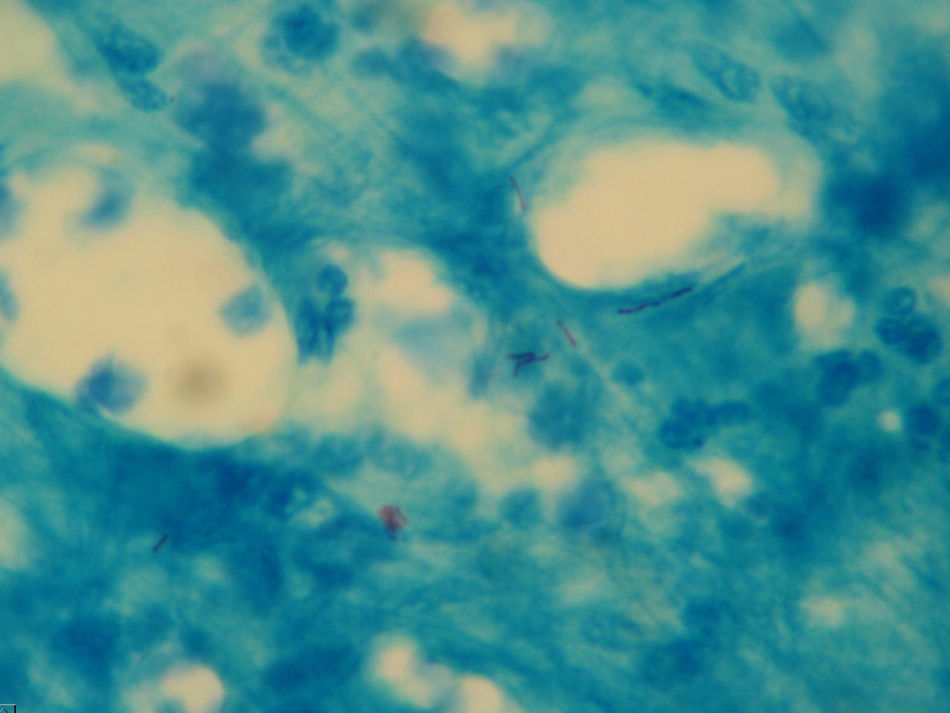
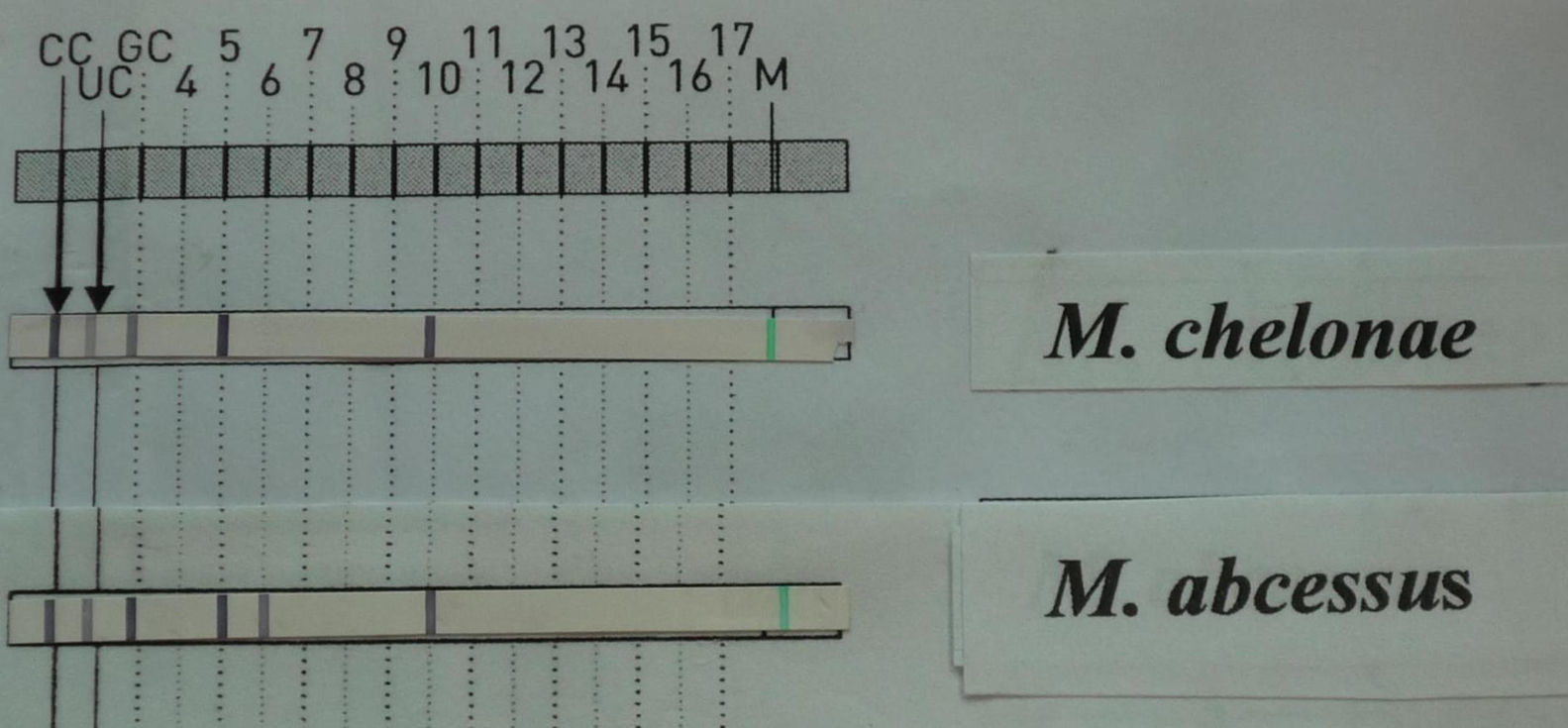
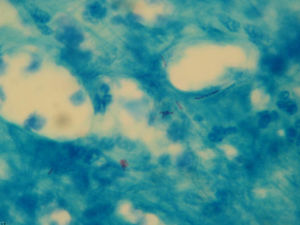
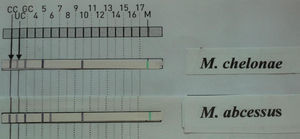
La tinción de Ziehl-Neelsen del material obtenido mediante punción aspirativa realizada cuando uno de los nódulos mostró escasos bacilos ácido-alcohol resistentes (fig. 3). El cultivo bacteriano fue negativo. Varias muestras del exudado purulento fueron sembradas en medios líquidos (Bactec® MGIT 960) y sólido (Löwenstein-Jensen) incubándose este último tanto a 30°C como a 37°C. A los 4 días se detectó abundante crecimiento en el medio de Löwenstein a 30°C y a los 7-10 días en los incubados a 37°C, tanto líquido como sólido, identificándose como Mycobacterium chelonae (M. chelonae) por amplificación y posterior hibridación reversa basada en tecnología DNA-STRIP® de GenoType®Mycobacterium CM (fig. 4). El antibiograma se realizó por E-test y mostró sensibilidad a claritromicina y resisitencia a amikacina, cefotaxima, ciprofloxacino, levofloxacino, doxiciclina, imipenem y linezolid.
EvoluciónLa paciente fue tratada con claritromicina 500mg/12h y moxifloxacino 400mg/24h por vía oral con buena tolerancia. A pesar de ello, la paciente continuó con dolor importante y la aparición de nuevos nódulos durante 5 semanas más, que también se fistulizaron. Posteriormente, la evolución ha sido favorable con cicatrización de las lesiones. La duración del tratamiento fue de 4 meses.
ComentarioLa mesoterapia consiste en la estimulación física y química de la dermis y tejido subcutáneo mediante la inyección de numerosas y variopintas sustancias con efectos muy diversos y poco contrastados como antiinflamatorios no esteroideos, relajantes musculares, vasodilatadoras, lipolíticos (aminofilina), vitaminas y extractos plantas1. Entre las complicaciones de esta controvertida técnica, cuyo objetivo más frecuente es mejorar el aspecto estético del paciente, se encuentran la aparición de hematomas, paniculitis, reacciones urticariales o liquenoides2,3.
Las micobacterias no tuberculosas pueden causar infecciones de la piel y tejido celular subcutáneo generalmente después de un antecedente traumático en piel como inyecciones, laceraciones, depilación, contacto con acuarios e intervenciones quirúrgicas4–8. Característicamente, la mayoría de las infecciones cutáneas tras mesoterapia con finalidad cosmética, han sido producidas por micobacterias de crecimiento rápido como M. chelonae, M. abscessus y M. fortuitum en el contexto de brotes epidémicos y guardan una gran similitud con lo acontecido a nuestra paciente4–8. Estos casos se han atribuido a la inoculación a través de las agujas de un producto contaminado por micobacterias, como ha sido sugerida una revisión basada en un elevado número de casos9, a la utilización de agua corriente para su limpieza10–12. La paciente presentada es el primer caso de infección por M. chelonae tras mesoterapia comunicado en nuestro país7,8.
Las lesiones en casos de infección cutánea por micobacterias atípicas tras mesoterapia (ICMM) se caracterizan por su inicio tardío (entre una y diez semanas después de la inyección) y suelen estar constituidas por nódulos eritematosos dolorosos con crecimiento progresivo (2-5cm) con tendencia a la abscesificación y ulceración4,10. El número de lesiones que aparecen guardan relación con el número de inyecciones realizadas4. La positividad de las tinciones para micobacterias en el exudado inflamatorio se ha situado entre el 4 y el 37%4,9,10. El diagnóstico suele confirmarse mediante el cultivo para micobacterias de las muestras obtenidas mediante punción aspirativa o de la biopsia, que suele ser positivo durante la primera semana de incubación4,9–11. Más del 80% de los pacientes con ICMM habían recibido tratamiento antibiótico inadecuado al inicio de los síntomas por la realización de un diagnóstico erróneo de foruculosis9. El tiempo promedio de diagnóstico definitivo de ICMM en una serie amplia fue de 16 semanas después del inicio de los síntomas debido a un bajo índice de sospecha de infección por micobacterias que retrasó el procesamiento adecuado de las muestras4,9,10. Aunque el método recomendado por el NCCLS para el antibiograma de las micobacterias de crecimiento rápido es la microdilución en caldo, la dilución en agar o la técnica E-test también se consideran alternativas adecuadas13. Se eligió esta última técnica por su rápida y facil lectura e interpretación.
El tratamiento óptimo para las infecciones cutáneas debidas a M. chelonae no está bien establecido en la literatura10. La mayoría de las cepas de M. chelonae son sensibles in vitro a claritromicina, tigeciclina, tobramicina y amikacina14–16. No obstante, a pesar de la instauración de un tratamiento adecuado es frecuente la progresión del cuadro clínico, pudiendo aparecer recidivas tardías10. La mayoría de los pacientes son tratados con dos fármacos entre 4 y 6 meses con la finalidad de evitar recidivas y la aparición de resistencia debidas a monoterapia9,10,17.