Nos gustaría felicitar a Blasco et al. por su iniciativa de realizar de nuevo una evaluación económica de costes y eficiencia de pautas preferentes de tratamiento antirretroviral inicial1. Con el ánimo de contribuir a la discusión y teniendo en cuenta que este tipo de estudios puede presentar limitaciones insalvables por la naturaleza de su diseño, nos parece de especial relevancia comentar algunos aspectos relacionados con las pautas basadas en la combinación a dosis fija de abacavir y lamuvidina (ABC/3TC).
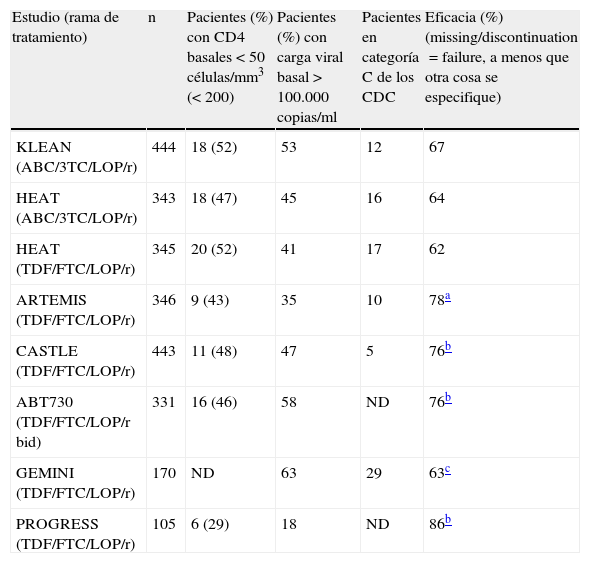
Las eficacias consideradas para ABC/3TC+lopinavir/ritonavir (LPV/r) y tenofovir/emtricitabina (TDF/FTC)+LPV/r en el análisis son del 66 y del 75% (diferencia de 9 puntos), respectivamente, estando basado el cálculo de la eficacia en ambos casos en la media ponderada de resultados de ensayos clínicos realizados con dichas combinaciones. Se han incluido en el análisis los estudios HEAT2 y KLEAN3 para ABC/3TC+LPV/r, y los estudios ARTEMIS4, CASTLE5, ABT7306, GEMINI7, HEAT2 y PROGRESS8 para TDF/FTC+LPV/r. Sin embargo, el único estudio aleatorizado que compara directamente ambas pautas es el estudio HEAT2, un ensayo clínico aleatorizado, doble ciego, que incluyó a 688 pacientes, en el que la pauta ABC/3TC+LPV/r demostró la no inferioridad frente a TDF/FTC+LOP/r (eficacia del 68% versus 67%, respectivamente; IC95% de la diferencia, –6,63 a 7,40; ITT-E missing equal to failure). El análisis de Blasco et al. utiliza para asignar la eficacia de las pautas comparadas el análisis ITT-E missing or non-completer equal to failure, y según este análisis los resultados de eficacia del estudio HEAT son del 64% para ABC/3TC y del 62% para TDF/FTC (IC95% de la diferencia, –5,18 a 9,24; no mostrado en el artículo). Estos intervalos de confianza, que incluyen el 95% de los posibles resultados, no incluyen el valor –9 puntos considerado en el análisis de Blasco et al., lo que sugiere que es muy poco probable que exista en realidad esa diferencia de 9 puntos a favor de TDF/FTC+LPV/r (respecto a ABC/3TC+LPV/r). El resultado de eficacia de la pauta TDF/FTC+LPV/r en el estudio HEAT es el más bajo de los 6 estudios utilizados para asignar la eficacia a esta pauta. Para la asunción de la eficacia media del 75% de TDF/FTC+LPV/r se tuvieron en cuenta algunos estudios (ARTEMIS4, CASTLE5, PROGRESS8) en los que las características basales de los pacientes en términos de carga viral de VIH-1 o recuento basal de linfocitos T CD4+ (2 de los principales marcadores pronósticos de eficacia en estudios de tratamiento antirretroviral) fueron significativamente diferentes de los que presentaban los pacientes incluidos en los estudios utilizados para evaluar la eficacia de ABC/3TC (HEAT2 y KLEAN3) (tabla 1). Como ejemplo, en el estudio PROGRESS la proporción de pacientes con carga viral de VIH-1>100.000copias/ml en la rama de TDF/FTC+LPV/r fue del 18%, frente al 53 y al 45% de la rama de ABC/3TC+LPV/r en los estudios KLEAN y HEAT. En el caso de pacientes con <200 células CD4/μl, los porcentajes fueron del 29% para TDF/FTC+LPV/r y del 52 y del 47% para ABC/3TC+LPV/r. Aunque los autores ajustan acertadamente los valores observados de eficacia para el número de pacientes incluidos en cada estudio, el sesgo inherente de comparar estudios distintos que han incluido poblaciones con características basales significativamente diferentes, realizados en momentos y lugares diferentes y con criterios de inclusión diferentes, debería ser tenido en cuenta, especialmente cuando existe una comparación directa entre 2 pautas que ofrece un diferencial de eficacia significativamente distinto al obtenido usando comparaciones indirectas.
Características basales de los pacientes incluidos en estudios que evaluaron las pautas ABC/3TC+LPV/r o TDF/FTC+LPV/r
| Estudio (rama de tratamiento) | n | Pacientes (%) con CD4 basales <50células/mm3 (<200) | Pacientes (%) con carga viral basal >100.000copias/ml | Pacientes en categoría C de los CDC | Eficacia (%) (missing/discontinuation=failure, a menos que otra cosa se especifique) |
| KLEAN (ABC/3TC/LOP/r) | 444 | 18 (52) | 53 | 12 | 67 |
| HEAT (ABC/3TC/LOP/r) | 343 | 18 (47) | 45 | 16 | 64 |
| HEAT (TDF/FTC/LOP/r) | 345 | 20 (52) | 41 | 17 | 62 |
| ARTEMIS (TDF/FTC/LOP/r) | 346 | 9 (43) | 35 | 10 | 78a |
| CASTLE (TDF/FTC/LOP/r) | 443 | 11 (48) | 47 | 5 | 76b |
| ABT730 (TDF/FTC/LOP/r bid) | 331 | 16 (46) | 58 | ND | 76b |
| GEMINI (TDF/FTC/LOP/r) | 170 | ND | 63 | 29 | 63c |
| PROGRESS (TDF/FTC/LOP/r) | 105 | 6 (29) | 18 | ND | 86b |
ND: datos no disponibles en la publicación.
En relación a la prueba del HLA-B*5701 y en línea con lo que recomiendan tanto la ficha técnica del medicamento como todas las guías de tratamiento, el modelo imputa el coste de la prueba a las pautas basadas en ABC/3TC. Sin embargo, para la asignación de los datos de eficacia y efectos adversos se recogen datos de estudios en los que no se realizó la prueba del HLA-B*5701. Estos estudios observaron, por tanto, un porcentaje de toxicidad e interrupciones por reacciones de hipersensibilidad (RHS) potencialmente asociadas a ABC mayor del observado cuando se hace un cribado previo con la prueba del HLA-B*57019. Esto lleva a que se aplique el coste del HLA-B*5701 a las pautas con ABC/3TC y a la vez no se consideren los beneficios derivados de utilizarla (reducción significativa de casos de sospecha de RHS).
Por otra parte, esta prueba evalúa un marcador genético que no cambia a lo largo de la vida del individuo. Por ello, el análisis a 48 semanas penaliza a la combinación ABC/3TC, dado que el coste completo de la prueba del HLA-B*5701 se contabiliza el primer año y no de manera proporcional a la duración real del tratamiento, permitiendo solo recoger los efectos adversos y discontinuaciones producidas durante las primeras 48 semanas y no las toxicidades a largo plazo, lo cual podría penalizar las pautas con peor tolerabilidad inicial pero menor potencial de toxicidades acumulativas en el largo plazo.
Respecto al análisis de coste de iniciar el tratamiento, si consideramos que los cambios de tratamiento por sus pautas alternativas son adecuados para conseguir que el paciente sea respondedor a la semana 48, no queda claro cuál sería la información adicional que aporta el análisis de coste por respondedor, aparte de reflejar el coste de un respondedor que no ha cambiado de tratamiento durante las primeras 48 semanas.
Finalmente, con respecto a la pauta ABC/3TC+atazanavir/ritonavir (ATV/r), sugerimos a los autores evaluar la posibilidad de incluir en un próximo análisis los datos de la rama de ATV/r del estudio ARIES10, solicitando los resultados a 48 semanas al promotor del estudio. Este estudio fue el primero en incluir la realización de forma rutinaria de la prueba del HLA-B*5701 antes de la aleatorización de los pacientes.
Conflicto de interesesJose E. Martín Herrero y Felipe Rodríguez Alcántara trabajan para ViiV Healthcare S.L., compañía que comercializa Kivexa® (combinación a dosis fija de abacavir/lamivudina). Javier Parrondo García trabaja para GlaxoSmithKline S.A. y da soporte a ViiV Healthcare S.L. en asuntos de acceso al mercado de medicamentos.