El uso de anticuerpos contra el factor de necrosis tumoral alfa (anti-TNF) aumenta el riesgo de tuberculosis (TB) en pacientes con enfermedad inflamatoria intestinal (EII). GETECCU publicó las primeras guías de cribado de TB para pacientes con EII en 2003 y las revisó en 2006. Sin embargo, la implementación en la práctica clínica de nuevas pruebas diagnósticas como los test de liberación de interferón gamma, el mayor conocimiento epidemiológico y clínico de la TB en el contexto de tratamiento anti-TNF y la evidencia de que las recomendaciones de cribado de infección tuberculosa latente en pacientes candidatos a terapia anti-TNF disminuye pero no erradica los casos de TB han motivado la revisión de las recomendaciones de GETECCU al respecto.
The use of antibodies against tumor necrosis factor alpha (anti-TNF) increases the risk of tuberculosis (TB) in patients with inflammatory bowel diseases (IBD). The Spanish Working Group in IBD (GETECCU) developed the first guidelines for TB screening in IBD in 2003, and they were further reviewed in 2006. However, the widespread use in clinical practice of new diagnostic tools such as interferon-gamma release assays, the better knowledge of epidemiological and clinical features of TB in the setting of anti-TNF therapy, and the evidence that TB has decreased but still occurs despite the implementation of guidelines for the screening of latent TB infection, prompted a new revision of the GETECCU recommendations.
Tras la comunicación del mayor riesgo de tuberculosis (TB) en pacientes tratados con fármacos inhibidores del factor de necrosis tumoral alfa (anti-TNF)1, distintas sociedades científicas publicaron guías para minimizarlo2-4. El Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU) publicó sus primeras recomendaciones en enero de 20035, que fueron revisadas en el año 20066. La aparición de los test de liberación de interferón gamma (IGRA, del inglés Interferon Gamma Release Assay) y la evidencia de que el seguimiento de las recomendaciones disminuye7-9 pero no erradica los casos de TB han motivado la revisión de estas guías10. Actualmente se plantean diferentes estrategias para el diagnóstico de la infección tuberculosa latente (ITL): sustitución de la prueba de la tuberculina (PT) por los IGRA11,12, utilización indistinta de ambos test13-15 y uso conjunto de los mismos (estrategia de «cualquier test positivo»)16,17.
Las estrategias de diagnóstico y tratamiento de la ITL en candidatos a anti-TNF deben adaptarse a la epidemiología local de la TB18,19. Aunque en España la incidencia de la TB está disminuyendo progresivamente20, las guías de países de baja incidencia no deberían ser asumidas directamente como propias, sin haberse tenido previamente en cuenta características epidemiológicas locales. Por todo ello, GETECCU ha decidido actualizar sus recomendaciones para la prevención de la TB en los pacientes con enfermedad inflamatoria intestinal (EII).
Epidemiología de la tuberculosis en pacientes con enfermedad inflamatoria intestinal: factores de riesgoEspaña, con una incidencia de TB en el año 2013 de 11,88 casos/100.000 habitantes, se encuadra entre las áreas de baja incidencia (<20 casos/100.000 habitantes/año), si bien hay amplias variaciones de frecuencia entre las distintas comunidades autónomas; Ceuta, Melilla y Galicia presentan tasas de incidencia superiores a 20 casos/100.000 habitantes, mientras que en otras, como en Andalucía, Navarra, Castilla-La Mancha, Extremadura y Canarias, estas tasas son inferiores a 10 casos/100.00020. Hasta el año 2000 las tasas de incidencia de TB en España fueron mayores (hasta 40 casos/100.000 habitantes), lo que explicaría la elevada frecuencia de ITL (12,5-33,5%)21,22 que aún hoy se objetiva en pacientes con EII y que los sitúa en riesgo de reactivación de la infección.
Factores de riesgo de tuberculosis en pacientes con enfermedad inflamatoria intestinalLa infección por Mycobacterium tuberculosis se adquiere, habitualmente, por la inhalación de gotas de aerosol a partir de una persona infectada. Un 50-70% de los individuos infectados pueden eliminar la infección a través de la inmunidad innata o adaptativa; el resto evolucionan hacia la ITL (95%), o hacia la enfermedad activa precoz (5%). A lo largo de la vida, un 10% de los pacientes con ITL reactivarán la infección y desarrollarán una enfermedad activa23.
Existen factores que aumentan el riesgo de reactivación de una ITL por encima del 10%, algunos de los cuales pueden estar presentes en los pacientes con EII con más frecuencia que en la población general (p.ej., malnutrición, tabaquismo en pacientes con enfermedad de Crohn)24. Por otra parte, estos pacientes también se encuentran en riesgo de transmisión nosocomial de M.tuberculosis, al precisar con frecuencia ingresos hospitalarios y visitas al hospital (urgencias, tratamientos en hospital de día, consultas ambulatorias, realización de técnicas radiológicas y endoscópicas, etc.)25.
El perfil del paciente con TB ha cambiado, y a los tradicionales colectivos afectados en las últimas décadas (inmunodeprimidos, personas procedentes de países de alta prevalencia…) se han añadido otros, como los viajeros y las personas tratadas con fármacos inmunosupresores y biológicos. El tratamiento con fármacos inmunosupresores (tiopurinas, metotrexato, inhibidores de la calcineurina) y con corticoides incrementa el riesgo de TB26. En el registro TREAT, los corticoides fueron el factor aislado que más se asociaba a complicaciones infecciosas, tanto en cifras absolutas como considerando tan solo las graves27. Como en todas las infecciones, los tratamientos inmunosupresores combinados implican un mayor riesgo de TB26,28.
La aparición y la notificación de casos de TB en pacientes tratados con el primer anti-TNF aprobado (infliximab) constituyen la demostración de que los ensayos clínicos pueden no ser adecuados para detectar efectos adversos poco frecuentes1. Se han comunicado también casos de TB en pacientes expuestos a otros anti-TNF disponibles con posterioridad, como adalimumab, certolizumab y golimumab29. Actualmente disponemos de fármacos biológicos con distinto mecanismo de acción; aunque el riesgo de TB con fármacos anti IL 12/23 (ustekinumab) o con anti-integrinas (vedolizumab, natalizumab) parece menor, se han descrito también casos de TB asociados a su uso, habiéndose incorporado en la ficha técnica de los mismos la necesidad de cribado de ITL antes de su administración30,31; por otra parte, nuevos fármacos inmunomoduladores, como tofacitinib, parecen asociarse en un metaanálisis a un riesgo de TB equiparable al de los anti-TNF32. No obstante, fuera del tratamiento anti-TNF el riesgo-beneficio del tratamiento de la ITL no está claramente establecido, por lo que estas recomendaciones se ciñen fundamentalmente a este grupo de pacientes.
¿Por qué siguen apareciendo casos de tuberculosis a pesar de las recomendaciones de prevención?Son varias las causas por las que siguen apareciendo casos de TB durante el tratamiento con agentes anti-TNF33-37. En primer lugar, el incumplimiento de las recomendaciones de cribado y manejo de la ITL podría explicar hasta el 80% de casos de TB en algunas series18,38. En una encuesta europea, el 20-27% de gastroenterólogos no seguían las recomendaciones de cribado de ITL39. En España, en el 40-58% de los casos de TB en pacientes con EII que recibían tratamiento biológico no se habían seguido correctamente las recomendaciones; en la mayoría de los casos se debía a no haberse realizado el doble test en la PT (booster) o a no haberse indicado la quimioprofilaxis cuando esta era necesaria25,40. La no realización del booster era también la principal causa de no cumplimiento de las recomendaciones entre los reumatólogos españoles41. Dado que el riesgo de TB es 7 veces mayor en los pacientes en los que no se habían seguido las recomendaciones respecto a los pacientes en los que sí se habían seguido41, tanto GETECCU42 como la European Crohn's and Colitis Organisation (ECCO)19 recomiendan rellenar listados de verificación (check list) de forma sistemática antes de iniciar un tratamiento anti-TNF.
En segundo lugar, la sensibilidad de la PT para el diagnóstico de ITL es baja en estados de inmunosupresión, situación frecuente entre los pacientes con EII43. Una estrategia para aumentar la sensibilidad de la PT es la realización de las pruebas de cribado en el momento del diagnóstico de la EII, antes de iniciar el tratamiento con corticoides o inmunosupresores19,42. El papel de los IGRA en el diagnóstico de la ITL será discutido más adelante.
En tercer lugar, el tratamiento de la ITL no siempre es eficaz en prevenir la reactivación de la infección; en 3 series españolas35,36,40, hasta el 12% de los casos se produjeron en pacientes que habían recibido quimioprofilaxis con isoniazida.
En cuarto lugar, pueden no haberse recogido factores de riesgo en la historia clínica del paciente, como el contacto con familiares con TB, o la procedencia o estancias en países de alta prevalencia de TB. Los pacientes nacidos en áreas endémicas tienen un riesgo 10 veces mayor de desarrollar TB38, habiéndose también descrito casos de TB después de viajar a estos países44; deben extremarse las precauciones con los viajeros a Centroamérica, gran parte de Sudamérica, países del Este de Europa, África y Sudeste Asiático. El segundo consenso de ECCO sobre infecciones oportunistas19 ya incluye un apartado específico relacionado con este tema.
Por último, algunos casos que aparecen después de un año del inicio del tratamiento anti-TNF podrían corresponder a infecciones de novo38,45,46. Se ha sugerido38 que las diferencias en la mediana de tiempo para la aparición de TB entre las series actuales y la primera descrita por Keane et al.1 (12meses vs. 14semanas) se deberían a un menor porcentaje de reactivaciones por la eficacia de las medidas de profilaxis y a una mayor frecuencia de infecciones de novo. No obstante, se han demostrado reactivaciones de ITL hasta 58meses tras el inicio de terapia anti-TNF25. En estos casos es importante tener en cuenta los viajes o estancias en países endémicos y la posibilidad de transmisión nosocomial25. Los estudios de epidemiología molecular, mediante genotipado de M.tuberculosis, podrían confirmar si se trata de infecciones de novo o reactivaciones tardías.
Métodos diagnósticos de la infección tuberculosa latenteNo existe un patrón oro para el diagnóstico de la ITL. El proceso diagnóstico debe incluir:
- 1.
Anamnesis dirigida a factores de riesgo de exposición a M.tuberculosis: contacto con personas con TB activa, procedencia o viajes a países con alta prevalencia de TB, personal sanitario, residentes y trabajadores de instituciones cerradas (prisiones, albergues u otros centros sociosanitarios), abuso de alcohol u otros tóxicos, estados de inmunosupresión y otras comorbilidades (infección por el virus de la inmunodeficiencia humana [VIH], enfermedades autoinmunes, trasplantados, tumores, silicosis, insuficiencia renal crónica, gastrectomía, diabetes).
- 2.
Realización de una radiografía de tórax con búsqueda de signos de una TB previa (ganglios o nódulos calcificados, engrosamiento apical pleural, tractos fibrosos). La tomografía computarizada (TC) de tórax es más sensible que la radiología simple para detectar lesiones pulmonares; sin embargo, su uso sistemático no estaría indicado dado el elevado coste y riesgo de radiación frente al bajo incremento diagnóstico47.
- 3.
Pruebas de inmunodiagnóstico, basadas en la detección de una respuesta inmune frente al M.tuberculosis, como son la prueba de la tuberculina (PT) y los test liberación de interferón gamma (IGRA). No permiten diferenciar una ITL de una infección activa.
PT. La PT detecta, in vivo, una hipersensibilidad celular retardada frente al PPD (derivado proteico purificado que contiene más de 200 proteínas de M.tuberculosis, algunas presentes también en BCG y algunas micobacterias ambientales); la técnica que se utiliza es la intradermorreacción de Mantoux en la cara ventral del antebrazo, y la lectura se practica 72h después, midiendo el diámetro transversal de la induración según el eje longitudinal del antebrazo. En la práctica clínica se considera positiva cuando la induración es ≥5mm. En pacientes con enfermedades reumáticas o con EII bajo tratamiento inmunosupresor, la realización de una segunda PT a los 7-10días de una primera negativa permite diagnosticar hasta el 14% del total de pacientes con una PT positiva21,41; si la segunda PT se realiza a todos los pacientes, independientemente de que reciban tratamiento inmunosupresor o no, el 5-23% del total de resultados positivos se producen en este segundo test22,48. Estas positivizaciones se deben al llamado efecto empuje o booster sobre la respuesta inmunitaria de una segunda inyección de PPD en sujetos previamente infectados (aunque también pueden aparecer en vacunados).
La especificidad de la PT para el diagnóstico de la ITL se ve reducida por la presencia de micobacterias ambientales y, especialmente, por la vacunación BCG49, aunque esta dependerá especialmente de la pauta utilizada; así, los vacunados en el momento del nacimiento rara vez tendrán falsos positivos tras 10años, frente a un 20% de falsos positivos si la vacunación se produce después del primer año de vida50. En España, la vacunación BCG fue obligatoria al nacimiento entre 1965 y 1981, por lo que su influencia sobre el resultado de la PT podría no ser muy importante; no obstante, debe tenerse en cuenta que en la población inmigrante procedente de países en los que sea obligatoria aún la vacunación BCG sí puede estar comprometida la especificidad de la PT.
La sensibilidad de la PT estará influenciada por estados de inmunosupresión y por problemas inherentes a la propia prueba (fallos en la conservación o en la dilución de la tuberculina PPD, inyección incorrecta, error en la lectura). En diversos estudios, tanto nacionales22,48 como internacionales51-53, se ha demostrado la influencia de los corticoides e inmunomoduladores sobre la sensibilidad de la PT. No disponemos de estudios que hayan evaluado el papel de los test cutáneos de anergia en la detección de falsos negativos de la PT en pacientes con EII bajo tratamiento inmunosupresor. En cuanto a la existencia de diferencias en la realización o interpretación de la técnica, se ha constatado que el porcentaje de pacientes con una PT positiva pasó del 16 al 26% al ser realizada en el hospital, siempre por la misma enfermera experta, en vez de realizarse a cada paciente en su centro de salud22.
En resumen, las principales limitaciones de la PT son la posible influencia de las micobacterias ambientales y la vacunación BCG previa (falsos positivos) y de la inmunosupresión (falsos negativos), así como la posibilidad de discrepancias en el resultado dependiendo de la realización o interpretación de la técnica. Por otra parte, ha habido periodos de tiempo con problemas de escasez de PPD, por falta de su suministro.
Test IGRA. Los test IGRA permiten la cuantificación, in vitro, de la respuesta inmune celular frente a M.tuberculosis, al detectar la producción de interferón-gamma (IFN-γ) por los linfocitosT sensibilizados. Los antígenos utilizados para estimular la respuesta inmune (ESAT-6, CFP-10 y TB 7.7) son codificados por genes del M.tuberculosis, y no están presentes en la vacuna BCG ni en la mayoría de las micobacterias ambientales (excepto en M.kansasii, M.marinum y M.szulgai).
En la actualidad hay comercializados 2 test IGRA: el QuantiFERON-TB Gold In-Tube (QFT-GIT) y el T-SPOT.TB (T-Spot), cuyas características se resumen en la tabla 154. Las ventajas de los IGRA respecto a la PT son la ausencia de interferencias con la vacuna BCG, la objetividad en la interpretación de los resultados y la no necesidad de una segunda visita de lectura. Por otra parte, las principales limitaciones o áreas de incertidumbre en el uso de los IGRA son las siguientes.
Tabla 1.Características técnicas e interpretación de resultados de los test IGRA comercializados
Tipo de test IGRA Realización de la técnica Interpretación de resultados QuantiFERON-TB Gold-In-Tube test (QFT-GIT) Extracción de 3ml de sangre; 1ml se recoge en el tubo problema (contiene los antígenos ESAT-6, CFP-10, TB7.7), 1ml en el tubo control positivo (contiene fitohemaglutinina) y 1ml en el tubo control negativo (no contiene reactivos). La fitohemaglutinina induce, de forma inespecífica, la liberación de interferón por los linfocitosTIncubación durante 18-22h en estufa a 37°CCentrifugado de los tubos, se hace un ELISA en el plasma obtenido. El plasma podría ser almacenado, lo cual permitiría diferir la prueba y organizar la carga de trabajo del laboratorio Resultado positivo si la concentración de IFN-γ en el tubo problema es ≥0,35UI/ml que en el control negativoResultado indeterminado cuando el valor del control negativo es superior a 8,0UI/ml o el valor del control positivo es <0,5UI/ml T-SPOT.TB (T-Spot) Extracción de 8-10ml de sangre heparinizadaCentrifugación, y aislamiento de las células mononucleares, ajustando su número a 250.000 células/mlInoculación en 4 pocillos (2 contienen los antígenos ESAT-6 y CFP-10, uno es el control positivo con fitohemaglutinina y uno el control negativo sin reactivos)Incubación de la placa durante 18-22h en estufa a 37°CInmunospot (cada mancha o spot es una célulaT productora de IFN-γ) Resultado positivo es cuando en cualquiera de los pocillos problema hay ≥6 manchas que en el control negativoResultado indeterminado cuando hay ≥10 manchas en el control negativo o hay ≤20 manchas en el control positivo Los resultados indeterminados se producen cuando hay un alto nivel de IFN-γ en el control negativo o un bajo nivel en el control positivo, e impiden confirmar o descartar un diagnóstico de infección TB. Estos resultados indeterminados se han asociado a retraso en la incubación de la muestra55, linfopenia, hipoalbuminemia, tratamiento inmunosupresor y, especialmente, al uso de corticoides22,56-58, y son mayores con T-Spot (6-6,4%) que con QFT-GIT (2,4-2,8%)22,52.
- •
Es posible que tras la realización de una PT se produzca un refuerzo en la producción de IFN-γ que altere los resultados de los IGRA; esto ocurre cuando los IGRA se realizan más de 3 días tras la inyección de PPD, y especialmente en sujetos que ya eran IGRA positivos, aunque también se ha observado positivización en un 12% de sujetos IGRA negativos59. Por tanto, se recomienda que los test IGRA se hagan simultáneamente a la inyección de PPD, o no más de 3 días tras ella.
- •
La utilidad de los test IGRA en la monitorización de la infección TB se ve limitada por las frecuentes fluctuaciones en los niveles de IFN-γ (falsas conversiones y falsas reversiones) cuando se realizan de manera repetida59, y por la posible influencia del tratamiento anti-TNF en su resultado60-62, dada la capacidad de estos fármacos de disminuir, en modelos experimentales, el número de linfocitosT productores de IFN-γ63.
- •
La PT detecta infecciones más antiguas que los test IGRA64. En estos casos, el nivel de IFN-γ no aumentaría durante las 16h de exposición al antígeno en los test IGRA, pero sí tras las 72h de exposición en la PT. La incubación prolongada en los IGRA podría detectar también infecciones remotas65.
- •
El efecto de los fármacos inmunosupresores (corticoides e inmunomoduladores) sobre los resultados de los IGRA se ha constatado en algunos estudios62,66, aunque no en otros22,51,52,67. Un metaanálisis sobre la capacidad diagnóstica de los IGRA en pacientes con EII mostró que la inmunosupresión afectaba a su resultado, aunque el grado de heterogeneidad de los estudios incluidos (distintas poblaciones, uso de distintos regímenes de tratamiento, diferentes dosis o combinaciones de inmunosupresores, uso de distintas generaciones o tipos de IGRA) era muy elevado53. Independientemente del efecto de la inmunosupresión sobre los IGRA, lo que sí se ha demostrado es que la adición de estos a la PT en pacientes con EII bajo tratamiento inmunosupresor aumenta el número de pacientes diagnosticados de ITL en nuestro medio, siendo mayor la mejora diagnóstica con el T-Spot (56%) que con el QFT-GIT (22%)22.
- •
La concordancia entre los resultados de la PT y los IGRA es baja. Esto podría deberse a la influencia de la vacunación BCG sobre la PT y no sobre los IGRA, a la mayor capacidad de la PT sobre los IGRA para detectar infecciones antiguas, y a posibles diferencias en el grado de influencia de los fármacos inmunosupresores y biológicos sobre cada test. Por tanto, probablemente los 2 tipos de test evalúan distintos aspectos de la respuesta de la inmunidad celular ante la infección tuberculosa y, hoy por hoy, serían más complementarios que alternativos el uno del otro.
- •
Dado que la inmunosupresión afecta tanto a la PT como a los IGRA, y una única prueba no es capaz de detectar a todos los pacientes en riesgo68, se han recomendado 2 estrategias para aumentar la sensibilidad de los test diagnósticos:
- •
Dado que muchos pacientes con EII van a recibir tratamiento inmunosupresor, parece adecuada la realización de cribado en el momento del diagnóstico de la EII, antes de que el paciente reciba inmunosupresión (o de llevar más de 2semanas con ella) o, en su defecto, tras el tratamiento del primer brote (3semanas tras la suspensión de los corticoides)19,53,57,62. Si no ha sido posible este cribado inicial, se podría realizar el estudio posteriormente, en una fase de la EII en la que el paciente no esté recibiendo inmunosupresores. El coste-beneficio de esta estrategia podría variar según la frecuencia de la ITL en la población general de cada área. En esta situación de inmunocompetencia la PT es preferible, al detectar tanto contactos antiguos como recientes, y no sería necesario hacer una segunda PT (booster). Con esta estrategia, si el paciente presenta una ITL y precisa precozmente tratamiento anti-TNF se indicará la quimioprofilaxis con isoniazida; en caso contrario, se hará la quimioprofilaxis cuando precise la terapia anti-TNF, para evitar el sobretratamiento de los pacientes con ITL que nunca van a precisar el uso de estos fármacos.
- •
Cuando los pacientes con EII van a comenzar un tratamiento anti-TNF, habitualmente presentan una enfermedad activa y se encuentran bajo tratamiento inmunosupresor (corticoides y/o inmunomoduladores), siendo también posible encontrarnos con situaciones de malnutrición, por lo que la sensibilidad de los test de inmunodiagnóstico de ITL va a verse afectada. En este escenario, en los pacientes sin estudios de cribado o con estudios previos negativos se debe realizar un cribado doble (PT e IGRA en el mismo día o antes de 3días). Esta estrategia doble ha producido, en estudios en nuestro medio22 y en otros países68,69, un aumento en la identificación de pacientes en riesgo, y es recomendada por la CDC70 y otras sociedades científicas españolas17. En esta estrategia doble, los pacientes con cualquiera de los 2 test positivos deberían recibir tratamiento de ITL, dado que en estos casos debería primar la sensibilidad sobre la especificidad.
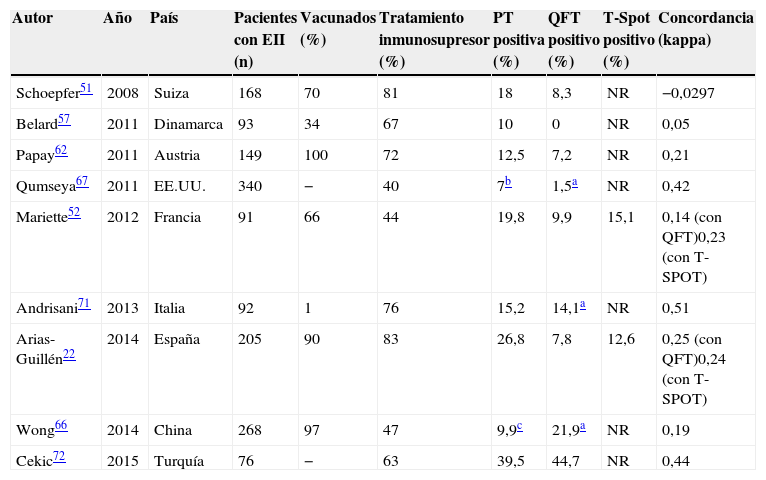
En la tabla 2 se describen los principales resultados de los estudios que han utilizado conjuntamente la PT y un test IGRA para el cribado de ITL en pacientes con EII.
Tabla 2.Resultados de los estudios de cribado de infección tuberculosa latente usando la prueba de la tuberculina y un test IGRA (cribado doble) en pacientes con enfermedad inflamatoria intestinal
Autor Año País Pacientes con EII (n) Vacunados (%) Tratamiento inmunosupresor (%) PT positiva (%) QFT positivo (%) T-Spot positivo (%) Concordancia (kappa) Schoepfer51 2008 Suiza 168 70 81 18 8,3 NR −0,0297 Belard57 2011 Dinamarca 93 34 67 10 0 NR 0,05 Papay62 2011 Austria 149 100 72 12,5 7,2 NR 0,21 Qumseya67 2011 EE.UU. 340 − 40 7b 1,5a NR 0,42 Mariette52 2012 Francia 91 66 44 19,8 9,9 15,1 0,14 (con QFT)0,23 (con T-SPOT) Andrisani71 2013 Italia 92 1 76 15,2 14,1a NR 0,51 Arias-Guillén22 2014 España 205 90 83 26,8 7,8 12,6 0,25 (con QFT)0,24 (con T-SPOT) Wong66 2014 China 268 97 47 9,9c 21,9a NR 0,19 Cekic72 2015 Turquía 76 − 63 39,5 44,7 NR 0,44 EII: enfermedad inflamatoria intestinal; IGRA: interferon gamma release assay; NR: no realizado; PT: prueba de la tuberculina; QFT: quantiferón.
- •
En España, entre un 18 y un 53% de los casos de TB asociados a tratamiento anti-TNF aparecen después de un año de iniciado este25,35,36,40. Ante la sospecha clínica de TB (fiebre, astenia, malestar general, tos) deben hacerse las pruebas diagnósticas oportunas para descartar o confirmar la misma; en este sentido, debe tenerse en cuenta que 2 terceras partes de los casos se van a manifestar como formas extrapulmonares1. Si se diagnostica una TB activa debe realizarse tratamiento completo para TB y suspender el anti-TNF, el cual puede reiniciarse pasados 2 meses19.
Ahora bien, ¿podrían prevenirse algunos de estos casos realizando pruebas de cribado repetidas? ¿Qué test de inmunodiagnóstico deberíamos usar? ¿Con qué periodicidad? Todas estas son preguntas para las cuales aún no tenemos respuestas. En 3 estudios españoles se han descrito tasas anuales de conversión de la PT variables (1-8%)73-75 y, a pesar de las ya comentadas posibles limitaciones del uso de los IGRA en pacientes que reciben anti-TNF, también se han comunicado porcentajes de positivización del QFT-GIT del 0-13%75,76. Sin embargo, no se sabe con certeza si la conversión de alguno de estos test se debe a la detección de un nuevo contacto o a la positivización de un falso negativo debido a la mejoría del estado inmunológico del paciente.
Con los datos disponibles hasta este momento, no existe evidencia suficiente para recomendar de manera rutinaria la realización de pruebas repetidas anuales (o con otra periodicidad) para la detección de infección TB a todos los pacientes que reciben un anti-TNF. En este escenario, el consenso de la ECCO recomienda repetir el cribado de infección TB únicamente en los pacientes con contactos claros o viajes a países endémicos; en estos casos recomienda hacerlo a las 8-10semanas del contacto o de la vuelta del viaje19. Son necesarios más estudios que confirmen si existen otros grupos de riesgo (p.ej., hospitalización reciente) que pudiesen beneficiarse de un cribado de infección TB durante el tratamiento anti-TNF25.
Tratamiento de la infección tuberculosa latenteEl régimen preferido para el tratamiento de la ITL consiste en isoniazida durante 9meses a una dosis de 5mg/kg/día (máximo 300mg/día)77. Los estudios aleatorizados demuestran la eficacia de esta pauta, con tasas de protección por encima del 90% cuando se completa un curso de 9meses, descendiendo la protección a un 60-80% cuando la duración del ciclo es de 6meses78. Esta pauta es recomendada por los reumatólogos en nuestro país7 y por la mayoría de guías internacionales que contemplan el manejo de pacientes que van a recibir terapia biológica10.
Las pautas con rifampicina deben ser consideradas para personas en las que se sospecha han estado expuestas a una cepa de M.tuberculosis resistente a isoniazida o que han presentado efectos adversos con isoniazida. Puede usarse rifampicina a una dosis de 10-20mg/kg/día (máximo 600mg/día) durante 4meses, con menores efectos adversos y mejor adherencia que la pauta de 9meses con isoniazida79. Otra pauta aceptada es la administración diaria conjunta de 300mg de isoniazida y 600mg de rifampicina durante 3meses. Por último, una pauta con administración supervisada semanal de isoniazida (900mg) y rifapentina (900mg) durante 3meses tiene similar eficacia que la pauta clásica de 9meses con isoniazida, y se asocia a tasas mayores de cumplimiento (82% vs 69%) y menos toxicidad hepática (0,4% vs. 2,7%)80. Sin embargo, esta última pauta se asocia con una mayor tasa de interrupción permanente por efectos adversos (4,9% vs. 3,7%) y no se ha probado su eficacia en pacientes inmunodeprimidos.
Se considera que el 0,15% de pacientes desarrollarán hepatotoxicidad relevante asociada a isoniazida, y que esta puede ser ocasionalmente grave e incluso mortal81. En un estudio en nuestro medio, solo uno de 63 pacientes (1,5%) con EII desarrolló hepatotoxicidad significativa que obligara a la suspensión de la isoniazida21. En el registro español BIOBADASER, solo un 1,2% de pacientes que recibieron isoniazida desarrollaron hepatotoxicidad relevante que obligó a la suspensión del tratamiento41.
Es razonable realizar una analítica hepática inicial en pacientes que reciben isoniazida. Si esta analítica no objetiva toxicidad hepática, no está definido con qué frecuencia se debe repetir. Pacientes que presentan alteración de las enzimas hepáticas en el análisis inicial o aquellos que tengan aumento de riesgo de padecer hepatopatía crónica por ser portadores de del virus de la hepatitisC, obesos, alcohólicos o estar en tratamiento con otros fármacos hepatotóxicos precisan de control analítico mensual77. Para los pacientes sin estos criterios, algún autor recomienda solo control clínico, y realizar analítica si aparece fiebre, astenia, náuseas o ictericia81. En pacientes que presenten síntomas y elevación de transaminasas de más de 3 veces el rango normal (o aquellos sin síntomas y con valores repetidos de más de 5 veces el rango normal) debe suspenderse el tratamiento con isoniazida82.
Al tratarse de un tratamiento de larga duración en pacientes asintomáticos, se han detectado tasas de incumplimiento de hasta el 20% en nuestro medio, por lo que se recomienda concienciar a los pacientes83.
¿Cuándo podemos iniciar el anti-TNF en un paciente con ITL? La mayoría de guías recomiendan retrasar el inicio del anti-TNF entre 1 y 2meses tras el comienzo de la profilaxis10. En la guía ECCO se considera razonable el periodo de 3semanas antes de iniciar el anti-TNF, salvo en casos en que el inicio de este sea urgente19.
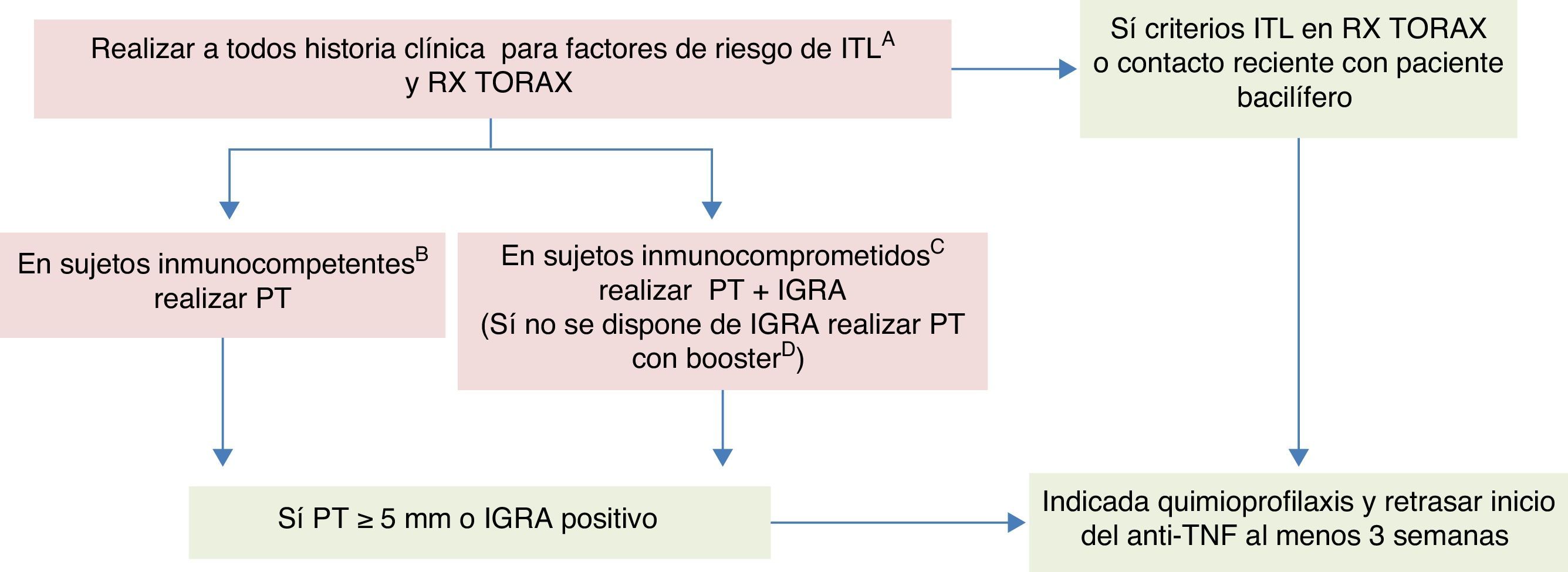
Recomendaciones GETECCU 2015 para el cribado y el tratamiento de la infección tuberculosa latente en pacientes con enfermedad inflamatoria intestinalBasadas en la evidencia publicada hasta junio de 2015 y en las guías al respecto, se resumen a continuación las recomendaciones de GETECCU para el cribado de ITL en pacientes con EII (ver algoritmo en la fig. 1):
- 1.
Debe realizarse cribado de ITL en todos los pacientes con EII candidatos a tratamiento con agentes anti-TNF, con el fin de realizar tratamiento preventivo y evitar los casos de TB en esta población de riesgo.
- 2.
El cribado de ITL debe incluir:
- •
Historia clínica dirigida a investigar factores de riesgo de ITL (historia previa de TB, contacto con TB activa, pruebas para ITL previas, estancias en países de riesgo y trabajos de riesgo, entre otros).
- •
Radiografía de tórax en búsqueda de lesiones antiguas sugestivas de TB. Es conveniente la interpretación experta de cualquier anomalía, y si persisten dudas realizar una TC, que aumenta la capacidad de detección de lesiones antiguas y de TB en una fase inicial.
- •
En pacientes que no estén recibiendo corticoides ni inmunomoduladores, estará indicada la realización de una PT, la cual identifica más pacientes con criterios de ITL en comparación con los IGRA.
- •
En pacientes en un estado potencial de anergia (tratamiento inmunosupresor y/o malnutrición) se realizará cribado doble para ITL con PT e IGRA, realizados preferiblemente el mismo día, o el IGRA no más tarde de 3días después de la PT.
- •
Si no se dispone de IGRA, la PT debe ser de 2 pasos (realizar booster si la primera PT es negativa). Solo si el paciente tiene enfermedad grave y precisa recibir el anti-TNF con urgencia puede iniciarse el anti-TNF antes de realizar el booster.
- •
Si disponemos de IGRA, parece preferible utilizarlos como prueba complementaria a la PT en lugar de realizar un booster. No obstante, se puede considerar añadir el booster, a pesar de una PT y un IGRA negativos, en pacientes con alto riesgo de anergia (malnutrición, tratamiento con inmunosupresores y corticoides).
- •
En los pacientes con PT negativo/IGRA indeterminado debe repetirse el IGRA para confirmar el resultado, que suele ser negativo.
- •
- 3.
Está indicado el tratamiento de la ITL antes de recibir un fármaco anti-TNF si se objetiva una PT positiva (induración ≥5mm) o un IGRA positivo, si hay lesiones sugestivas de una TB pasada no tratada en la radiografía de tórax o, en el caso de pacientes con PT o IGRA negativo, si existe constancia epidemiológica de una TB anterior no correctamente tratada o de un contacto reciente con un paciente bacilífero. En la estrategia de cribado doble los pacientes con cualquiera de los 2 test positivo deben recibir tratamiento para la ITL.
- 4.
El régimen recomendado para el tratamiento de la ITL consiste en isoniazida durante 9meses a una dosis 5mg/kg/día (máximo 300mg/día), retrasando el inicio del anti-TNF al menos 3semanas.
- 5.
El tratamiento de la ITL debe monitorizarse siempre de acuerdo a criterios clínicos y con una analítica hepática en la primera revisión, y posteriormente teniendo en cuenta el riesgo de hepatotoxicidad.
- 6.
Con los datos actualmente disponibles no hay evidencia suficiente para recomendar de manera rutinaria la realización de pruebas repetidas anuales (o con otra periodicidad) para la detección de ITL en pacientes bajo tratamiento con anti-TNF. En el momento actual solo estaría indicado el cribado de infección TB en estos pacientes si ha habido contacto con paciente con TB o tras un viaje a áreas endémicas de TB.
- 7.
El cumplimiento de estas recomendaciones no elimina totalmente el riesgo de desarrollar una TB activa, por lo que se precisa mantener un alto grado de sospecha clínica; en estos casos es obligatorio realizar todas las pruebas diagnósticas necesarias para descartar o confirmar una TB.
- 8.
Si se diagnostica una TB activa, debe suspenderse el tratamiento anti-TNF y realizarse tratamiento de la TB; el anti-TNF puede reiniciarse tras 2meses de tratamiento tuberculostático.
- 9.
Aunque actualmente no existen datos robustos sobre un aumento de riesgo de TB en pacientes con EII tratados con terapia biológica no anti-TNF o con nuevos fármacos inmunomoduladores, siempre deberá primar la seguridad del paciente cuando usemos estos fármacos, por lo que parece indicado realizar cribado para ITL.
Cribado de infección tuberculosa latente en pacientes con enfermedad inflamatoria intestinal candidatos a terapia anti-TNF.
anti-TNF: anticuerpos anti tumor necrosis factor α; IGRA: Interferon Gamma Release Assay; IMM: inmunomoduladores; ITL: infección tuberculosa latente; PT: prueba de tuberculina; QP: quimioprofilaxis para ITL.
A Contactos, estancias en países de riesgo y trabajos de riesgo. Si en la historia clínica se documenta que un paciente con EII y anergia potencial ha tenido un contacto reciente, estrecho y continuado con un paciente bacilífero, estaría indicada quimioprofilaxis antes de iniciar un anti-TNF.
B Si <2 semanas de tratamiento con corticoides o >3 semanas después de la última dosis de corticoides, <1 mes con IMM, no malnutrición.
C Si >2 semanas de tratamiento con corticoides o <3 semanas después de la última dosis de corticoides, >1 mes con IMM, o malnutrición.
D Para realizar el cribado doble se lleva a cabo una PT junto con IGRA, efectuados preferiblemente el mismo día, o el IGRA no más tarde de 3días después de la PT. Si no se dispone de IGRA la PT debe ser de 2 pasos (realizar booster tras 7-10días si la primera PT es negativa). Si el paciente tiene enfermedad grave y precisa recibir el anti-TNF con urgencia, puede iniciarse este antes de realizar el booster.
Sabino Riestra: Asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie, Hospira, Kern Pharma, Faes Farma, Ferring, Tillots, Shire Pharmaceuticals.
Carlos Taxonera: Asesoramiento científico o actividades formativas: MSD, Abbvie, Hospira, Ferring, Falk Pharma, Shire Pharmaceuticals, Gebro Pharma.
Daniel Carpio: Asesoramiento científico, soporte para investigación y/o actividades formativas: Abbvie, MSD, Ferring, Shire Pharmaceuticals, Dr. Falk Pharma, Chiesi, Gebro Pharma, UCB Pharma, Almirall.
Antonio López San Roman: Asesoramiento científico o actividades formativas: MSD, Abbvie, Hospira, Kern Pharma, Takeda, Ferring, Faes Farma, Shire Pharmaceuticals, Gebro Pharma, Tillotts. Apoyo a la investigación: MSD, Abbvie, Tillotts.
Javier P. Gisbert: Asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie, Hospira, Kern Pharma, Takeda, Janssen, Pfizer, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Chiesi, Casen Fleet, Gebro Pharma, Otsuka Pharmaceutical, Vifor Pharma.
Eugeni Domènech: Asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie, Hospira, Kern Pharma, Takeda, Celgene, Ferring, Faes Farma, Shire Pharmaceuticals, Tillots, Gebro Pharma, Otsuka Pharmaceutical.