La enfermedad inflamatoria intestinal (EII) en pediatría presenta características propias. Se recomienda un tratamiento precoz, intensivo y mantenido. Los inmunosupresores están indicados como mantenimiento de la remisión en la enfermedad de Crohn pediátrica (EC-P) tratada en la inducción con nutrición enteral exclusiva y en la colitis ulcerosa pediátrica (CU-P) que precisa esteroides en la fase de inducción. La terapia combinada está indicada en pacientes con alto riesgo de complicaciones, individualizando el tratamiento y valorando el perfil de seguridad. En cuanto a la prevención de la pérdida de respuesta a los anti-TNF y la formación de anticuerpos, no hay estudios concluyentes que justifiquen el uso de las tiopurinas, precisando estudios prospectivos en cohortes pediátricas más amplias.
Pediatric Inflammatory Bowel Disease (P-IBD) has its own characteristics and early, intensive and sustained treatment is recommended. Immunomodulator treatment is indicated for maintenance of remission in P-CD (Pediatric Crohn's Disesase) treated with exclusive enteral nutrition (EEN) to induce remission and P-UC (Pediatric Ulcerative Colitis) that requires steroids to induce remission. Combo therapy is recommended for patients at high risk of complications; however, individualized treatment and the assessment of adverse events is mandatory. By now, the use of thiopurines is not justified for the prevention of loss of response to anti-TNF and antibody formation. Larger pediatric prospective studies are needed.
Alrededor de un tercio de los pacientes con enfermedad inflamatoria intestinal (EII) debutan por debajo de los 18 años de edad. Paralelamente a la descripción del aumento de la incidencia global de dicha enfermedad, se ha descrito también un aumento de la misma en niños y adolescentes en diferentes áreas geográficas. En España, en el periodo 1996-2009, la incidencia de la enfermedad inflamatoria intestinal pediátrica (EII-P) se triplicó, correspondiendo el aumento más importante a la enfermedad de Crohn (EC)1.
La EII-P presenta características propias con una creciente evidencia científica que la EII iniciada en la infancia es una patología con particularidades diferentes a la del adulto. El inicio temprano de estas enfermedades parece estar asociado a un mayor peso de las causas genéticas y un menor efecto de los factores externos ambientales que se barajan en la etiopatogenia de la EII de los adultos.
En cuanto al fenotipo de la enfermedad y la historia natural, existen diferencias entre niños y adultos. La extensión de la enfermedad, tanto en la EC como en la colitis ulcerosa (CU) en la infancia, es mayor en su debut, con una evolución más grave. En la EC pediátrica el colon es el segmento más frecuentemente afectado, presentando afectación difusa (de múltiples segmentos) en muchos casos y con progresión de la enfermedad dentro de la primera década tras el diagnóstico pero con un tiempo hasta la primera cirugía mayor. En cuanto a la CU en edad pediátrica, debuta en la mayor parte de casos en forma de pancolitis (hasta un 80-90% de los casos según series), y la necesidad de colectomía suele ser más precoz. Por tanto, podemos decir según las evidencias científicas, que el debut en la edad pediátrica se caracteriza por una afectación intestinal extensa y una evolución rápida temprana.
Además, la EII-P presenta características propias que determinan la necesidad de un diagnóstico preciso. Una de las características más importantes es la repercusión de la enfermedad sobre el crecimiento y el desarrollo puberal de los pacientes, sobre todo en la EC: en un 80% de los pacientes se encuentra una velocidad de crecimiento disminuida en el momento del diagnóstico y en un 20-40% se aprecia afectación en su ganancia ponderal.
El fracaso del crecimiento constituye un marcador de la actividad mantenida de la enfermedad mientras que la remisión suele acompañarse de una mejoría del estado nutricional y el crecimiento. Debe prestarse especial atención a estos problemas en los pacientes que se encuentran en pleno brote puberal. A los objetivos principales del tratamiento de la EII (inducción de la remisión de manera efectiva y precoz, mantenimiento de la remisión a largo plazo, mejoría de la calidad de vida y minimización de las complicaciones), se tienen que tener en cuenta objetivos específicos en la edad pediátrica:
- -
Recuperar y mantener un crecimiento adecuado y preservar el desarrollo puberal (fases críticas).
- -
Preservar la maduración psicológica.
- -
Preservar la escolarización.
- -
Favorecer un correcto desarrollo psicosocial y familiar.
- -
Minimizar los efectos secundarios de los fármacos a largo plazo.
Así pues, el tratamiento ideal en la EII-P debería tener rápido inicio de acción, aceptable perfil de seguridad, eficacia en la consecución de la remisión y efecto mantenido a largo plazo, sin descuidar la capacidad de preservar el crecimiento y maduración, y una presentación que facilite la adherencia.
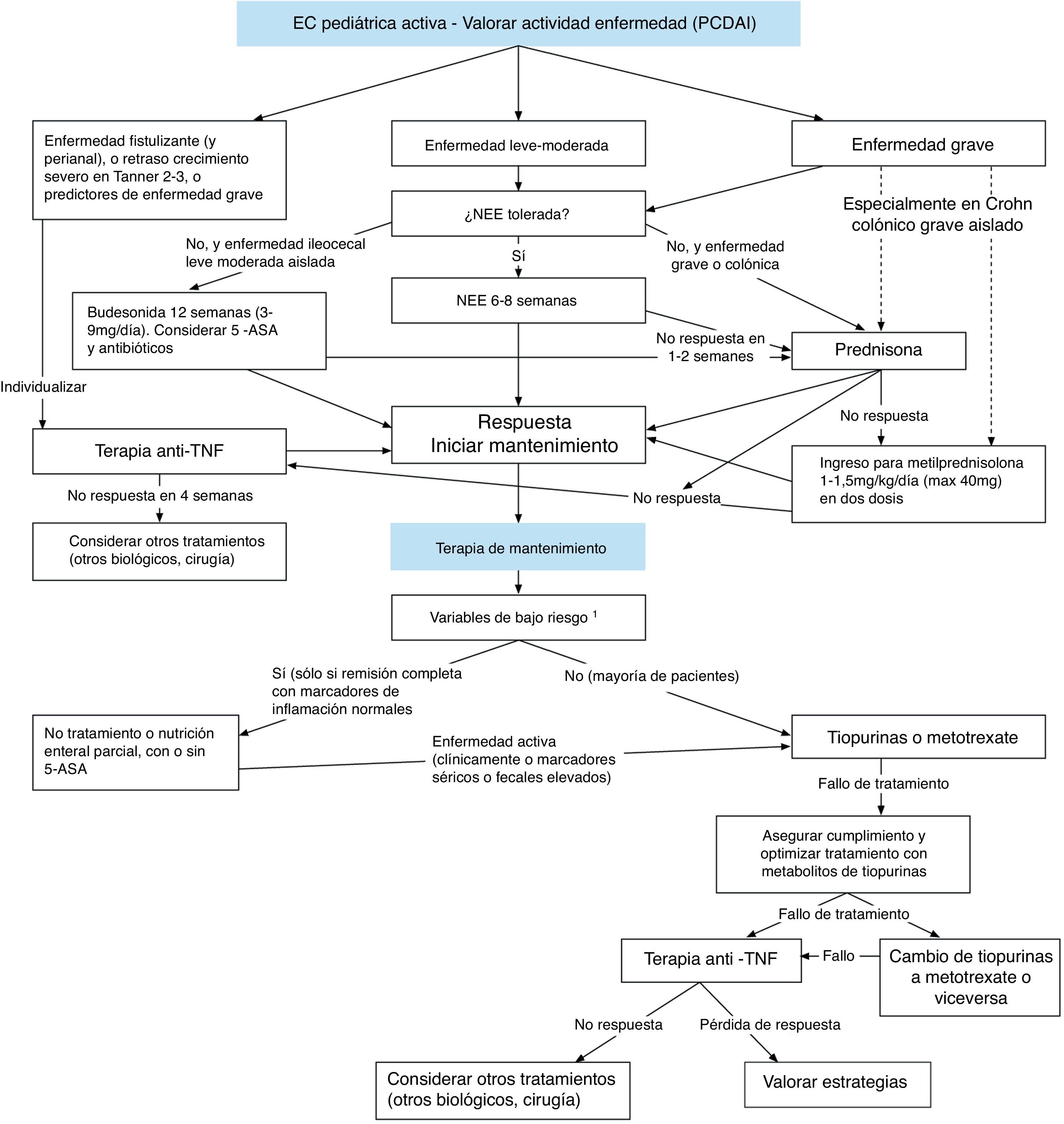
Tratamiento inmunosupresor en la enfermedad inflamatoria intestinal pediátricaInmunosupresores y enfermedad de Crohn pediátricaEn el reciente consenso ESPGHAN-ECCO sobre el tratamiento de la EC pediátrica, publicado en 20142, se recomienda la nutrición enteral de manera exclusiva (NEE) como terapia de primera línea para inducir la remisión en niños con fases activas de EC leve-moderada. La curación mucosa con NEE es significativamente mayor que con el uso de corticoides, así como también el tiempo en remisión tras el tratamiento nutricional3. El uso de inmunosupresores se recomienda en el mantenimiento de la remisión en pacientes con EC que presenten factores de riesgo como enfermedad perianal, retraso del crecimiento grave, úlceras profundas, enfermedad extensa o necesidad de uso de corticoides al diagnóstico. Dado que los inmunosupresores tiopurínicos (azatioprina [AZA], mercaptopurina) han sido clásicamente los más utilizados en la edad pediátrica, son los que se contemplan como primera opción en dicho consenso, quedando relegado el metotrexate a aquellos casos con intolerancia o efectos adversos secundarios a los tiopurínicos. El uso de anti-TNF está justificado en pacientes de alto riesgo en el debut de la enfermedad o en aquellos con compromiso importante del crecimiento (fig. 1).
Tratamiento de la enfermedad de Crohn pediátrica.
Nota: 1pacientes de alto riesgo: enfermedad perianal, retraso de crecimiento grave, úlceras profundas en la endoscopia o enfermedad extensa (incluyendo afectación GI alta y/o intestino delgado proximal) o necesidad de corticoides al diagnóstico.
Modificada y traducida de Ruemmele et al.2
El tratamiento con tiopurinas ha demostrado ser efectivo en el tratamiento de mantenimiento de la EC tanto en niños como en adultos4,5, asociando además un efecto beneficioso de ahorrador de esteroides. Existen varios estudios donde se demuestra que el uso precoz de tiopurinas tiene efecto discreto sobre la historia natural de la EC, enlenteciendo la evolución de las formas inflamatorias a formas estenosantes o fistulizantes y retrasando el tiempo hasta la cirugía, aunque sin efecto preventivo6. En cuanto al mantenimiento de la remisión libre de esteroides con tiopurínicos, los resultados no son concluyentes. En el año 2000, un estudio randomizado controlado evaluó la eficacia de las tiopurinas como terapia de mantenimiento tras la inducción de la remisión con esteroides en pacientes pediátricos con EC moderada-grave encontrando que más de un 90% de los pacientes que alcanzaban la remisión y seguían con mercaptopurina, mantenían esta a los 18 meses5. Otros estudios prospectivos realizados posteriormente en pacientes pediátricos y adultos, encuentran que el tratamiento con tiopurinas es menos efectivo en el mantenimiento de la remisión que el descrito en dicho estudio inicial7,8 resaltando como posibles causas la utilización dispar de dosis, el control o no con niveles de metabolitos y la valoración de la adherencia al tratamiento. En cuanto el uso de tiopurínicos para la recurrencia posquirúrgica, estudios en adultos demuestran un papel discreto en la reducción de la tasa de recurrencia comparado con mesalazina y placebo9. La ECCO los recomienda como primera línea de tratamiento posquirúrgico en aquellos pacientes de alto riesgo y en pacientes asintomáticos pero con lesiones endoscópicas graves.
En cuanto a la eficacia y seguridad de los tiopurínicos y los anti-TNFα en monoterapia o en terapia combinada, en la inducción de la remisión se dispone del estudio SONIC en adultos. En dicho estudio, se evalúan las tasas de remisión de 508 pacientes con EC moderada-grave que previamente nunca hubiesen recibido ni inmunomoduladores ni terapias biológicas. Los autores concluyen que infliximab (IFX) asociado a AZA e IFX en monoterapia son superiores a AZA en monoterapia para alcanzar la remisión sin corticoides10. En población pediátrica se dispone de escasos estudios que evalúen la eficacia de la combinación de dichos tratamientos. Walters et al.11 realizan un estudio prospectivo observacional de 204 pacientes pediátricos con EC grave, divididos en 3 grupos: tratamiento precoz con anti-TNF, tratamiento precoz con inmunomodulador y pacientes sin tratamiento precoz con inmunoterapia. Observan que el tratamiento precoz con anti-TNFα es superior al tratamiento precoz con inmunomoduladores en cuanto a la remisión de la enfermedad y al pronóstico de talla al año de tratamiento. En relación con la utilización de terapia combinada versus monoterapia en pacientes pediátricos, Kierkus et al.12, en mayo de 2015, publican un estudio randomizado multicéntrico de 84 pacientes con EC pediátrica que responden a la inducción con IFX+ inmunomodulador (AZA o metotrexato). A las 10 semanas, randomizan a estos pacientes en 2 grupos. El grupo 1 (n=45) recibe IFX + inmunomodulador hasta la semana 54 y en el grupo 2 (n=39) el tratamiento inmunomodulador se suspende a la semana 26. Los autores no encuentran diferencias significativas en cuanto a pérdida de respuesta, el Pediatric Crohn's Disease Activity Index (PCDAI) ni el SES-CD score al final de la fase de mantenimiento. Así pues, los autores concluyen (al igual que el estudio clásico de Van Assche13 realizado en adultos) que en su muestra de pacientes, la terapia combinada de 26 semanas de duración parece ser eficaz y segura y que su prolongación no parece aportar beneficios significativos.
Uno de los aspectos más en boga actualmente es el posible papel que la inmunosupresión asociada puede jugar en el mantenimiento de la respuesta a los fármacos biológicos, actuando de manera preventiva frente a la pérdida de respuesta secundaria a los mismos. En la actualidad, para la optimización del tratamiento con agentes anti-TNF disponemos de técnicas para determinar en suero los niveles de fármaco y la presencia de anticuerpos frente a dichos fármacos. Los niveles bajos de IFX asociados a la existencia de anticuerpos anti-infliximab (ATI) se asocian con la pérdida de respuesta a dicho fármaco. La optimización de los niveles puede mejorar la eficacia del tratamiento a largo plazo. Singh et al.14 describen en una cohorte observacional de 58 pacientes pediátricos con EII, cómo los niveles de IFX así como la PCR a la semana 14 ayudan a predecir la remisión sostenida a la semana 54. Como punto de corte describen niveles de IFX a la semana 14 >3, >4 y >7mg/ml con un valor predictivo positivo del 64, 76 y 100% respectivamente, para predecir remisión sostenida. Diferentes estudios realizados en adultos han demostrado cómo el uso de inmunosupresores tiopurínicos y metotrexate, consiguen elevar los niveles séricos de anti-TNF, disminuir la presencia de ATI y paralelamente la recuperación de la respuesta al anti-TNF, tras una pérdida de respuesta secundaria previa15. Sin embargo, existe poca literatura al respecto en pacientes pediátricos con EC. Zitomersky et al.16 realizan un estudio transversal de 134 pacientes pediátricos y adultos jóvenes que reciben IFX. En el estudio miden los niveles de fármaco y los ATI y se recogen datos demográficos, uso de terapia combinada y necesidad de cirugía. Encuentran que en el momento de la recogida de la muestra no hay correlación en cuanto a niveles de IFX más altos o niveles de anticuerpos más bajos entre los que se encuentran en terapia combinada comparado con los que reciben monoterapia, pero sí observan diferencias significativas en los niveles de anticuerpos, siendo menores en aquellos pacientes que en algún momento han recibido tratamiento inmunomodulador. Los autores concluyen que la presencia de ATI se relaciona con una disminución de los niveles de IFX y con un aumento del riesgo de cirugía en los pacientes con EII.
Otro factor a tener en cuenta y de especial importancia en población pediátrica en la terapia combinada y el uso de inmunomoduladores es la seguridad asociada al tratamiento. A pesar del aumento del uso de terapia anti-TNF en pacientes pediátricos con EII, la seguridad a largo plazo más allá de un año, está escasamente estudiada en este escenario. Entre los efectos adversos más frecuentemente descritos de la terapia combinada están el mayor riesgo de infecciones oportunistas y el linfoma hepato-esplénico de células T (HSTCL), especialmente con una terapia mantenida a largo plazo. Debemos tener en cuenta que debido al inicio precoz de la enfermedad, son pacientes expuestos durante largo tiempo a inmunosupresión, y que por tanto, el riesgo de carcinogénesis también es más prolongado. Aun así, se desconoce cuál es la duración del tratamiento inmunosupresor relacionado con la aparición de carcinogénesis
linfática. Kotlyar et al17 realizan una revisión sistemática de los casos de HSTCL, donde observan que la mayoría de pacientes con este tipo de tumor son pacientes menores de 35 años con EII que han recibido tratamiento tiopurínico por períodos prolongados (mínimo 2 años). No reportan casos de HSTCL en pacientes con EII en monoterapia con anti-TNF. Los autores concluyen que se debería limitar el uso de tiopurinas y anti-TNF en pacientes varones, jóvenes, y administrarlo solo si el beneficio es claro, como en las primeras fases de la enfermedad o en aquellos casos de enfermedad grave. Vahabnezhad et al.18 realizaron un estudio retrospectivo en una cohorte de 188 pacientes menores de 21 años con EII que habían iniciado tratamiento con IFX y con seguimiento mínimo de un año. Se recogieron datos a partir de historia clínica, concluyendo que el tratamiento a largo plazo con IFX es seguro y efectivo en el mantenimiento de la remisión en pacientes pediátricos con EII y que dosis bajas de inmunomoduladores (metotrexato) no influyen en el resultado del tratamiento con IFX. La intensificación con IFX puede optimizar la eficacia a largo plazo y superar la pérdida de respuesta, que puede verse relacionada con el desarrollo de ATI. Cabe la posibilidad que dosis más altas de metotrexato oral sean necesarias para optimizar el tratamiento con IFX.
Basado en la bibliografía actual y las últimas recomendaciones publicadas en las guías de consenso, sugerimos que en EC moderado en tratamiento de mantenimiento con inmunosupresores tiopurínicos (o con metotrexate en casos con intolerancia a los mismos), tras la remisión inducida con nutrición enteral o con esteroides, con mal control o nuevos brotes, se realice un step-up acelerado iniciando tratamiento con biológicos, manteniendo tratamiento combinado entre 6 meses y un año, antes de plantear el paso a monoterapia con biológicos siempre tras objetivar el mayor grado posible de curación mucosa. En caso de pérdida de la respuesta tras la suspensión de los tiopurínicos y de cara a no volver a una combinación con un perfil de seguridad más comprometido, numerosos autores en la actualidad plantean como una opción a valorar asociar el metotrexate con el fin de recuperar la respuesta al anti-TNF. En EC grave o de alto riesgo (enfermedad extensa, enfermedad rectal o perianal grave, enfermedad corticorresistente o fallo de crecimiento en pubertad media-tardía), realizar tratamiento combinado (anti-TNF e IS) desde el inicio, siempre teniendo en cuenta las preferencias del paciente y su familia a la hora de tomar decisiones.
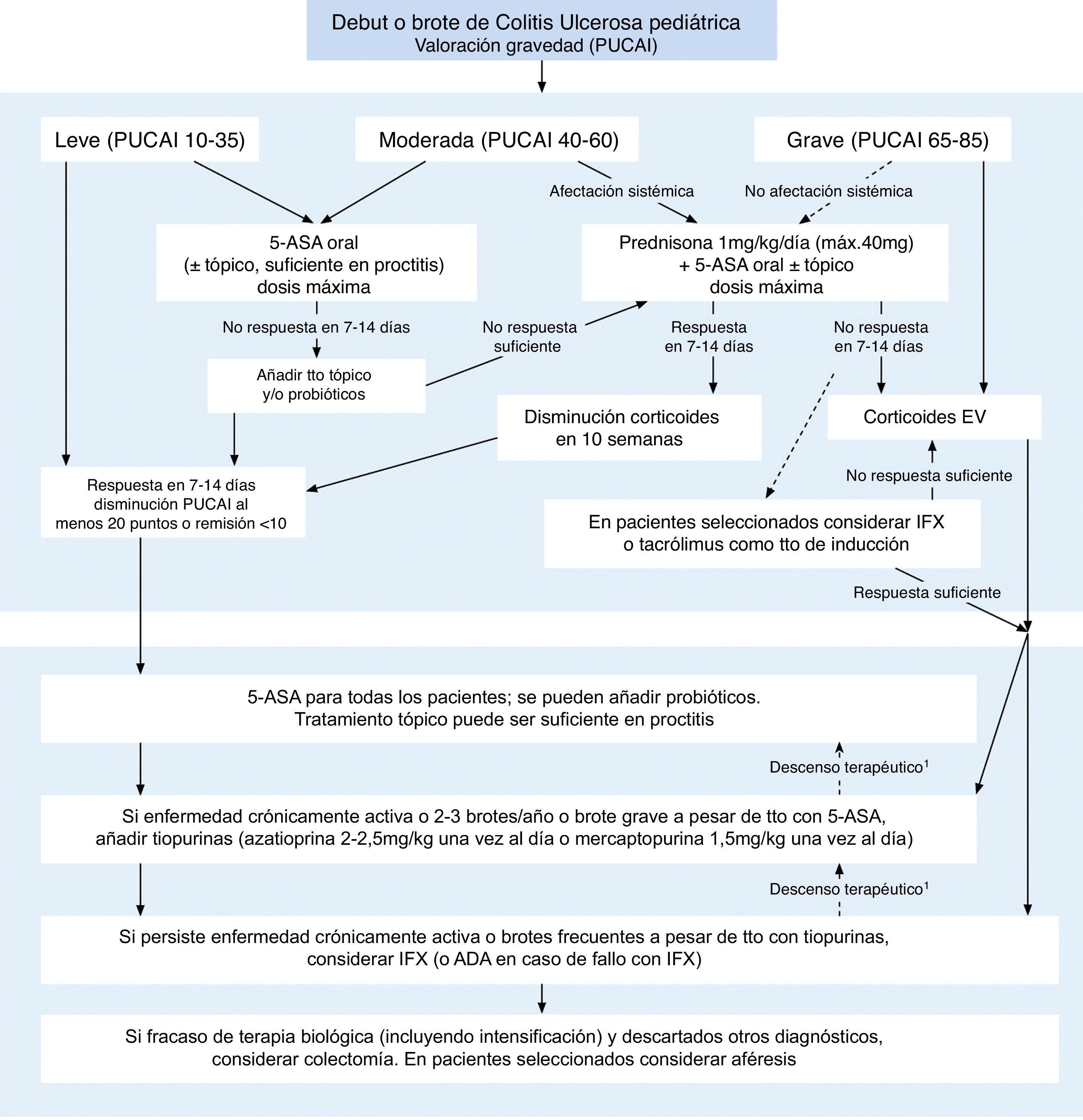
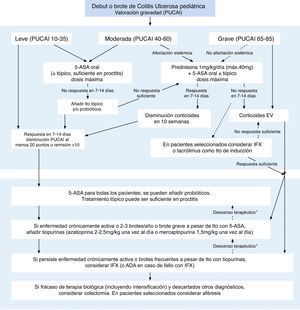
Inmunosupresores y colitis ulcerosa pediátricaLa última guía de consenso ECCO-ESPGHAN para el manejo de la CU-pediátrica19, publicada en 2012, recomienda el uso de tiopurinas en pacientes en los que existe enfermedad crónicamente activa, aquellos que presentan 2-3 brotes/año o los que presentan un brote grave a pesar de tratamiento con aminosalicilatos (fig. 2). En nuestra práctica clínica diaria, observamos que los pacientes que debutan con un brote grave de CU precisando tratamiento de inducción con corticoterapia endovenosa, suelen presentar un curso clínico lo suficientemente grave como para justificar el inicio de tratamiento inmunomodulador con tiopurinas desde el diagnóstico.
Manejo de la colitis ulcerosa pediátrica.
Modificada y traducida de Turner et al.19
En resumen, podemos decir que por las características específicas del paciente pediátrico y la EII en este grupo de edad, se recomienda un tratamiento precoz, intensivo y mantenido. El tratamiento con inmunosupresores está indicado como tratamiento de mantenimiento de la remisión en la EC-P tratada con NEE en la fase de inducción y en la CU-P que precisa tratamiento de inducción con tratamiento esteroideo. A pesar de que los estudios en pacientes pediátricos no encuentran beneficios en cuanto la terapia combinada versus la monoterapia, la evidencia disponible es escasa. Varios estudios en adultos muestran mayor eficacia en la terapia combinada, sobre todo en la inducción a la remisión. En la práctica clínica, la terapia combinada parece indicada en pacientes con alto riesgo de complicaciones como retraso del crecimiento, la enfermedad estenosante o fistulizante o la necesidad de cirugía. En cuanto al perfil de seguridad de las tiopurinas, parece adecuado el paso a monoterapia con anti-TNF cuando se considere indicado y debe individualizarse en cada paciente. A pesar de ello, en las guías de consenso de la ECCO-ESPGHAN para el manejo de la EC-P los autores concluyen que no hay suficiente evidencia para definir la ratio riesgo/beneficio para la combinación del tratamiento anti-TNF con los inmunomoduladores. Por el momento, no hay estudios concluyentes que justifiquen el uso de las tiopurinas para disminuir el riesgo de formación de anticuerpos ni prevenir la pérdida de respuesta a los anti-TNF. Tampoco se conoce con certeza si el uso de metotrexate y el control del tratamiento valorando niveles de fármaco y anticuerpos tras suspender el tratamiento con tiopurinas está justificado.
Para poder resolver todas estas cuestiones se precisan estudios prospectivos en cohortes más amplias de pacientes pediátricos, y por el momento se recomienda llevar a cabo estrategias personalizadas valorando los riesgos y beneficios en función del fenotipo y los predictores en cada paciente, implicando a la familia en la decisión terapéutica tras explicar los pros y contras de las distintas estrategias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.