El tratamiento de la enfermedad de Crohn (EC) pediátrica requiere una cuidadosa atención a la optimización del crecimiento y de la salud ósea, además de perseguir la curación mucosa. Reducir la exposición a corticoides sistémicos es un primer paso de suma importancia para influir en estos resultados a medio-largo plazo. Una alternativa eficaz a la terapia de inducción con corticoides es la nutrición enteral exclusiva (NEE), que se recomienda como tratamiento de primera línea en la EC pediátrica. En esta revisión se discute la razón de ser de la NEE, sus supuestos mecanismos de acción y las últimas modificaciones en los regímenes clásicos de NEE que auguran un futuro prometedor al tratamiento dietético de la EC pediátrica.
The treatment of paediatric Crohn's disease (CD) requires careful attention to optimising normal growth and bone health in addition to achieving mucosal healing. Reducing exposure to systemic corticosteroids can be a highly important first step to influence these medium-to-long-term disease-specific and general health outcomes. An effective alternative to induction therapy with corticosteroids is exclusive enteral nutrition (EEN) which is recommended as first-line therapy in paediatric CD. In this review, we discuss the rationale behind EEN, its putative mechanisms of action and novel, promising modifications to EEN for the future dietary management of paediatric CD.
La enfermedad de Crohn (EC) es un trastorno inflamatorio crónico idiopático cuyo curso natural evolutivo se caracteriza por periodos de actividad inflamatoria que se alternan con otros de remisión. Aproximadamente el 30% de los casos de enfermedad inflamatoria intestinal (EII) comienzan antes de los 18 años, con un pico de máxima incidencia durante la infancia entre los 13-15 años1,2. Este periodo es crítico3,4, ya que en él se producen cambios físicos con una rápida velocidad de crecimiento (fig. 1). El fracaso de crecimiento, las alteraciones del metabolismo óseo, el retraso puberal, la malnutrición y las deficiencias de micronutrientes y de determinadas vitaminas se asocian con frecuencia a la EII pediátrica5. El retraso del crecimiento que acontece al comienzo en el 40-50% de los niños con EC puede persistir en la edad adulta hasta en el 15-30% de los pacientes, y aproximadamente un 20% de los niños no alcanzan su talla diana. Resulta interesante resaltar el hecho de que el retraso en el crecimiento está relacionado con el tiempo desde el comienzo de los síntomas hasta el diagnóstico, siendo 3 veces superior en aquellos casos que tardan más de 6 meses en ser diagnosticados6. Los objetivos terapéuticos en la EC son el control de la inflamación, la curación mucosa, la modificación del curso de la enfermedad, evitar los efectos indeseables del tratamiento y garantizar un crecimiento y desarrollo adecuados. El arsenal terapéutico del que disponemos para el tratamiento de la EC pediátrica es muy similar al de los adultos, debido en parte a que la evidencia aportada por los ensayos clínicos en niños es escasa, y las decisiones terapéuticas se basan a menudo en una extrapolación a partir de la literatura sobre pacientes adultos. No obstante, pese al avance en el campo terapéutico aportado por los fármacos biológicos, la nutrición enteral exclusiva (NEE) continúa considerándose el tratamiento de primera línea en la EC luminal7. A continuación se exponen los aspectos más relevantes que justifican el empleo de la NEE como modalidad terapéutica en la EC pediátrica, sus posibles mecanismos de acción y las últimas modificaciones en los regímenes clásicos de NEE que auguran un futuro prometedor al tratamiento dietético de la EC pediátrica.
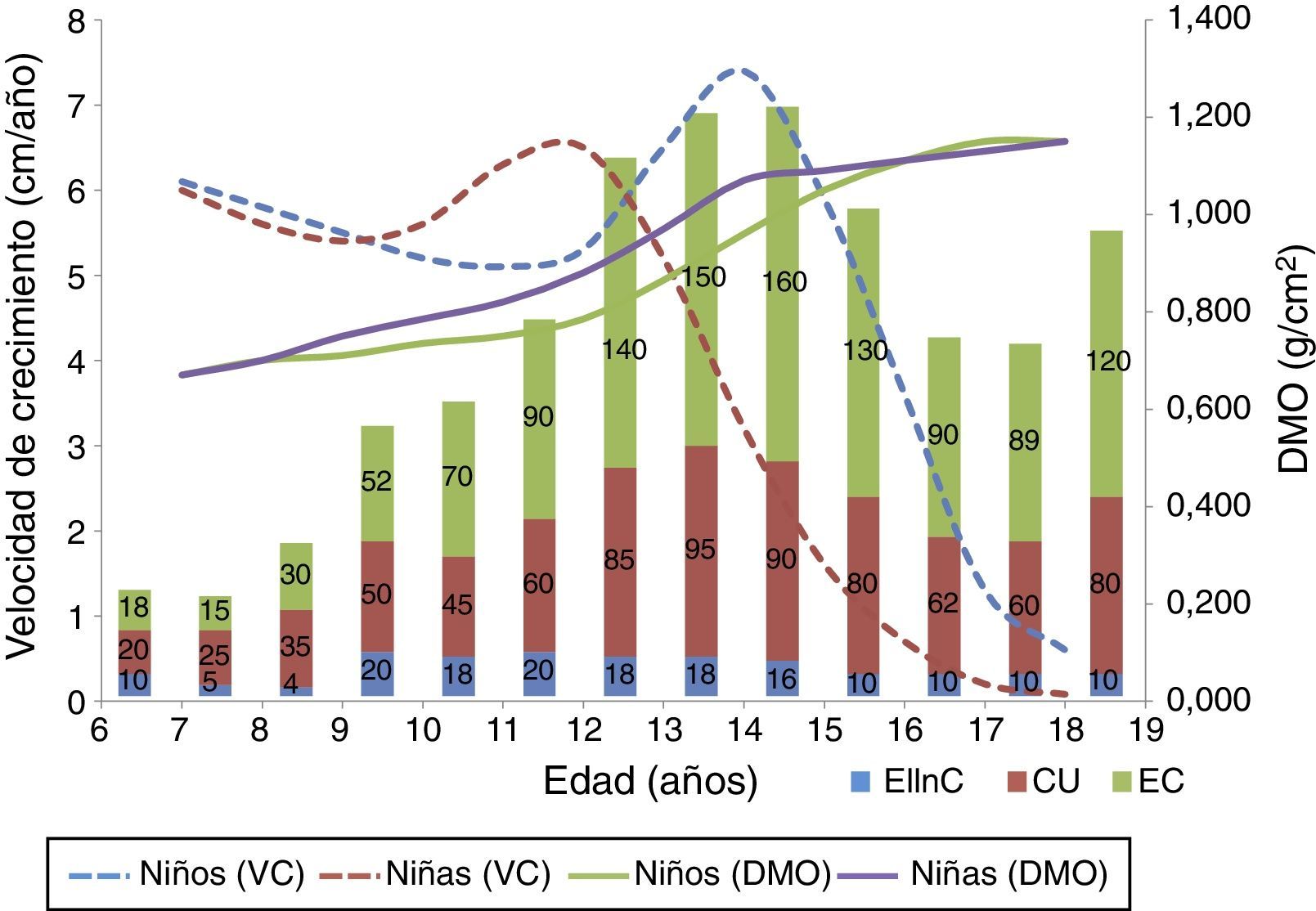
Incidencia de enfermedad inflamatoria intestinal en España: relación con la velocidad de crecimiento y la densidad mineral ósea en niños españoles. Las barras representan los casos de los diferentes tipos de EII (datos obtenidos del estudio SPIRIT1). Las líneas discontinuas representan la velocidad de crecimiento ([VC]; datos obtenidos de Carrascosa et al.3), las líneas continuas los valores de densidad mineral ósea ([DMO] datos obtenidos de Del Rio et al.4). En esta gráfica puede observarse cómo el momento de más incidencia de EII coincide con los mayores picos de velocidad de crecimiento y aposición ósea.
CU: colitis ulcerosa; EC: enfermedad de Crohn; EIInC: enfermedad inflamatoria intestinal no clasificada.
La utilización de la nutrición enteral en la EC transcurre paralela al desarrollo de las fórmulas enterales. En 1969 se publica el primer caso de paciente con EC tratado con nutrición enteral, aunque no con fines de alcanzar la remisión8. En 1971 Voitk et al.9 tratan de forma experimental a pacientes con EII en espera de intervención quirúrgica con fórmula elemental, comprobando mejoría clínica del estado nutricional y en algunos casos la remisión de la sintomatología, evitando así la cirugía. No obstante, esta época coincide con un auge en el empleo de nutrición parenteral en pacientes con EII por considerar al reposo intestinal pieza clave para alcanzar la resolución del cuadro. La publicación de series de casos y posteriormente el estudio controlado de O’Morain10 promovieron el resurgir de la nutrición enteral en la EC, quedando la nutrición parenteral indicada solo en aquellos pacientes que requerían soporte nutricional y en los que la alimentación enteral no era posible. El 23 de febrero de 1981 el grupo coordinado por el Dr. Gassull del Hospital Universitario de Bellvitge administra por primera vez en nuestro país NEE con fórmula elemental a un paciente con EC11. Este grupo fue también pionero en el empleo de las fórmulas poliméricas para este mismo fin, siendo asimismo los primeros en comprobar que la NEE era igual de efectiva que los esteroides12. Con posterioridad a las publicaciones del grupo del Dr. Gassull, el grupo liderado por el Dr. Vitoria publica la primera serie pediátrica, compuesta de 5 pacientes, en los que se usa NEE13. A su vez, Navas-López et al. publican una serie de pacientes con EC tratados de forma exclusiva con NEE, cuyos datos se actualizan en una publicación posterior, siendo esta última la serie más amplia publicada en nuestro país hasta la fecha14.
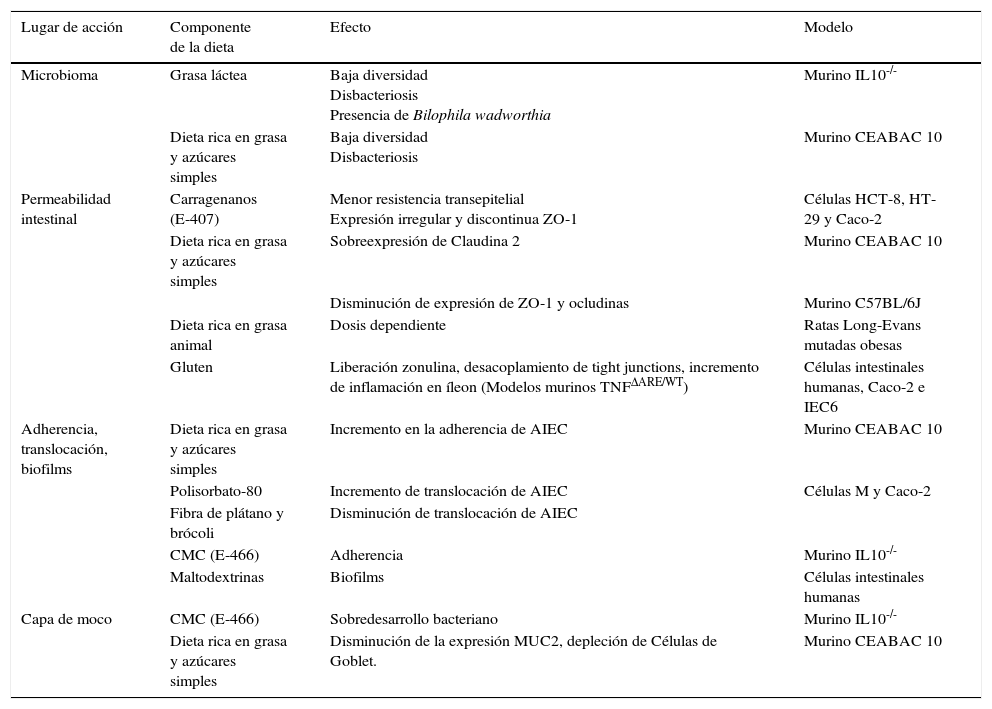
Mecanismos de acción de la nutrición enteral exclusiva. Factores relacionadosLa EII es un trastorno crónico cuya etiopatogenia aún no está bien dilucidada, aunque se postula que es un defecto en la interacción microbioma-huésped condicionado por factores ambientales en personas genéticamente predispuestas, lo que da lugar a una alteración en la respuesta inmune innata y adquirida. Un factor de riesgo ambiental que no ha sido explorado de forma adecuada es el beneficio de la dieta en la EC. Los diferentes componentes de la dieta pueden ejercer un efecto importante sobre la composición de la microbiota y sobre la funcionalidad y el desarrollo del sistema inmunitario intestinal. Dos hechos son claros en relación con el efecto de la dieta en la EC, de un lado esta enfermedad está claramente en aumento en los países expuestos a la industrialización y a la «dieta occidental», y de otro la NEE ha demostrado ser efectiva para inducir la remisión clínica e histológica en pacientes con EC15. Diferentes modelos humanos y murinos han puesto de manifiesto el efecto deletéreo de los determinados componentes dietéticos en las estructuras y mecanismos responsables de la homeostasis intestinal y sobre la microbioma (tabla 1). Varios posibles mecanismos pueden asociarse a los defectos de barrera epitelial en los pacientes con EC. En un primer escenario, la permeabilidad está aumentada de forma primaria, hay una mayor exposición de los antígenos bacterianos que dará lugar a una pérdida de la tolerancia e inflamación. Un segundo escenario comienza con un aumento selectivo de la permeabilidad intestinal favoreciendo la translocación bacteriana, fenómeno que desencadena una respuesta inmune adaptativa que pretende contener el proceso. En ambos casos los componentes de la dieta candidatos a ser considerados agentes causales deben ser aquellos contenidos en una dieta occidentalizada capaces de alterar algunos de los mecanismos previamente involucrados en el control de la permeabilidad intestinal. La adherencia bacteriana al epitelio intestinal, su entrada y replicación en el interior de las células epiteliales, células dendríticas y macrófagos da lugar a una continua estimulación del sistema inmune adaptativo e inflamación16. Si además el paciente presenta una predisposición genética, portando genes responsables de la pérdida de la autofagia o de la disfunción de células de Paneth, el sistema inmune innato será incapaz de detectar y erradicar a estas bacterias, dando lugar a una continua estimulación de la respuesta inmune adaptativa, daño tisular, pérdida de la integridad epitelial e incremento de la entrada de bacterias cerrando un círculo vicioso de inflamación denominado «ciclo de penetración bacteriana»16–19.
Efectos deletéreos de los diferentes componentes de la dieta
| Lugar de acción | Componente de la dieta | Efecto | Modelo |
|---|---|---|---|
| Microbioma | Grasa láctea | Baja diversidad Disbacteriosis Presencia de Bilophila wadworthia | Murino IL10-/- |
| Dieta rica en grasa y azúcares simples | Baja diversidad Disbacteriosis | Murino CEABAC 10 | |
| Permeabilidad intestinal | Carragenanos (E-407) | Menor resistencia transepitelial Expresión irregular y discontinua ZO-1 | Células HCT-8, HT-29 y Caco-2 |
| Dieta rica en grasa y azúcares simples | Sobreexpresión de Claudina 2 | Murino CEABAC 10 | |
| Disminución de expresión de ZO-1 y ocludinas | Murino C57BL/6J | ||
| Dieta rica en grasa animal | Dosis dependiente | Ratas Long-Evans mutadas obesas | |
| Gluten | Liberación zonulina, desacoplamiento de tight junctions, incremento de inflamación en íleon (Modelos murinos TNFΔARE/WT) | Células intestinales humanas, Caco-2 e IEC6 | |
| Adherencia, translocación, biofilms | Dieta rica en grasa y azúcares simples | Incremento en la adherencia de AIEC | Murino CEABAC 10 |
| Polisorbato-80 | Incremento de translocación de AIEC | Células M y Caco-2 | |
| Fibra de plátano y brócoli | Disminución de translocación de AIEC | ||
| CMC (E-466) | Adherencia | Murino IL10-/- | |
| Maltodextrinas | Biofilms | Células intestinales humanas | |
| Capa de moco | CMC (E-466) | Sobredesarrollo bacteriano | Murino IL10-/- |
| Dieta rica en grasa y azúcares simples | Disminución de la expresión MUC2, depleción de Células de Goblet. | Murino CEABAC 10 |
Traducido, adaptado y actualizado de Levine A16.
Los efectos terapéuticos pueden aparecer por exclusión de los factores dañinos de la dieta normal18,20, por un efecto directo antiinflamatorio21 o por cambios en la microbiota22. En los últimos años el estudio de la microbiota ha avanzado de forma considerable debido fundamentalmente a los avances en la tecnología de secuenciación y a la bioinformática compleja22. La diversidad de la microbiota suele estar disminuida en pacientes con EC antes de comenzar el tratamiento con NEE23–25. Además, es una verdadera paradoja el hecho contrastado que la NEE produce una disminución en la diversidad y reduce especies bacterianas supuestamente protectoras24,26,27. Las modificaciones en la microbiota antes y después de la primera semana de NEE se están investigando como posibles marcadores de respuesta a corto y medio plazo20. Otra paradoja es que la recurrencia de la EC después de NEE esta asociada con un incremento en la diversidad de la microbiota27. Otros estudios metagenómicos han puesto de manifiesto diferentes alteraciones en rutas metabólicas20,24. Recientemente Dunn et al. describen diferencias en la microbiota entre pacientes respondedores de forma prolongada a la NEE y aquellos que recaen precozmente cuando comienzan con dieta libre. Este segundo grupo tiene una abundancia alta de proteobacterias antes del comienzo de la NEE y su proporción no varía tras el periodo de NEE28.
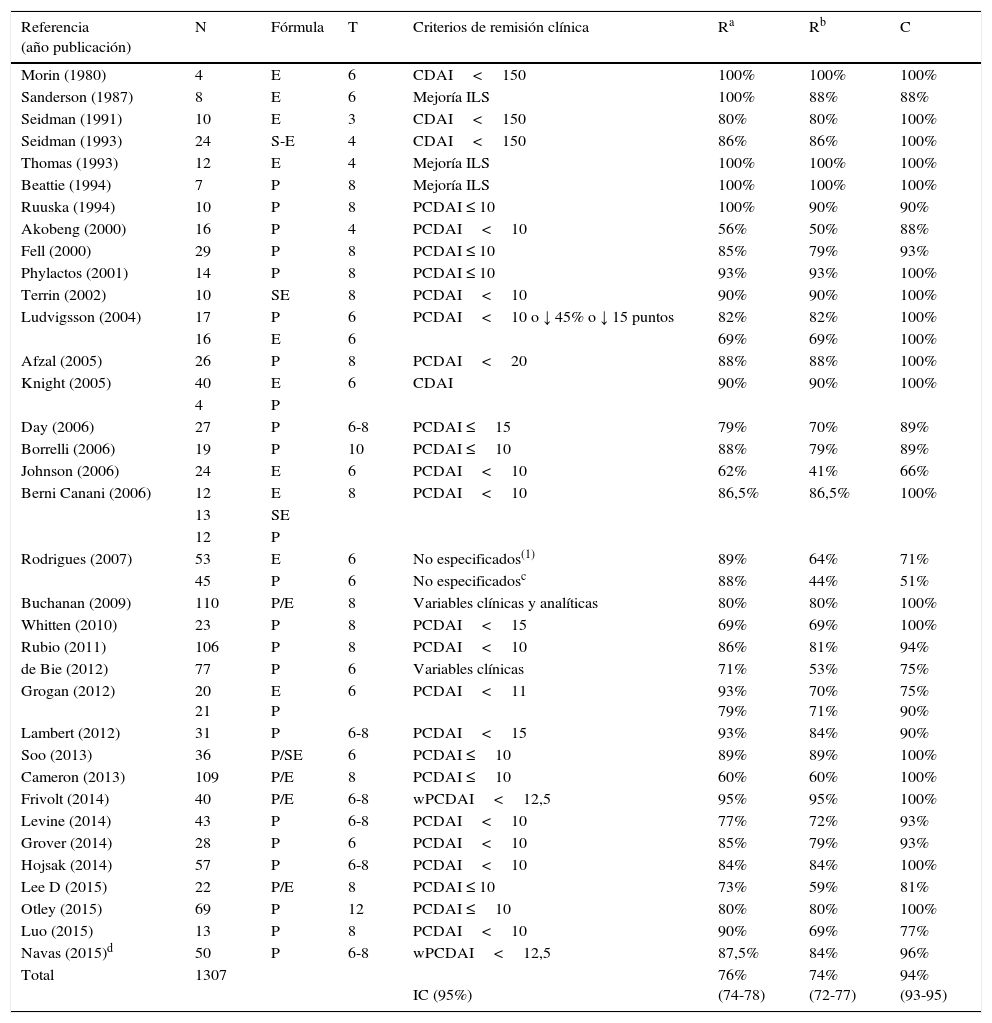
Eficacia de la nutrición enteral exclusivaSi analizamos de forma conjunta los datos publicados en los últimos 35 años sobre la eficacia de la NEE en el tratamiento de la EC se constata una tasa de eficacia del 81% (IC 95%: 78-83), aunque variable según las diferentes fórmulas enterales, criterios de remisión y duración de la NEE (tabla 2) utilizados. Las definiciones de remisión menos rigurosas pueden sobreestimar el porcentaje de pacientes que alcanzan la remisión clínica. Los metaanálisis clásicos, que no encontraban diferencias en la tasa de remisión entre la NEE y los esteroides30–32, dieron paso a estudios como el de Borreli et al.33, que demostraron que la curación mucosa era más frecuente en pacientes con NEE que en los tratados con esteroides, y a otros trabajos más recientes donde se describen efectos a corto y largo plazo de la NEE no observados en las series de pacientes tratados con corticoides, como una mayor tasa de remisión clínica y normalización de PCR en pacientes tratados 12 semanas con NEE34. Grover et al.35 publican una serie prospectiva de 34 pacientes con EC, de los cuales tras 6 semanas con NEE alcanzan remisión clínica el 84%, analítica el 76% y endoscópica (medida con el SES-CD) el 58%. En el 21% de los casos se observa además curación ileal transmural medida por enteroRM. Hubo además una mejoría significativa del peso e IMC a las 6 semanas. La remisión endoscópica precoz se asoció a menores tasas de recaída endoscópica (p=0,02), de uso de antiTNF (p=0,01) y de hospitalización (p<0,03) al año del diagnóstico.
Tasa de remisión clínica en niños con EC tratados con NEE durante el primer brote
| Referencia (año publicación) | N | Fórmula | T | Criterios de remisión clínica | Ra | Rb | C |
|---|---|---|---|---|---|---|---|
| Morin (1980) | 4 | E | 6 | CDAI<150 | 100% | 100% | 100% |
| Sanderson (1987) | 8 | E | 6 | Mejoría ILS | 100% | 88% | 88% |
| Seidman (1991) | 10 | E | 3 | CDAI<150 | 80% | 80% | 100% |
| Seidman (1993) | 24 | S-E | 4 | CDAI<150 | 86% | 86% | 100% |
| Thomas (1993) | 12 | E | 4 | Mejoría ILS | 100% | 100% | 100% |
| Beattie (1994) | 7 | P | 8 | Mejoría ILS | 100% | 100% | 100% |
| Ruuska (1994) | 10 | P | 8 | PCDAI ≤ 10 | 100% | 90% | 90% |
| Akobeng (2000) | 16 | P | 4 | PCDAI<10 | 56% | 50% | 88% |
| Fell (2000) | 29 | P | 8 | PCDAI ≤ 10 | 85% | 79% | 93% |
| Phylactos (2001) | 14 | P | 8 | PCDAI ≤ 10 | 93% | 93% | 100% |
| Terrin (2002) | 10 | SE | 8 | PCDAI<10 | 90% | 90% | 100% |
| Ludvigsson (2004) | 17 | P | 6 | PCDAI<10 o ↓ 45% o ↓ 15 puntos | 82% | 82% | 100% |
| 16 | E | 6 | 69% | 69% | 100% | ||
| Afzal (2005) | 26 | P | 8 | PCDAI<20 | 88% | 88% | 100% |
| Knight (2005) | 40 | E | 6 | CDAI | 90% | 90% | 100% |
| 4 | P | ||||||
| Day (2006) | 27 | P | 6-8 | PCDAI ≤15 | 79% | 70% | 89% |
| Borrelli (2006) | 19 | P | 10 | PCDAI ≤10 | 88% | 79% | 89% |
| Johnson (2006) | 24 | E | 6 | PCDAI<10 | 62% | 41% | 66% |
| Berni Canani (2006) | 12 | E | 8 | PCDAI<10 | 86,5% | 86,5% | 100% |
| 13 | SE | ||||||
| 12 | P | ||||||
| Rodrigues (2007) | 53 | E | 6 | No especificados(1) | 89% | 64% | 71% |
| 45 | P | 6 | No especificadosc | 88% | 44% | 51% | |
| Buchanan (2009) | 110 | P/E | 8 | Variables clínicas y analíticas | 80% | 80% | 100% |
| Whitten (2010) | 23 | P | 8 | PCDAI<15 | 69% | 69% | 100% |
| Rubio (2011) | 106 | P | 8 | PCDAI<10 | 86% | 81% | 94% |
| de Bie (2012) | 77 | P | 6 | Variables clínicas | 71% | 53% | 75% |
| Grogan (2012) | 20 21 | E P | 6 | PCDAI<11 | 93% 79% | 70% 71% | 75% 90% |
| Lambert (2012) | 31 | P | 6-8 | PCDAI<15 | 93% | 84% | 90% |
| Soo (2013) | 36 | P/SE | 6 | PCDAI ≤10 | 89% | 89% | 100% |
| Cameron (2013) | 109 | P/E | 8 | PCDAI ≤10 | 60% | 60% | 100% |
| Frivolt (2014) | 40 | P/E | 6-8 | wPCDAI<12,5 | 95% | 95% | 100% |
| Levine (2014) | 43 | P | 6-8 | PCDAI<10 | 77% | 72% | 93% |
| Grover (2014) | 28 | P | 6 | PCDAI<10 | 85% | 79% | 93% |
| Hojsak (2014) | 57 | P | 6-8 | PCDAI<10 | 84% | 84% | 100% |
| Lee D (2015) | 22 | P/E | 8 | PCDAI ≤ 10 | 73% | 59% | 81% |
| Otley (2015) | 69 | P | 12 | PCDAI ≤10 | 80% | 80% | 100% |
| Luo (2015) | 13 | P | 8 | PCDAI<10 | 90% | 69% | 77% |
| Navas (2015)d | 50 | P | 6-8 | wPCDAI<12,5 | 87,5% | 84% | 96% |
| Total | 1307 | IC (95%) | 76% (74-78) | 74% (72-77) | 94% (93-95) |
C: tasa de cumplimiento; CDAI: índice de actividad de la enfermedad de Crohn; E: elemental; ILS: índice Lloyd-Still; N: número de pacientes incluidos en el estudio; P: polimérica; PCDAI: índice de actividad de la enfermedad de Crohn pediátrica; R: pacientes que alcanzan la remisión; SE: semielemental; T: tiempo en semanas; wPCDAI: índice ponderado de actividad de la enfermedad de Crohn pediátrica.
Datos publicados en forma de tesis doctoral29. Referencias en anexo 1 (material suplementario disponible en Internet).
Otley et al.36 comparan de forma retrospectiva 69 pacientes tratados con NEE durante 12 semanas frente a 70 pacientes que recibieron tratamiento con esteroides. Los pacientes tratados con NEE presentaron un PCDAI menor a las 8 semanas y a los 6 meses, una remisión más rápida (4-8 semanas) y una tasa de respuesta superior (80% vs 63%, p<0,05). Durante el seguimiento el 76% al año, y hasta el 66% a los 3 años de seguimiento no habían requerido la utilización de corticoides. En un grupo de 74 pacientes con EC, 57 tratados con NEE y 17 con esteroides se constató una menor tasa de recaída del grupo tratado con NEE en los 2 años de seguimiento posteriores37.
Navas-López et al.29 constatan un descenso significativo de las cifras de calprotectina fecal (CF) tras la NEE, traduciendo una mejoría del grado de inflamación de la mucosa intestinal, observándose en el 50% de los casos cifras inferiores a 250μg/g de heces (14%<100μg/g, 28%<150μg/g y 50%<250μg/g) consideradas por algunos autores como punto de corte, con una sensibilidad de 80% y especificidad de 82%, para contemplar la escalada terapéutica38. Este descenso significativo también se observó en el estudio de Gerasimidis et al.39, describiendo que la variación de la CF a los 30 días con respecto al valor basal predice la respuesta a la NEE. De esa forma, una reducción en al menos el 18% del valor inicial tiene una sensibilidad del 100% (IC 95%: 54-100), especificidad del 89% (IC 95%: 52-100), VPP 86% (IC 95%: 42-100) y un valor predictivo negativo (VPN) del 100% (IC 95% 63-100) para predecir la remisión.
El efecto antiinflamatorio de la NEE repercute positivamente en otros aspectos de suma importancia como el estado nutricional, el crecimiento y la salud ósea40. Tras 8 semanas de NEE se normalizaron los marcadores óseos traduciéndose en un aumento de la formación y en una disminución de la reabsorción ósea41. Además 6 semanas de tratamiento con NEE y 2 semanas de nutrición enteral parcial (NEP) se tradujeron en una mejoría significativa de los z-scores de densitometría mineral ósea comparada con el grupo tratado con corticoides42. En otro estudio se observó un incremento de la masa magra y de la densidad de hueso trabecular43 después de 12 semanas de NEE.
Se estima que la eficacia de la NEE para el control de los brotes sucesivos varía entre el 50% y el 75%44,45; no obstante, aunque esa tasa de respuesta es inferior que la acontecida en el brote inicial, se ha descrito una disminución de la actividad inflamatoria y mejoría del estado nutricional incluso en los pacientes que no alcanzan la remisión.
No se han descrito diferencias en la tasa de remisión o de cumplimentación en relación con el tipo de fórmula enteral empleada (polimérica, semielemental o elemental), suplementada o no con glutamina o con triglicéridos de cadena media14. La fórmula de NEE puede administrarse por boca o por sonda nasogástrica (SNG), ya que ninguna estrategia ha demostrado ser más eficaz, aunque la vía oral tiene numerosas ventajas (costes, efectos secundarios y facilidad para su administración), si bien la palatabilidad puede influir en su cumplimentación46.
Factores clínicos predictivos de respuesta a la nutrición enteral exclusivaEn relación con los factores predictivos de respuesta ni las cifras de CF, PCR o VSG, la edad ni la gravedad del brote medida por wPCDAI/PCDAI han demostrado su utilidad29. Aún existe controversia acerca de la eficacia de la NEE según la localización de la EC, atribuyéndose clásicamente peor respuesta en casos de afectación exclusivamente colónica. Afzal et al.47 demostraron que la EC colónica no respondía igual que cuando hay afectación ileal (11/12 pacientes con L1, 32/39 con L3 y 7/14 con L2, p=0,0021). DeBie et al.48 encontraron mayor tasa de remisión en pacientes con afectación ileal exclusiva (14/16 con L1 frente 8/15 con L2 y 18/35 con L3, p=0,04). Otros investigadores49 no han confirmado los mismos resultados (10/13 con L1 frente a 15/19 con L2 alcanzaron la remisión después de 4 semanas de NEE, p=0,88). La recomendación actual es que la NEE se emplee en la EC luminal independientemente de la localización, aunque cuando hay afectación perianal grave y presencia de úlceras profundas colónicas se puede considerar el tratamiento con antiTNF como primera opción terapéutica7,50.
Eficacia de la nutrición enteral parcialLa nutrición enteral parcial (NEP) no había sido contemplada hasta hace unos años como una estrategia eficaz para inducir la remisión, y tan solo se consideraba una opción de mantenimiento de la remisión en pacientes seleccionados con enfermedad muy leve o con bajo riesgo de recaída generalmente asociada a otro tratamiento de mantenimiento7. En este escenario la NEP ha demostrado ser más efectiva que la dieta normal, e igual de efectiva que algunas modalidades terapéuticas para mantener la remisión en pacientes con EC inactiva51. Wilschanski et al.52 comparan, de forma retrospectiva, 28 niños con suplementación nocturna con fórmula elemental a través de SNG con 19 niños sin suplementación, una vez que habían alcanzado la remisión clínica. A los 12 meses el 43% de los pacientes suplementados había recaído frente al 79% de los no suplementados. En otra serie de 8 pacientes que recibían a través de SNG el 70% de los requerimientos energéticos durante periodos variables de uno a 4 meses se constató incremento del crecimiento, disminución del PCDAI y de necesidad de tratamiento esteroideo a los 12 meses de seguimiento53. La tasa de remisión clínica fue directamente proporcional a la cantidad de fórmula enteral ingerida durante el periodo de suplementación54.
Johnson et al.55 demostraron mayor eficacia de la NEE sobre la NEP para logar inducir la remisión en EC. A las 6 semanas de tratamiento 10/24 (42%, NEE) frente a 4/26 (15%, NEP), (p=0,035) habían alcanzado la remisión clínica. La baja tasa de respuesta a la NEE en este estudio (42%) hace pensar en la presencia de otros factores que hubiesen condicionado los resultados. Lee et al.56, en un estudio prospectivo, multicéntrico, llevado a cabo en Norteamérica también pusieron de manifiesto la superioridad de la NEE sobre la NEP (88% vs 64% según PCDAI; 45% vs 62% con niveles de CF≤250μg/g).
Basándose en estudios clásicos como el de Johnson, recientemente se han publicado otros protocolos de NEP para inducir la remisión con resultados similares. El protocolo de Gupta et al.57, aplicado en 23 pacientes (34% de ellos en tratamiento concomitante con corticoides), consistía en administrar durante 8-12 semanas el 80-90% de las calorías requeridas por el paciente a través de SNG durante la noche, permitiendo que el paciente tomase un 10-20% de las calorías de forma libre durante el día. La tasa de remisión fue del 63%, y un 16% más respondieron sin alcanzar la remisión. Hasta un 65% de los pacientes comunicaron efectos adversos derivados del empleo de la NEE nocturna (vómitos matutinos, extracción accidental de la sonda, sueño no reparador, distensión abdominal, etc.).
Sigall-Boneh et al.58 trataron a 47 pacientes con una edad media de 16±5,6 años durante 6 semanas con una pauta que consistía en administrar el 50% de sus requerimientos energéticos diarios mediante fórmula polimérica y el otro 50% a través de alimentos incluidos en la «dieta de exclusión de la enfermedad de Crohn», recogida en la tabla 3. La respuesta medida por el Índice de Harvey-Bradshaw y el PCDAI fue del 70% (33/47) a las 6 semanas. Durante las siguientes 6 semanas se fue reduciendo de forma progresiva la cantidad de fórmula polimérica y aumentando la dieta recomendada. Al final de las 12 semanas el 80% de los pacientes continuaban en remisión. Estos hallazgos podrían invitar a pensar en la posibilidad de emplear dicha dieta de exclusión de la EC, hasta mayor evidencia, en el periodo de transición de NEE a dieta normal.
Dieta de exclusión para la enfermedad de Crohn
| Alimentos permitidos diariamente |
| Modo de preparación: al horno, fritos, a la parrilla o cocidos |
| Pechuga de pollo, pescado fresco: ilimitado |
| Carne magra de ternera no procesada como el solomillo: una vez a la semana |
| Arroz blanco |
| Fideos de arroz |
| 2 patatas frescas peladas al día, no tomadas en la misma comida (no permitidas las patatas congeladas) |
| 2 huevos |
| 2 tomates |
| 2 pepinos pelados |
| Una zanahoria (en virutas) |
| Espinacas frescas (un plato) |
| Una manzana pelada (si no hay estenosis) |
| 2 plátanos |
| Un aguacate |
| Algunas fresas |
| Una rodaja de melón |
| Condimentos para cocinar permitidos |
| Aceite de oliva, aceite de canola, sal, pimienta, pimentón, canela en rama, hierbas frescas (hojas de menta, orégano, cilantro, romero, salvia, albahaca y tomillo), cebolla fresca, ajo o jengibre. Zanahoria rallada para ensaladas, arroz o sopas. Miel. Azúcar de mesa (2-3 cucharaditas para el té o para cocinar) |
| Bebidas permitidas |
| Agua, soda, tés. Un vaso al día de zumo de naranjas frescas (no de cartón o embotelladas) |
| Alimentos no permitidos |
| Productos lácteos |
| Margarina |
| Trigo, cereales de desayuno, pan y productos de panadería de cualquier tipo, levadura para hornear |
| Productos sin gluten no mencionados con anterioridad, productos de soja, patata o harina de maíz |
| Carnes y pescados elaborados o ahumados (salchichas, fiambres, salami o palitos de pescado) |
| Salsas, aderezos para ensaladas, siropes y mermeladas de cualquier tipo |
| Productos en conserva y frutos secos |
| Aperitivos envasados (patatas fritas, palomitas de maíz, pretzels, nueces, etc.) |
| Caramelos, bombones, pasteles, galletas y chicles |
| Bebidas no permitidas |
| Todas las bebidas gaseosas, zumos de frutas, bebidas azucaradas, bebidas alcohólicas y café. |
Traducido y adaptado de Sigall-Boneh R et al.58.
La dieta de hidratos de carbono específicos (SCD) se utilizó inicialmente para tratar la enfermedad celíaca a mediados del siglo xx, y se popularizó en la década de los 90. Esta dieta limita la ingesta de trigo, cebada, maíz y arroz, y utiliza harinas de nueces, almendras o coco para hacer pan y otros productos horneados. Además, la ingesta de azúcar se restringe a la fructosa contenida en la miel. También están restringidos los lácteos, a excepción de los yogures totalmente fermentados. El efecto terapéutico de la dieta se atribuye al restablecimiento del equilibrio de la microbiota. Obih et al.59 utilizaron una SCD en 20 pacientes pediátricos con EC durante una media de 9 meses, comprobando mejoría, e incluso normalización en algunos casos de parámetros analíticos y antropométricos. Cohen et al.60 demostraron remisión clínica y cambios endoscópicos (mediante videocápsula) en un estudio de 10 niños siguiendo la SCD, pero sin grupo de control.
La dieta baja en FODMAP (oligosacáridos, disacáridos, monosacáridos y polioles fermentables) puede aliviar el dolor abdominal en estos pacientes, y por tanto disminuir los valores del PCDAI y wPCDAI, aunque no hay evidencia de que induzca la remisión ni mejore los parámetros analíticos y antropométricos.
La dieta baja en lactosa está indicada en pacientes con EC e intolerancia demostrada a la lactosa, no debiendo prescribirse de forma universal, ya que puede ser deficitaria en calcio y vitamina D. Hasta el momento no hay evidencia del efecto de una dieta sin gluten sobre la actividad de la EC16,18.
Las dietas restrictivas en grasa, las veganas u ovolactovegetarianas o la dieta paleolítica no han demostrado beneficio en el tratamiento de los pacientes con EII61.
Inicio de la nutrición enteral exclusiva. Consideraciones prácticasUna vez establecida la indicación de NEE se deben tener en cuenta las necesidades energéticas del paciente, tipo de fórmula, densidad calórica, volumen a administrar, vía de administración (oral o por SNG) y duración de la NEE (tabla 4). El cálculo de los requerimientos energéticos se establece mediante calorimetría o el empleo de fórmulas predictivas, aunque como norma general los pacientes van a requerir el 110-120% de sus requerimientos de energía y proteínas para su edad y sexo. La fórmula empleada suele ser polimérica normocalórica (1kcal/ml), aunque cabe la posibilidad de concentrar la fórmula o emplear fórmulas hipercalóricas (1,5kcal/ml) en casos en los que sea complicado la ingesta del volumen prescrito. A los pacientes solo se les permite tomar agua entre las tomas, aunque algunos autores44 permitían el empleo de saborizantes (siropes, cacao en polvo, etc.) o chicles. En las series publicadas suele ser excepcional el empleo de sonda nasogástrica, además no se ha comprobado mejor tasa de respuesta con su empleo46. El inicio de la NEE debe ser progresivo alcanzando en los siguientes 2-3 días la totalidad del volumen prescrito, que se repartirá en 4-5 tomas al día. El estado nutricional del paciente debe ser evaluado de forma regular durante el periodo de NEE y los requerimientos reajustados a sus necesidades. Si el paciente queda con hambre, o la ganancia ponderal no es adecuada, puede incrementarse el volumen diario de fórmula enteral. Ya que en muchos casos la respuesta aparece dentro de las primeras 2 semanas cuando hay adherencia total a la NEE, la respuesta a la misma debe evaluarse a las 3-4 semanas si en este tiempo no se evidencia respuesta razonable y se puede modificar el plan terapéutico de manera individualizada. La duración de la NEE varía sustancialmente en las diferentes series consultadas y oscila entre las 3 y 12 semanas, si bien la mayoría de las unidades emplean ciclos de 6-8 semanas. Se recomienda mantener la NEE durante al menos 8 semanas5, periodo que podrá prolongarse en casos seleccionados (pacientes desnutridos, retraso en lograr tomar la cantidad diaria de fórmula prescrita o cuando se constate actividad inflamatoria (elevación de PCR, VSG o calprotectina fecal) pese a encontrarse en remisión clínica.
Nutrición enteral exclusiva. Aspectos prácticos
| 110-120% de los requerimientos de energía y proteínas según edad y sexo |
| Fórmula polimérica normo (1kcal/ml) o hipercalórica (1,5kcal/ml) repartida en 4-5 tomas, preferiblemente por boca |
| Inicio gradual alcanzando volúmenes prescritos a las 48–72h |
| Evaluación de respuesta a partir de las 2 semanas |
| Revisiones periódicas para comprobar aceptación, tolerancia, adherencia, ganancia ponderal y sensación de hambre |
| Duración: 6-8 semanas. Prolongar en casos de desnutrición, retraso en lograr tomar la cantidad diaria de fórmula prescrita o cuando se constate actividad inflamatoria (elevación de PCR, VSG o calprotectina fecal) pese a encontrarse en remisión clínica |
| Precaución en pacientes con riesgo de síndrome de realimentación |
En nuestro país44, una vez completado el periodo de inducción con NEE durante 6-8 semanas, el 94,2% de las unidades realiza un paso progresivo a la dieta normal en las siguientes 2-4 semanas, el 7,6% siguiendo protocolos propios y el 92,4% restante sin seguir ningún protocolo. Además, un 5,8% pasa a dieta normal de forma rápida, sin tener en cuenta ningún orden a la hora de introducir los grupos de alimentos. No hay datos que apoyen una u otra práctica. Faiman et al.62 no encontraron diferencias entre un grupo de 20 pacientes que tras la NEE reintrodujeron de forma progresiva la dieta (2 nuevos alimentos cada 2 días durante 3 semanas mientras disminuían progresivamente la cantidad de fórmula polimérica) frente a otro de 19 pacientes donde tras 3 días de dieta baja en residuos comenzaron una dieta sin restricciones.
Complicaciones de la nutrición enteral exclusivaLa NEE es un tratamiento seguro y bien tolerado. Un efecto secundario extremadamente infrecuente es el síndrome de realimentación5; es por ello que se recomienda en aquellos pacientes con desnutrición grave que vayan a recibir NEE realizar un control clínico-analítico en medio hospitalario para iniciar tratamiento de forma precoz.
Dificultades para utilizar la nutrición enteral exclusiva. Predictores de no adherencia a la nutrición enteral exclusivaEn una encuesta realizada en 51 unidades de gastroenterología del territorio español44 se recogieron la falta de aceptación por el paciente y/o familia (71%) y la falta de tiempo y/o personal auxiliar (dietistas, nutricionistas, psicólogos, etc.) para colaborar en el seguimiento y soporte de estos pacientes (69%) como los factores limitantes más frecuentes a la hora de establecer la NEE como tratamiento. Otros aspectos menos importantes fueron la dificultad para convencer al paciente y/o familia de la idoneidad del tratamiento (43%), la limitación presupuestaria (10%), la dificultad para utilizar en el hospital vías alternativas a la oral como la SNG o gastrostomía (8%), o las dificultades logísticas para la prescripción y administración de la nutrición por parte del hospital (2%). Aunque las dificultades son parecidas en otras áreas, como Norteamérica63, es importante resaltar que la formación clínica del gastroenterólogo influye en el uso de la NEE en su práctica clínica diaria. DeBie et al.48 estudian la adherencia a la NEE; los pacientes no cumplidores eran significativamente mayores (15,5 años vs 13,4 años, p=0,04), predominantemente mujeres (36% vs 7%, p=0,003), de padres no holandeses (35% vs 13%, p=0,06) y que recibían NEE por vía oral (27% vs 10%, p=0,08). Pese a las dificultades más frecuentemente referidas por los pacientes y sus familiares (mal sabor de la fórmula, el aislamiento social, monotonía y la excesiva duración del tratamiento), casi el 60% volvería a completar otro curso de NEE en sucesivos brotes (SvolosV et al. —datos no publicados—).
Calidad de vida y nutrición enteral exclusivaLa carga de enfermedad impuesta a los niños y adolescentes con EC y colitis ulcerosa es considerable. No obstante, se ha documentado con menos frecuencia la carga psicológica a la que estos enfermos se encuentran sometidos. Los instrumentos para evaluar la calidad de vida relacionada con la salud (HRQOL) pretenden ponderar este aspecto. La HRQOL puede definirse como el grado de satisfacción general con la vida sobre el que influye, positiva o negativamente, la percepción que tienen las personas sobre determinados aspectos de la vida que son importantes para ellos, incluidas las cuestiones relacionadas o no con la salud. Afzal et al.64 comprobaron una mejoría en la calidad de vida medida por el IMPACT II de 26 pacientes con EC después de 8 semanas de NEE; esta mejoría no se correlacionó con la curación mucosa, pero sí con un descenso significativo del PCDAI. Esto es debido a que en niños con EII la HRQOL se relaciona directamente con la actividad inflamatoria, los síntomas y con la comorbilidad psicológica. Además, puntuaciones bajas de HRQOL son predictivas de la hiperfrecuentación de los servicios sanitarios por parte de los pacientes con EII.
ConclusionesEl tratamiento de la EC requiere atención tanto para alcanzar la curación mucosa como para la optimización del crecimiento, manteniendo asimismo una correcta salud ósea. La NEE se recomienda como tratamiento de primera línea en la EC luminal. Los mecanismos terapéuticos de la NEE se están descubriendo por los avances en el estudio de la microbiota intestinal. Aunque la exclusión total de una dieta normal durante el tiempo de NEE sigue siendo de alta importancia, nuevas modalidades de NEE hacen esperar un futuro exitoso para el manejo nutricional de la EC.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relacionado con este manuscrito.
JVL is supported by a NASPGHAN/CCFA Young Investigator Development award (2013-2015), a Nova Scotia Health Research Foundation (NSHRF) establishment award (2015-2017), a Future Leaders in Inflammatory Bowel Disease (FLIBD) Program grant (2015-2016), a Dalhousie Medical Research Foundation equipment grant (2015-2016), a donation from the MacLeod family, an IWK Health Centre Research Associateship grant and a Canadian Institutes of Health Research (CIHR)-Canadian Association of Gastroenterology (CAG)-Crohn's Colitis Canada (CCC) New Investigator Award (2015-2020: 201412XGP-340307-205026).




![Incidencia de enfermedad inflamatoria intestinal en España: relación con la velocidad de crecimiento y la densidad mineral ósea en niños españoles. Las barras representan los casos de los diferentes tipos de EII (datos obtenidos del estudio SPIRIT1). Las líneas discontinuas representan la velocidad de crecimiento ([VC]; datos obtenidos de Carrascosa et al.3), las líneas continuas los valores de densidad mineral ósea ([DMO] datos obtenidos de Del Rio et al.4). En esta gráfica puede observarse cómo el momento de más incidencia de EII coincide con los mayores picos de velocidad de crecimiento y aposición ósea. CU: colitis ulcerosa; EC: enfermedad de Crohn; EIInC: enfermedad inflamatoria intestinal no clasificada. Incidencia de enfermedad inflamatoria intestinal en España: relación con la velocidad de crecimiento y la densidad mineral ósea en niños españoles. Las barras representan los casos de los diferentes tipos de EII (datos obtenidos del estudio SPIRIT1). Las líneas discontinuas representan la velocidad de crecimiento ([VC]; datos obtenidos de Carrascosa et al.3), las líneas continuas los valores de densidad mineral ósea ([DMO] datos obtenidos de Del Rio et al.4). En esta gráfica puede observarse cómo el momento de más incidencia de EII coincide con los mayores picos de velocidad de crecimiento y aposición ósea. CU: colitis ulcerosa; EC: enfermedad de Crohn; EIInC: enfermedad inflamatoria intestinal no clasificada.](https://static.elsevier.es/multimedia/16967801/0000001500000003/v1_201610010111/S1696780116300677/v1_201610010111/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)


