El tratamiento biológico con anticuerpos frente al factor de necrosis tumoral alfa (anti-TNF) ha mejorado las posibilidades terapéuticas de la enfermedad inflamatoria intestinal (EII). Estos fármacos han mostrado una elevada eficacia clínica, asociada fundamentalmente a la curación de la mucosa intestinal y a la mejora de la calidad de vida de los pacientes. Sin embargo, un porcentaje considerable de pacientes no responden inicialmente al tratamiento o pierden la respuesta conseguida a lo largo del tiempo. Con vistas a resolver el fracaso del tratamiento anti-TNF, se han empleado varias estrategias en una actitud conocida como intensificación del tratamiento. Estas estrategias incluyen el aumento de la dosis del fármaco anti-TNF, el acortamiento de los intervalos de administración, la asociación del anti-TNF con un inmunomodulador, o bien, sin ser estrictamente una actitud de intensificación, el cambio a otro fármaco anti-TNF o a otro tipo de fármaco biológico (pocas alternativas en caso de la EII). Estas estrategias se han aplicado habitualmente de forma empírica, en base a la situación clínica de los pacientes. Recientemente, la introducción en la práctica clínica de la monitorización farmacológica de los anti-TNF, con la determinación de los niveles séricos del fármaco y de la presencia de anticuerpos frente al fármaco, permite efectuar una selección más precisa de estas estrategias. Aun así, hay ciertos aspectos sobre la intensificación del tratamiento anti-TNF que quedan por resolver, y los pacientes con tratamiento intensificado deben vigilarse exhaustivamente por el riesgo elevado de infecciones.
Biological treatment with drugs targeting tumor necrosis factor-α (anti-TNF) has improved the therapeutic options for inflammatory bowel disease (IBD). These drugs have shown high clinical efficacy associated primarily with mucosal healing and improvement in the patient¿s quality of life. However, a high percentage of patients do not respond to initial treatment or lose the achieved response over time. To prevent or attenuate anti-TNF failure, several strategies have been employed in an attitude known as treatment intensification. These strategies include: increasing anti-TNF dosage, shortening the intervals in administration, associating anti-TNF to an immunomodulator or, although not strictly an attitude of intensification, switching to another anti-TNF or biological drug (there are few alternatives in IBD). These strategies are usually applied empirically, based on the clinical condition of patients. Recently, the introduction of anti-TNF monitoring in clinical practice through the determination of drug serum levels and presence of antibodies to the drug, allows a more accurate selection of strategies. Nevertheless, there are certain aspects of the intensification of anti-TNF treatment that remain unresolved and patients with intensified treatment must be closely and thoroughly monitored because of the high risk of infection.
Las terapias biológicas han revolucionado el tratamiento de la enfermedad inflamatoria intestinal (EII), donde los anticuerpos monoclonales contra el factor de necrosis tumoral alfa (anti-TNF) han demostrado ser capaces de inducir y mantener de forma prolongada la remisión clínica de la enfermedad e incluso de promover la curación de las lesiones de la mucosa intestinal1,2.
En la enfermedad de Crohn (EC) la respuesta inicial a los fármacos anti-TNF se produce en el 70-85% de los pacientes2. Sin embargo, se ha descrito que el tratamiento con infliximab y adalimumab fracasa en la inducción de la remisión en el 13-40% de los pacientes3, y que el tratamiento con estos 2 fármacos sufre una pérdida anual de respuesta en el 13% y en el 24% de los pacientes, respectivamente4,5. Por otra parte, en la colitis ulcerosa (CU) el fracaso del tratamiento está menos estudiado, pero la pérdida de respuesta secundaria ha sido descrita en cerca del 40%6 de los pacientes, incluso algunos estudios muestran que podría ser mayor en la CU que en la EC7. Estas situaciones de fracaso terapéutico han llevado a emplear diferentes estrategias para superarlas, como aumentar la dosis de los fármacos biológicos, reducir/acortar sus tiempos de administración o asociar inmunosupresores, en caso de que hayan sido retirados, en lo que se conoce como intensificación del tratamiento.
Definiciones y factores relacionados con el fracaso del tratamiento anti-TNF en la enfermedad inflamatoria intestinalEl fracaso del tratamiento biológico puede producirse en la fase de inducción o durante el mantenimiento de la respuesta conseguida con la inducción. La primera situación se conoce como no respuesta primaria, y la segunda, como pérdida de respuesta secundaria8. La definición de no respuesta primaria no es unánime en la literatura debido, fundamentalmente, a la fijación de los tiempos a partir de los cuales se debe considerar la no respuesta primaria. Los ensayos clínicos iniciales consideraban no respuesta clínica primaria la que se producía a las 2 semanas de la administración de una única dosis de infliximab9, mientras que en ensayos posteriores este tiempo se prolonga, estableciendo que el fracaso no se debería determinar antes de la semana 14 para infliximab, de la 12 para adalimumab y de la 8 para certolizumab3. Sin embargo, en la práctica clínica el tratamiento se suele prolongar, dependiendo de la situación clínica, hasta 6 meses antes de considerar la no respuesta primaria3.
Tampoco existe un consenso respecto a la definición de pérdida de respuesta secundaria. Se refiere a la situación clínica cuando un paciente con respuesta inicial a un fármaco biológico presenta una disminución o una menor duración de esta respuesta en el tiempo8. Para ello, es necesario la reaparición de los síntomas y que estos sean debidos al proceso inflamatorio de la EII.
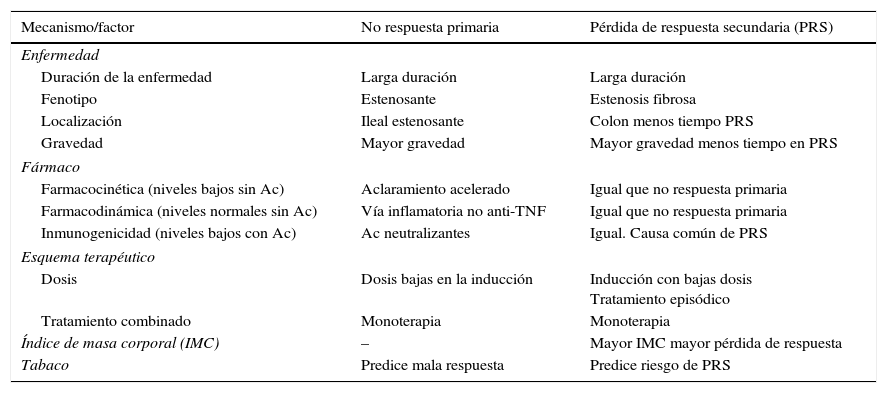
La evidencia actual sugiere que los mecanismos relacionados con el fracaso del tratamiento biológico (no respuesta primaria y pérdida de respuesta secundaria) son multifactoriales (tabla 1). Entre estos factores, los relacionados con el fármaco (farmacocinética, inmunogenicidad y dosis) y el consumo de tabaco son los más susceptibles de ser modificados para mejorar la respuesta o recuperarla3. Se considera fracaso farmacocinético del anti-TNF cuando los niveles séricos de fármaco son bajos o ausentes, y no se evidencian anticuerpos (Ac) frente al fármaco; este fenómeno se atribuye a un aclaramiento acelerado no inmune del fármaco en los tejidos o en la circulación sistémica. En el fracaso farmacodinámico, los niveles séricos de fármaco son normales y tampoco se detectan Ac frente al mismo; en este caso, el fracaso terapéutico se atribuye a la existencia de una vía inflamatoria no relacionada con el factor de necrosis tumoral alfa. Por último, en el fallo inmunogénico la presencia de títulos elevados de Ac frente al anti-TNF se asocia a niveles séricos del fármaco bajos o ausentes; la aparición de estos Ac se ha evidenciado incluso después de la primera infusión del fármaco3.
Mecanismos/factores relacionados con el fracaso del tratamiento biológico en la enfermedad inflamatoria intestinal
| Mecanismo/factor | No respuesta primaria | Pérdida de respuesta secundaria (PRS) |
|---|---|---|
| Enfermedad | ||
| Duración de la enfermedad | Larga duración | Larga duración |
| Fenotipo | Estenosante | Estenosis fibrosa |
| Localización | Ileal estenosante | Colon menos tiempo PRS |
| Gravedad | Mayor gravedad | Mayor gravedad menos tiempo en PRS |
| Fármaco | ||
| Farmacocinética (niveles bajos sin Ac) | Aclaramiento acelerado | Igual que no respuesta primaria |
| Farmacodinámica (niveles normales sin Ac) | Vía inflamatoria no anti-TNF | Igual que no respuesta primaria |
| Inmunogenicidad (niveles bajos con Ac) | Ac neutralizantes | Igual. Causa común de PRS |
| Esquema terapéutico | ||
| Dosis | Dosis bajas en la inducción | Inducción con bajas dosis Tratamiento episódico |
| Tratamiento combinado | Monoterapia | Monoterapia |
| Índice de masa corporal (IMC) | – | Mayor IMC mayor pérdida de respuesta |
| Tabaco | Predice mala respuesta | Predice riesgo de PRS |
Fuente: Ding et al.3
En la actualidad, se dispone de varias opciones para superar el fracaso de los anti-TNF, tanto el que acontece durante la fase de inducción como el que se produce durante la fase de mantenimiento. Previamente a decidir la estrategia a emplear, siempre debe confirmarse que los síntomas que presenta el paciente son debidos al proceso inflamatorio propio de la EII y no a otras causas (tabla 2)3,10. Las opciones que se emplean ante la falta o pérdida de respuesta al tratamiento anti-TNF son:
- -
Aumentar la dosis del anti-TNF.
- -
Acortar el intervalo de tiempo de administración entre las dosis del anti-TNF.
- -
Asociar un inmunomodulador al anti-TNF.
- -
Cambiar a otro anti-TNF.
- -
Cambiar el tipo de fármaco biológico.
Causas de síntomas en pacientes con enfermedad inflamatoria intestinal durante el tratamiento con fármacos antifactor de necrosis tumoral no debidos a actividad de la enfermedad
| No inflamatorias |
| Síndrome de intestino irritable |
| Estenosis fibrosas |
| Neoplasias |
| Dietéticas (intolerancias) |
| Miscelánea |
| Amiloidosis |
| Sobrecrecimiento bacteriano |
| Malabsorción de sales biliares |
| Inflamatorias |
| Infección |
| Colitis isquémica |
| Vasculitis |
La eficacia de estas medidas se muestra en la tabla 3. Estudios que han comparado las diferentes opciones (fundamentalmente el aumento de dosis vs. acortar el intervalo de tiempo entre infusiones) no han mostrado diferencias significativas entre ambas opciones respecto al beneficio clínico, aunque doblar la dosis, en caso de anti-TNF de administración intravenosa, parece una opción preferible por presentar un menor coste11. Expertos recomiendan emplear una u otra opción en base a la clínica del paciente: si los pacientes tienen síntomas durante todo el intervalo de tratamiento, lo indicado sería aumentar la dosis; por el contrario, si los síntomas aparecen al final del intervalo de tratamiento, acortar el tiempo de administración sería la decisión más lógica12. Estas estrategias de intensificación del tratamiento han sido empleadas tanto en la fase de inducción como durante el mantenimiento. Incluso se ha empleado en la práctica clínica una estrategia combinada de doblar dosis y acortar el intervalo de administración del fármaco, fundamentalmente cuando no se disponía de niveles ni de estudio farmacocinético de los anti-TNF (tabla 3).
Eficacia de las estrategias de recuperación de la respuesta al tratamiento biológico en la enfermedad inflamatoria intestinal
| Estrategia | Eficacia % |
|---|---|
| Doblar la dosis o acortar intervalo de administración | 50-70 |
| Doblar dosis | 77/50a |
| Acortar intervalo de administración | 66/39a |
| Asociar inmunosupresor al anti-TNF | 100b |
| Cambiar de fármaco anti-TNF | |
| Cambio a adalimumabc | |
| Tras fracaso primario (remisión/respuesta) | 30/53 |
| Tras pérdida de respuesta (remisión/respuesta) | 45/70 |
| Tras intolerancia (remisión/respuesta) | 61/70 |
| Cambio a certolizumabc | 41 |
La asociación de un inmunomodulador, cuando se produce una pérdida de respuesta al tratamiento anti-TNF, ha mostrado conseguir restaurar la respuesta clínica incluso en pacientes en los que previamente el tratamiento inmunosupresor había fracasado13,14. La eficacia del inmunomodulador, cuando se pierde la respuesta al anti-TNF, está asociada a la eliminación de los anticuerpos contra el fármaco y al consiguiente aumento de los niveles del anti-TNF14.
La eficacia de un segundo fármaco anti-TNF es menor que la alcanzada en un paciente que no haya sido tratado previamente con otro anti-TNF15; no obstante, una revisión sistemática sobre esta estrategia de cambio de fármaco ante la pérdida de respuesta o intolerancia muestra que el empleo de un segundo anti-TNF alcanza una tasa de remisión del 62%12,15. Sin embargo, dadas las escasas opciones terapéuticas actuales una vez fracasan los anti-TNF, y que algún estudio ha mostrado que doblar la dosis puede tener un efecto beneficioso sobre la calidad de vida frente al cambio de fármaco biológico16, la elección de la estrategia a emplear debería apoyarse en datos objetivos sobre el mecanismo que ha contribuido al fracaso terapéutico. En este sentido, el empleo en la práctica clínica de la determinación de niveles séricos de fármacos anti-TNF y de la presencia de Ac frente a estos fármacos puede permitir intensificar el tratamiento anti-TNF con mayor precisión17.
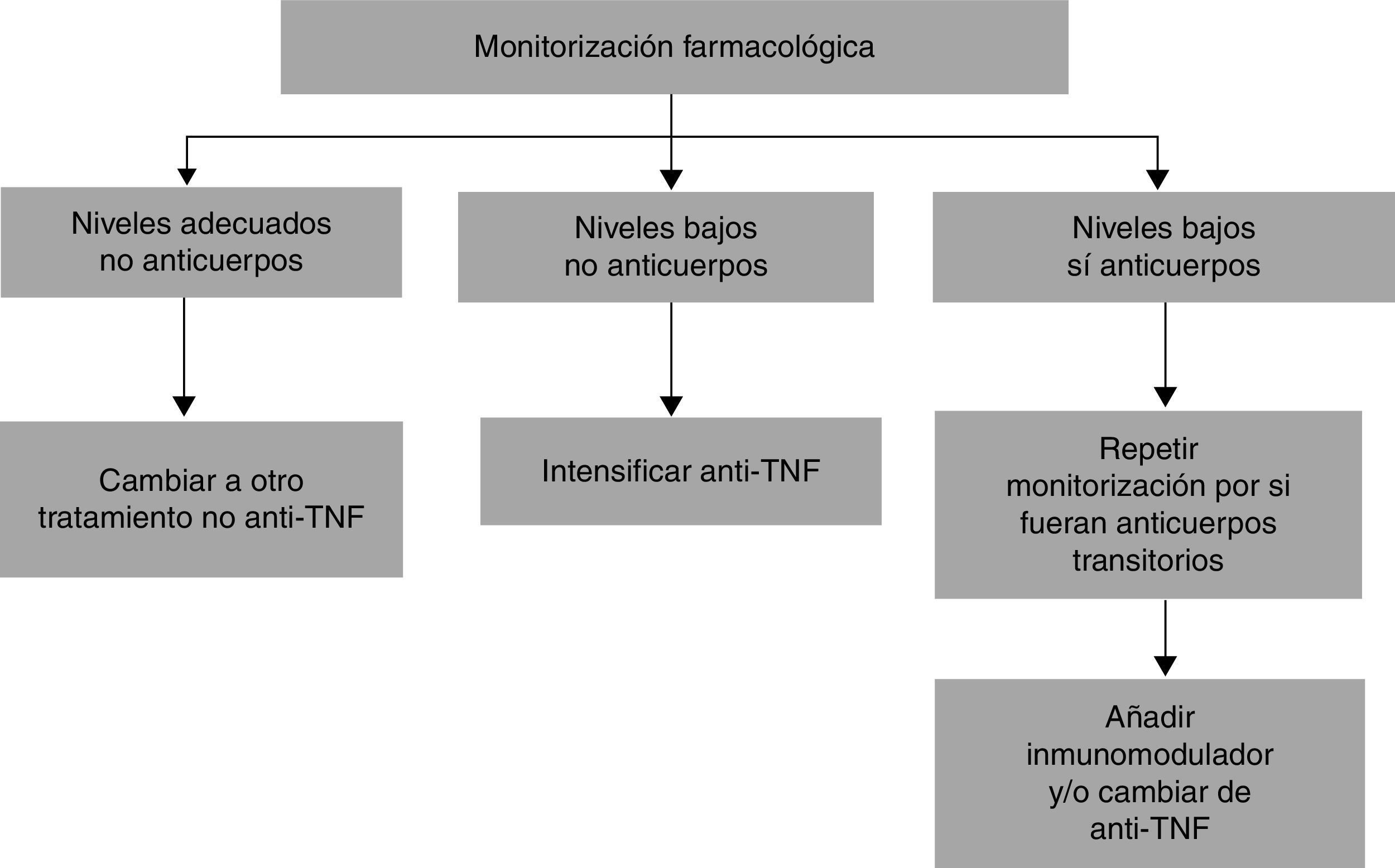
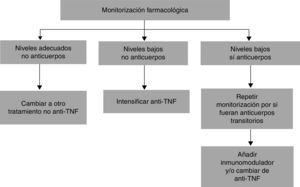
Estrategia de intensificación guiada por la monitorización farmacológicaLa práctica seguida hasta la actualidad de intensificar el tratamiento en base a los síntomas del paciente puede ser suficiente para recuperar la respuesta18; sin embargo, esta práctica empírica no garantiza que todos los pacientes reciban el ajuste óptimo de su tratamiento12. Hoy en día, la monitorización de los niveles en suero de fármacos anti-TNF y de la presencia de Ac se emplea cada vez más en la práctica clínica para mejorar la eficacia del tratamiento y reducir sus efectos secundarios17; de hecho, la presencia de niveles séricos adecuados de fármaco se ha relacionado con una mejor respuesta clínica, biológica y endoscópica19. Así, ante la pérdida de respuesta al fármaco anti-TNF, la monitorización farmacológica para conocer los niveles séricos del fármaco y la posible existencia de Ac contra el mismo representa una medida de gran utilidad para seleccionar la estrategia a seguir más adecuada entre intensificar el tratamiento o cambiar de fármaco (otro anti-TNF o un fármaco con distinto mecanismo de acción), como se muestra en el algoritmo de la figura 120. En esta situación de pérdida de respuesta clínica, la monitorización farmacológica y de Ac permite mejorar la tasa de curación mucosa tras la siguiente dosis de intensificación, tanto en pacientes con EC como con CU21. Además, esta estrategia guiada por la monitorización farmacológica tiene una mejor relación coste-eficacia que la intensificación empírica22,23.
La utilidad de la monitorización farmacológica de los anti-TNF en pacientes sin clínica de pérdida de respuesta ha sido evaluada en un estudio reciente que compara 2 actitudes de intensificación diferentes. Una está basada en la reaparición de los síntomas y otra en la monitorización rutinaria de los niveles de fármacos y presencia de Ac, con el objetivo de ajustar el tratamiento independientemente de la situación clínica24. Este estudio aleatorizado y controlado incluye 263 pacientes (178 con EC y 85 con CU) que, tras un ajuste de la dosis inicial en base a los niveles de fármaco, se aleatorizan (1:1) en los 2 grupos comentados. El objetivo final del estudio es alcanzar la remisión clínica y bioquímica al año de seguimiento. Aunque el estudio no muestra diferencias significativas entre los 2 grupos en el objetivo principal (66% de pacientes en remisión en el grupo de ajustes en base a la clínica vs. 69% en el grupo donde el tratamiento se ajusta en base a la monitorización farmacológica; p=0,686), sí se evidencia una tasa significativamente menor de recaídas en el grupo donde el ajuste de tratamiento se hace en base a la monitorización farmacológica frente al grupo en el que se ajusta el tratamiento en base a la clínica (7% vs. 17%, respectivamente; p=0,018).
Sin embargo, el empleo de la monitorización farmacológica como guía de la intensificación del tratamiento aún presenta dilemas por resolver10,17. En situaciones en las que los niveles de fármaco son infraterapéuticos y los Ac frente al fármaco negativos, que en base al algoritmo debería implicar un aumento de la dosis del fármaco, se ha evidenciado cómo los Ac se positivizan al demorar la administración del fármaco y permitir que se liberen del mismo. Por otra parte, varios estudios han mostrado cómo en situaciones con pérdida de respuesta y niveles de fármaco infraterapéuticos con Ac positivos (según el algoritmo indicación de cambio a otro fármaco), se ha conseguido recuperar la respuesta aumentando la dosis del fármaco, fenómeno atribuible, según algunos expertos, a que la detección de Ac puede no tener las mismas implicaciones en diferentes pacientes debido a la variación individual en la afinidad, la funcionalidad y el título de estos Ac10.
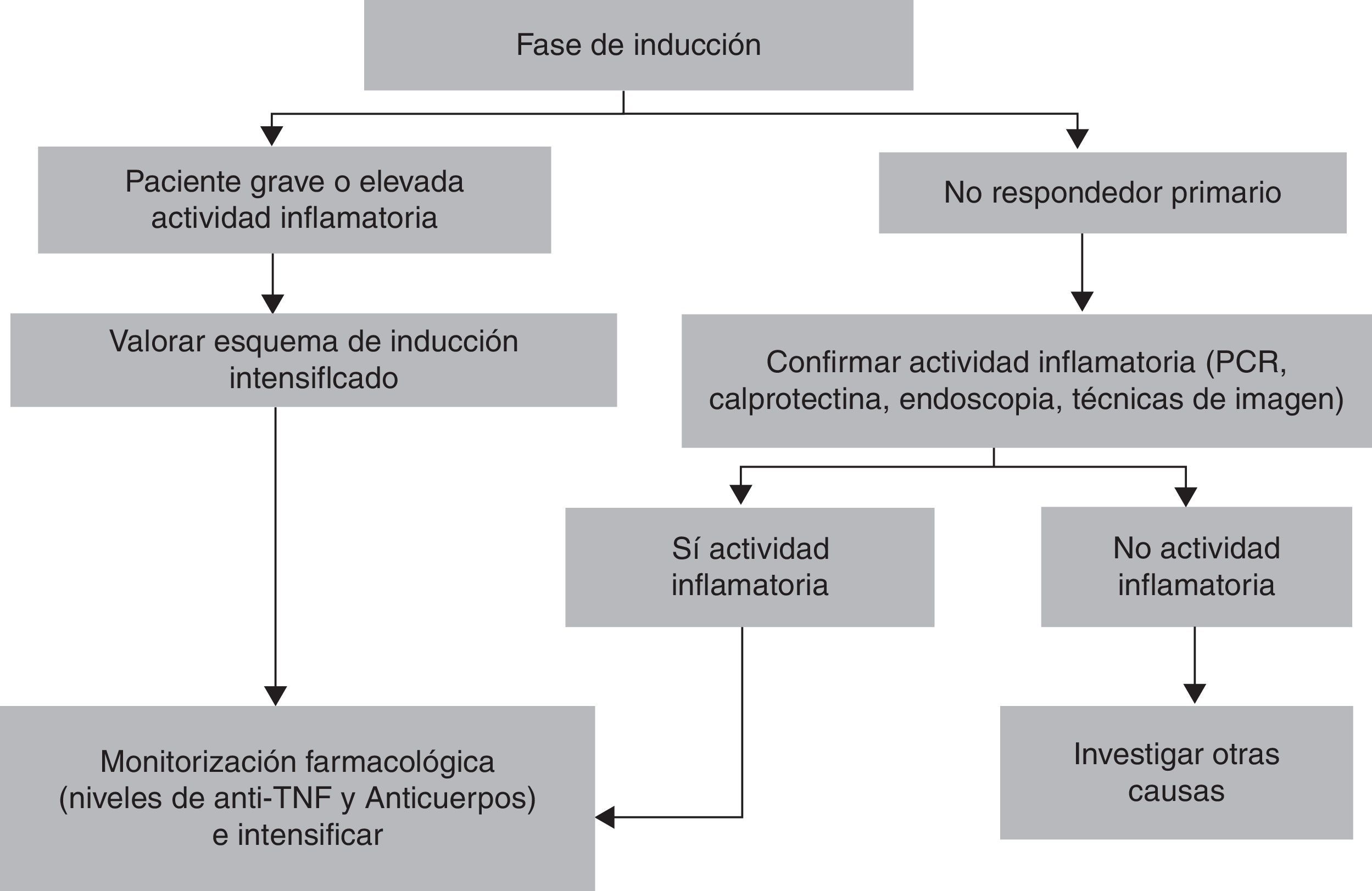
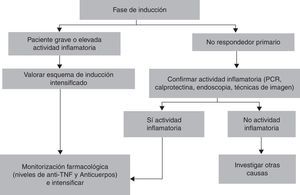
Enfoque práctico para la intensificación del tratamiento anti-TNFEn la fase de inducción parece que realizar un tratamiento intensificado con anti-TNF sea una mejor opción en los pacientes con EC y cifras elevadas de proteína C reactiva25, así como en los pacientes con CU grave26. También, la monitorización farmacológica precoz, a las 2 semanas del inicio de la inducción, puede predecir el fracaso del tratamiento si los niveles de fármaco son bajos27.
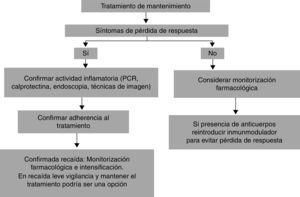
Ante la sospecha clínica de fracaso del tratamiento anti-TNF, tanto durante la fase de inducción como durante la de mantenimiento, debe plantearse la necesidad de intensificar el tratamiento para optimizar sus resultados. Previo a realizar la intensificación debe confirmarse que existe actividad inflamatoria asociada a la EII (biomarcadores, técnicas de imagen, endoscopia), descartar otras posibles causas de los síntomas3 y comprobar la cumplimentación del tratamiento (hasta un 15% de los pacientes en tratamiento con adalimumab no lo cumplimentaban)28. Llegado a este punto, si los síntomas son leves, una opción es simplemente vigilar de forma estrecha al paciente durante un corto periodo de tiempo (1-2 semanas)10, dado que hasta un 50% de los pacientes recuperan la respuesta manteniendo el mismo tratamiento y con la misma posología29,30. En caso de presentar una recaída moderada-grave, intensificar el tratamiento, acortando el intervalo entre dosis o aumentando la misma, es lo indicado3,10,12. En esta situación, la determinación de los niveles séricos de anti-TNF y la detección de Ac claramente orientan para realizar la intensificación más adecuada.
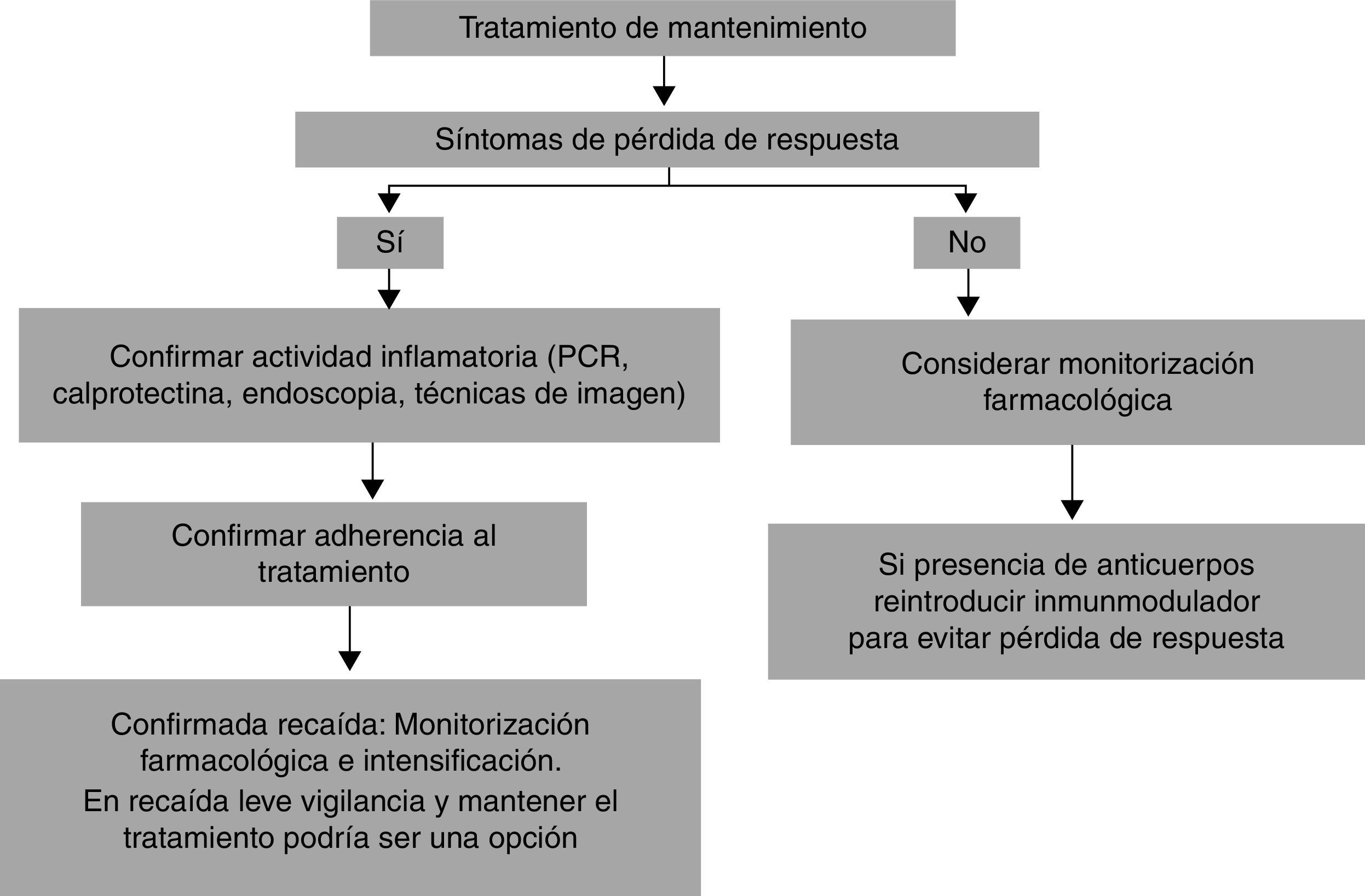
Una situación algo más controvertida es el empleo de la monitorización farmacológica en pacientes que mantienen una adecuada respuesta durante el tratamiento de mantenimiento. Aunque la presencia de niveles séricos de anti-TNF bajos y/o de Ac frente al fármaco son hallazgos que pueden predecir la pérdida de respuesta3, hay que tener en cuenta que la presencia de Ac frente al fármaco puede ser transitoria y no tener un efecto neutralizante frente al anti-TNF17. Por ello, en esta situación con mantenimiento de la respuesta clínica, algunos expertos recomiendan no suspender el anti-TNF y reintroducir un inmunomodulador3.
En las figuras 2 y 3 se muestran 2 propuestas de algoritmos de intensificación para la inducción y durante el mantenimiento.
Un estudio inicial que evaluó el papel de infliximab en la EC fistulizante mostraba un aumento de efectos secundarios en el grupo de pacientes que recibió 10mg/kg (84%) frente a los pacientes tratados con 5mg/kg (65%)31. Sin embargo, resultados de ensayos clínicos9 y del registro TREAT32 no sugieren que existan diferencias respecto al desarrollo de infecciones graves o a la presencia de efectos secundarios que obliguen a suspender el tratamiento entre los pacientes tratados con 10mg/kg, frente a los que recibieron 5mg/kg.
Un estudio reciente, donde se emplean dosis altas de infliximab (>10mg/kg/8 semanas), aunque sí muestra una tasa elevada de infecciones, fundamentalmente entre los pacientes que reciben dosis superiores a 2,5mg/kg/semana, la tasa de abandono del tratamiento debida a los efectos secundarios fue del 7%, semejante a la descrita en los ensayos clínicos, interesando a un pequeño grupo de pacientes (en un paciente, tratado con >2,5mg/kg/semana, ocurrieron un 80% de las infecciones graves de su grupo)33.
Es necesario vigilar estrechamente a los pacientes con dosis altas de anti-TNF que presenten otros factores de riesgo (tratamiento combinado, desnutrición, mal control de la EII) para desarrollar infecciones.
ConclusiónOptimizar el empleo de los fármacos anti-TNF sigue siendo una prioridad en el tratamiento de los pacientes con EII. Para ello, intensificar el tratamiento de una forma precoz y orientada por la monitorización farmacológica es una medida eficaz que debe aplicarse en la práctica clínica. El riesgo de efectos secundarios de la intensificación del tratamiento anti-TNF no parece superior al de las dosis habituales; sin embargo, debe realizarse una vigilancia exhaustiva en aquellos pacientes con más riesgo de desarrollar infecciones.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.