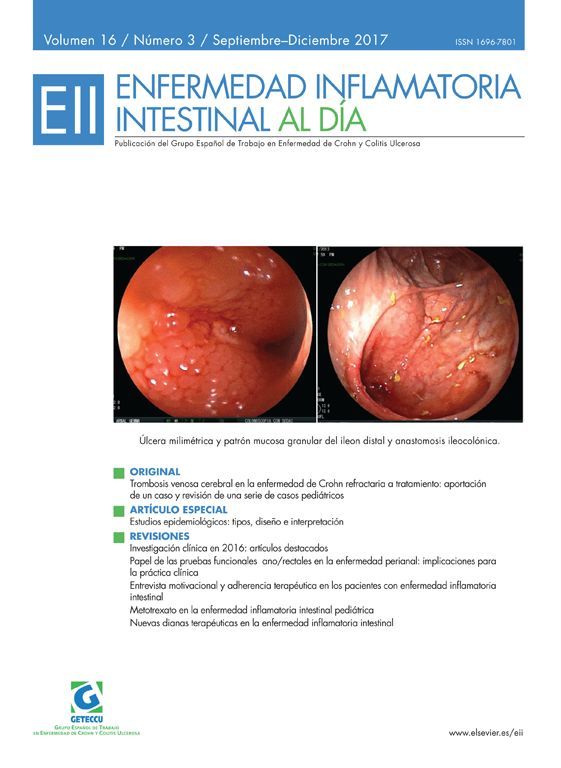
Ben-Horin S, Yavzori M, Benhar I, Fudim E, Picard O, Ungar B, Lee S, Kim S, Eliakim R, Chowers Y. Cross-immunogenicity: Antibodies to infliximab in Remicade-treated patients with IBD similarly recognise the biosimilar Remsima. Gut. 2015. pii: gutjnl-2015-309290. doi: 10.1136/gutjnl-2015-309290. [Epub ahead of print]
La inmunogenicidad cruzada del biosimilar de infliximab Remsima con el medicamento originador Remicade aún se desconoce; por lo tanto, se examinó el suero de pacientes con enfermedad inflamatoria intestinal (EII) con o sin anticuerpos para infliximab (API) medibles anti-Remicade para su reactividad cruzada en 2 lotes de Remsima. Se evaluó la capacidad de los anticuerpos anti-Remicade para su inhibición funcional a la fijación al factor de necrosis tumoral α (TNF-α) por Remsima/Remicade en un ensayo competitivo. También se investigó la reactividad cruzada de los anticuerpos antiadalimumab hacia Remsima/Remicade. El suero de 125 pacientes y controles fue examinó. Los 56 controles API anti-Remicade negativos (14 individuos sanos y 42 pacientes con EII) también fueron negativos para API anti-Remsima. Los 69 sueros positivos con EII anti-Remicade presentaron reacción cruzada con Remsima. Los títulos de API contra Remicade y Remsima se correlacionaron fuertemente. Los API anti-Remicade de pacientes con EII ejercieron una inhibición funcional similar para la capacidad de fijación al TNF-α por Remsima/Remicade. Los anticuerpos antiadalimumab en pacientes tratados con EII no presentaron reacción cruzada hacia Remsima o Remicade. Se concluyó que los anticuerpos anti-Remicade de pacientes con EII reconocen y funcionalmente inhiben el Remsima en un grado parecido, lo que evidencia una inmunogenicidad similar al compartir estos 2 agentes infliximab, epítopes inmunodominantes. En contraste, los anticuerpos antiadalimumab no presentan reacción cruzada hacia Remsima o Remicade.
ComentariosSe definen como biológicos aquellos fármacos de origen biotecnológico desarrollados de proteínas derivadas del ADN mediante procesos de hibridación y de recombinación requiriendo organismos vivos para su producción con el objetivo de actuar sobre el sistema inmunitario1. En el proceso inflamatorio intervienen diferentes grupos celulares y mediadores de la inflamación susceptibles de actuación terapéutica; son los llamados blancos terapéuticos (dianas biológicas).
La inhibición del TNF-α se ha probado eficaz en el control de la inflamación moderada a grave en la enfermedad de Crohn (EC) y en la colitis ulcerosa, al igual que en otros desórdenes inflamatorios inmunológicos, tales como la espondilitis anquilosante (EA), la psoriasis y la artritis reumatoide (AR), lo cual ha causado una revolución en el manejo de estos pacientes, específicamente en la EII y especialmente en aquellos con compromiso fistulizante por EC, ya que antes del advenimiento de esta clase de medicamentos (hace 18 años) no existía ninguna terapia efectiva.
Los grandes logros de la terapia anti-TNF-α y por vez primera en la EII moderada a grave están logrando una remisión profunda sostenida (remisión clínica, libre de esteroides, con biomarcadores negativos y cicatrización mucosa), lo que se traduce en prevención del daño estructural y reducción de hospitalización y cirugía, que al final redunda en una mejoría en la calidad de vida y menores costos socioeconómicos para los pacientes y para la sociedad.
Hasta el momento se han desarrollado biosimilares para infliximab: CT-P13, Remsima (Celltrion, Corea del Sur), Inflectra (Hospira, EE. UU.). Este desarrollo es complejo, costoso y solo verá la luz si se cumplen 3 condiciones: una compañía farmacéutica encuentra un biológico interesante desde el punto de vista económico cuya patente esté a punto de expirar, se toma el riesgo y el costo de producir un biosimilar, y que una agencia regulatoria lo apruebe2. De acuerdo con un estudio holandés, los biológicos son responsables del 64% del costo total del manejo de la EC y del 31% en el manejo de la colitis ulcerosa. Se estima que el valor de los biosimilares por miligramo es entre un 25 y un 40% menor que el costo de los biológicos2. Todo lo anterior ha despertado un debate en temas tales como la seguridad y la preocupación sobre bioequivalencia con respecto al potencial de inmunogenicidad y de eventos adversos inmunológicos.
Existen 2 términos que en el contexto de los biosimilares se deben entender: extrapolación e intercambiabilidad3.
El primero se refiere a lo que precisamente ha pasado con el Remsima (CT-P13), y es que hay estudios extensos comparativos in vitro pero ninguno clínico en EII y solo 2 de comparación cabeza a cabeza en pacientes con AR y EA, y bajo la premisa de que una «alta similitud» en los estudios predice resultados clínicos «altamente similares»; la Agencia Europea de Medicamentos (EMA) los autorizó para ser usados en todas las otras indicaciones (extrapolación) con respecto al original (Remicade). El principal argumento para aceptar la extrapolación es que la alta «similitud» analítica es la base científica más firme para comparar biológicos de orígenes independientes2. Pero cuando se analizan los estudios más detalladamente se encuentra que el PLANETRA, de no inferioridad fase iii en 600 pacientes con AR con Remicade como comparador se reporta una diferencia frente a este de un 2% de efectividad pero con un margen de equivalencia de±15% (IC 95%) y con unos niveles de inmunogenicidad entre el CT-P13 y el infliximab similares. Cabe anotar que en este estudio los pacientes recibieron conjuntamente metotrexato, el cual es sabido que actúa como un inmunomodulador evitando o retrasando la formación de API y, por ende, no permitiendo que se aprecien temprana o fácilmente diferencias en inmunogenicidad entre ambos productos. En el estudio PLANETRA fase i en donde se incluyeron 250 pacientes con EA, se demostró bioequivalencia entre CT-P13 e infliximab en términos de farmacocinética.
Se requiere más investigación cuando los datos de eficacia y seguridad se extrajeron de estudios clínicos de pacientes con AR, ya que se sabe que en esta enfermedad el mecanismo de acción del anti-TNF-α es básicamente la neutralización del TNF-α; en cambio, en la EII estos medicamentos actúan al disminuir la producción de citocinas induciendo la apoptosis de los monocitos y linfocitos activados3. Además, la tasa de aclaramiento de infliximab es 40% mayor en pacientes con EII que con EA.
La EMA es supremamente estricta en la farmacovigilancia de los biosimilares, exigiendo un plan detallado del manejo de riesgos; este plan se considera incluso más importante si la extrapolación es aceptada2.
La intercambiabilidad es a lo que este artículo se refiere, ya que se investigó la comparabilidad inmunogenética entre Remicade y Remsima al saber que todos los anticuerpos monoclonales generan una respuesta inmunológica contra el medicamento, y fue por esta razón que se quiso examinar si los anticuerpos producidos por el tratamiento con Remicade en pacientes con EII también reaccionan de manera cruzada y reconocen el Remsima en un grado similar. Si lo anterior es cierto se podría considerar intercambiar, en un paciente, de manera libre, el agente innovador y el «similar» sin perder la eficacia y la seguridad comprobadas del primero a un costo significativamente menor.
La metodología que se utilizó en este trabajo fue la recolección de 125 sueros de 108 pacientes tratados en el Departamento de Gastroenterología del Centro Médico de Sheba con EII recibiendo Remicade (n=86), así como de pacientes con EII sin recibir biológicos (n=5), controles sanos (n=14) y 3 pacientes con enfermedad reumatológica. Ninguno de estos sujetos había estado expuesto a Remsima. La edad promedio fue de 31 años (rango 4-70) y la duración promedio del uso de infliximab fue de 7 meses (rango 0,5-66); la distribución de pacientes con EII fue: EC 59 pacientes (69%), colitis ulcerosa 24 pacientes (28%), EII no clasificada 3 pacientes (3,5%). Para los pacientes tratados con infliximab, el suero se obtuvo antes de la siguiente infusión y los niveles valle y API fueron medidos mediante pruebas de ELISA y posteriormente se les realizó deglucosilación de Remicade/Remsima, purificación de IgG, diálisis de excipientes y purificación de monómeros por cromatografía de exclusión según el tamaño.
Los 56 controles API anti-Remicade negativos (14 individuos sanos y 42 pacientes con EII) también fueron negativos para API anti-Remsima. Los 69 sueros positivos con EII anti-Remicade presentaron reacción cruzada con Remsima. Ninguno de los anteriores sujetos había sido expuesto en el pasado a Remsima. Los títulos de API contra Remicade y Remsima se correlacionaron fuertemente. Los API anti-Remicade de pacientes con EII ejercieron una inhibición funcional similar para la capacidad de fijación al TNF-α por Remsima/Remicade. Tomando estos últimos en conjunto se puede inferir que tienen un perfil inmunogenético similar, debido posiblemente a epítopes inmunodominantes que son compartidos por los 2. Lo anterior evidencia que en un individuo que haya generado títulos altos de API y que presente alguna reacción adversa a la infusión o pérdida de la respuesta no se justifica utilizar el otro «agente» infliximab ya que con una alta probabilidad presentará el mismo evento adverso. En contraste, en un individuo con API negativos se podrían intercambiar libremente ambos «agentes» sin provocar ningún tipo de reacción inmunológica adversa, pero es importante hacer énfasis en que antes de estandarizar este abordaje como de uso rutinario se deben hacer estudios clínicos en donde se examine el suero de pacientes tratados con Remsima y que desarrollen API anti-Remsima para evaluar su reactividad cruzada con infliximab.
En este estudio se evidenció que los anticuerpos antiadalimumab en pacientes tratados con EII no presentaron reacción cruzada hacia Remsima o Remicade; por lo tanto, se infiere que si un paciente presenta reacción adversa o falta de respuesta debido a anticuerpos antiadalimumab se podría cambiar este por Remsima o Remicade indistintamente con buena respuesta; aunque también se ha documentado que un paciente que tenga API altos tendrá una probabilidad de generar tempranamente anticuerpos antiadalimumab cuando sea expuesto a adalimumab.
Aunque la estructura global del biológico sea conocida, la plataforma de su manufactura es desconocida, ya que esto forma parte del secreto de propiedad intelectual; por lo tanto, Remicade y Remsima son producidos en diferentes líneas celulares, con distintas condiciones de crecimiento, utilizando procesos de purificación y formulación dispares que pueden llevar a impurezas diferentes relacionadas con el procesamiento. Por lo tanto, los métodos analíticos actuales no pueden garantizar la bioequivalencia estructural de estas moléculas complejas con las moléculas de referencia. La anterior equivalencia clínica solo podría ser probada en estudios clínicos, los cuales en este momento no existen para la EII.
Existen diferentes posiciones entre las agencias regulatorias, no habiendo consenso ni siquiera en cuanto a su denominación: la Agencia de Alimentos y Medicamentos estadounidense los llama: «productos de proteínas de continuación» («follow-on protein products»); Salud Canadá (Health Canada) los llama «biológico de entrada posterior» («subsequent entry biologic»), y la EMA los denomina «biosimilares».
La EMA, en 2005 definió los conceptos de «biológicamente similar» o «bioequivalente» una vez que se estandarizaron las características básicas de los medicamentos biológicos4.
- 1.
Biológico: es una medicina cuyo principio activo es una sustancia biológica (ADN recombinante, virus atenuado, derivados sanguíneos o plasmáticos, anticuerpos monoclonales, etc.) producida o extraída de una fuente biológica física y químicamente caracterizada.
- 2.
Biológicos de nueva generación: también llamados en inglés biológicos «me too», son agentes de última tecnología cuyos blancos terapéuticos o dianas biológicas son las mismas del producto original, pero son elaborados de manera diferente e individual como productos nuevos que se someten a las pruebas de eficacia y seguridad convencionales.
- 3.
Biosimilar: es un medicamento biológico que se desarrolla para que sea similar a un medicamento biológico ya existente (el «medicamento de referencia»). Contiene el mismo componente activo, diseñado para ser usado contra la misma enfermedad por la misma vía de administración y a las mismas dosis que el medicamento de «referencia».
El problema con estas definiciones es el término «similar», ya que antes de acuñar este concepto, el medicamento debe someterse a múltiples estudios in vitro, tales como: tolerabilidad, pureza, seguridad, bioequivalencia, efectividad, farmacocinética, etc., e in vivo a través de ensayos clínicos aleatorizados doble ciego, controlados y con una potencia adecuada. Es después de todo este proceso cuando se puede acuñar el término de «biosimilar»1.
Los biosimilares no son considerados copias ni genéricos de los productos innovadores, ya que los genéricos tradicionales se consideran terapéutica y estructuralmente idénticos a la fórmula química original e implican que la sustancia activa es idéntica al medicamento de referencia. La mayoría de los fármacos sintéticos tiene un bajo peso molecular de solo unos cientos de daltons (el ácido acetil salicílico tiene 180Da con 21 átomos; omeprazol tiene 345Da con 17 átomos de carbono). Este no es el caso de los biosimilares, ya que el principio activo de un biológico es una estructura compleja tridimensional con alto peso molecular (infliximab tiene 149.000Da y adalimumab 150.000Da, ambos con>20.000 átomos), cuya heterogeneidad, dependencia en la producción de cultivos celulares y procesos de manufactura altamente sofisticados los hacen completamente diferentes a una molécula individual poco compleja de bajo peso y técnicas tradicionales de manufactura, que es la forma como se presentan los medicamentos convencionales, además de que estos tienen la capacidad de inducir respuesta inmunológica.
Existen otras agencias regulatorias, tales como Health Canada, cuya posición es aún más rigurosa que la de la Agencia de Alimentos y Medicamentos estadounidense, y que entre sus políticas utiliza los términos de intercambiabilidad y de sustitubilidad que no coinciden en algunos aspectos con la EMA (por ejemplo, la extrapolación)5.
Si la bioequivalencia y la intercambiabilidad se pueden demostrar entre los biosimilares y la molécula innovadora en pacientes con EII, entonces se podrían obtener unos ahorros importantes en costes, lo que, a su vez, abriría una nueva puerta para el inicio más temprano de estos medicamentos en pacientes que los requieran o combinarlos con otras moléculas; esto, hasta el momento, no se hace por diferentes motivos3.