Analizar las características clínicas y endoscópicas de pacientes con várices gástricas que reciben terapia endoscópica con N-butil-2-cianoacrilato.
Materiales y métodosSe analizaron en forma retrospectiva 72 casos de pacientes con várices gástricas que fueron tratados con N-butil-2-cianoacrilato, utilizando una mezcla 1:1 con lipiodol, la cual fue inyectada intravaricealmente durante el periodo octubre de 2004 a febrero de 2014 en el hospital de tercer nivel de atención «Lic. Arturo Montiel Rojas» de Instituto de Seguridad Social del Estado de México y Municipios (ISSEMyM). La indicación terapéutica fue hemorragia activa, profilaxis primaria y secundaria.
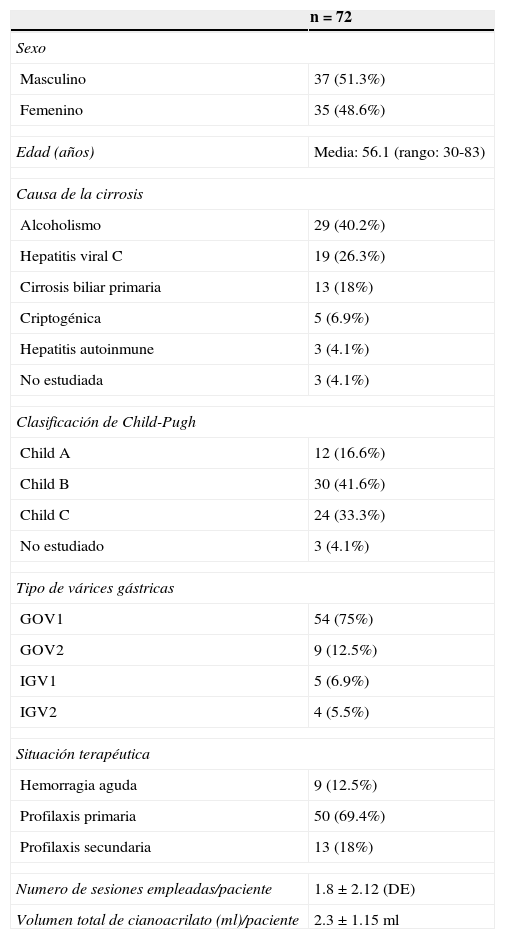
ResultadosDe los 72 pacientes, 9 (12.5%) presentaban hemorragia activa, obteniendo control de la misma en 8 (88.8%) pacientes. Se realizó profilaxis primaria en 50 (69.4%) pacientes y profilaxis secundaria en 13 (18%). El número de sesiones empleadas por paciente para logar erradicación de las várices fue de 1.8±2.1 (DE), con un volumen total de cianoacrilato (ml/paciente) de 2.3±1.15 (DE). Las várices fueron gastroesofágicas tipo 1 en el 75%, várices gastroesofágicas tipo 2 en el 12.5%, várices gástricas aisladas tipo 1 en el 6.9% y várices gástricas aisladas tipo 2 en el 5.5%.
ConclusionesLa hemorragia aguda de várices gástricas fue controlada satisfactoriamente en el 88.8% de los casos, sin eventos adversos mayores reportados. Los datos obtenidos muestran que el tratamiento fue seguro y efectivo para el control de la hemorragia debida a várices gástricas.
To analyze the clinical and endoscopic characteristics of patients with gastric varices who receive endoscopic therapy with N-butyl-2-cyanoacrylate.
Materials and methodsA retrospective analysis was performed in 72 cases of patients with gastric varices who were treated with N-butyl-2-cyanoacrylate during the period October 2004 to February 2014 in the tertiary care hospital “Lic. Arturo Montiel Rojas” of Social Security Institute of Mexico State and Municipalities (ISSEMyM). A 1.1 N-butyl-2-cyanoacrylate solution with lipiodol was used, which was injected within the varix. The therapeutic indication was acute bleeding, primary and secondary prophylaxis.
ResultsOf the 72 patients, 9 (12.5%) had active bleeding, gaining control of bleeding in 8 (88.8%) patients. Primary prophylaxis was performed in 50 (69.4%) patients, and secondary prophylaxis in 13 (18%) patients. The number of sessions per patient required to eradicate the varices was 1.8±2.1 (SD), with a total volume of cyanoacrylate (ml/patient) 2.3±1.15 (SD). The varices were gastro-oesophageal varices 1 in 75%, gastro-oesophageal varices 2 in 12.5%, isolated gastric varices 1 in 6.9% and isolated gastric varices 2 in 5.5%.
ConclusionsAcute bleeding from gastric varices was controlled successfully in 88.8% of cases, with no major adverse events reported. The data obtained suggest that the treatment was safe and effective for the control of bleeding from gastric varices.
Las várices gástricas son una complicación de la hipertensión portal y se presentan aproximadamente en el 20% de los pacientes cirróticos. El riesgo de hemorragia aparece en un 50-80% de los pacientes, con una mortalidad cercana al 45%. Si bien, sangran menos frecuentemente que las várices esofágicas, cuando lo hacen su severidad es mayor y el control de la hemorragia más difícil1.
Los factores de riesgo para hemorragia de várices gástricas incluyen entre otros, el tamaño de las várices (que son grandes, medianas y pequeñas, definidas como >10mm, 5-10mm y <5mm respectivamente). De igual forma, otros factores de riesgo incluyen el grado de insuficiencia hepática (Child-Pugh), presencia de hepatocarcinoma así como aparición de puntos rojos sobre la superficie de las várices1,2.
Para el tratamiento de várices gástricas los métodos de obliteración constituyen la primera opción. Dicho procedimiento fue descrito por Nib Soehendra en 1986 en Alemania y a partir de entonces se difundió a varios países del mundo. Este gel tisular se polimeriza al entrar en contacto con la sangre, solidificándose dentro de la várice casi instantáneamente, obliterándola y de esta forma deteniendo o previniendo el sangrado3,4.
El N-butil-2-cianoacrilato es un monómero que sufre rápidamente polimerización en presencia de sustancias iónicas incluida la sangre y fluidos tisulares, y otro más es el isobutil-2-cianoacrilato, ambos se han usado de manera satisfactoria para tratar várices gástricas; se administra junto con lipiodol (que evita la polimerización temprana) de manera intravariceal5. Un estudio del Reino Unido reportó hemostasia inmediata con efectividad del 100% con el uso endoscópico de cianoacrilato para hemorragia de origen variceal gástrico6.
El uso de N-butil-2-cianoacrilato ha demostrado excelentes tasas de hemostasia primaria y disminuyó ostensiblemente las tasas de resangrado en comparación con otros procedimiento utilizados, como la ligadura con bandas elásticas y la escleroterapia (polidocanol, alcohol absoluto, solución hipertónica)4, sin embargo no está exento de complicaciones, algunas de las cuales pueden ser letales, como son la embolia sistémica del producto inyectado y la sepsis; afortunadamente estas son poco frecuentes, sobre todo si se lleva a cabo una técnica de aplicación correcta6.
El consenso de Baveno V menciona que para los pacientes que han tenido hemorragia de várices gástricas aisladas (isolated gastric varices) tipo 1 (IGV1) o gastroesofágicas (gastro-oesophageal varices) tipo 2 (GOV2), está recomendado el N-butil-2-cianoacrilato o la derivación porto-sistémica transyugular. Los pacientes que han tenido sangrado de GOV tipo 1 (GOV1) pueden ser tratados con N-butil-2-cianoacrilato, ligadura para várices o betabloqueadores7.
Material y métodosEstudio observacional, descriptivo y retrospectivo en el cual se analizaron 72 expedientes electrónicos y clínicos que fueron captados de la base de datos electrónica del servicio de endoscopia a través del software Microsoft Access utilizando como criterios de búsqueda las palabras clave «cianoacrilato» y «várices gástricas» realizado en el hospital de tercer nivel, Centro Médico Instituto de Seguridad Social del Estado de México y Municipios (ISSEMyM) «Lic. Arturo Montiel Rojas» en el periodo de tiempo que va de octubre de 2004 a febrero de 2014.
Criterios de inclusiónPacientes que recibieron terapia endoscópica de várices gástricas con N-butil-cianoacrilato.
Criterios de exclusiónNo contar con expediente clínico, haber recibido otra modalidad de tratamiento endoscópico en várices gástricas diferente al N-butil-2-cianoacrilato, que incluye ligadura variceal (realizado en várices gástricas) y aplicación de polidocanol.
MétodosSe utilizaron endoscopios de la marca Olympus (series 145 y 180), el material inyectado de manera intravariceal fue una mezcla de lipiodol y N-butil-2-cianoacrilato en relación 1:1. En cada procedimiento se contaba con médico endoscopista, anestesista, técnico en endoscopia y enfermera.
Se realizaron procedimientos con fines de profilaxis primaria, secundaria, así como de hemorragia aguda. Se define profilaxis primaria como todas aquellas medidas terapéuticas encaminadas a prevenir el primer episodio de hemorragia de origen variceal, profilaxis secundaria es definida como aquellas medidas terapéuticas encaminadas a prevenir el resangrado en un paciente que ya ha presentado un episodio de hemorragia.
En los casos en que las várices gástricas se asociaron a várices esofágicas (con datos de mal pronóstico), el paciente recibió terapia para ambas, y fue utilizada la ligadura endoscópica para las várices esofágicas.
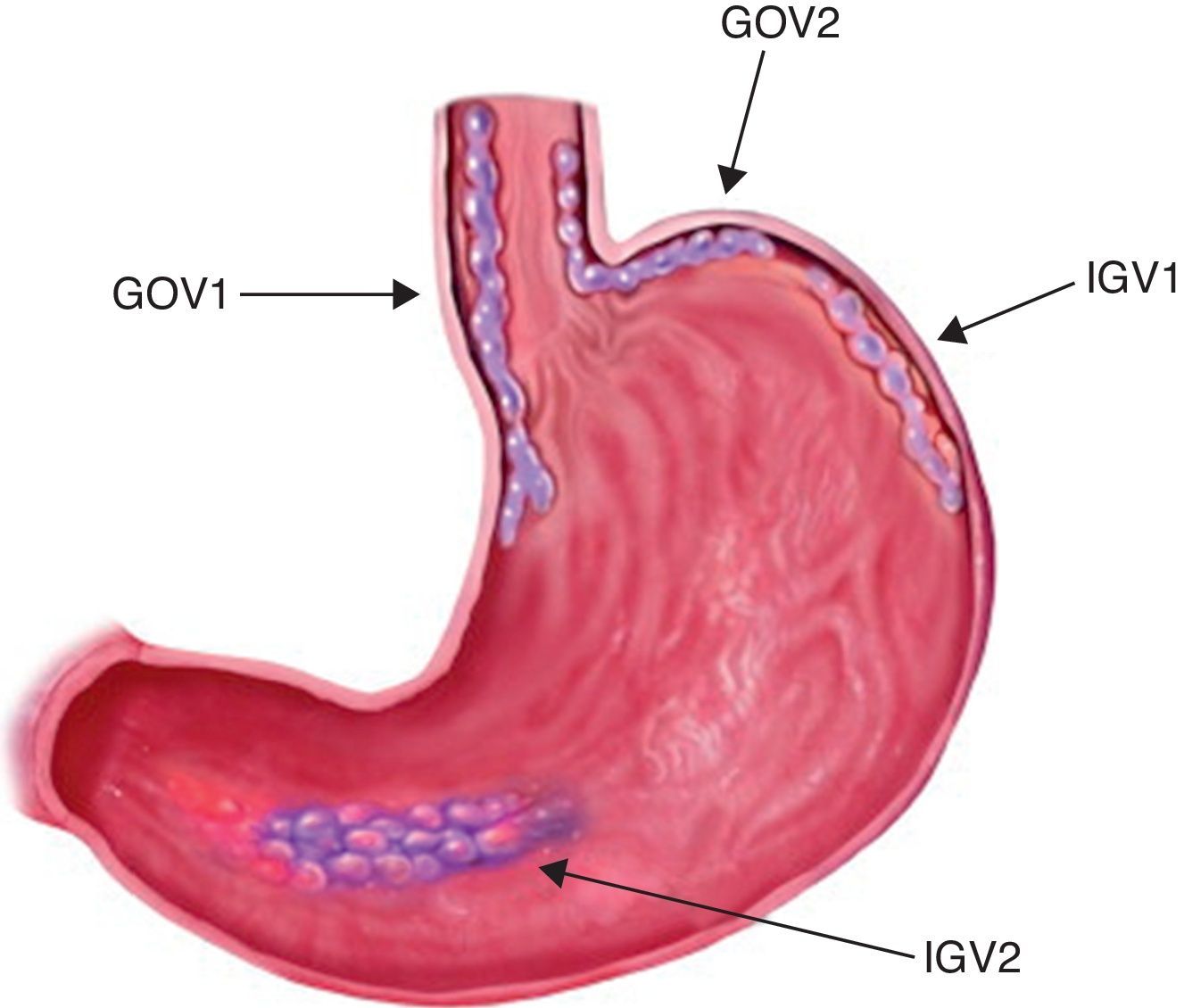
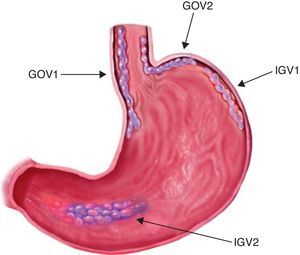
Para unificar criterios de localización, la clasificación de Sarin (fig. 1) es la que actualmente tiene más difusión y uso por la mayor parte de los médicos endoscopistas; en ella las GOV1 son localizadas en curvatura menor, las GOV2 en curvatura mayor, las IGV1 en fondo y las IGV tipo 2 (IGV2) en cuerpo, antro o alguna otra parte del estómago.
Éxito de la terapia endoscópicaSe evaluó en términos de hemostasia y erradicación, en revisiones endoscópicas ulteriores, las cuales se realizaron de uno a 3 meses después de la terapia endoscópica.
Se consideró hemostasia la ausencia de hemorragia clínica y/o endoscópicamente visible luego de la inyección de N-butil-2-cianoacrilato en pacientes con hemorragia activa.
Se consideró erradicación a la no visualización de várices gástricas durante las endoscopias de seguimiento de cada paciente.
Análisis estadísticoSe utilizó el método de estadística descriptiva, utilizando medidas de tendencia central y desviación estándar.
ResultadosLos resultados se resumen en las tablas 1 y 2.
Características clínicas y endoscópicas de pacientes con várices gástricas
| n=72 | |
|---|---|
| Sexo | |
| Masculino | 37 (51.3%) |
| Femenino | 35 (48.6%) |
| Edad (años) | Media: 56.1 (rango: 30-83) |
| Causa de la cirrosis | |
| Alcoholismo | 29 (40.2%) |
| Hepatitis viral C | 19 (26.3%) |
| Cirrosis biliar primaria | 13 (18%) |
| Criptogénica | 5 (6.9%) |
| Hepatitis autoinmune | 3 (4.1%) |
| No estudiada | 3 (4.1%) |
| Clasificación de Child-Pugh | |
| Child A | 12 (16.6%) |
| Child B | 30 (41.6%) |
| Child C | 24 (33.3%) |
| No estudiado | 3 (4.1%) |
| Tipo de várices gástricas | |
| GOV1 | 54 (75%) |
| GOV2 | 9 (12.5%) |
| IGV1 | 5 (6.9%) |
| IGV2 | 4 (5.5%) |
| Situación terapéutica | |
| Hemorragia aguda | 9 (12.5%) |
| Profilaxis primaria | 50 (69.4%) |
| Profilaxis secundaria | 13 (18%) |
| Numero de sesiones empleadas/paciente | 1.8±2.12 (DE) |
| Volumen total de cianoacrilato (ml)/paciente | 2.3±1.15ml |
Situación terapéutica
| Hemorragia | n: 9 |
| Control de la hemorragia | 8 (88.8%) |
| No control de la hemorragia | 1 (11.1%) |
| Tipo de várices en hemorragia | n: 9 |
| GOV1 | 5 (55.5%) |
| GOV2 | 4 (44.4%) |
| Profilaxis primaria | n: 50 |
| Número de sesiones necesarias para lograr erradicación de las várices gástricas | |
| 1 | 24 (48%) |
| 2 | 16 (32%) |
| 3 | 10 (20%) |
| 4 | No necesario |
| Profilaxis secundaria | n: 13 |
| Número de sesiones necesarias para lograr erradicación de las várices gástricas | |
| 1 | 5 (38.4%) |
| 2 | 3 (23%) |
| 3 | 3 (23%) |
| 4 | 2 (15.3%) |
Se incluyeron 37 pacientes del sexo masculino y 35 del sexo femenino, con una edad media 56.1 años (rango de edad de 30-83 años). La principal causa de cirrosis hepática fue secundaria a etilismo crónico en 29 pacientes (40.2%), seguido de virus de hepatitis «C»’ en 19 (26.3%), cirrosis biliar primaria en 13 pacientes (18.0%), criptogénica en 5 (6.9%), en 3 (4.1%) pacientes era de origen autoinmune, y finalmente 3 (4.1%) pacientes no fueron estudiados.
La clase funcional hepática de los pacientes cirróticos medida por el score de Child-Pugh, fue «A» en 12 casos (16.6%), «B» en 30 (41.6%) y «C» en 24 (33.3%), en 3 pacientes por ser foráneos no fue posible determinar el Child-Pugh.
El tipo de várices gástricas encontradas fue GOV1 en 54 pacientes (75%), GOV2 en 9 pacientes (12.5%), IGV1 en 5 pacientes (6.9%) e IGV2 en 4 pacientes (5.5%). La asociación de várices gástricas con várices esofágicas existió en 60 pacientes (83.3%), siendo las várices esofágicas grado v las más frecuentemente encontradas en 24 pacientes (40%), de grado iii en 20 pacientes (33.3%), grado iv en 11 pacientes (18.3%), grado ii en 3 pacientes (5%) y finalmente grado i en 2 pacientes (1.2%).
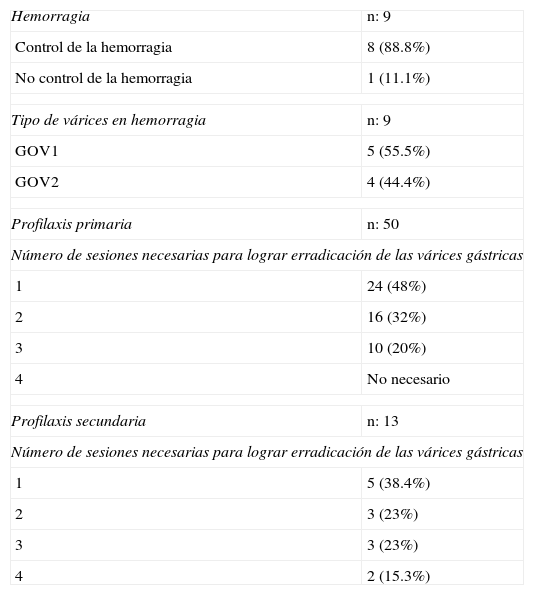
En 9 pacientes se presentó hemorragia de várices gástricas, de estas 5 eran GOV1 (55.5%) y 4 eran GOV2 (44.4%). Se logró control del sangrado en 8 pacientes (88.8%), a un paciente que se presentó con resangrado en las primeras horas posprocedimiento, no fue posible controlarle por endoscopia por lo que se le colocó sonda de balones; este paciente tenía GOV2.
El número de sesiones empleadas por paciente para lograr la erradicación fue de 1.8±2.12 (DE), el volumen total de cianoacrilato (ml/paciente) 2.3±1.15 (DE).
Se realizó profilaxis primaria en 50 pacientes (69.4%) y profilaxis secundaria en 13 (18%). Se resumen en la tabla 2.
La revisión endoscópica entre una sesión y otra osciló de 20 a 60 días.
Los eventos adversos que se reportaron fueron menores y sin repercusión clínica en 3 pacientes (fiebre dentro de las primeras 24h posprocedimiento, sin tener repercusión en la evolución de los pacientes).
DiscusiónEn nuestra serie se obtuvo control de la hemorragia aguda en el 88.8% de los pacientes, la literatura mundial reporta un control de alrededor del 91% para estos casos. Es importante considerar que la hemorragia aguda representa un reto para todo el equipo de la sala endoscópica, ya que en estos casos se tiene una visión limitada y generalmente hay poca cooperación por parte del paciente; existen otras condiciones que harán que el cianoacrilato actúe adecuadamente o no, como es el patrón hemodinámico, vasos aferentes y eferentes, flujo sanguíneo y dirección.
Según Sarin, las várices tipo GOV1 son las más frecuentes (74%), mientras GOV2, IGV1 e IGV2 representan el 18, 8 y 2% respectivamente. Los resultados confirman lo reportado en la literatura mundial.
En este estudio solo se incluyeron los pacientes que fueron tratados con cianoacrilato, siendo la indicación terapéutica de profilaxis primaria la más común.
Respecto al número de sesiones necesarias para lograr la erradicación de las várices, resulta interesante observar que en el grupo de profilaxis tanto primaria como secundaria, hubo un mayor porcentaje con una sola sesión, siendo del 48% y del 38.4% respectivamente.
Dentro de los eventos adversos potencialmente mortales con el uso de cianoacrilato está la embolización del gel hacia pulmones, lo que podría condicionar la muerte del paciente. En nuestra serie encontramos que 3 pacientes presentaron fiebre dentro de las primeras 24h y que esto fue asociado al uso del gel tisular; no se reportaron eventos adversos de mayor relevancia clínica.
El fracaso terapéutico manifestado por resangrado ocurrió en un paciente en el que fue necesaria la colocación de sonda de balones. De los pacientes que recibieron profilaxis primaria y secundaria ninguno de ellos se presentó a la sala de urgencias con reingreso por hemorragia de origen variceal gástrico.
La técnica estandarizada de inyección del cianoacrilato con dilución de 0.5ml con 0.5ml de lipiodol ha dado excelentes resultados. En nuestro servicio hace más de 9 años que se realiza este procedimiento, siguiendo la técnica mencionada.
Dentro de las limitaciones de este trabajo está su naturaleza retrospectiva y la falta de seguimiento estandarizado que motivó la pérdida en algunos pacientes y la falta de datos en otros. Nuestro hospital es un centro de referencia por lo que algunos pacientes no tuvieron seguimiento, sin embargo los datos que fueron recabados concuerdan con los publicados a nivel mundial. En nuestro hospital es la primera vez que se reportan los datos epidemiológicos del uso de cianoacrilato y en nuestro país existen pocos estudios que reporten su experiencia con el uso de este gel tisular.
ConclusionesEl uso de N-2-butil-cianoacrilato es seguro y efectivo para el tratamiento de hemorragia aguda de origen variceal gástrico así como para profilaxis; constituye una excelente opción con altos porcentajes de éxito y con una técnica bien estandarizada, de aplicación intravariceal y presenta pocos eventos adversos.
La hemorragia gástrica de origen variceal es una urgencia médica con alto índice de mortalidad cuando la terapia endoscópica se retrasa o si no se cuenta con los insumos adecuados y técnica por parte del endoscopista para tratarla. El uso del N-butil-2-cianoacrilato como tratamiento de primera línea para pacientes que presentan hemorragia de várices gástricas actualmente se considera como terapia de primera línea para esta entidad clínica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesTodos los autores no tienen ningún conflicto de intereses por presentar este estudio.