Existen numerosos adelantos en endoscopia gastrointestinal en relación a la calidad de imagen, diagnóstico de patología de intestino delgado y vía biliar, detección de lesiones en colon, técnicas de ablación y resección, así como diagnóstico y tratamiento a través del ultrasonido endoscópico. Por lo que el objetivo de esta revisión es describir el fundamento técnico, la utilidad clínica y la evidencia científica que existe para cada una de las nuevas tecnologías. Así como describir las perspectivas a futuro de la endoscopia gastrointestinal.
There have been numerous advances in gastrointestinal endoscopy in relation to image quality, diagnosis of pathology of small intestine and biliary system, detection of lesions in the colon, resection and ablation techniques, and diagnosis and treatment by endoscopic ultrasound. So the aim of this review is to describe the technical basis, the clinical and scientific evidence that exists for each of the new technologies and describe the future perspectives of gastrointestinal endoscopy.
Introducción
Desde la primera descripción de una gastroscopia rígida en 1868 y posteriormente semiflexible en 1932 en Alemania, la endoscopia gastrointestinal (EGI) ha evolucionado de forma constante. Alrededor de los años 60´s se desarrolló el fibroscopio y en 1983 surgió la video endoscopia que conocemos a la fecha gracias a un sensor de imagen acoplado a la punta del endoscopio, dicho sensor es conocido como CCD por sus siglas en inglés (charge coupled device).1 Actualmente existen numerosos adelantos en EGI en relación a la calidad de imagen, diagnóstico de patología de intestino delgado y vía biliar, detección de lesiones en colon, técnicas de ablación y resección, así como diagnóstico y tratamiento a través del ultrasonido endoscopico (USE). Por lo que es de vital importancia conocer cada una de ellas, entender su fundamento técnico, conocer su utilidad clínica y la evidencia científica que existe para cada una de las nuevas tecnologías.
Lo nuevo en imagen
En los últimos 10 años se han desarrollado diferentes modalidades para mejorar la calidad de imagen, las cuales se agrupan en cuatro categorías:2
• Alta resolución y magnificación.
• Endoscopia de contraste.
• Autofluorescencia.
• Histología in vivo.
Alta resolución o endoscopia de realce
Contiene CCD`s de nueva generación que permiten capturar más de un millón de pixeles digitales en comparación con 300 000 pixeles capturados mediante endoscopia convencional, lo cual aumenta la resolución y la calidad de la imagen.2 Una de las utilidades clínicas de esta tecnología es dirigir las biopsias en esófago de Barrett, con una tasa de detección reportada del 80%.3 Respecto a los adenomas en colon, la endoscopia de alta resolución (EAR) ofrece una tasa de detección del 75.9%, sin embargo la detección de pólipos en general es menor para la EAR comparada con la imagen de banda estrecha o narrow band imaging (NBI) la cual se describirá más adelante.4,5
Magnificación o endoscopia de aumento
Aumenta la imagen 1.5 a 150 veces lo cual permite caracterizar mejor las lesiones como metaplasia intestinal, esófago de Barrett y lesiones gástricas (Figura 1). Sin embargo es operador dependiente, consume tiempo y su técnica no está estandarizada. Hasta el momento únicamente se han descrito series de casos, reportes de casos y estudios observaciones que fundamentan su utilización en la práctica clínica, por lo que la sensibilidad y especificidad de esta técnica son muy variables.2,6,7
| Figura 1. Esófago de Barrett con luz blanca y magnificación.
Cromoendoscopia o endoscopia de contraste
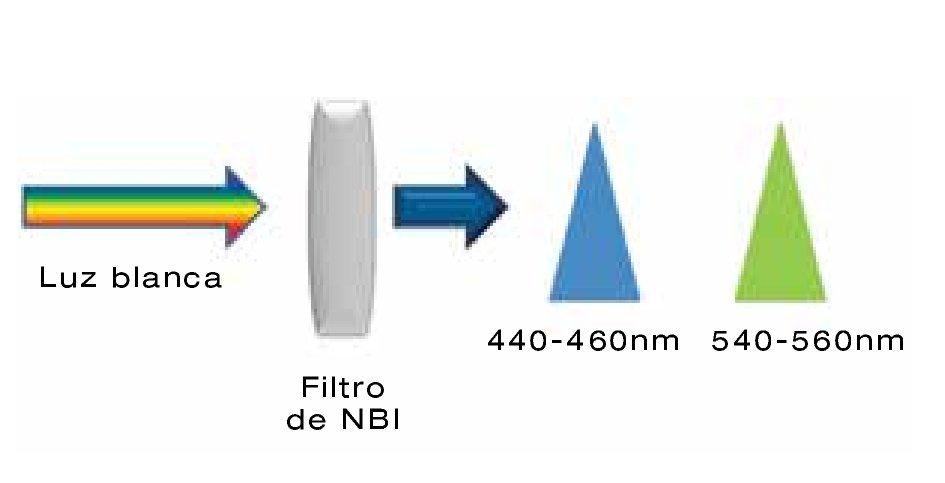
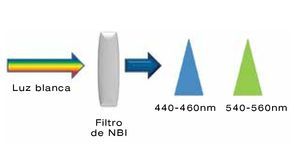
Esta se logra aplicando tinciones o pigmentos a la mucosa, o bien mediante filtros que aumentan la cantidad de luz azul. Existen diferentes tinciones como las absortivas (lugol y azul de metileno), tinciones de contraste como el índigo carmín y tinciones reactivas como el rojo congo. Sin embargo a pesar de que aumentan la tasa de detección, esta tecnología es poco reproducible y consume tiempo.2,8 Por lo que se desarrolló la cromoendoscopia digital o electrónica inicialmente descrita en el 2004 por Gono y colaboradores, la cual consiste en eliminar la luz con longitud de onda color rojo y estrechar la luz con longitud de onda color azul (440-460nm) y verde (540-560nm). Esta tecnología lleva el nombre de NBI (Olympus Corporation®, Tokio, Japón) (Figura 2) y tiene como principio penetrar la mucosa de forma superficial y gracias a su absorción por la hemoglobina permite detallar lesiones superficiales y patrones microvasculares. Con esta tecnología las estructuras vasculares se observan obscuras teniendo en cuenta que el tejido anormal tiene aumento en la vascularidad (Figura 3). Una de las ventajas del NBI es la disminución en el tiempo del estudio.1,2 Respecto a la utilidad clínica, en el 2010 se publicó un meta-análisis de NBI en esófago de Barrett, donde se reportó una sensibilidad del 96% y especificidad del 94% para displasia de alto grado.9
|Figura 2. Imagen de banda estrecha o NBI (narrow band imaging), la cual consiste en eliminar la luz con longitud de onda color rojo, y estrechar la longitud de onda de la luz azul (440-460 nm) y verde (540-560 nm) a través de un filtro.
| Figura 3. Esófago de Barrett con imagen de banda estrecha o NBI (narrow band imaging) y magnificación.
Existen otras dos modalidades de cromoendoscopia electrónica, FICE (Fujinon Intelligent Chromo Endoscopy) de la marca Fujinon® (Saitama, Japón), la cual utiliza una técnica de filtrado digital incorporado a un software, y el I-SCAN® (Pentax Corporation, empresa subsidiaria de Hoya Corporation, Tokio, Japón), el cual modifica la agudeza, tono y contraste de una imagen de alta resolución similar al Adobe Photoshop pero en vivo.8
Autofluorescencia
Consiste en activar sustancias biológicas endógenas llamadas fluoroforos mediante luz con longitud de onda corta. Una vez activadas, estas sustancias endógenas emiten luz con una longitud de onda amplia. En principio la autofluorescencia es diferente en tejido normal y tejido neoplásico. Esta tecnología inicialmente mostró resultados prometedores, sin embargo en estudios subsecuentes se documentaron varias limitantes en su uso como tecnología única. Por lo que la marca Olympus® creó un prototipo de endoscopio con imagen trimodal, el cual incorpora alta resolución, autofluorescencia y NBI.1,2,10 Esta tecnología mejoró la agudeza diagnóstica en tres entidades: esófago de Barrett, colitis ulcerativa crónica idiopática (CUCI) y pólipos en colon, sin embargo los estudios iniciales se llevaron a cabo en centros de referencia. Más adelante en dos estudios aleatorizados controlados publicados en 2011, se demostró que la tecnología multimodal no mejora la detección de displasia en esófago de Barrett y adenomas en colon al compararla con la endoscopia estándar.4,10
Histología in vivo
También conocida como la histología virtual, permite conocer detalles histológicos en tiempo real y consta de dos modalidades:2
• Endomicroscopía láser confocal (ELC).
• Endocitoscopia.
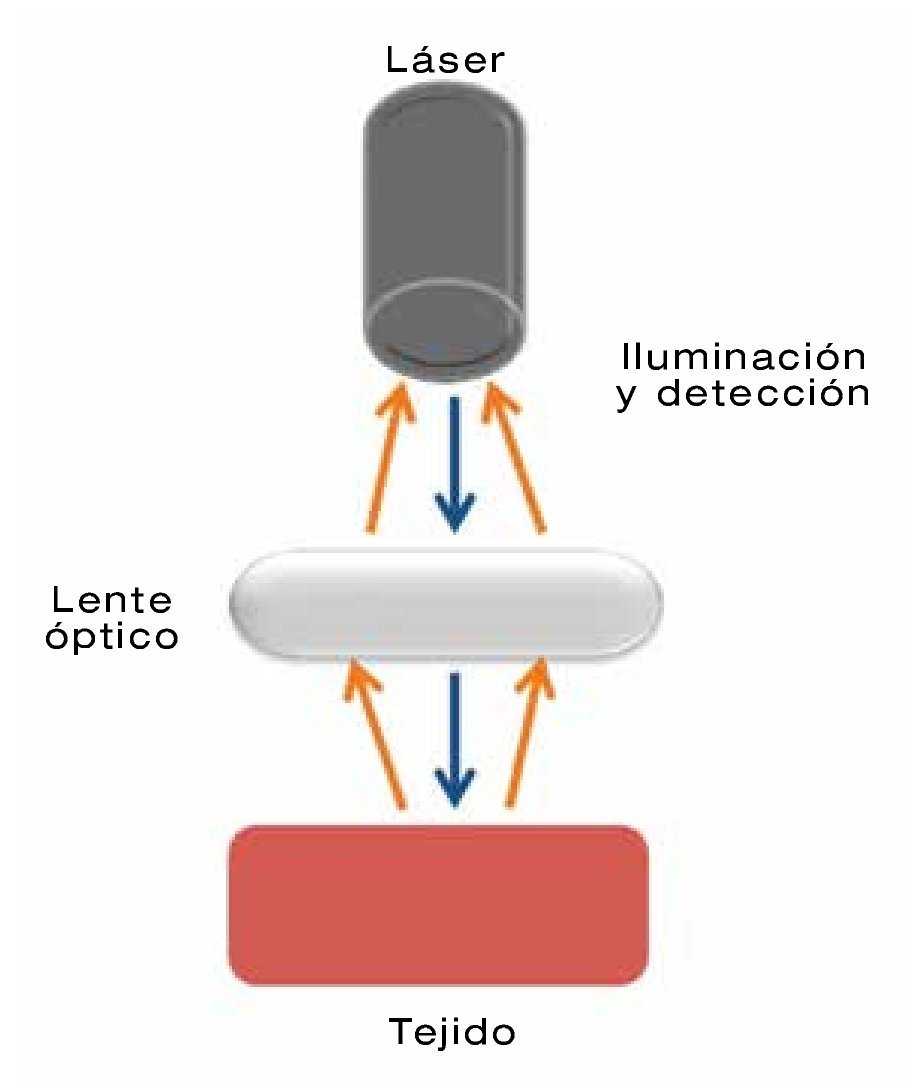
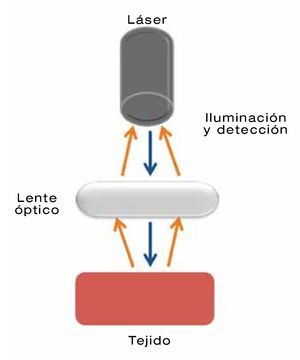
La primera de ellas, la ELC consiste en la realización de cortes ópticos seriados in vivo de forma directa y no invasiva. De hecho, el término confocal proviene del principio de que la iluminación y detección se llevan a cabo en el mismo plano focal (Figura 4). Los cortes ópticos se logran a través de un láser con longitud de onda azul (488 nm) que incide sobre un espécimen histológico fluorescente, se realizan de forma horizontal, alcanzan una profundidad de 250 μm y cada corte tiene un grosor de 7 μm (Figura 5). Las imágenes se obtienen mediante un microscopio adosado a la punta del endoscopio conocido como e-ELC (Pentax®, Tokio, Japón), o bien a través de una sonda que se introduce por el canal de trabajo y que contiene el microscopio, denominado p-ELC (Cellvizio®, Mauna KeaTechnologies, París, Francia).11
| Figura 4.Endomicroscopía láser confocal (ELC) donde la iluminación y detección de realizan en el mismo plano confocal.
| Figura 5. Endomicroscopía láser confocal (ECL) donde se logran cortes ópticos seriados y horizontales de 7 μm de grosor, alcanzando una profundidad de 250 μm.
Existen dos agentes fluorescentes de contraste: los sistémicos como la fluoresceína sódica al 10%, la cual se difunde y tiñe la matriz extracelular respetando el núcleo y la mucina. Tras su administración intravenosa, el efecto dura 30 minutos y como efectos secundarios provoca cambios reversibles y temporales en la coloración de piel y orina. Y existen los agentes tópicos como la Acriflavina al 0.2%, la cual se aplica mediante una cánula de aspersión y se une a compuestos ácidos, por lo que tiñe el núcleo y capas superficiales. Como ventaja, ofrece una mejor definición intraepitelial, sin embargo tiene el potencial de dañar al DNA.11
La ELC es un auxiliar en el diagnóstico de lesiones sospechosas detectadas mediante luz blanca o cromoendoscopia digital. De hecho debe evitarse el uso concomitante de ELC y cromoendoscopia con tinciones vitales. Una vez detectada la lesión de interés, se aplica esta tecnología con la finalidad de obtener un diagnóstico histológico y obtener una guía terapéutica. La utilidad clínica de la ELC se aplica a colonoscopia de vigilancia, esófago de Barrett, adenocarcinoma gástrico, cáncer esofágico escamoso y detección in vivo de Helicobacter pylori. De hecho, los primeros estudios llevados a cabo en centros de referencia y en pacientes seleccionados mostraron una agudeza diagnóstica del 90% para estas entidades.11
Posteriormente un estudio prospectivo aleatorizado multicéntrico internacional, llevado a cabo en cinco centros de referencia y en 101 pacientes con esófago de Barrett, demostró que la endoscopia de alta resolución seguida de ELC de lesiones sospechosas, mejora la detección de neoplasia en esta entidad clínica.12
La otra modalidad de histología in vivo es la endocitoscopia, la cual consiste en niveles altos de magnificación mediante lentes ópticos, utiliza luz de halógeno y se requiere de contacto directo con la mucosa así como de la aplicación de azul de metileno al 1%. Con esta tecnología se logra una magnificación de hasta 1,100x para el endocitoscopio prototipo 2 (Olympus®, Japón), lo cual permite observar el núcleo celular, sin embargo únicamente es posible valorar la capa mucosa más superficial. El equipo consiste en una sonda de 3.4 mm de diámetro y 250 cm de longitud, la cual se introduce a través del canal de trabajo. Existe poca literatura reportada respecto a su utilidad en la práctica clínica.2,13
Sin embargo y a pesar de la evidencia científica, hasta este momento las recomendaciones de la Asociación Americana de Gastroenterología (AAG) respecto al esófago de Barrett postulan que el seguimiento de esta entidad se lleve a cabo con endoscopia de luz blanca y que las nuevas tecnologías tales como cromoendoscopia y ELC, se utilicen en pacientes con displasia previamente conocida o quienes se detectaron irregularidades en la mucosa con luz blanca.14
Mientras que las guías de enfermedad inflamatoria intestinal del 2011, sugieren que la vigilancia de carcinoma colorrectal se lleve a cabo mediante cromoendoscopia vital con toma de biopsias dirigidas, y en caso de no contarse con medio de contraste, sugieren se realice toma de biopsias cada 10 cm de los cuatro cuadrantes.15
Lo nuevo en diagnóstico
Spyglass
De la marca Boston Scientific® (Natick, MA, EUA), consiste en un catéter 10Fr con un canal de trabajo de 1.2 mm de diámetro, a través del cual se introduce una fibra óptica de 0.7 mm de diámetro o un litotriptor hidráulico de 3Fr. Dicho catéter se introduce por el canal de trabajo de un duodenoscopio convencional y como utilidad clínica destaca la realización de colangioscopía, pancreatoscopía, toma de biopsias y litotripsia.16 Hasta este momento únicamente se ha reportado un estudio piloto retrospectivo realizado en 55 pacientes con operador único, el cual mostró un éxito técnico del 100%, visual del 60%, una mediana de tiempo por procedimiento de 10 minutos y 0% de pancreatitis posprocedimiento. Sin embargo, hacen falta más estudios a futuro.17
Enteroscopía
Actualmente existen tres tipos de enteroscopios: de doble balón, mono-balón y en espiral. El primero de ellos pertenece a la marca Fujinon® (Wayne, NJ) y tiene una longitud de 200 cm, un diámetro de 9.4 mm, un sobretubo de 140 cm y dos balones de látex. Este equipo permite la realización de procedimientos terapéuticos con tasas de éxito del 16%-86%, tiene una agudeza diagnóstica en sangrado de tubo digestivo oculto (STDO) del 60%-80% y una tasa de complicaciones de 0.8%, principalmente íleo, pancreatitis y perforación. Mientras que el enteroscopio mono-balón (Olympus America®) comparte dimensiones con el enteroscopio de doble balón respecto a la longitud, diámetro y tamaño del sobretubo, con la diferencia de tener un balón de silicón. Este equipo ha demostrado una agudeza diagnóstica en STDO del 60%-66%, sin embargo hacen falta más estudios respecto a su seguridad y eficacia. Y finalmente el enteroscopio en espiral conocido como Endo Ease Discovery SB® (Spirus Medical, Stoughton, MA) el cual consiste en un enteroscopio con una longitud de 118 cm, diámetro menor a 9.4 mm y una porción en espiral de 20 cm de longitud y 5.5 mm de diámetro. Respecto a su utilidad clínica, existe un estudio preliminar el cual muestra una agudeza diagnóstica de 33%, un promedio de inserción de 176 cm a partir del ángulo de Treitz, una mediana de tiempo de 33 ± 8 minutos y una tasa de complicaciones del 0.3%, principalmente perforación en el 0.27% de los casos. Sin embargo se requieren más estudios a futuro que comparen esta tecnología con el enteroscopio de doble balón.18
Cápsula endoscópica
Creada en el año 2000, actualmente mide 26 x 11 mm, ofrece imágenes en alta resolución, captura mayor número de imágenes por segundo y tiene una batería de mayor duración.1,18 Existen cuatro modelos:
• Pillcam SB2® (Given Imaging, Yoqneam, Israel).
• Endo® (Olympus America, Valle Central, PA).
• Omom® (Jinshan Science and Technology, Chongqing, China).
• Mirocam® (IntroMedic, Seúl, Korea).
Únicamente las dos primeras están aprobadas por la FDA para adultos y niños mayores de 10 años de edad. Ambas permiten la valoración completa del intestino delgado en el 79%-90% de los casos, con una agudeza diagnóstica del 38%-83% para STDO. Como limitantes destaca la imposibilidad de realizar procedimientos terapéuticos y de manipular su posición, así como un porcentaje de falsos negativos del 11% y la retención de la misma en presencia de estenosis.18
Recientemente, se creó la cápsula colónica Pillcam 2® (Given Imaging Ltd, Yoqneam, Israel), la cual además de tener un mayor ángulo de visión, tiene la ventaja de modificar el número de imágenes obtenidas en relación al movimiento, es decir, captura 35 imágenes en movimiento vs dos imágenes cuando se detiene. Un estudio publicado en 2011 mostró una sensibilidad y especificidad del 84% y 64% respectivamente para lesiones mayores a 6 mm y valores de 88% y 95% para lesiones mayores a 10 mm.19 Actualmente, la principal indicación de la cápsula colónica es la imposibilidad o contraindicación para llevar a cabo una colonoscopia, ya que ésta continua siendo la piedra angular para el diagnóstico y tratamiento de patología en colon.2
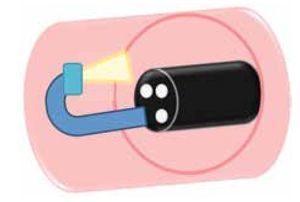
Tercer ojo
Creado por Avantis Medical® (Sunnyvale, California, EUA), se introduce a través del canal de trabajo del colonoscopio y proporciona una visión anterógrada y retrógrada de forma simultánea.2 (Figura 6). Un estudio prospectivo aleatorizado controlado multicéntrico realizado en nueve centros de Europa y EUA, comparó la tasa de detección de adenomas en colon de la colonoscopia convencional vs "tercer ojo". Dicho estudio incluyó a 448 pacientes y demostró un riesgo relativo de 2.56 (p<0.001) de no detectar pólipos, y un riesgo relativo de 1.92 (p<0.029) de no detectar adenomas, con una duración total del estudio de 16.97 minutos vs 20.87 minutos para colonoscopia convencional y "tercer ojo", respectivamente.20
| Figura 6. "Tercer ojo", el cual se introduce a través del canal de trabajo y proporciona una visión anterógrada y retrógrada de forma simultánea.
Técnicas de ablación
Ablación por radiofrecuencia (ARF)
Consiste en aplicar corriente eléctrica alternante a través de un electrodo introducido por el canal de trabajo de un endoscopio convencional. El principio técnico de esta tecnología consiste en crear un campo electromagnético el cual a su vez provoca oscilación iónica y fricción molecular, generando calor local y por consiguiente daño tisular. Existen dos modalidades de ARF (BARRX Medical Inc, Sunnyvale, CA, EUA), la circunferencial conocida como HALO360,
la cual se logra a través de un balón cubierto por un electrodo bipolar de 3 cm de longitud y la ARF focal o HALO90, la cual consta en un electrodo de 20 x 13 mm que se fija a la punta de endoscopio. La utilidad clínica de la ARF radica en el tratamiento de lesiones premalignas como el esófago de Barrett, con tasas de erradicación para metaplasia intestinal de 77.4% vs 2.3% al comparar ARF con el grupo control. Y tasas de erradicación para displasia de bajo y alto grado de 90.5% y 81% respectivamente, vs 22.7% y 12% para el grupo control. Estos resultados se obtuvieron luego de un seguimiento a 12 meses, y se reportó una frecuencia de estenosis del 6% para el grupo de ARF.2,21
Crioterapia
Tiene como principio crear destrucción tisular a través de la aplicación local de un criógeno como nitrógeno líquido o dióxido de carbono, el cual se aplica a través del canal de trabajo de un endoscopio convencional. Una de las desventajas de esta tecnología es que no permite obtener una muestra de tejido para estudio histopatológico. Por otro lado, existe poca evidencia respecto a su utilidad clínica y hasta el momento existen reportes con muestras pequeñas y seguimientos a corto plazo.2 Tal es el caso de un estudio retrospectivo publicado en 2010, donde se valoró la seguridad y eficacia de la crioterapia para el tratamiento de adenocarcinoma esofágico refractario a tratamiento convencional. Dicho estudio se llevó a cabo en 79 pacientes y se documentó una respuesta a la crioterapia en el 62.1% de los casos, con un seguimiento a 11 meses y una frecuencia de estenosis del 13%.22
Técnicas de resección
Resección endoscópica de la mucosa (REM)
Se logra de tres formas: elevación y corte, multiligadura y capuchón. Esta tecnología ofrece excelentes resultados a largo plazo. Tal es el caso de un estudio publicado en 2006 realizado en 124 pacientes con cáncer gástrico temprano menor a 2 cm, tratados con REM con un periodo de observación de 58 meses, donde se documentó una sobrevida específica para cáncer gástrico de 99% a cinco y 10 años.23
Disección endoscópica de la submucosa (DES)
Descrita inicialmente en Japón, consta de tres pasos: infiltrar la submucosa, resecar la mucosa y disecar la submucosa. Originalmente se creó para tratar cáncer gástrico temprano y posteriormente se extrapoló para tumores en colon. Como complicaciones presenta sangrado, estenosis y perforación con tasas que varían de acuerdo al sitio gastrointestinal afectado.2 Recientemente, la marca Olympus® (Tokio, Japón) creó el endoscopio "R", el cual consta de dos canales de trabajo con la finalidad de facilitar la DES.16
Ultrasonido endoscópico
Esta tecnología es una herramienta diagnóstico-terapéutica, ya que permite llevar a cabo las siguientes intervenciones:
• Toma de biopsias.
• Drenaje de pseudoquistes, abscesos y necrosis pancreática.2
• Introducir marcadores de radioterapia y agentes antitumorales en cáncer de páncreas.
• Medir biomarcadores en cáncer de páncreas a través de la BAAF, lo cual permite pronosticar la respuesta a la gemcitabina y por lo tanto predecir sobrevida.1,24
• Aplicación local de etanol y paclitaxel para lesiones quísticas de páncreas con tasas de resolución del 60%.25,26
Se ha descrito en estudios preliminares la posibilidad de tratar neoplasias gastrointestinales de manera local mediante la aplicación de inmunoterapia a través de USE, donde se implanta un cultivo alogénico de linfocitos mixtos denominado citoimplante en el tejido neoplásico con la finalidad de desencadenar una respuesta inmune específica al tumor. De hecho, en 2010 se publicó la fase uno del citoimplante en cáncer de páncreas.27
El futuro de la endoscopia
Se predice que en los próximos 10-20 años, el futuro de la endoscopia consistirá en mejorar la tecnología de la cápsula endoscópica creando una batería recargable de forma extracorpórea, cápsulas biodegradables que permitan el abordaje diagnóstico aún en presencia de estenosis, imágenes en 360o, el desarrollo de una cápsula pediátrica, interpretaciones digitales automáticas donde el endoscopista únicamente confirmará el diagnóstico, lograr capturar imágenes en tiempo real con la finalidad de modificar la calidad y posición de dicha imagen y la posibilidad de realizar procedimientos terapéuticos. Respecto a la posibilidad de manipular la posición de la cápsula, esto se logrará mediante radio-electro estimulación, control remoto o bien mediante navegación robótica creada a través de campos magnéticos.1 De hecho, en 2010 se publicó el primer reporte de manipulación magnética en esófago y estómago de la cápsula endoscópica en un voluntario sano.28
Otra área a futuro es la imagen molecular, la cual detecta cambios moleculares a nivel celular con fines diagnósticos y terapéuticos. Esto se logra a través de anticuerpos, fragmentos de anticuerpos, péptidos o nano-partículas los cuales detectan enzimas proteolíticas, componentes de matriz extracelular, receptores celulares, tirosin-quinasas y marcadores de apoptosis. Algunas de las tecnologías ópticas actualmente en desarrollo son: espectroscopia fluoroscópica, espectroscopia de Raman, tomografía óptica y endomicroscopía confocal fluorescente.29
En relación al USE, se desarrollarán equipos más ligeros y pequeños, con frecuencias mayores que mejoren la calidad de la imagen, equipos con tecnología bimodal, es decir linear y radial, así como la posibilidad de crear reconstrucciones en tercera dimensión.1
Respecto a NOTES (Natural Orifice Trans-Endoscopic Surgery ) inicialmente descr ito en 2004-2006, actualmente se desconoce si es mejor que las técnicas laparoscópicas convencionales y se desconoce si el entrenamiento deba ser por parte de un cirujano o un gastroenterólogo, por lo que probablemente se desarrolle la subespecialidad de "Gastroenterología Intervencionista", la cual consistirá en un entrenamiento quirúrgico con endoscopia terapéutica.1
Finalmente, se predice que en los próximos 10 años la endoscopia terapéutica seguirá realizándose con endoscopios similares a los actuales, y que para el 2015-2020 la cápsula reemplazará a la endoscopia diagnóstica, ya que se espera que ésta sea más pequeña e incorpore técnicas de alta resolución, NBI y biosensores capaces de detectar mutaciones y proteínas asociadas a cáncer. Así como también se espera el desarrollo de equipos multi-modales capaces de integrar luz blanca, magnificación, NBI, microscopía electrónica y USE en un mismo equipo.1
Conclusión
A pesar de los avances tecnológicos en EGI, las nuevas tecnologías son selectivas ya que únicamente se encuentran disponibles en centros de referencia y no se utilizan de forma rutinaria. Por otro lado, la mayoría de ellas no han sido validadas ni estandarizadas por lo que no forman parte de las recomendaciones actuales. Sin embargo, prometen mucho a futuro tanto el ámbito diagnóstico como terapéutico.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron ningún patrocinio para llevar a cabo este artículo.