El cáncer colorrectal es la tercera causa de muerte por cáncer. Hasta el 20% de estos pacientes desarrollará obstrucción intestinal mecánica que tradicionalmente ha sido tratada con una derivación intestinal y la creación de un estoma.
En 1991 se realizó la primera colocación de una endoprótesis metálica autoexpandible) colónica para el manejo de la obstrucción por cáncer de colon. Puede ser paliativa, en el caso de la enfermedad incurable, o utilizada como puente hacia una cirugía definitiva, permitiendo tratar al paciente, recuperar su homeostasis y hacer una cirugía programada segura.
Se presenta el caso de un paciente masculino de 78 años, tratado previamente con múltiples cirugías, que cursa con obstrucción de más del 90% de la luz colorrectal por un cáncer sin posibilidad de tratamiento quirúrgico.
Colorectal cancer is the third cause of death related to cancer. Up to 20% of these patients will develop mechanical intestinal obstruction, which has traditionally been treated with intestinal diversion and stoma.
In 1991 the first colonic self-expandable metallic stent was used for the management of colonic obstruction due to colonic cancer. This can be a palliative procedure for the incurable disease or used as a bridge to surgery, hence, allowing to treat and restore patient homeostasis and perform a safer elective surgery.
The case is presented of a 78 year old male patient previously treated with multiple surgical procedures, having an obstruction of more than 90% of the colorectal lumen secondary to a cancer that was not eligible for surgical treatment.
El cáncer de colon es la tercera causa de muerte por cáncer con más de 10,000 casos nuevos diagnosticados al año1. El cáncer de colon izquierdo representa la mayoría de los casos en el que desafortunadamente el 70% tienen enfermedad avanzada y solo el 50% son candidatos para cirugía curativa al momento del diagnóstico2. Aproximadamente el 20% de los pacientes con cáncer de colon izquierdo tendrá obstrucción intestinal mecánica3. La cirugía de urgencia con derivación colónica y creación de estoma, terminal o en asa, ha sido el manejo tradicional en estos casos. Sin embargo, la presencia de un estoma se asocia con baja calidad de vida, y del total de pacientes solo el 60% será sometido a una cirugía para revertir el estoma2,4. Las endoprótesis enterales se empezaron a utilizar para la paliación del cáncer de colon desde 1991 por Dohmoto et al. y desde entonces se han utilizado para el manejo de la obstrucción intestinal mecánica5.
La colocación de una endoprótesis metálica autoexpandible (EMAE) permite cambiar un procedimiento quirúrgico de urgencia con elevada morbimortalidad por un procedimiento programado, a través de la descompresión colónica inmediata y recuperación de la homeostasis del paciente. Este puente hacia la cirugía definitiva permite estudiar al paciente, estadificarlo, buscar un cáncer colorrectal sincrónico y metástasis a distancia, que en definitiva van a alterar el manejo de la enfermedad3,6,7.
En el contexto de la paliación se ha encontrado descompresión exitosa en el 95% de los casos con una tasa de respuesta clínica del 81%, definida como continuación de la permeabilidad tras 6 meses de la colocación1. Varios estudios han demostrado la efectividad de las endoprótesis, además de que reducen el tiempo de estancia hospitalaria, costos médicos, número de cirugías para realizar estomas, y la morbimortalidad del paciente8.
Presentación del casoPaciente masculino de 78 años con cuadros de oclusión intestinal intermitente. Hace 7 años se le diagnosticó un adenocarcinoma rectal para lo cual se le realizó resección del tumor, bolsa de Hartmann y colostomía de sigmoides. Tres meses después se realizó colorrectoanastomosis con éxito. Hace 5 años tuvo recidiva tumoral en colon descendente por lo cual se realizó resección de colon descendente y colorrectoanastomosis primaria de transverso. Ha recibido quimioterapia y radioterapia. No tiene otros antecedentes de importancia.
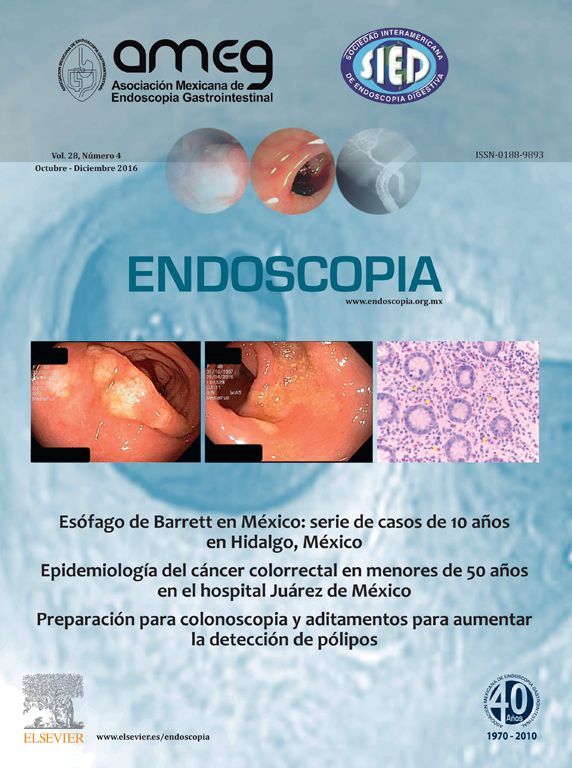
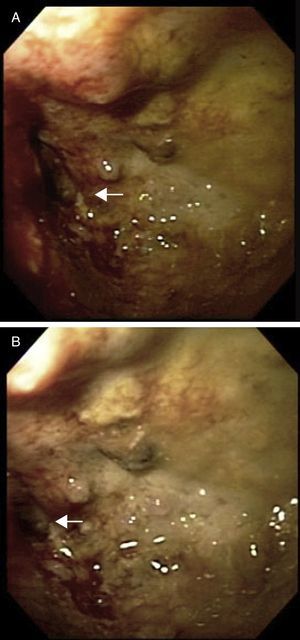
El paciente cursa desde hace un mes con cuadros de oclusión intestinal intermitente. Se realiza colonosopia, encontrando tumor a 8cm del margen anal, con oclusión de más del 90% de la luz (fig. 1).
El paciente ingresa con adecuado estado hemodinámico y con evacuaciones disminuidas en calibre, para colocación de endoprótesis colónica mediante colonoscopia y control fluoroscópico.
Se decide utilizar una EMAE de 25mm de diámetro, recubierta, de 23cm de longitud.
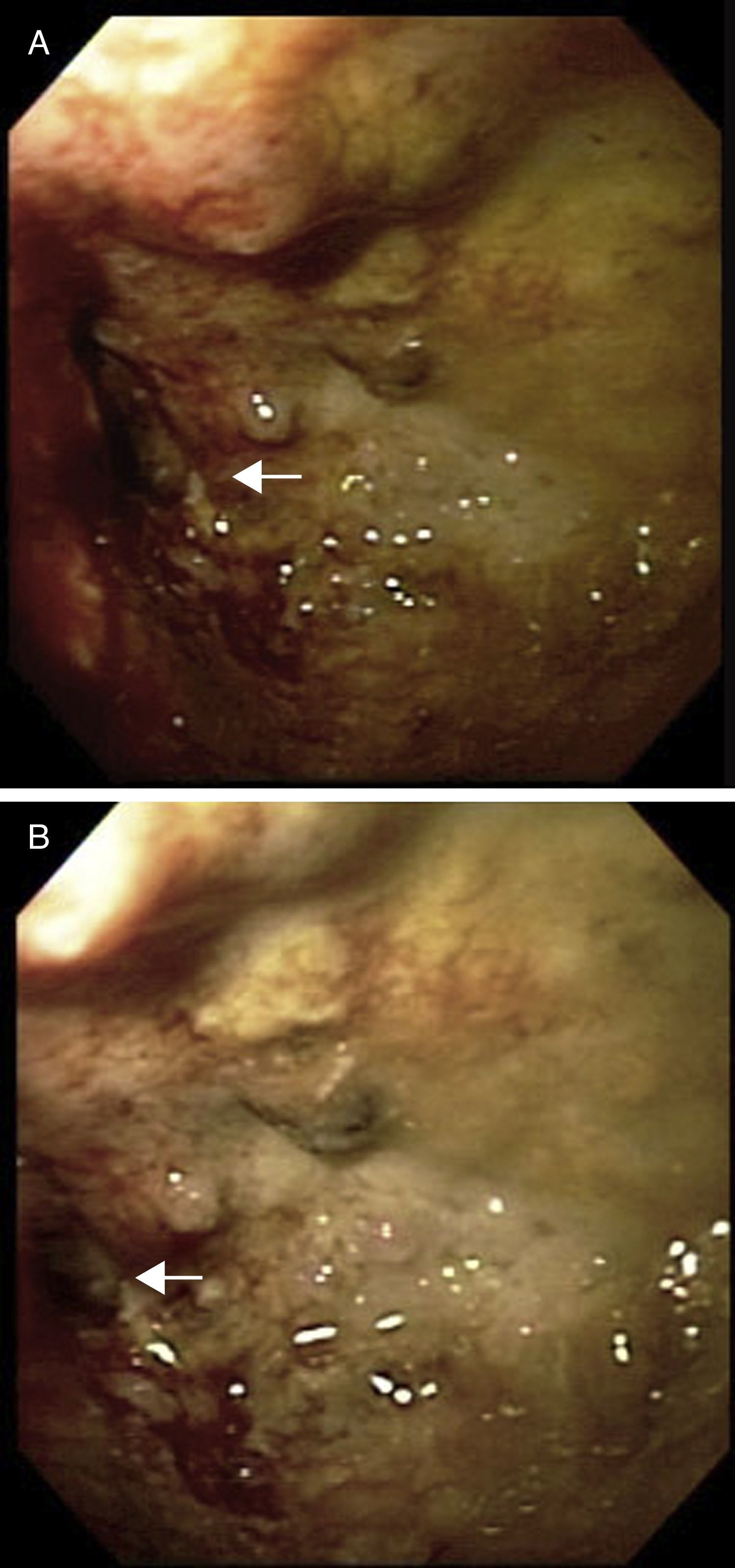
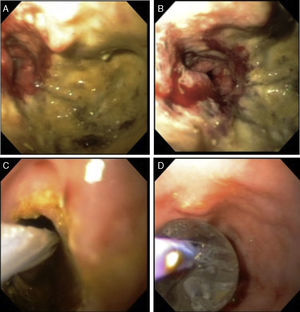
Con el paciente bajo sedación se realiza colonoscopia, logrando franquear el tumor hasta colon transverso (fig. 2A y 2B). Debido a que la estenosis compromete casi la totalidad de la luz colónica se coloca un dilatador neumático a través de la estenosis el cual se infla a 20mmHg durante 5min, dilatando la estenosis (fig. 2C y 2D).
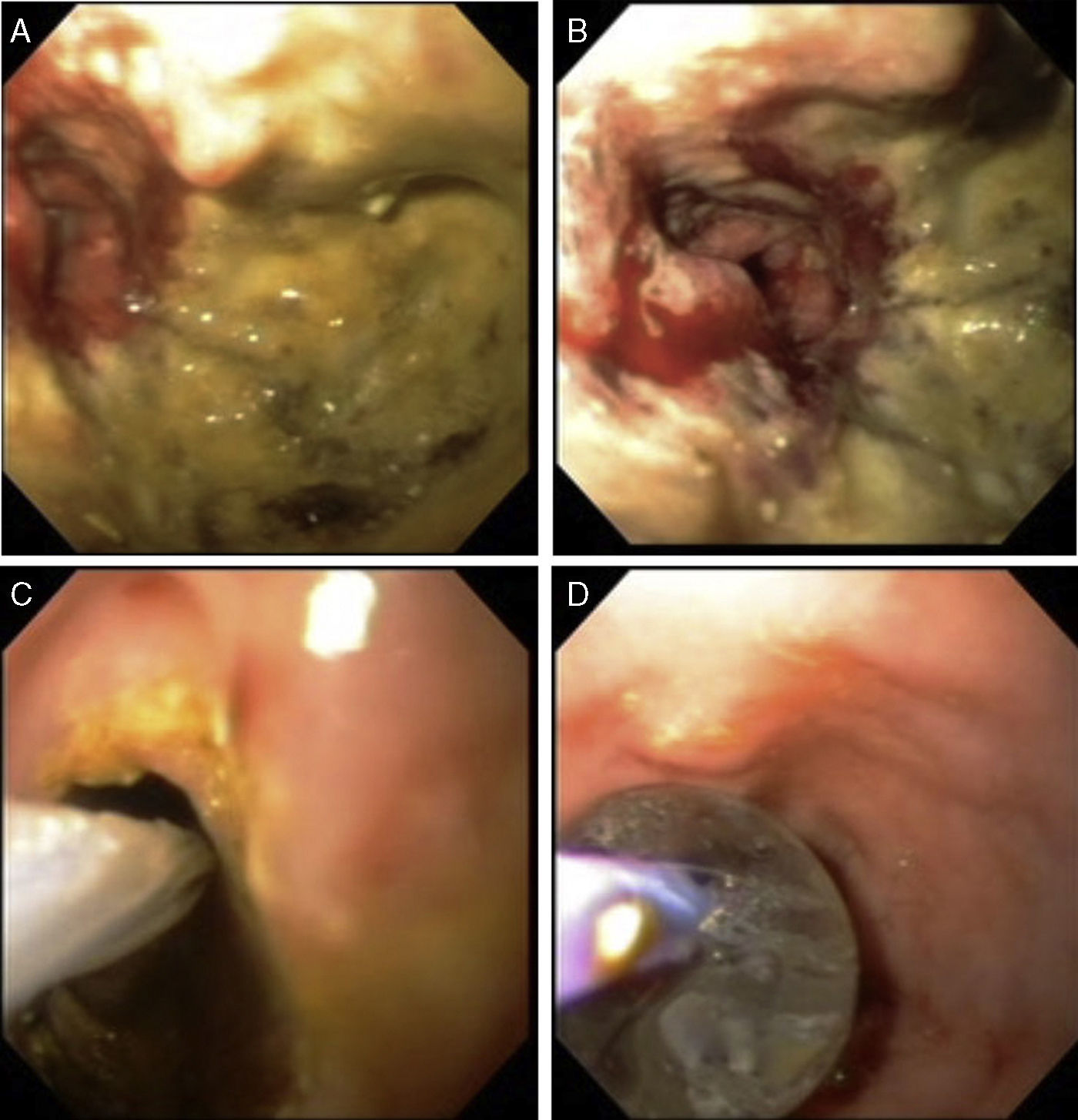
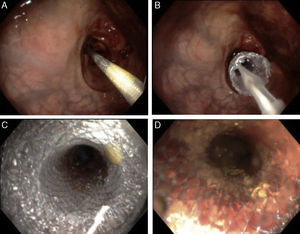
Se elige el tamaño de la endoprótesis de acuerdo a la longitud estimada por colonoscopia, buscando cubrir por lo menos 2cm de bordes sanos. Se introduce el liberador de la endoprótesis que debe colocarse abarcando el borde proximal sano, el sitio de la estenosis y el borde distal sano (fig. 3A). Se libera hasta desplegarla en toda su extensión (fig. 3B y 3C).
Se pasa el colonoscopio a través de la luz de la endoprótesis corroborando su adecuada expansión y contención del tumor (fig. 3D).
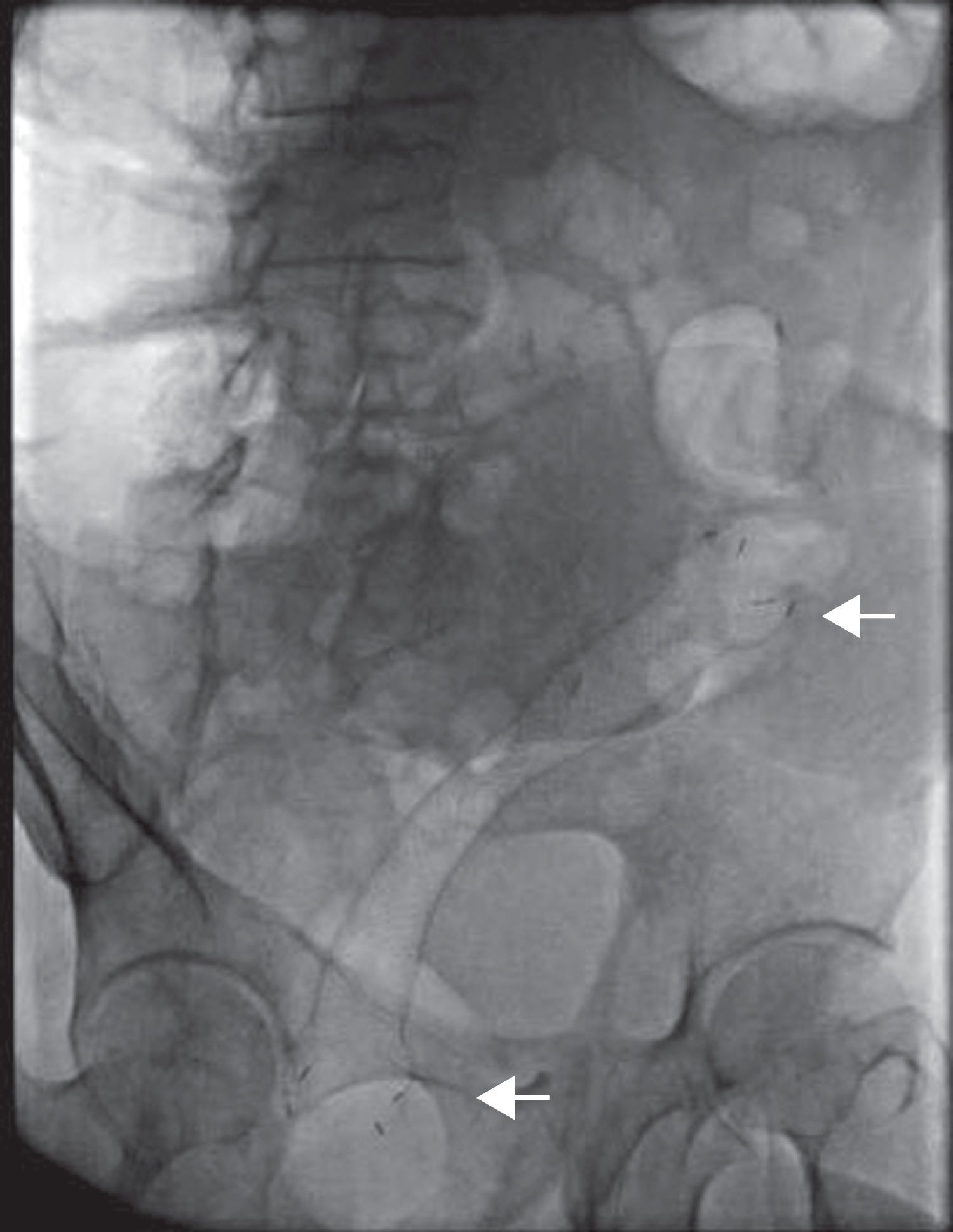
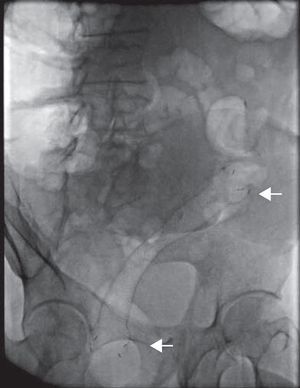
Finalmente se corrobora la colocación de la endoprótesis por fluoroscopia, encontrando adecuada colocación y longitud (fig. 4). Durante la fluoroscopia dinámica se observa paso de heces a través de la EMAE en tiempo real.
El paciente permanece 12hs en ayuno y se inician líquidos los cuales tolera. Tras 24h de evolución se progresa dieta y es egresado sin complicaciones.
Actualmente el paciente tiene un mes de evolución, ha cursado con diarrea tratada con loperamida, y tenesmo que ha mejorado con el transcurso de los días.
DiscusiónA pesar de que existe evidencia clara en la literatura, la colocación de una EMAE colónica para el manejo de la obstrucción por cáncer de colon no es una práctica habitual en nuestro medio.
Las prótesis colónicas deben ser reservadas para pacientes con sintomatología clínica y evidencia por estudios de imagen de una obstrucción intestinal colónica maligna sin signos de perforación. Las prótesis se recomiendan en tumores que estén más allá de 8-10cm del margen anal para evitar sensación de cuerpo extraño y el estudio de imagen de elección es la tomografía con contraste9, Es importante establecer el escenario clínico del paciente al que se le colocará la EMAE. Se puede tratar de un paciente con una expectativa de vida muy corta, independientemente del estadio del cáncer, que requiere solamente cuidados para mejorar la calidad de vida, o puede tratase de un paciente que no es candidato a cirugía pero que se puede beneficiar de la quimioterapia basada en oxiplatino para citorreducción tumoral9,10,12.
La Sociedad Europea de Endoscopia Gastrointestinal (ESGE, European Society of Gastrointrestinal Endoscopy) emite una recomendación fuerte, con bajo nivel de evidencia sobre el uso de antiangiogénicos en combinación con EMAE. Hay varias series retrospectivas que han reportado un incremento en la perforación por prótesis (17-50%) en pacientes tratados con bevacizumab a los que se les coloca una EMAE. Es razonable pensar que otros antiangiogénicos como el afilbercept y el regorafenib conlleven un riesgo similar9,11.
La indicación clínica para la colocación de una EMAE con más alto nivel de evidencia es la paliación de un cáncer colónico incurable, en el paciente que tiene obstrucción intestinal mecánica. En esta situación la guía de la ESGE la recomienda como la primera opción de tratamiento9,13. También pueden ser utilizadas para resolver la urgencia de un paciente que comienza con obstrucción maligna, como un puente hacia la cirugía potencialmente curativa, con un intervalo quirúrgico de 5-10 días3,9.
En un metaanálisis que revisó 13 estudios sobre el uso de EMAE para la paliación de obstrucción por cáncer colorrectal incurable (n=404) en comparación con cirugía abierta (n=433) se encontró una disminución de la estancia hospitalaria (10 vs. 19 días), y una menor frecuencia de admisión a la unidad de cuidados intensivos (0.8 vs. 18%). También puede iniciarse la quimioterapia de forma más temprana tras la colocación de la EMAE en comparación con la cirugía abierta (16 vs. 33 días). La necesidad de una ileostomía/colostomía fue menor tras la inserción de la endoprótesis paliativa (13 vs. 54%)6,13.
También se ha encontrado que la eficiencia de la EMAE es comparable con el manejo quirúrgico, y que el inicio de la quimioterapia tras la inserción de una endoprótesis paliativa en cáncer colónico incurable puede mejorar la supervivencia14,15.
Una revisión sistemática de Cochrane encontró que el manejo paliativo del cáncer colónico incurable mediante la colocación de endoprótesis colónica disminuye el tiempo de estancia hospitalaria, el tiempo de procedimiento y la pérdida de sangre, con una morbimortalidad, complicaciones generales y tasa de infección de la herida quirúrgica comparables en ambos grupos16. También establece que la inserción de endoprótesis colónica debe ser llevada a cabo por endoscopistas o radiólogos con experiencia en el campo del intervencionismo9.
Los materiales disponibles para las prótesis colónicas son el acero inoxidable, Elgiloy® y nitinol, siendo este ultimo el más utilizado. El nitinol es una aleación de níquel y titanio que tiene memoria en su forma, una gran elasticidad y es compatible con la resonancia magnética. Existen endoprótesis biodegradables, desarrolladas originalmente para tratar estenosis benignas que están hechas de polímeros sintéticos, principalmente poliglicólidos, polidioxanona y poliláctidos. La vida media de degradación in vitro varía dependiendo del diámetro de la fibra, la estructura de la malla, el tipo de tejido donde se colocó, el tipo de material biodegradable utilizado, el pH y la temperatura.
Actualmente se puede elegir entre endoprótesis cubiertas y no cubiertas, dependiendo de la presencia o ausencia de una membrana alrededor de la endoprótesis metálica. Las endoprótesis cubiertas fueron desarrolladas para prevenir o reducir el crecimiento tumoral y por lo tanto la oclusión temprana de la prótesis. Sin embargo, la desventaja de las endoprótesis cubiertas es que tienen una tasa mayor de migración17. La ESGE recomienda ambos tipos de prótesis, teniendo la misma seguridad y eficacia9.
La métodos de colocación incluyen fluoroscopia sola, colonoscopia sola, y combinación de ambas. En el recto y colon distal se puede elegir uno de los 2 métodos, pero para lesiones más proximales se recomienda un abordaje mixto. La colonoscopia puede ayudar al abordaje y paso de la guía, y la fluoroscopia es útil para documentar la extensión de la obstrucción y para el diagnóstico de perforación8,9. Se recomienda la preparación del colon distal a la estenosis con un enema para permitir la adecuada visión del colonoscopio9.
La colocación de una EMAE como puente hacia la cirugía o como paliación de un tumor irresecable conlleva complicaciones, que se observan con mayor frecuencia en comparación con el abordaje quirúrgico4. Estas pueden ser complicaciones menores como sangrado rectal leve o moderado, dolor anorrectal transitorio, tenesmo e incontinencia temporal. Están descritas otras complicaciones más severas y que pueden poner en riesgo la vida como perforación y muerte (tabla 1)8,9,18.
Complicaciones relacionadas con la colocación de endoprótesis colónica
| Perforación | Tasa de perforación del 4.8%Aumenta cuando se requiere dilatación con balón (19%)Ocurre más frecuente en áreas de necrosis tumoralSiempre sospechar cuando el paciente refiere dolor |
| Descompresión inadecuada | Sospechar mala posición o expansión incompletaLa expansión inicial de la EMAE puede ser insuficiente el primer díaPuede haber carcinoma sincrónico hasta en el 5%También se puede deber a impactación fecal o heces retenidas |
| Migración | Se reporta una tasa de migración del 4-10%Más frecuentemente durante las primeras 24hOcurre por factores técnicos como expansión inadecuada, longitud insuficiente, diámetro pequeño y angulación del colonMás frecuente en pacientes que recibieron quimioterapia y radioterapiaSe pueden utilizar ablandadores de heces para prevenir la impactación fecalLo más frecuente es que el paciente se mantenga asintomático, aunque puede referir irritación rectal o síntomas de reobstrucción como dolor y estreñimiento |
| Obstrucción tras una descompresión exitosa | La causa más común es sobrecrecimiento tumoral, que sucede en el 30%Más frecuente en casos de paliaciónPara evitarlo se recomiendan endoprótesis recubiertas y tener un margen de tejido sano de 2cmEsta complicación puede ser tratada con una segunda endoprótesisOtras causas son migración e impactación fecal |
| Sangrado | Se encuentra en el 0-5% de los pacientes y generalmente es leve a moderado. Generalmente no requiere tratamiento |
| Dolor | El dolor abdominal y rectal es la complicación más frecuente, generalmente no requiere tratamiento y cede espontáneamenteLa ferulización de la porción inferior del recto se asocia con tenesmo severo, debe ser evitada |
Cuando ocurre obstrucción o migración de la prótesis en el contexto de la paliación se puede reintervenir endoscópicamente colocando una «prótesis sobre prótesis» o reemplazándola9,18.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.