El drenaje de colecciones intraabdominales (CIA) de cualquier etiología se ha hecho tradicionalmente por medio de cirugía con alto éxito terapéutico, pero con significativa morbilidad y mortalidad, produciendo estancias hospitalarias prolongadas y altos costos.
El drenaje endoscópico (DE) guiado por ultrasonido endoscópico (USE) es una alternativa terapéutica efectiva y segura en las CIA pancreáticas. Con respecto a las CIA no pancreáticas, los datos preliminares son prometedores y su perfil de seguridad parece ser excelente.
The drainage of intrabdominal collections of any etiology traditionally have been drained by surgery with high therapeutic success however with significant morbidity and mortality with prolonged hospital stays and high costs.
The endoscopic drainage guided by endoscopic ultrasound is an alternative effective and safe therapy in pancreatic intra-abdominal collections. With respect to non-pancreatic intra-abdominal collections, preliminary data are promising and its safety profile appears to be excellent.
Introducción
El drenaje de colecciones intraabdominales (CIA) de cualquier etiología se ha hecho tradicionalmente por medio de cirugía con alto éxito técnico y terapéutico, sin embargo la morbilidad (10%-30%) y mortalidad (1%-5%) son significativas.1 Sumado a lo anterior, el abordaje quirúrgico de este tipo de lesiones causa estancias hospitalarias prolongadas y altos costos.2
El drenaje endoscópico (DE) guiado por ultrasonido endoscópico (USE) de una CIA fue descrito por primera vez, en 1992 por Wiersema y colaboradores.3 Desde entonces, ha crecido la evidencia científica sobre este procedimiento. En 11 estudios realizados entre 1995 y 2008, en los cuales se incluyeron 368 pacientes quienes fueron sometidos al DE de CIA pancreáticas, el éxito terapéutico fue reportado en 91.8% de los casos y solamente en 7.68% de los pacientes ocurrió alguna complicación.4-15
Recientemente ha aumentado el número de estudios que reportan el DE guiado por USE (DEUSE) de CIA no pancreáticas, como colecciones posquirúrgicas, abscesos hepáticos, colecciones asociadas a diverticulitis y asociados a enfermedad de Crohn, con alto éxito terapéutico y baja frecuencia de complicaciones.16-22
El objetivo de la presente revisión es describir las indicaciones, técnica y resultados del DE-USE.
Previo al procedimiento
La indicación de drenaje de una CIA es cuando existen síntomas asociados (Tabla 1). Es importante la valoración clínica del paciente, de los estudios de imágenes de la CIA y los estudios de laboratorios, por un equipo multidisciplinario compuesto por endoscopistas experimentados en terapéutica, cirujanos y radiólogos intervencionistas, esto con el fin de seleccionar la mejor conducta terapéutica al inicio del tratamiento y de acuerdo a la evolución clínica de cada uno de los pacientes. Previo a cualquier procedimiento, se debe informar al paciente sobre los posibles riesgos y beneficios del abordaje endoscópico, con un adecuado consentimiento informado para el procedimiento. Además, se recomienda administrar profilaxis antibiótica, previo al procedimiento y por tres a cinco días posteriores al mismo.23
Instrumentos y materiales
Los procedimientos endoscópicos de drenaje deben ser realizados en una sala de fluoroscopia, con el fin de visualizar la colocación de guías, prótesis o drenajes dentro de la CIA.
Ecoendoscopios
Los ecoendoscopios lineales permiten la punción en tiempo real de la CIA bajo guía endosonográfica, estos deben de contar con un canal de trabajo de al menos 3 mm, dentro de este tipo de ecoendoscopios se incluyen el FG 38 UX (Pentax Precision Instruments Corp., Orangeburg, NY, USA), el EG 38UT (Pentax Precision Instruments Corp., Orangeburg, NY, USA) y el GF-UCT 140/180 (Olympus Medical System Corporation, Center Valley, PA, USA). Por ejemplo, el EG 38UT y el GF-UCT140 disponen de canales de trabajo con diámetros de 3.8 y 3.7 mm, respectivamente; mientras que el FG 38X tiene un canal de 3.2 mm, que sólo permite el paso de prótesis de 8.Fr. Si sólo se dispone de ecoendoscopio con canal de trabajo pequeño, este debe ser intercambiado durante el procedimiento por un gastroscopio terapéutico o duodenoscopio, que disponen de un canal de trabajo más amplio.24
Accesorios
Se requiere de una aguja para biopsia por aspiración (BAAF) calibre 19G, que permita el paso de una guía rígida de calibre de 0.035 pulgadas dentro de la CIA. Un dispositivo aguja cuchillo sobre la guía utilizada, se usa para puncionar la pared de la CIA, con el fin de facilitar la colocación de prótesis o drenajes. Alternativamente, en pacientes con alto riesgo de sangrado, se pueden utilizar de manera progresiva dilatadores estándar (dilatador de Soehendra) para colangiopancreatografía retrógrada endoscópica (CPRE). Un balón de dilatación con diámetro de 6-15 mm, es requerido para dilatar el tracto entre la CIA y el lumen del tracto gastrointestinal (TGI). Además, prótesis plásticas doble de cochino (7/8.5F, 10F), prótesis metálicas autoexpandibles, catéteres naso-absceso, se necesitan para facilitar el drenaje de una CIA.24
Técnica del procedimiento
El DE de cualquier CIA puede ser realizada de manera convencional (sin USE) o con la guía de USE. La utilización del USE ha demostrado un aumento significativo en el éxito técnico del procedimiento (33% vs. 100%), disminución de las posibles complicaciones como sangrado y perforación (< 5%), además se ha observado que hasta en el 5% a 37% de los casos, el USE realiza un diagnóstico alternativo de tumoraciones quísticas principalmente en el caso de colecciones pancreáticas, lo que cambia radicalmente el tratamiento de este tipo de lesiones.13,25 Se han propuesto varias indicaciones absolutas para la utilización del USE en el DE de CIA como: ventana pequeña entre la CIA y el TGI para el abordaje endoscópico por tomografía computarizada (TC), ausencia de compresión extrínseca o localización inusual de la misma, coagulopatía o trombocitopenia, várices previamente documentadas y previo intento fallido de DE en forma convencional.26,27
Bajo visión endosonográfica, la posición ideal para realizar la punción es donde exista un íntimo contacto entre la pared del TGI y la CIA (idealmente < 1.5 cm), ausencia de vasos sanguíneos en el trayecto de punción y que todo lo anterior se logre con mínima torsión del ecoendoscopio, para así permitir fácilmente el paso de accesorios necesarios durante el procedimiento a través del canal de trabajo.23
Con respecto a la creación de la fístula comunicante entre la CIA y el TGI, se han utilizado varias técnicas para realizar la punción, dilatación y mantener la permeabilidad de su trayecto.
En primer lugar, existen dos formas para llevar a cabo la punción para el trayecto de la fístula: sin corriente eléctrica (uso de aguja para BAAF 19G y canulador estándar para CPRE), y con corriente eléctrica (utilización de dispositivo aguja cuchillo). En la mayoría de los casos se lleva a cabo la punción, en primer lugar con la aguja de BAAF de calibre 19G con el paso de una guía a la CIA, y posteriormente se completa la punción con un dispositivo con corriente eléctrica sobre la guía colocada.23 En pacientes con alto riesgo de sangrado se ha utilizado la punción gradual con el canulador estándar de CPRE, en lugar del dispositivo aguja cuchillo. También existen dispositivos que integran ambas técnicas de punción con o sin corriente, como lo son el cistostomo y la aguja diseñada por Giovannini (Wilson Cook Corporation), que permiten en un solo paso sin la necesidad del intercambio de accesorios, la punción completa de la pared del TGI y de la CIA.
En segundo lugar, la dilatación del trayecto de la fístula de manera gradual y secuencial a través de la guía con varios accesorios como el canulador estándar de CPRE, catéteres dilatadores y balón de dilatación, ha demostrado tener un alto éxito técnico (95%) y éxito terapéutico (93%), sin complicaciones mayores como sangrado o perforación, debido a que en ninguno de los pasos se usa un dispositivo con corriente en la dilatación de la fístula.28 No hay estudios comparativos entre el uso de dispositivos con corriente vs. la dilatación gradual de la fístula, por lo que la decisión de por cuál de las dos opciones tomar, debe ser basada en la experiencia del endoscopista.24 También es importante mencionar, que no hay evidencia para poder dar recomendaciones sobre el límite del grado de dilatación a realizar. En grandes CIA y con grandes áreas de contacto de la misma con la pared gástrica, se puede dilatar de manera segura hasta 12-15 mm. Si la CIA es pequeña y por lo tanto, el área de contacto con la pared gástrica es mínima, la dilatación de 8-10 mm es suficiente por el riesgo de perforación o fuga. En el caso de DE por vía transduodenal, la dilatación se sugiere entre los 8-10 mm. El abordaje endoscópico transesofágico debido al riesgo de neumoperitoneo, en la experiencia de los autores Varadarajulu y Prasad, la dilatación hasta 6 mm es segura con menos riesgo de neumomediastino. También, la dilatación entre 6-8 mm puede ser suficiente en los DE por vía transyeyunal.24
En tercer lugar, el paso a seguir durante el procedimiento es lograr mantener la permeabilidad de la fístula, que permita la resolución completa de la CIA. Para dicho objetivo, se ha utilizado habitualmente la colocación de varias prótesis plásticas transmurales con diseño doble cola de cochino, con el fin de que un extremo en cuerno de la prótesis se ancle dentro de la CIA y el otro en el TGI. La posición de estas prótesis permiten ferulizar la fístula para que ésta se mantenga permeable, además su diseño permite menos posibilidad de migración de las mismas.23
Por la ausencia de estudios grandes, aleatorizados, que comparen los diferentes tipos, tamaños y cantidad de prótesis plásticas para utilizar en los DE-USE de CIA, conlleva a la opinión de experto a predominar sobre esa decisión, por lo que la mayoría de autores recomiendan el uso de varias prótesis plásticas grandes y tipo doble cola de cochino.29
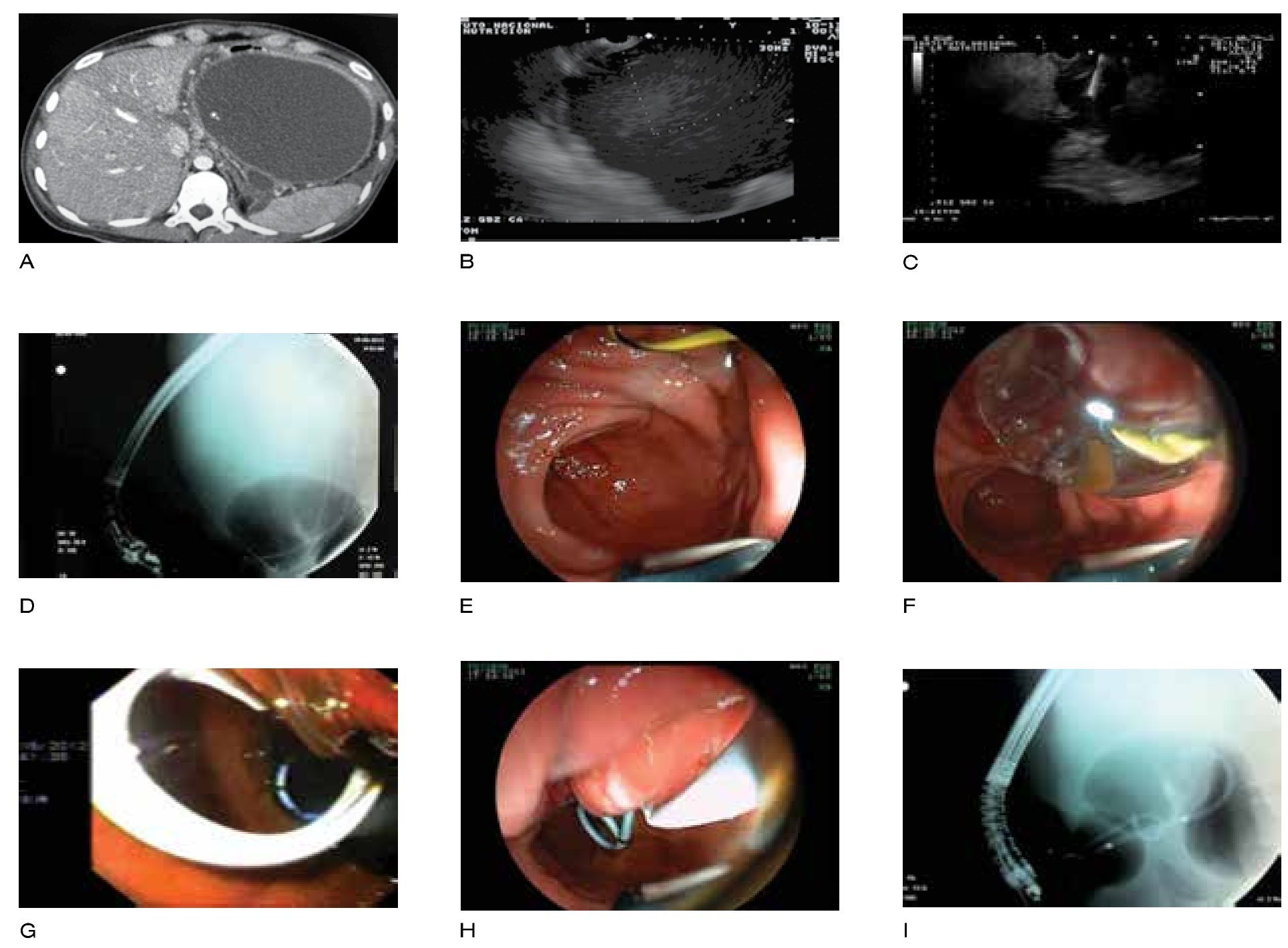
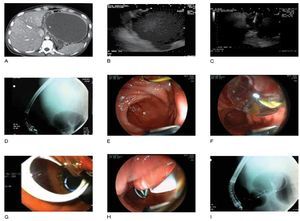
Sin embargo, la colocación de varias prótesis plásticas de estas características es técnicamente difícil y tedioso, por lo que se ha propuesto la utilización de una única prótesis metálica autoexpandible totalmente recubierta (PMAETR) en el DE de CIA, lo que conlleva en teoría al uso de una sola prótesis de mayor diámetro, siendo un procedimiento mucho más rápido.30 En la Figura 1 se muestran los diferentes pasos para el DE-USE de seudoquistes.
Figura 1. Pasos del procedimiento del DE guiado por USE de una CIA. A) Imagen tomográfica de una CIA sintomática. B) Imagen endosonográfica de la CIA. C) Punción bajo guía ultrasonográfica de la CIA. D) Imagen fluoroscópica de una CIA con medio de contraste y una guía 0.035" en su interior. E) Imagen endoscópica de la guía que conduce a la CIA. F) Dilatación con balón del trayecto de la fístula entre el tracto gastrointestinal y la CIA. G) Imagen endoscópica de una prótesis plástica doble cola de cochino en el interior de la CIA. H) Imagen endoscópica de un catéter naso-quístico que conduce a la CIA. I) Imagen fluoroscópica de la prótesis plástica doble cola de cochino y el catéter naso-quístico en el interior de la CIA.
En un estudio prospectivo no aleatorizado por Penn y colaboradores, que incluyó 20 pacientes con seudoquiste pancreático, se realizó un DE-USE con la utilización una PMAETR de diámetro de 10 mm y largo de 40 mm, con una prótesis plástica doble cola de cochino de 7-10Fr, que sirvió de anclaje para la PMAETR. El éxito técnico fue 100%, el éxito terapéutico fue de 70% y la migración de la prótesis ocurrió en 15% de los pacientes, con un tiempo de seguimiento promedio de 101 días. Los autores consideran que las PMAETR son una alternativa factible, segura y efectiva a considerar en el DE de los seudoquistes, sin embargo no se realizó un análisis de costos de tal intervención.30
En otro estudio donde se comparó la utilización de prótesis plásticas vs. PMAETR, en el DE de CIA pancreáticas en 56 pacientes, el DE con PMAETR tomó menos tiempo de procedimiento comparado con la utilización de prótesis plásticas (14.2 minutos vs. 29.2 minutos; p<0.01), además el tiempo promedio para la resolución completa fue menor con las PMAETR (p<0.01). El éxito técnico, complicaciones (neumoperitoneo, sangrado, migración de la prótesis) y resultados clínicos fueron similares en ambos grupos, sin diferencias significativas. Los autores concluyen que las PMAETR ofrecen un procedimiento endoscópico más corto, con efectividad y seguridad.31
Otro tipo de prótesis utilizadas en el DE de CIA son los catéteres naso-quísticos, los cuales permiten una comunicación externa con las CIA infectadas y la posibilidad de su lavado con agua estéril. En un estudio con 95 pacientes con colecciones pancreáticas, se comparó el uso de catéter naso-quístico más prótesis transmurales vs. únicamente prótesis transmurales en su drenaje endoscópico. Los autores llegaron a la conclusión que la resolución completa de las colecciones fue similar en ambos grupos, pero que el uso de catéteres naso-quísticos podría disminuir el número de procedimientos endoscópicos necesarios para tal objetivo.32
Seguimiento posterior al procedimiento
No hay recomendaciones formales al respecto, pero una TC puede ser realizada dentro de dos a tres días posterior al procedimiento. Si la CIA disminuyó su tamaño en más del 50% de su diámetro original y el paciente clínicamente tiene mejoría de sus síntomas, el cáteter naso-quístico, si se utilizó, puede ser retirado.24 Otra TC puede ser realizada dentro de seis a ocho semanas posterior al DE, para valorar la resolución de la CIA. Si la CIA resolvió, las prótesis transmurales son removidas por endoscopia. Si la CIA persiste, se puede valorar la colocación de prótesis adicionales o el pacientes es referido a cirugía.24 Pero hay que tener en cuenta, que la evolución clínica del paciente puede variar esta conducta de seguimiento posterior al DE.23
Circunstancias especiales a considerar durante el procedimiento
Existen varias circunstancias especiales de las CIA que demandan la modificación del procedimiento estándar del DE como: CIA pancreáticas con material necrótico, CIA pequeñas (≤ 4 cm), múltiples CIA, colecciones pancreáticas asociadas a síndrome de conducto pancreático desconectado y el drenaje de colecciones con anatomía alterada del TGI.
Las CIA pancreáticas con material necrótico requieren una dilatación más amplia del trayecto fístuloso para poder accesar con un endoscopio de visión frontal dentro de la CIA, esto con el objetivo de realizar un desbridamiento endoscópico del contenido necrótico con diferentes accesorios como canastas, pinzas y asas, así como lavado directo con agua estéril. El DE de este tipo colecciones usualmente requieren varias sesiones para lograr el éxito terapéutico. Un punto importante a considerar en esta circunstancia, es que no existen accesorios óptimos para efectuar la desbridación.33,34
Con respecto a las CIA pequeñas (≤ 4 cm), se recomienda únicamente la aspiración completa de su contenido por medio de la punción con aguja para BAAF.35
Por otro lado, las CIA múltiples demandan también un abordaje múltiple de aquellas CIA cercanas al TGI para su DE. Por lo cual, es necesario la realización del procedimiento descrito en diferentes puntos del TGI para el drenaje de cada una de las CIA. En un estudio con 60 pacientes con CIA pancreáticas, seis de ellos presentaron múltiples colecciones. El DE de dichas CIA múltiples tuvo un éxito técnico del 100%, con un éxito terapéutico en el 66% de los casos.28
Otra condicion especial a considerar en las CIA pancreáticas es el síndrome del conducto pancreático desconectado o la persistencia de una fístula pancreática, que conlleva a la recurrencia de este tipo de colecciones. En un estudio por Varadarajulu y colaboradores, en el cual trataron 22 pacientes con colecciones asociadas a SCPD por medio del DE con la colocación de múltiples protesis plásticas con la intención de no retirarlas, obtuvieron los siguientes resultados: un 100% de éxito de tratamiento, 0% recurrencia y 13.6% de los casos con migración de las prótesis, con un tiempo promedio de seguimiento de 1 026 días. Los autores concluyen que la colocación indefinida de prótesis transmurales, disminuyen la frecuencia de recurrencia de las CIA pancreáticas asociadas con SCPD, pero además hacen referencia que las PMAETR podrían ser de gran utilidad en estas circunstancias, debido a que conservan su funcionalidad por mayor tiempo en comparación con las prótesis plásticas, pero se necesitan más estudios para definirlo36 (Figura 2).
Figura 2. Utilización de PMAETR en el DE guiado por USE de CIA.
Por último, el DE-USE en pacientes con anatomía gastrointestinal alterada posterior a cirugía conlleva un alto riesgo de perforación, debido a la rigidez del tubo y la visión oblicua del ecoendoscopio, sin embargo, se ha reportado el drenaje éxitoso de una colección a traves de una Y de Roux.28
Resultados clínicos del DE guiado por USE de CIA
CIA pancreáticas
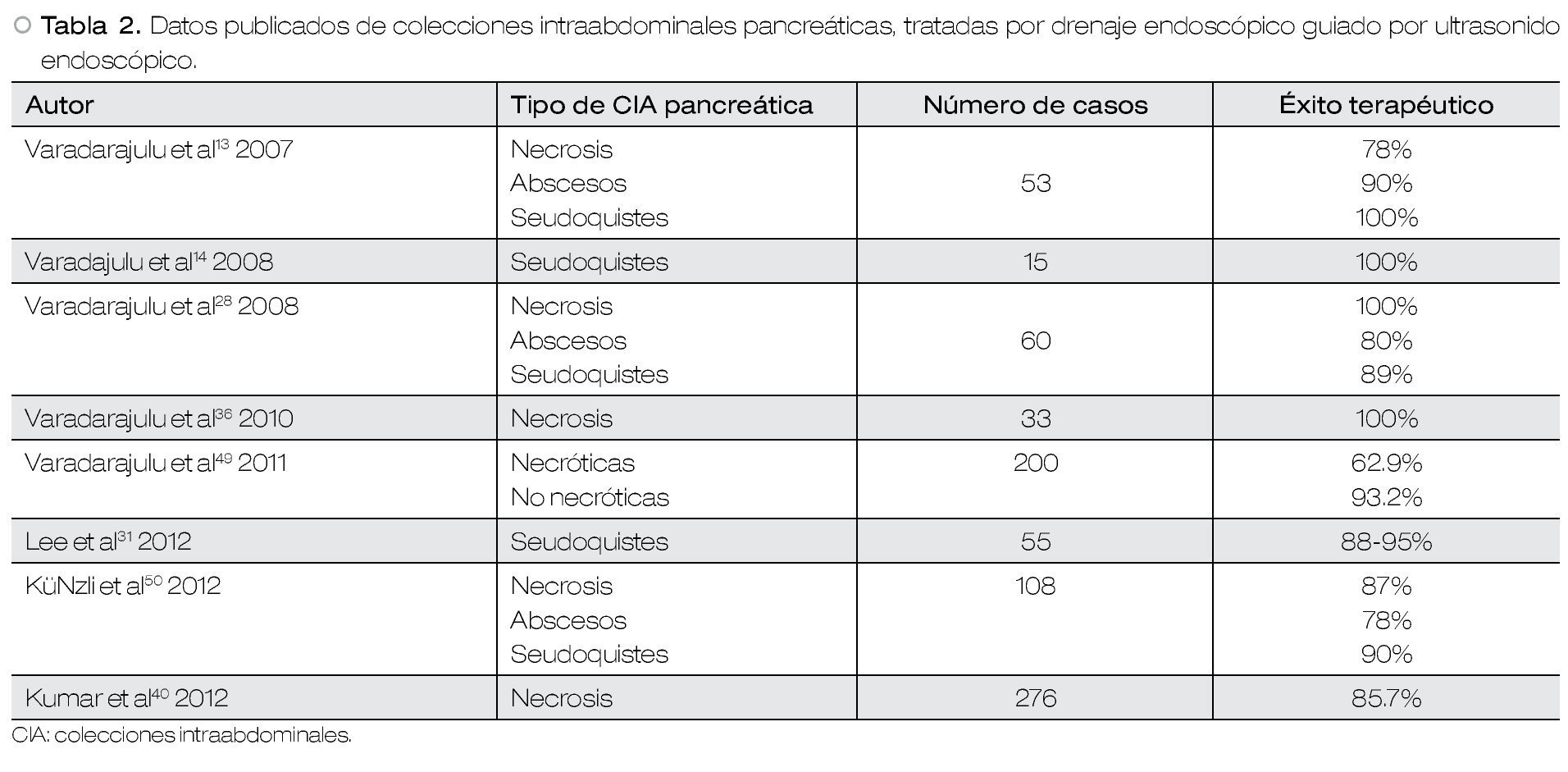
El éxito terapéutico del DE guiado por USE en CIA pancreáticas, depende si se trata de un seudoquiste o una necrosis pancreática.
Con respecto a los seudoquistes, el éxito terapéutico es reportado entre el 80% a 100% de los casos.29 En un estudio con reporte de 14 casos de pacientes con seudoquiste quienes fueron tratados con DEUSE, se reporta un éxito terapéutico, complicaciones y mortalidad en 94%,1.5% y 0% de los casos, respectivamente.37 Cuando se compara la cistogastrostomía endoscópica vs. la quirúrgica, no hay diferencias significativas en el éxito técnico, terapéutico, complicaciones o en la necesidad de reintervenciones entre ambos abordajes; pero al compararlos con respecto a costos y estancias hospitalarias, dichos rubros son significativamente menores con el tratamiento endoscópico.2 Por lo anterior, se concluye que cuando esté disponible el DE-USE, éste deber ser el tratamiento de primera línea de los seudoquistes pancreáticos.2
En cambio, el éxito terapéutico del DE-USE de la necrosis pancreática es reportado en aproximadamente el 70% a 86%% de los casos.29 La necrosectomía endoscópica ha demostrado disminuir en forma significativa la necesidad de cirugía, cuando se compara con drenaje percutáneo de este tipo de CIA.38 Cuando se han comparado la necrosectomía endoscópica vs. necrosectomía quirúrgica, el éxito técnico y terapéutico, así como las complicaciones, no tuvieron diferencias significativas entre ambos grupos. Pero de igual manera que el abordaje endoscópico de los seudoquistes, la necrosectomía endoscópica genera estancias hospitalarias más cortas y menos costos en honorarios médicos, en comparación con la necrosectomía quirúrgica.39 En un meta-análisis con el objetivo primario de evaluar los resultados de la necrosectomía endoscópica, el cual incluyó nueve estudios con 276 pacientes, reporta que el éxito terapéutico fue de hasta en el 85.7% de los casos, con una frecuencia de 21.9% de complicaciones. Por lo tanto, los autores de este estudio concluyen que, el DE-USE es efectivo y tiene un perfil de complicaciones aceptable.40 En un estudio reciente por un grupo de investigación holandés, en el cual se incluyó a 20 pacientes con necrosis infectada quienes fueron aleatorizados a necrosectomía endoscópica y quirúrgica, se reporta una disminución importante en la aparición de falla orgánica múltiple (0% vs. 42%; p=0.04) y desarrollo de fístulas pancreáticas (10% vs. 58%; p=0.03) en el grupo que fue sometido a necrosectomía endoscópica.41
Cuando el DE-USE de CIA pancreáticas se compara con el drenaje percutáneo, tampoco se encuentran diferencias significativas con respecto a éxito técnico, terapéutico y frecuencia de complicaciones. Pero el DE-USE se asocia a estancias hospitalarias más cortas.42
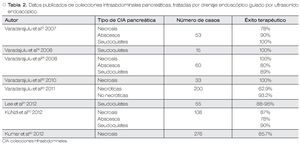
Con respecto a las complicaciones relacionadas al procedimiento, en un estudio por Varadarajulu y colaboradores con 148 pacientes sometidos a DE-USE de CIA pancreáticas, ocurrieron las siguientes complicaciones: perforación en el sitio de drenaje en dos pacientes con un seudoquiste en el proceso uncinado (1.3%), sangrado en un paciente con una coagulopatía de base (0.67%), migración de prótesis (0.67%) e infección (2.7%); por lo que los autores concluyen que las complicaciones son raras durante este procedimiento y pueden ser manejadas exitosamente en la mayoría de los pacientes43 (Tabla 2).
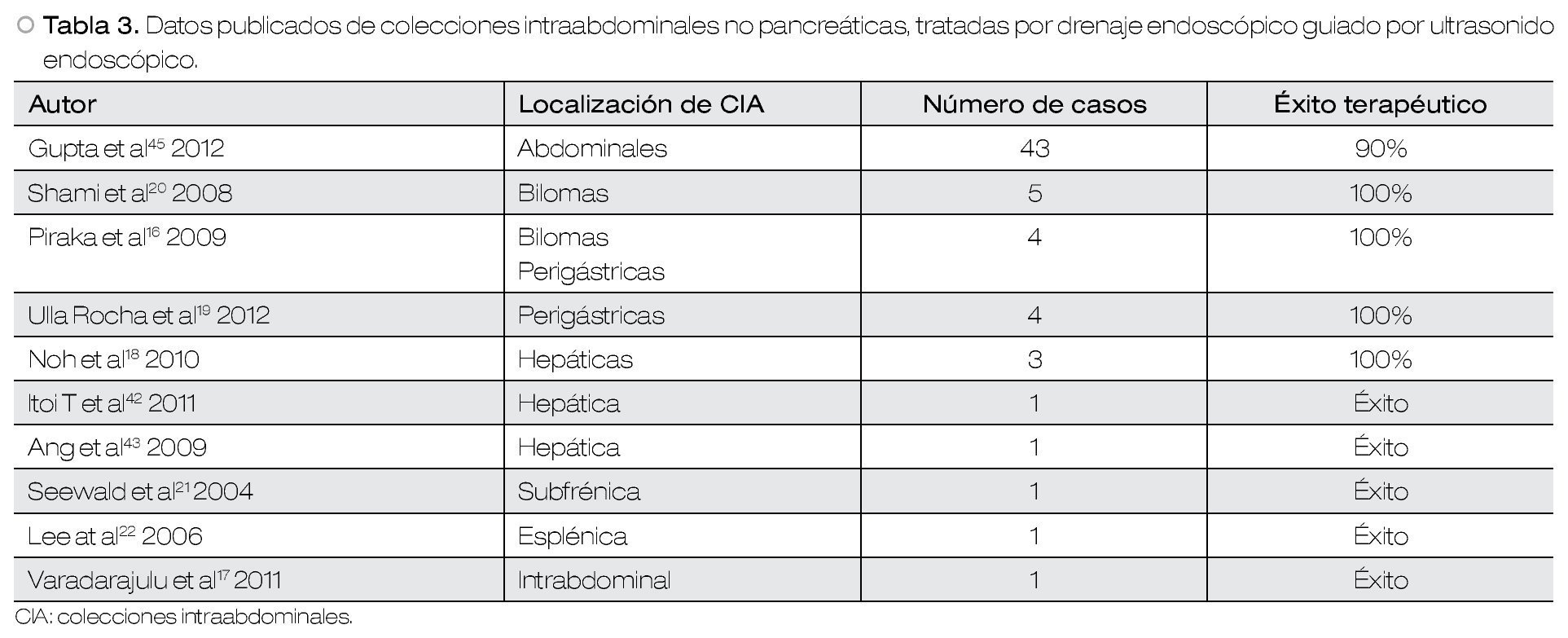
CIA no pancreáticas
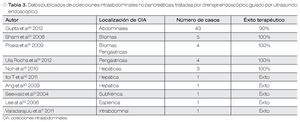
La mayor parte de la literatura respecto al DE-USE de CIA, corresponde a colecciones pancreáticas. Sin embargo, ha aumentado la evidencia en casos de CIA no pancreáticas, principalmente abscesos posquirúrgicos. Otras CIA no pancreáticos tratadas por DE, incluyen abscesos asociados a diverticulitis y a enfermedad de Crohn, además abscesos hepáticos de diferente etiología. Este abordaje se ha asociado con éxitos terapéuticos entre 75% a 100% de los casos, con pocas complicaciones asociadas.16-19,21,22,44,45 En un estudio de una serie de cinco pacientes con biloma fueron drenados endoscópicamente con un éxito terapéutico del 100% y con 0% de recurrencia; por lo cual se considera un procedimiento seguro que parece ser una buena alternativa terapéutica al drenaje percutáneo o quirúrgico.20 El estudio con la mayor cantidad de pacientes con CIA no pancreáticas drenadas con DE guiado por USE, incluyó a 43 pacientes con colecciones posquirúrgicas (pancreáticas, bariátricas, esplenectomía, resección hepática, cirugía renal), el cual obtuvo un 90% de éxito terapéutico con una frecuencia de 14.6% de complicaciones como sangrado (n=4), migración de prótesis (n=2) y una fístula colónica (n=1). Los autores llegan a la conclusión que el DEUSE de CIA posquirúrgicas, es un método terapéutico exitoso.46 Este método es particularmente efectivo en pacientes críticamente enfermos. En pacientes con trasplante hepático, el DE-USE de dicha CIA obtuvo excelentes resultados clínicos17 (Tabla 3).
Es claro que se necesitan estudios comparativos entre el DE-USE y los métodos terapéuticos convencionales, como el quirúrgico y el percutáneo, en el tratamiento de CIA no pancreáticas para definir claramente su papel dentro del abordaje terapéutico de estas lesiones.46 Los resultados publicados hasta el momento orientan a que el DE-USE es una buena alternativa para las colecciones no pancreáticas, y aquellas secundarias a complicaciones de pancreatitis (Tabla 4).
Limitaciones técnicas del procedimiento
Las limitaciones técnicas del DE-USE de una CIA son características propias del ecoendoscopio y la ausencia de accesorios diseñados propiamente para el procedimiento.
En primer lugar, dos características importantes del ecoendoscopio que pueden ser limitantes durante el procedimiento, son el diámetro del canal de trabajo y la visión endoscópica oblicua del instrumento. El diámetro del canal recomendado para el paso de accesorios es de ≥ 3.7 mm, el cual permite el uso de accesorios como prótesis de 10F, sin la necesidad de intercambiar el endoscopio.23 Con respecto a la visión endoscópica oblicua del ecoendoscopio, ésta puede ser una limitante durante la creación de la fístula entre el TGI y la CIA, cuando hay que manipular los accesorios necesarios con este ángulo de visión endoscópica. Por tal motivo, se realizó el diseño de un prototipo de ecoendoscopio de visión frontal marca Olympus® (Olympus Medical System Corporation, Center Valley, PA, USA), el cual permite la inserción de accesorios de forma frontal en la fístula; sin embargo en un estudio comparativo con el ecoendoscopio estándar, no demostró diferencias con respecto a facilidad técnica, seguridad y eficacia del tratamiento. Algo importante a mencionar es que este ecoendoscopio de visión frontal tenía algunas debilidades técnicas, como no contar con elevador, así como el escaneo endosonográfico era más limitado.47
Por último, la mayoría de los accesorios utilizados en el procedimiento no han sido diseñados para el mismo, un claro ejemplo es el uso de asas para polipectomía, pinzas de biopsia, cepillos para biopsia en la realización de necrosectomía endoscópica. También faltan accesorios que permitan la creación y mantenimiento de una fístula de mayor tamaño, así como aquellos accesorios nuevos que faciliten la introducción de prótesis en las CIA.15 Se ha intentado modificar lo anterior con el diseño de algunos dispositivos que faciliten el procedimiento como es el caso del dispositivo NAVIX®, el cual consta de un trocar de diámetro de 19G, que permite el paso de un balón de dos estaciones (uno de anclaje dentro de la CIA y otro de dilatación), y que cuenta con dos puertos para guías calibre 0.035" y prótesis plásticas de diámetro de 10F. En un estudio con nueve pacientes con CIA pancreáticas (siete seudoquistes y dos necrosis) utilizando este dispositivo, se logró un éxito técnico del 100% y éxito terapéutico del 89% de los casos.48
Conclusiones
El DE guiado por USE es una alternativa terapéutica efectiva y segura en las CIA pancreáticas. Con respecto a las CIA no pancreáticas, los datos preliminares son prometedores y su perfil de seguridad parece ser excelente. Actualmente, el DE-USE de CIA no pancreáticas puede ser considerado como una terapia alternativa efectiva, en pacientes críticamente enfermos no candidatos a tratamiento convencional.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
No se recibió patrocinio para llevar a cabo este artículo.
Correspondencia:
Dr. Félix Ignacio Téllez Ávila.
Departamento de Endoscopia, Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán".
Vasco de Quiroga N° 15, Colonia Sección XVI, Delegación Tlalpan, C.P. 14000, México D.F., México.
Correo electrónico: felixtelleza@gmail.com