La interpretación de los biomarcadores de función tiroidea durante la gestación requiere de intervalos de referencia específicos para dicha etapa y estratificados por trimestre, dados los cambios fisiológicos que durante el embarazo repercuten en la fisiología de la glándula tiroidea. Los objetivos de este estudio fueron: a) establecer los intervalos de referencia de tirotropina (TSH) y tiroxina no unida a proteína (T4 libre) durante el primer trimestre de gestación y b) establecer la prevalencia de enfermedad tiroidea autoinmunitaria en mujeres embarazadas residentes en Cartagena (Murcia).
Pacientes y métodoSe incluyó a 441 gestantes entre las semanas de gestación 11–13 en el estudio. En todas ellas se obtuvo una muestra de sangre para la medida de TSH, T4 libre y anticuerpos antitiroideos. La población de referencia para la obtención de los intervalos de referencia de TSH y T4 libre estuvo formada por 400 gestantes sin autoinmunidad tiroidea ni enfermedad tiroidea conocida.
ResultadosSe demostró la presencia de autoinmunidad tiroidea en 23 gestantes (5,2%), que presentaron valores de TSH mayores que los de las gestantes sin autoinmunidad tiroidea. Los intervalos de referencia fueron los siguientes: TSH de 0,130–3,710mUI/l y T4 libre de 0,89–1,50ng/dl. Estos intervalos de referencia fueron diferentes a los empleados en nuestro laboratorio para mujeres no embarazadas.
ConclusionesLos intervalos de referencia obtenidos son una herramienta útil en la valoración de la función tiroidea de la gestante durante las semanas de gestación 11–13. En cualquier caso, dicha interpretación requiere de intervalos obtenidos a partir de una población de referencia sin autoinmunidad tiroidea y con la metodología empleada habitualmente para la medida de estos parámetros.
The physiological changes that occur during pregnancy affect the physiology of the thyroid gland. Consequently, interpretation of thyroid function markers during pregnancy requires trimester-specific reference intervals. The aims of our study were to: 1) establish first-trimester reference intervals for biochemical markers of thyroid function [thyroid-stimulating hormone (TSH) and free thyroxine (T4)] and 2) to establish the prevalence of autoimmune thyroid disease in pregnant women resident in Cartagena (Murcia, Spain).
Patients and methodA total of 441 women between weeks 11 and 13 of pregnancy were included in this study. A blood sample was extracted from all women to measure TSH, free T4 and antithyroid antibodies. Reference intervals for TSH and free T4 were determined in 400 pregnant women without autoimmune thyroid disease or known thyroid disease.
ResultsAutoimmune thyroid disease was detected in 23 pregnant women (5.2%) who showed TSH levels higher than those in pregnant women without thyroid autoimmunity. First-trimester reference intervals were as follows: TSH: 0.130–3.710mUI/L; free T4: 0.89–1.50ng/dL. These reference intervals differed from the non-pregnant reference intervals used in our laboratory.
ConclusionsThe reference intervals established are useful to evaluate thyroid function in women between 11 and 13 weeks of pregnancy. Interpretation of thyroid function requires intervals established in a reference population without autoimmune thyroid disease and with the methodology usually used to analyze these markers.
El funcionamiento adecuado de la glándula tiroidea es esencial en todas las etapas de la vida, incluyendo la gestación y el desarrollo fetal, especialmente durante el primer trimestre, ya que hasta las semanas de gestación (SG) 10–12 el aporte de hormonas tiroideas es completamente dependiente de la madre1. La disfunción tiroidea materna se asocia a mayor morbilidad materna y morbimortalidad perinatal2. Así, el incremento de tirotropina (TSH) se asocia a un incremento del riesgo de parto pretérmino, a un desprendimiento prematuro de la placenta, a la muerte fetal y a un deterioro del desarrollo neurológico del hijo3–5, y la hipotiroxinemia maternal, tanto en las etapas precoces como en las etapas finales del embarazo, se asocia a alteraciones en el desarrollo psicomotor del niño6–8. Respecto al hipertiroidismo, menos frecuente durante la gestación, su forma clínica afecta al desarrollo de la gestación (incremento del riesgo de aborto, prematuridad y preeclampsia)9 y se asocia a consecuencias adversas tanto para la madre (fallo cardíaco congestivo, tormenta tiroidea e incluso muerte) como para el feto (retraso del crecimiento, malformaciones congénitas e incluso muerte fetal)1. Finalmente, la presencia de anticuerpos antitiroideos incrementa el riesgo de hipotiroidismo en gestantes eutiroideas1, así como de aborto, prematuridad y desarrollo de tiroiditis posparto10,11. Todas estas razones justifican la importancia de los programas de cribado y control durante la gestación de la función tiroidea, en la que los test bioquímicos juegan un papel esencial12.
Recientemente, la Sociedad Española de Endocrinología y Nutrición ha recomendado el cribado universal de la función tiroidea durante el período pregestacional o el primer trimestre13. De forma similar, esta recomendación ya había sido recogida anteriormente por diversas sociedades internacionales de endocrinología, de bioquímica y de ginecología y obstetricia, que aconsejan el cribado universal14–16 o selectivo en gestantes de riesgo17,18.
El diagnóstico de la disfunción tiroidea se basa en la medida de los parámetros bioquímicos de laboratorio. Sin embargo, la interpretación de los biomarcadores de función tiroidea se dificulta durante la gestación, dado que esta comporta una serie de cambios fisiológicos que repercuten en la fisiología normal de la glándula tiroidea, especialmente el incremento de la concentración sérica de la proteína transportadora de hormonas tiroideas, cuya síntesis es estimulada por los estrógenos, y el aumento de la concentración sérica de gonadotropina coriónica humana. Por tanto, una evaluación correcta de la función tiroidea durante la gestación requiere de intervalos de referencia específicos para la gestación estratificados por trimestres17,19,20 y obtenidos con la metodología habitualmente empleada en cada laboratorio15,21.
Los objetivos de este estudio fueron establecer los intervalos de referencia de TSH y tiroxina no unida a proteína (T4 libre) en mujeres gestantes durante el primer trimestre de gestación con la metodología empleada en nuestro laboratorio y determinar la prevalencia de enfermedad tiroidea autoinmunitaria en mujeres gestantes atendidas en nuestra área de salud.
Material y métodosLa población de estudio estuvo formada por mujeres gestantes, entre las SG 11–13, mayoritariamente de origen caucásico, que acudieron al Servicio de Análisis Clínicos del Hospital Universitario Santa María del Rosell (Cartagena, Murcia) para cribado prenatal. En todas ellas se extrajo una muestra de sangre venosa para la medida de TSH, T4 libre y anticuerpos antitiroideos (anticuerpos antiperoxidasa (Ac-TPO) y anticuerpos antitiroglobulina (Ac-Tg) en el suero. La edad gestacional fue evaluada ecográficamente mediante ultrasonidos.
Los individuos de referencia para el establecimiento de los intervalos fueron seleccionados utilizando los siguientes criterios de exclusión:
- •
Autoinmunidad tiroidea definida por Ac-TPO y/o Ac-Tg positivos. También se excluyó a aquellas con resultados no concluyentes.
- •
Antecedentes personales conocidos de disfunción tiroidea clínica o subclínica.
- •
Bocio visible o palpable.
- •
Toma de medicamentos que afectan a la función tiroidea.
Las hormonas TSH y T4 libre fueron determinadas mediante electroquimioluminiscencia en los autoanalizadores Cobas 6000 (módulo e 601) y Modular Analytics (módulo E170) de Roche Diagnostics®, cuya transferibilidad de resultados fue previamente comprobada. La sensibilidad analítica para TSH y T4 libre es de 0,005mUI/l y de 0,023ng/dl, respectivamente, y la sensibilidad funcional para TSH es de 0,014mUI/l. El coeficiente de variación para la medida de TSH en concentraciones de 0,035, 0,151 y 3,66mUI/l es del 7,2, el 3,2 y el 3,3%, respectivamente. Para la medida de T4 libre el coeficiente de variación en concentraciones de 1,16, 1,39 y 2,79ng/dl es del 2,7, el 2,6 y el 3,6%, respectivamente. Los intervalos de referencia empleados en nuestro laboratorio para no gestantes son los siguientes: TSH de 0,27–4,2mUI/l y T4 libre de 0,93–1,70ng/dl. La determinación de Ac-TPO y Ac-Tg se realizó mediante enzimoinmunoanálisis en un autoanalizador InmunoCap® de Pharmacia. Para la valoración de los resultados se emplearon los límites recomendados por el fabricante, considerándose como positivos valores iguales o superiores a 100 y a 344UI/ml para Ac-TPO y Ac-Tg, y como resultados negativos valores inferiores a 60 y a 280UI/ml para Ac-TPO y Ac-Tg, respectivamente.
Análisis estadísticoPara el análisis de los datos se utilizó el programa estadístico SPSS v. 15.0. Para comprobar la normalidad de la distribución de TSH y T4 libre se empleó el test de Kolmogorov-Smirnov. Para la detección de posibles diferencias en los valores de los test de función tiroidea según la SG se emplearon test paramétricos (ANOVA) o no paramétricos (Kruskal-Wallis) en función del tipo de distribución de las variables por comparar. Las variables se expresan como media (desviación estándar) o mediana (amplitud intercuartílica) en función del tipo de distribución. Se consideró como estadísticamente significativa una p<0,05. Se definió el intervalo de referencia para cada uno de los test de función tiroidea como el intervalo comprendido entre los percentiles 2,5–97,515–22.
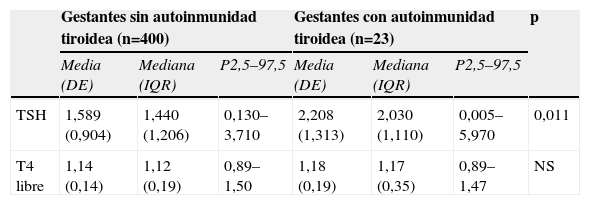
ResultadosDe las 441 gestantes incluidas en el estudio (edad mediana: 30 años [7]; límites: 15–46 años) se confirmó la presencia de autoinmunidad tiroidea, definida por Ac-TPO y/o Ac-Tg positivos, en 23 mujeres (el 5,2%; edad media de 30,8 años [4,2]; límites: 23–40 años): 3 mujeres fueron positivas para Ac-TPO y Ac-Tg, 16 para Ac-TPO y 4 para Ac-Tg. Los resultados de los test de función tiroidea en gestantes sin autoinmunidad y con autoinmunidad tiroidea se muestran en la tabla 1. Cuando se compararon dichos resultados las concentraciones de TSH fueron mayores en las gestantes con autoinmunidad tiroidea, no observándose diferencias en las concentraciones de T4 libre. No se observó diferencia significativa en la edad entre ambos grupos.
Resultados de los test de función tiroidea en gestantes con y sin autoinmunidad tiroidea
| Gestantes sin autoinmunidad tiroidea (n=400) | Gestantes con autoinmunidad tiroidea (n=23) | p | |||||
| Media (DE) | Mediana (IQR) | P2,5–97,5 | Media (DE) | Mediana (IQR) | P2,5–97,5 | ||
| TSH | 1,589 (0,904) | 1,440 (1,206) | 0,130–3,710 | 2,208 (1,313) | 2,030 (1,110) | 0,005–5,970 | 0,011 |
| T4 libre | 1,14 (0,14) | 1,12 (0,19) | 0,89–1,50 | 1,18 (0,19) | 1,17 (0,35) | 0,89–1,47 | NS |
DE: desviación estándar; NS: no significativo; P: percentil, T4 libre: tiroxina no unida a proteína; TSH: tirotropina.
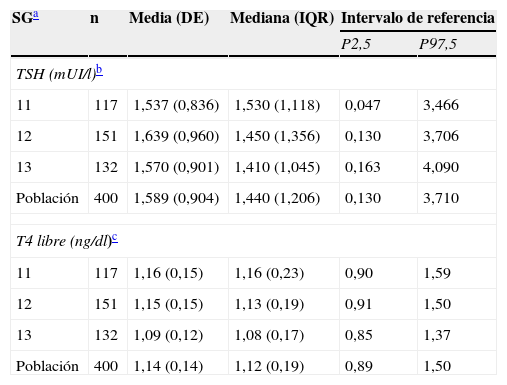
Para la obtención de los intervalos de referencia, 41 mujeres fueron excluidas: 23 (5,1%) por presentar resultados positivos en la determinación de anticuerpos antitiroideos, 8 (1,8%) por presentar resultados no concluyentes en la determinación de anticuerpos antitiroideos y 10 (2,2%) por presentar antecedentes personales de disfunción tiroidea. Las restantes 400 mujeres (edad mediana de 30 años [8]; límites: 15–46 años) constituyeron la población de referencia (117 [29,3%] en la SG 11, 151 [37,8%] en la SG 12 y 132 [33%] en la SG 13). No se observó diferencia significativa en la edad de las gestantes en función de la SG. El estudio de comparación de medias no mostró diferencias significativas en la concentración de TSH en función de la edad gestacional; sin embargo, sí se detectó una variación significativa en la concentración de T4 libre según la SG, con un descenso de ésta al avanzar la edad gestacional. El análisis de comparación intergrupos para la concentración de T4 libre demostró una diferencia estadísticamente significativa entre las semanas 13 y las semanas 11–12, no observándose diferencia entre estas 2 últimas (tabla 2). Se obtuvieron los siguientes intervalos de referencia: TSH de 0,130–3,710mUI/l y T4 libre de 0,89–1,50ng/dl. Las medidas de centralización y dispersión de TSH y T4 libre se muestran en la tabla 2.
Medidas de centralización y dispersión e intervalos de referencia de los test de función tiroidea
| SGa | n | Media (DE) | Mediana (IQR) | Intervalo de referencia | |
| P2,5 | P97,5 | ||||
| TSH (mUI/l)b | |||||
| 11 | 117 | 1,537 (0,836) | 1,530 (1,118) | 0,047 | 3,466 |
| 12 | 151 | 1,639 (0,960) | 1,450 (1,356) | 0,130 | 3,706 |
| 13 | 132 | 1,570 (0,901) | 1,410 (1,045) | 0,163 | 4,090 |
| Población | 400 | 1,589 (0,904) | 1,440 (1,206) | 0,130 | 3,710 |
| T4 libre (ng/dl)c | |||||
| 11 | 117 | 1,16 (0,15) | 1,16 (0,23) | 0,90 | 1,59 |
| 12 | 151 | 1,15 (0,15) | 1,13 (0,19) | 0,91 | 1,50 |
| 13 | 132 | 1,09 (0,12) | 1,08 (0,17) | 0,85 | 1,37 |
| Población | 400 | 1,14 (0,14) | 1,12 (0,19) | 0,89 | 1,50 |
DE: desviación estándar; P; percentil; SG: semana de gestación; T4 libre: tiroxina no unida a proteína; TSH: tirotropina.
Los cambios fisiológicos de la función tiroidea durante el embarazo pueden dificultar la interpretación de los resultados de TSH y T4 libre; a ello se unen la falta de consenso respecto a qué punto de corte de TSH debe emplearse para definir el hipotiroidismo durante la gestación así como por debajo de qué concentración de T4 libre se define la hipotiroxinemia. La National Academy of Clinical Biochemistry15 y más recientemente la Sociedad Española de Endocrinología y Nutrición13 recomiendan un punto de corte de TSH en el primer trimestre de 2,5mUI/l para el diagnóstico y el seguimiento del hipotiroidismo. Respecto a la T4 libre, la única recomendación es la necesidad de establecer intervalos de referencia según la metodología usada para su medición13. Sin embargo, otros autores recomiendan el empleo de intervalos de referencia estratificados por trimestre y generados en la población sobre la que van a ser aplicados17. Aunque varios estudios proporcionan estos intervalos de referencia23–32, pocos han sido obtenidos con la metodología empleada en nuestro estudio26,28 y con una población semejante a la evaluada habitualmente en nuestro laboratorio.
En este estudio hemos determinado la prevalencia de enfermedad tiroidea autoinmunitaria en mujeres gestantes definida por criterios de laboratorio, y hemos obtenido intervalos de referencia de TSH y T4 libre para gestantes en las SG 11–13 de acuerdo a los criterios establecidos por la National Academy of Clinical Biochemistry15.
La prevalencia de enfermedad tiroidea autoinmunitaria en nuestra población fue del 5,2%, menor que la descrita por Stricker et al24 (19,4%), Pearce et al29 (12,4%) y más recientemente por Bocos et al31 (14,77%), obtenida en una población con una composición étnica similar a la nuestra. De forma similar a otros estudios24,29,31, la presencia de anticuerpos antitiroideos se asoció a valores aumentados de TSH, lo que demuestra la necesidad de excluir a gestantes con autoinmunidad tiroidea para la obtención de los intervalos de referencia15.
Los intervalos de referencia obtenidos para TSH y T4 libre en gestantes durante el primer trimestre difieren de los utilizados en nuestro laboratorio en población adulta no gestante, lo que tiene gran trascendencia en el cribado y el control de la disfunción tiroidea de la gestante para evitar una clasificación incorrecta. El percentil 97,5 de TSH en nuestro estudio correspondió a una concentración de 3,71mUI/l, superior al punto de corte de 2,5mUI/l recomendado en algunas guías13,15. Además, dichos intervalos difieren de los de estudios recientes en Suiza24, Australia27, Estados Unidos29 y España31. Dichas diferencias son atribuibles tanto al uso de tecnología diferente a la empleada en nuestro estudio como a la inclusión en todos ellos de gestantes en estadios más precoces del embarazo, dado que el efecto tirotrópico de la gonadotropina coriónica humana condiciona la concentración de TSH. Igualmente, en otro estudio reciente en India28, con la misma metodología que la utilizada en el nuestro, el intervalo de referencia obtenido fue más amplio (0,6–5,0mUI/l). En este caso, las diferencias serían atribuibles a la población de referencia, de diferente composición étnica; estudios anteriores ya han descrito diferencias entre grupos étnicos en los test bioquímicos de función tiroidea32,33. Respecto a los valores de T4 libre, se observó un descenso con la edad gestacional durante el primer trimestre, de forma similar a la descrita en otros estudios24,31, y los límites del intervalo de referencia obtenido fueron superiores a los empleados para no gestantes, circunstancia que, al igual que en el caso de la TSH, es compatible con los cambios fisiológicos que se producen en la función tiroidea durante el embarazo. Es destacable que los resultados de nuestro estudio fueron similares a los descritos en un estudio reciente en mujeres en la misma edad gestacional que empleó la misma tecnología que en nuestro laboratorio26 (0,85–1,48ng/dl). La variabilidad en los intervalos de referencia obtenidos para TSH y T4 libre refleja la importancia de la población de referencia en la que se obtienen aquellos, así como de la metodología usada.
Nuestro estudio presenta como limitación principal la falta de disponibilidad de datos respecto al estado nutricional del yodo en gestantes en nuestra área geográfica, dado que este condicionaría los resultados del estudio. Análisis recientes realizados en otras zonas de España, algunas próximas a la Comunidad Autónoma de Murcia34, concluyen que la ingesta de yodo de las gestantes es baja, alejada de cifras de yoduria indicativas de yodosuficiencia y que el déficit de yodo en nuestro país sigue siendo un problema sanitario grave no corregido a pesar de las recomendaciones vigentes35.
En conclusión:
- •
Los intervalos de referencia obtenidos en este estudio contribuyen a una interpretación correcta de los test bioquímicos de función tiroidea durante el primer trimestre en la población gestante evaluada en nuestra área de salud. Consideramos que el empleo de un punto de corte de 2,5mUI/l para definir el hipotiroidismo es una estrategia conservadora sólo aplicable si no se dispone de intervalos de referencia generados a partir de la población que es evaluada y con la metodología empleada en cada laboratorio, y cuyo uso tendría como consecuencia el incremento del número de gestantes clasificadas como hipotiroideas y, consecuentemente, el tratamiento incorrecto de éstas.
- •
La obtención de intervalos de referencia de TSH en gestantes requiere de la exclusión de aquellas con autoinmunidad tiroidea, asociada a concentraciones aumentadas de TSH.
Los autores declaran no tener ningún conflicto de intereses.