La cirugía transesfenoidal se considera, a día de hoy, el tratamiento de primera elección en la enfermedad de Cushing. La curación inicial se consigue en aproximadamente el 70-85% de los casos, pero entre los pacientes con remisión inicial el 10-15% sufrirá una recidiva meses o años después. La irradiación de la hipófisis se ha utilizado como tratamiento de la enfermedad de Cushing desde hace muchos años. Hoy en día se suele considerar un tratamiento de segunda línea, cuando la enfermedad persiste o recidiva tras la cirugía. En este trabajo revisamos las vías de abordaje quirúrgico, las tasas de curación comunicadas por diferentes grupos, los factores pronósticos y las complicaciones quirúrgicas más habituales, así como las distintas técnicas disponibles para la irradiación de la hipófisis, y los resultados y las complicaciones obtenidos hasta la fecha con cada una de ellas en pacientes afectos de enfermedad de Cushing.
Transsphenoidal surgery is currently considered the treatment of choice for Cushing's disease. Initial remission is achieved in approximately 70-85%, but 10-15% of patients with remission will suffer a recurrence months or years later. Pituitary irradiation has been used as a therapeutic tool for many years. Nowadays, this option is considered a second-line treatment, to be used when there is postsurgical persistence or recurrence of the disease. The present article reviews the surgical approaches, remission rates reported by different groups, prognostic factors, and the most frequent complications after transsphenoidal surgery. We also review the different techniques that can be used for pituitary irradiation, as well as the efficacy and morbidity reported for each of these techniques in patients with Cushing's disease.
Al plantearnos el tratamiento de un paciente con enfermedad de Cushing nos gustaría contar con una opción terapéutica que consiguiera eliminar de forma definitiva la secreción excesiva de cortisol y corticotropina (ACTH) y, con ello, los síntomas, signos y complicaciones propios de la enfermedad, que eliminara la masa tumoral y los síntomas por compresión que pudiera ocasionar, todo ello evitando la insuficiencia suprarrenal o la deficiencia de otras hormonas adenohipofisarias, y con una baja tasa de complicaciones o efectos secundarios. La cirugía transesfenoidal sigue siendo, a día de hoy, el tratamiento de primera elección en la enfermedad de Cushing porque puede llegar a cumplir todos estos objetivos, aunque no siempre lo consigue, y un porcentaje no despreciable de pacientes sufren la persistencia o la reaparición de la enfermedad tras la intervención.
Técnica quirúrgicaLa vía transesfenoidal es el abordaje quirúrgico menos agresivo de la glándula hipofisaria, ya que evita lesionar las estructuras cerebrales. Hasta 1970, cuando la introducción del microscopio quirúrgico permitió una detallada visión de la glándula y las estructuras adyacentes a través de una vía de entrada estrecha, el abordaje quirúrgico de la hipófisis se llevaba a cabo por vías transcraneales (subfrontal, pterional), que aún son necesarias cuando se trata de resecar tumores de gran tamaño con expansiones superiores, anteriores o laterales. La vía de entrada en la cirugía transesfenoidal permite distintas alternativas: algunos neurocirujanos realizan una incisión bajo el labio superior y rompen y desplazan el tabique nasal para acceder al seno esfenoidal, otros entran directamente a la cavidad nasal (el campo visual es más estrecho, pero se evita dañar la encía y su inervación superficial y se puede evitar el taponamiento nasal postoperatorio), o realizan un túnel submucoso sobre el tabique nasal. Desde el seno esfenoidal se incide el suelo de la silla turca hasta exponer la glándula hipofisaria1.
En la última década, la introducción del endoscopio en la cirugía transesfenoidal ha permitido una alternativa a la visión que proporciona el microscopio; el endoscopio permite entrar a través de la fosa nasal, sin disecar la mucosa, con lo que se reduce el dolor postoperatorio y la necesidad de taponamiento nasal, y permite una visión panorámica, que amplía la visión lateral (hacia el seno cavernoso) y superior. Como inconvenientes, resta maniobrabilidad al cirujano, ya que una mano se reserva al manejo del endoscopio, e impide la visión estereoscópica que sí ofrece el microscopio binocular. Los resultados publicados parecen similares a los de otras series en cuanto a tasa de remisión y complicaciones, aunque no se dispone de seguimiento a largo plazo2,3. Probablemente, la combinación de ambas técnicas permita rentabilizar las ventajas de cada una de ellas en estos próximos años.
La actuación quirúrgica ideal es aquella que consigue la extirpación completa del tejido tumoral y respeta la hipófisis sana. Un campo quirúrgico amplio es deseable cuando no se ha conseguido la identificación preoperatoria del adenoma y el neurocirujano tiene que explorar toda la glándula en su busca. Cuando no lo identifica, puede realizar una hemihipofisectomía, eligiendo el lado con mayor secreción de ACTH en el cateterismo de senos petrosos inferiores si éste se ha realizado o el lado contrario al tallo hipofisario cuando éste se aleja de la línea media en las imágenes de la resonancia magnética (RM), o una hipofisectomía total, que prácticamente garantiza la curación, pero a costa de un panhipopituitarismo asegurado, por lo que se suele reservar para pacientes mayores.
ResultadosNo es fácil hablar de porcentajes de remisión de la cirugía transesfenoidal en la enfermedad de Cushing.
La primera dificultad es que los resultados son claramente mejores en los centros con mayor experiencia4, de tal manera que puede que obtengamos resultados peores a lo esperado si trabajamos con neurocirujanos con menor experiencia que los de grupos que publican sus resultados, es decir menores tasas de remisión y más complicaciones. También nos enfrentamos a la dificultad para definir la remisión ya que, entre las numerosas series de pacientes con enfermedad de Cushing operados por vía transesfenoidal que se han publicado, hay grandes diferencias en las determinaciones hormonales realizadas y sus puntos de corte, en el momento de realizar dichas determinaciones y en el tiempo de seguimiento, por lo que las comparaciones se hacen difíciles. Además, al no ser homogénea la definición de remisión, tampoco pueden ser comparables los datos relativos a las recidivas posteriores5.
El criterio de remisión más utilizado en las publicaciones recientes es la obtención de un cortisol plasmático < 5 μg/dl o a 1,8 μg/dl6-8, pero no está claro el mejor momento para la determinación9,10 ni cuánto influye la profilaxis de la insuficiencia adrenal postoperatoria con glucocorticoides11. Algunos grupos utilizan cobertura periquirúrgica con glucocorticoides y disminuyen progresivamente la dosis hasta suspenderlo en 7-10 días y generalmente miden el cortisol 24 h después de la última dosis7. Otros no utilizan glucocorticoides salvo que aparezcan signos de insuficiencia suprarrenal, y miden el cortisol a las 24-48 h de la intervención12,13. Newell-Price11 defiende esta última estrategia alegando que de esta manera un cortisol indetectable reflejará realmente la ausencia de secreción de ACTH por parte de las células corticotropas tumorales (y, por lo tanto, un excelente pronóstico) y no su inhibición por los glucocorticoides administrados. Sin embargo, un trabajo que compara ambas estrategias en un mismo centro hospitalario concluye que el cortisol presenta, a los 10 días de la intervención, mejor correlación con la persistencia o la remisión de la enfermedad14. En cualquier caso, la mayoría de los pacientes que mantienen la remisión a largo plazo han pasado previamente por una fase de insuficiencia suprarrenal, de duración variable, habitualmente unos 10-20 meses, durante la cual el tratamiento sustitutivo con glucocorticoides se hace imprescindible. Es lógico que aparezca esta insuficiencia suprarrenal al resecar el adenoma corticotropo, pues las células corticotropas sanas han permanecido inhibidas por el exceso de cortisol durante la fase activa de la enfermedad, y tardan en recuperarse, como ocurre tras el consumo prolongado de glucocorticoides. En el otro extremo están los pacientes no curados, fáciles de identificar, ya que presentan todas las características clínicas y bioquímicas propias de la enfermedad (pérdida del ritmo circadiano, cortisol libre urinario elevado, ausencia de supresión con dosis bajas de dexametasona, etc.). Pero entre esos dos extremos quedan muchos pacientes con cortisol plasmático detectable, con mejoría o desaparición de las manifestaciones clínicas del síndrome, y respuestas variables a las distintas pruebas de evaluación del eje hipotalamohipofisosuprarrenal. Es en este grupo donde no hay consenso para establecer a quiénes se puede considerar curados y a quiénes no.
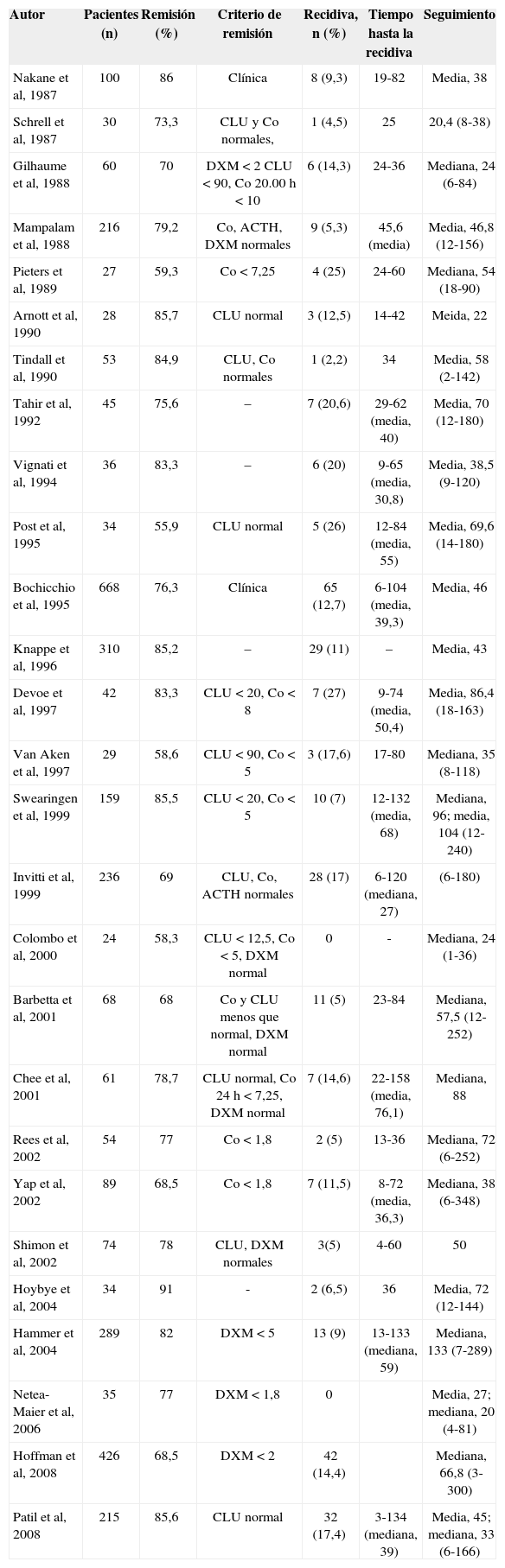
Con todas estas salvedades podemos afirmar que la remisión inicial se consigue en aproximadamente el 70-85% de los casos2,6,7,13,15-26. De estos pacientes, el 10-15% sufrirá una recidiva, que puede aparecer tan pronto como a los 6 meses de la intervención o tan tarde como 10 años después6,13,16,20,22,24,27-29. La tabla 1 recoge los resultados inmediatos y a largo plazo de numerosas series, teniendo en cuenta el criterio utilizado para definir la remisión. En niños y adolescentes, en los que la enfermedad de Cushing es una rareza, la tasa de remisión tras la cirugía desciende al 60-75%30-32.
Resultados iniciales y recidivas en distintas series de pacientes con enfermedad de Cushing sometidos a cirugía transesfenoidal y seguidos a largo plazo
| Autor | Pacientes (n) | Remisión (%) | Criterio de remisión | Recidiva, n (%) | Tiempo hasta la recidiva | Seguimiento |
| Nakane et al, 1987 | 100 | 86 | Clínica | 8 (9,3) | 19-82 | Media, 38 |
| Schrell et al, 1987 | 30 | 73,3 | CLU y Co normales, | 1 (4,5) | 25 | 20,4 (8-38) |
| Gilhaume et al, 1988 | 60 | 70 | DXM < 2 CLU < 90, Co 20.00 h < 10 | 6 (14,3) | 24-36 | Mediana, 24 (6-84) |
| Mampalam et al, 1988 | 216 | 79,2 | Co, ACTH, DXM normales | 9 (5,3) | 45,6 (media) | Media, 46,8 (12-156) |
| Pieters et al, 1989 | 27 | 59,3 | Co < 7,25 | 4 (25) | 24-60 | Mediana, 54 (18-90) |
| Arnott et al, 1990 | 28 | 85,7 | CLU normal | 3 (12,5) | 14-42 | Meida, 22 |
| Tindall et al, 1990 | 53 | 84,9 | CLU, Co normales | 1 (2,2) | 34 | Media, 58 (2-142) |
| Tahir et al, 1992 | 45 | 75,6 | – | 7 (20,6) | 29-62 (media, 40) | Media, 70 (12-180) |
| Vignati et al, 1994 | 36 | 83,3 | – | 6 (20) | 9-65 (media, 30,8) | Media, 38,5 (9-120) |
| Post et al, 1995 | 34 | 55,9 | CLU normal | 5 (26) | 12-84 (media, 55) | Media, 69,6 (14-180) |
| Bochicchio et al, 1995 | 668 | 76,3 | Clínica | 65 (12,7) | 6-104 (media, 39,3) | Media, 46 |
| Knappe et al, 1996 | 310 | 85,2 | – | 29 (11) | – | Media, 43 |
| Devoe et al, 1997 | 42 | 83,3 | CLU < 20, Co < 8 | 7 (27) | 9-74 (media, 50,4) | Media, 86,4 (18-163) |
| Van Aken et al, 1997 | 29 | 58,6 | CLU < 90, Co < 5 | 3 (17,6) | 17-80 | Mediana, 35 (8-118) |
| Swearingen et al, 1999 | 159 | 85,5 | CLU < 20, Co < 5 | 10 (7) | 12-132 (media, 68) | Mediana, 96; media, 104 (12-240) |
| Invitti et al, 1999 | 236 | 69 | CLU, Co, ACTH normales | 28 (17) | 6-120 (mediana, 27) | (6-180) |
| Colombo et al, 2000 | 24 | 58,3 | CLU < 12,5, Co < 5, DXM normal | 0 | - | Mediana, 24 (1-36) |
| Barbetta et al, 2001 | 68 | 68 | Co y CLU menos que normal, DXM normal | 11 (5) | 23-84 | Mediana, 57,5 (12-252) |
| Chee et al, 2001 | 61 | 78,7 | CLU normal, Co 24 h < 7,25, DXM normal | 7 (14,6) | 22-158 (media, 76,1) | Mediana, 88 |
| Rees et al, 2002 | 54 | 77 | Co < 1,8 | 2 (5) | 13-36 | Mediana, 72 (6-252) |
| Yap et al, 2002 | 89 | 68,5 | Co < 1,8 | 7 (11,5) | 8-72 (media, 36,3) | Mediana, 38 (6-348) |
| Shimon et al, 2002 | 74 | 78 | CLU, DXM normales | 3(5) | 4-60 | 50 |
| Hoybye et al, 2004 | 34 | 91 | - | 2 (6,5) | 36 | Media, 72 (12-144) |
| Hammer et al, 2004 | 289 | 82 | DXM < 5 | 13 (9) | 13-133 (mediana, 59) | Mediana, 133 (7-289) |
| Netea-Maier et al, 2006 | 35 | 77 | DXM < 1,8 | 0 | Media, 27; mediana, 20 (4-81) | |
| Hoffman et al, 2008 | 426 | 68,5 | DXM < 2 | 42 (14,4) | Mediana, 66,8 (3-300) | |
| Patil et al, 2008 | 215 | 85,6 | CLU normal | 32 (17,4) | 3-134 (mediana, 39) | Media, 45; mediana, 33 (6-166) |
Las recidivas se expresan en números absolutos y en porcentaje respecto al total de pacientes inicialmente curados. Los valores de cortisol libre urinario (CLU) se expresan en μg/24 h y los de cortisol plasmático (Co) en μg/dl. DXM: valores de cortisol plasmático exigidos tras la supresión con dosis bajas de dexametasona. El tiempo hasta la recidiva, así como la media o mediana de seguimiento (intervalo), se expresa en meses2,6-8,13,15,16,18-22,24,27,28,36-47.
Los resultados son peores cuando se reinterviene a un paciente por persistencia o reaparición de la enfermedad. En un análisis retrospectivo de una serie amplia el 57% de los pacientes reoperados por enfermedad de Cushing presentaron una remisión inicial, pero un 25% de ellos tuvieron recidivas tras una media de seguimiento de 31 meses33. Algunos autores han propuesto una reintervención precoz por vía transesfenoidal cuando la evaluación del paciente en el postoperatorio inmediato muestra una clara persistencia de la enfermedad. De este modo, el cirujano encontrará menos fibrosis y adherencias que si la reintervención se produce meses o años después16,34,35. Con este abordaje, un número significativo de pacientes no curados tras la primera cirugía alcanzará la remisión tras la segunda (50-70%), pero a costa de una gran frecuencia de hipopituitarismos. Esta actitud nos lleva de nuevo a la dificultad para identificar a los pacientes no curados. Si aplicamos los criterios de remisión más estrictos (por ejemplo, cortisol plasmático < 1,8 μg/dl o 2 μg/dl, como proponen algunos autores), tendremos que asumir que algunos de los pacientes reoperados hubieran tenido un buen pronóstico a largo plazo sin necesidad de la segunda intervención.
La cirugía transesfenoidal puede constituir también una buena alternativa terapéutica para los pacientes con enfermedad de Cushing que, tras una suprarrenalectomía bilateral, desarrollan síndrome de Nelson, es decir, un crecimiento significativo del tumor hipofisario. La cirugía permite reducir la masa tumoral y paliar los síntomas por compresión (por ejemplo, deficiencias en el campo visual o cefaleas), aunque no siempre consigue la normalización de las cifras de ACTH48,49.
Factores pronósticosEs difícil identificar en el estudio inicial a los pacientes con menos probabilidades de curarse tras la cirugía transesfenoidal. Ni las características demográficas ni las pruebas hormonales nos ayudan en ese sentido. Sólo las pruebas de imagen tienen valor pronóstico, ya que las tasas de remisión son máximas en los pacientes con microadenomas visibles en la RM (o en la tomografía computarizada [TC]), algo peores cuando no se visualiza el tumor, y claramente inferiores en los pacientes con macroadenomas1,8,15,25,50-53; además, las recidivas son frecuentes en los macroadenomas que alcanzan la remisión. También sabemos que la probabilidad de que un paciente se cure mediante cirugía transesfenoidal es mayor si el neurocirujano localiza el tumor durante la intervención y realiza una resección selectiva y si la anatomía patológica confirma el diagnóstico, identificando un adenoma hipofisario con tinción inmunohistoquímica para ACTH12,15,20,22,54. De todos modos, ni una cosa ni otra se consideran imprescindibles, y se dan casos de pacientes con una evolución excelente a largo plazo, con tumores no localizados y/o no confirmados histológicamente, probablemente porque muchos tumores son pequeños y de consistencia blanda y pueden ser destruidos o aspirados inadvertidamente, y no llegar a procesarse para su estudio histológico1.
Superada la intervención, no es fácil predecir el pronóstico de un paciente individual una vez que los signos y síntomas de la enfermedad mejoran tras la cirugía. La ausencia de insuficiencia suprarrenal posquirúrgica se considera, de forma unánime, un factor de mal pronóstico. Pero también entre los pacientes con insuficiencia suprarrenal se producen recidivas y se sabe que éstas son más probables cuanto mayor es la cifra de cortisol plasmático en el postoperatorio y cuanto menor es la duración de la insuficiencia suprarrenal. El problema es que no se puede establecer un punto de corte claro, ya que en todas las series hay superposición de ambos parámetros entre los pacientes con recidivas durante el seguimiento y los que no las presentan. Aunque la remisión a largo plazo es muy probable cuando el cortisol plasmático posquirúrgico es muy bajo (< 1,8 μg/dl), no hay ningún punto de corte que excluya completamente la posibilidad de una recidiva. Con menos evidencia, otros autores han propuesto otros factores de mal pronóstico: la respuesta persistente del cortisol o la ACTH a corticoliberina (CRH), a metopirona o desmopresina o la supresión incompleta tras dosis bajas de dexametasona, que probablemente reflejen, todas ellas, un grado menor de insuficiencia suprarrenal. Los valores posquirúrgicos de ACTH han sido mucho menos estudiados que los de cortisol, por la mayor dificultad en el manejo de las muestras y en las técnicas de laboratorio, pero el valor pronóstico parece similar, con mayores valores en los pacientes que recaerán, pero sin un punto de corte claro. Nosotros proponemos exigir no un determinado valor de cortisol, sino la recuperación de las características funcionales normales del eje hipotalamohipofisosuprarrenal (ritmo circadiano, supresibilidad tras dexametasona y respuesta a la hipoglucemia), ya que en nuestra experiencia las recidivas son excepcionales (un paciente de 33, tras una media de seguimiento de 70 meses) tras normalizar todos estos parámetros29. En cualquier caso, y asumiendo que no disponemos de ningún parámetro que prediga con seguridad la remisión a largo plazo ni la recidiva, se hace imprescindible un seguimiento de por vida de los pacientes con enfermedad de Cushing tras la cirugía transesfenoidal.
ComplicacionesLa enfermedad de Cushing es debilitante, con afección multisistémica, que conlleva numerosos inconvenientes cuando el paciente tiene que afrontar la anestesia y la cirugía. El hipercortisolismo condiciona una mayor dificultad para la intubación, por la obesidad, y mayores tasas de crisis hipertensivas durante la anestesia, de infecciones perioperatorias, debidas a la inmunosupresión y, en ocasiones, a la hiperglucemia, y de trombosis por hipercoagulabilidad1. El tratamiento prequirúrgico con inhibidores de la esteroidogénesis mejora la condición del enfermo y puede ayudar a prevenir estas complicaciones, sobre todo en los pacientes más afectados.
La mortalidad en las grandes series quirúrgicas oscila entre el 0 y el 2%; las principales causas de muerte son la enfermedad tromboembólica, el infarto de miocardio y la meningitis. La morbilidad, excluidos los déficit de hormonas adenohipofisarias, está en torno al 7-15%8,55 y está representada por diabetes insípidas permanentes (0,3-8%), fístulas de líquido cefalorraquídeo, hemorragias intraoperatorias, meningitis, secreción inapropiada de ADH y lesiones del nervio óptico o de los nervios oculomotores. La diabetes insípida transitoria es muy común, pero suele resolverse antes del alta hospitalaria y, bien manejada, apenas repercute en la salud del paciente. Con menor frecuencia, se han descrito alteraciones neurológicas focales, perforación del tabique nasal, epistaxis y sinusitis. La aparición de complicaciones suele ser menor en manos de neurocirujanos con mayor experiencia. Por el contrario, son más frecuentes en los estudios que publican resultados de pacientes reoperados7,8,16,18,19,22,28,37,42,51,53,55-59.
El estudio de la función adenohipofisaria tras el tratamiento quirúrgico de la enfermedad de Cushing resulta complejo, al condicionar el propio hipercortisolismo una alteración en la secreción basal o estimulada de las hormonas. Algunos autores, de hecho, sólo evalúan la función adenohipofisaria en los pacientes en que el hipercortisolismo se corrige tras la cirugía. Los datos sobre la incidencia de hipopituitarismos posquirúrgicos son difícilmente comparables entre distintos grupos, ya que algunos grupos incluyen a todos los pacientes operados y otros excluyen a los no curados22, otros excluyen las hipofisectomías totales, en casi ningún caso se define el déficit (¿necesidad de recibir tratamiento sustitutivo?, ¿valores hormonales basales?, ¿valores estimulados?, ¿con qué umbral de corte?) y muchos no evalúan el posible déficit de somatotropina (GH). Incluso el momento de la evaluación implicará resultados distintos, ya que la recuperación de la secreción de GH, y quizá de gonadotropinas, en ocasiones, se produce muchos meses después de la intervención24,57. Con esta dificultad, en las publicaciones encontramos cifras de hipopituitarismos posquirúrgicos que oscilan entre el 1 y el 35%7,22,25,42,60. Muchos estudios coinciden en la mayor aparición de hipopituitarismos entre los pacientes que alcanzan la insuficiencia suprarrenal o entre aquellos sometidos a cirugías más agresivas.
Varios grupos han comunicado un mayor número de fallos en la función adenohipofisaria y diabetes insípida tras la cirugía de la enfermedad de Cushing respecto a otros tumores hipofisarios (productores de GH, prolactinomas o no funcionantes)7,61. Ello podría deberse a un abordaje quirúrgico más agresivo, ya que con mayor frecuencia se trata de tumores muy pequeños y no localizados prequirúrgicamente, lo que obliga al cirujano a movilizar toda la glándula para buscar el adenoma o incluso a realizar hemihipofisectomías o hipofisectomías totales en los casos en que no visualiza el tumor. Alguna otra publicación ha apuntado a esta misma desventaja de los pacientes con enfermedad de Cushing frente a otras enfermedades hipofisarias en cuanto a la aparición de hemorragias y meningitis62, pero esto no ha sido confirmado por otros estudios25.
ConclusionesLa cirugía transesfenoidal sigue considerada, a día de hoy, el tratamiento de primera elección para los pacientes con enfermedad de Cushing, aunque no está exenta de complicaciones. En manos expertas, y con criterios estrictos de remisión, se puede esperar una tasa de éxitos del 70-80%, con pocas recidivas a largo plazo. Este porcentaje de éxitos se reduce notablemente cuando nos enfrentamos a un macroadenoma, ya que sólo la mitad mejorará tras la intervención y, de ellos, un porcentaje significativo sufrirá una recidiva de la enfermedad a lo largo del seguimiento, o a un paciente sometido a una cirugía previa y con persistencia o reaparición de la enfermedad. En los casos en que la cirugía transesfenoidal fracasa, recurriremos a tratamientos alternativos: cirugía hipofisaria transcraneal, radioterapia, tratamiento farmacológico o suprarrenalectomía bilateral. Confiemos en que el futuro nos traiga tanto avances técnicos en la localización intraoperatoria y la resección de los adenomas productores de ACTH como mejoría en los resultados de otras alternativas terapéuticas.
RADIOTERAPIA HIPOFISARIA EN LA ENFERMEDAD DE CUSHINGRadioterapia convencionalLa irradiación de la hipófisis se ha utilizado como tratamiento de la enfermedad de Cushing desde hace muchos años63,64. Antes de que se generalizara la cirugía transesfenoidal en los años ochenta, algunos grupos utilizaron la radioterapia (RT) hipofisaria externa como el tratamiento inicial de la enfermedad, así consiguieron la remisión (normalización del cortisol urinario o sus metabolitos) en el 20-60% de los pacientes adultos65-69. Los resultados no eran mejores cuando la irradiación hipofisaria se combinaba con una adrenalectomía unilateral70 y sí lo eran cuando se combinaba con la administración de mitotano71, por el efecto adrenolítico del fármaco. En un estudio el porcentaje de remisión fue mucho más alto en pacientes menores de 18 años72.
Posteriormente, cuando la cirugía transesfenoidal se convirtió en el tratamiento inicial de elección, la radioterapia hipofisaria pasó a ser uno de los tratamientos de segunda línea. Hace 10 años, describimos los resultados de la RT convencional en nuestros primeros 30 pacientes con enfermedad de Cushing persistente o recidivante después de la cirugía73. El tratamiento normalizó las concentraciones de cortisol urinario en el 83% de los casos, entre 6 y 60 meses después de la irradiación (en los primeros 24 meses en la mayoría), porcentaje de remisión mayor al descrito con la RT sin cirugía previa. El tratamiento indujo déficit de GH en el 57%, de gonadotropinas en el 20% y de TSH en el 10% de los casos, sin otros efectos secundarios (déficit visuales, necrosis cerebral o tumores radioinducidos). Posteriormente, se ha demostrado la utilidad de la RT convencional postoperatoria en niños y adolescentes, con remisión del hipercortisolismo en el 100% de los casos y respuestas más rápidas que en los adultos74.
En los últimos años las técnicas de irradiación con sistemas estereotácticos han sustituido a la RT convencional en el tratamiento de los pacientes con adenomas hipofisarios.
RadiocirugíaEl término radiocirugía (RC) se refiere a la administración de una dosis de irradiación única elevada en un blanco previamente definido; el proceso se realiza en condiciones estereotácticas75. Su objetivo es administrar una dosis eficaz en el tumor con un elevado gradiente (que la dosis se reduzca a valores mínimos en unos pocos milímetros), evitando irradiar el tejido sano.
La RC tiene limitaciones y sólo debe aplicarse en tumores menores de 3 cm, bien definidos radiológicamente y que se encuentren a más de 5 mm del nervio óptico o del quiasma, porque la vía óptica es la estructura más sensible a una dosis única de irradiación y no tolera más de 8 Gy, lo cual es mucho menos de lo necesario para el control de los adenomas hipofisarios.
Aunque las dosis óptimas aplicables a este tipo de tumores no han sido claramente definidas, parece que 12-14 Gy pueden ser suficientes para estabilizar o reducir el volumen tumoral y que son necesarias dosis mayores, probablemente > 18 Gy, para controlar la hipersecreción hormonal.
La RC puede aplicarse con varios sistemas: la unidad gamma o gamma-knife (múltiples fuentes de cobalto 60), el acelerador lineal (fotones de rayos X) y las partículas pesadas (protones o partículas de helio, con una tecnología disponible sólo en unos pocos centros en todo el mundo).
Los resultados de los diversos estudios son difíciles de comparar por sus diferencias en cuanto a dosis, tiempo de seguimiento y técnicas de localización radiológica y planificación, que han mejorado progresivamente con los años. La mayor parte de los trabajos incluyen unos pocos pacientes con escaso seguimiento y los criterios de remisión utilizados en algún estudio son difícilmente aceptables76.
La normalización del cortisol urinario se consigue entre el 42 y el 90% de los pacientes77-83, con respuestas más rápidas que con la RT convencional en algunas series. La RC produjo grados variables de hipopituitarismo en el 16-60% de los casos78-82, porcentaje similar al de los pacientes tratados con RT convencional, a pesar de que con RC la irradiación hipotalámica es menor. La incidencia de déficit hipofisarios es mayor en los estudios con más tiempo de seguimiento y en las series más antiguas, en las que la planificación del tratamiento se realizaba con técnicas de imagen mucho menos precisas que las actuales79. En algunas series resulta llamativamente elevado el número de pacientes en los que reaparece el hipercortisolismo una vez conseguida la remisión80,81, mayor que el descrito con RT convencional. Que tanto el hipopituitarismo como la recidiva sean más frecuentes de lo esperado en los pacientes tratados con RC pudiera estar relacionado con la dificultad/imposibilidad para definir claramente la lesión hipofisaria en la mayoría de los pacientes con enfermedad de Cushing previamente operados. Esta dificultad llevará, en algunos casos, a que parte o toda la hipófisis normal reciba una dosis de irradiación elevada (mayor riesgo de hipopituitarismo) y, en otros, a que parte de las células tumorales reciban una dosis insuficiente (mayor riesgo de recidiva después de la remisión).
Radioterapia estereotáctica fraccionadaLa radioterapia estereotáctica fraccionada (RTEF) reúne las ventajas de precisión de un sistema estereotáctico y las que tiene el fraccionamiento en muchos casos. La planificación es similar a la utilizada en RC, pero el tratamiento no se administra en una sola sesión, sino que la dosis se divide en varias sesiones, generalmente con un fraccionamiento similar al de la RT convencional (1,8-2 Gy por fracción); se alcanza una dosis total de 45-50 Gy a lo largo de 5 o 6 semanas y se obtiene un elevado gradiente de dosis entre el volumen tumoral y el tejido sano84.
Las indicaciones son las mismas que las de otras técnicas de irradiación hipofisaria, pero en este caso no existen las limitaciones que tiene la RC en cuanto a tamaño tumoral y distancia a la vía óptica, porque con este fraccionamiento y estas dosis todos los órganos pueden estar incluidos en el volumen de tratamiento con escasa toxicidad. La RTEF también podrá emplearse en los pacientes (la mayoría en el caso de la enfermedad de Cushing) en que persista la hipersecreción hormonal sin una lesión radiológicamente visible, incluyendo todo el contenido selar en el volumen de tratamiento.
Los resultados descritos son escasos y muy preliminares. Lo esperable es que el grado de control de la enfermedad sea, al menos, similar al que se consigue con la RT convencional, pero con menos efectos secundarios por la menor dosis de irradiación que reciben los tejidos normales. En una serie, 9 de 12 (75%) pacientes con enfermedad de Cushing persistente después de la cirugía estaban en remisión tras una media de 29 meses85. De nuestros primeros 14 pacientes tratados con RTEF después de la cirugía transesfenoidal, el cortisol urinario se normalizó en 9 (64%) entre 6 y 24 meses después de la irradiación (datos no publicados).
ConclusionesLa RT convencional de la hipófisis es un tratamiento efectivo y bien tolerado en pacientes con enfermedad de Cushing que persiste o recidiva después de la cirugía transesfenoidal. El control de la hipersecreción hormonal es más rápido y tiene lugar en un porcentaje mayor de casos que en otros tipos de adenomas hipofisarios funcionantes.
En la mayoría de los pacientes con enfermedad de Cushing la persistencia del hipercortisolismo después de la cirugía no se acompaña de una lesión radiológicamente visible, por lo que el tratamiento con RC es difícilmente aplicable. Esta técnica puede ser utilizada como tratamiento primario en pacientes con contraindicaciones para la cirugía y microadenomas bien definidos, o como tratamiento postoperatorio de restos de macroadenomas con las limitaciones descritas previamente.
Aunque la experiencia con RTEF es muy escasa, es probable que consiga tasas de remisión similares a las de la RT convencional, pero con menos incidencia de hipopituitarismo por la menor irradiación del hipotálamo. En nuestra opinión, es la técnica de elección en la gran mayoría de los pacientes con enfermedad de Cushing que persiste o recidiva después de la cirugía.