Diversos estudios realizados en varones han demostrado la existencia de una correlación entre las concentraciones séricas de andrógenos así como de proteína transportadora de hormonas sexuales (sex hormone binding globulin o SHBG), y la presencia de alteraciones de la tolerancia a la glucosa, diabetes y síndrome metabólico. El objetivo de este estudio fue evaluar las concentraciones séricas de testosterona total, SHBG y testosterona biodisponible en la cohorte del Estudio Asturias, y su asociación con el grado de tolerancia a la glucosa y el síndrome metabólico.
Pacientes y métodosSe estudiaron 282 varones adultos de 36 a 85 años de edad con concentraciones séricas normales de testosterona total, evaluándose tanto su grado de tolerancia a la glucosa como la presencia o no de síndrome metabólico.
ResultadosLas concentraciones en suero de testosterona y testosterona biodisponible se correlacionaron negativamente con la edad, el índice de masa corporal, el perímetro de cintura,la glucemia, las concentraciones de hemoglobina glucosilada y la insulinemia. Los hombres con intolerancia a la glucosa o diabetes mellitus tenían concentraciones en suero de testosterona total, SHBG y testosterona biodisponible inferiores a las de los que tenían tolerancia normal a la glucosa. Tras el análisis multivariable, la edad y las concentraciones de testosterona total fueron predictores independientes de la presencia de diabetes mellitus o intolerancia a la glucosa. Los hombres con concentraciones de testosterona total en el cuartil inferior tenían un riesgo de padecer intolerancia o diabetes más de 2,5 veces mayor que el de los que tenían la testosterona plasmática en el cuartil superior.
ConclusionesEn esta muestra de población general de Asturias los hombres con concentraciones en plasma más bajas de testosterona total, aún dentro del rango de normalidad, tienen mayor riesgo de presentar intolerancia a la glucosa o diabetes, independientemente de la edad y del índice de masa corporal.
Studies in men have demonstrated a correlation between serum concentrations of androgens and sex hormone binding globulin (SHBG) with the presence of impaired glucose tolerance, diabetes and metabolic syndrome. The aim of this study was to evaluate circulating levels of total testosterone, SHBG, and bioavailable testosterone in the cohort of the Asturias Study and their association with the degree of glucose tolerance and metabolic syndrome.
Patients and methodsThe study population consisted of 282 men aged 36 to 85 years old with normal concentrations of total testosterone. The degree of glucose tolerance and the presence of metabolic syndrome were evaluated.
ResultsSerum concentrations of testosterone and bioavailable testosterone were negatively correlated with age, body mass index, waist circumference, blood glucose, glycated hemoglobin levels and insulin. Serum concentrations of total testosterone, bioavailable testosterone and SHBG were lower in men with glucose intolerance or diabetes than in those with normal glucose tolerance. After multivariate analysis, age and total testosterone levels were independent predictors of the presence of diabetes or glucose intolerance. The risk of glucose intolerance or diabetes mellitus was over 2.5 times higher in men with total testosterone levels in the lowest quartile than in those with total testosterone in the top quartile.
ConclusionsIn this general population sample from Asturias, men with lower plasma concentrations of total testosterone – even when within the normal range – have an increased risk of glucose intolerance or diabetes, regardless of age and body mass index.
Tanto en hombres como en mujeres se ha observado que las alteraciones en las concentraciones plasmáticas de testosterona se asocian con diabetes tipo 2 e intolerancia a la glucosa, así como con la resistencia a la insulina y el síndrome metabólico. Esta asociación parece tener un carácter opuesto en dependencia del sexo1. Mientras que en los hombres2,3 las concentraciones plasmáticas bajas de testosterona se asocian a diabetes y a mayor resistencia a la insulina, en las mujeres es el hiperandrogenismo, como ocurre en el síndrome del ovario poliquístico4, el que se asocia a diabetes mellitus, alteraciones de la tolerancia a la glucosa y menor sensibilidad a la insulina.
Por otro lado, varios estudios han demostrado que el hipogonadismo masculino es un factor de riesgo para el desarrollo de resistencia a la insulina, síndrome metabólico y diabetes5, y se ha observado también que en los hombres con diabetes son frecuentes las concentraciones bajas de testosterona, las cuales se asocian a mayor resistencia a la insulina6.
Diversos estudios y un metanálisis han mostrado una correlación inversa de las concentraciones sanguíneas de testosterona total7 y el riesgo de desarrollar diabetes tipo 2. Sin embargo, en el único estudio realizado en una muestra de población general no se observó esta correlación de una forma significativa más que para la testosterona libre o la testosterona biodisponible calculada8.
Hemos medido las concentraciones séricas de testosterona total, proteína transportadora de hormonas sexuales o SHBG (sex hormone binding globulin) y testosterona biodisponible calculada en una muestra de población general mayor de 36 años del Estudio Asturias9 y se ha evaluado su relación con la edad, diversos parámetros antropométricos y la presencia o no de diabetes mellitus, intolerancia a la glucosa y síndrome metabólico.
Material y métodosLa población estudiada fue la población masculina de la cohorte del Estudio Asturias9 en la evaluación realizada en noviembre de 2004. El Estudio Asturias es un estudio prospectivo de base poblacional de la diabetes y los factores de riesgo cardiovascular, iniciado en 1999 en el Principado de Asturias. Se realizó inicialmente un muestreo en dos fases. Quince áreas básicas de salud fueron seleccionados al azar de entre las 76 de Asturias, con una probabilidad proporcional al número de tarjetas sanitarias de usuarios de entre 30 y 75 años. Se seleccionaron al azar 125 personas en cada zona básica de salud. Fueron excluidas 87 personas por diversos motivos (diabetes tipo 1, embarazo, enfermedad grave, hospitalización o el uso de fármacos diabetogénicos) y otros 162 por imposibilidad de contar con los datos de contacto necesarios. La muestra final estuvo compuesta por 1.626 personas, de las cuales 1.034 (63,6%) aceptaron participar en el estudio.
En el año 2004 se realizó la segunda evaluación. De la cohorte original, 42 personas habían muerto y 19 habían abandonado Asturias. Otros 30 individuos fueron excluidos (embarazo, enfermedad grave, hospitalización o el uso de fármacos diabetogénicos). De las restantes 943 personas, 700 (74,2%) participaron en esta segunda evaluación, de los cuales 321 eran varones. De ellos, para este estudio, se contó con 282 varones de edades comprendidas entre 36 y 85 años cuya testosterona total era superior a 2,5 ng/ml. A todos ellos se les extrajo sangre en ayunas y se les realizó una sobrecarga oral con 75g de glucosa. Las muestras fueron centrifugadas in situ, utilizando una centrífuga portátil, transportadas al laboratorio en una nevera portátil y conservadas a -40°C. A todos ellos se les midió el perímetro de cintura y se les determinó la tensión arterial sistólica y diastólica, la talla y el peso corporal.
La glucosa se determinó por el método de la hexoquinasa enzimática (DPP Hitachi) y los pacientes fueron clasificados como normales, con intolerancia a la glucosa o con diabetes mellitus según los criterios de la Organización Mundial de la Salud10, tras la sobrecarga oral de glucosa (SOG). Se definió como intolerancia la presencia de una glucemia a las 2h de la SOG entre 140 y 200mg/dl, y como diabetes mellitus un valor superior a 200mg/dl. Se midieron también las concentraciones plasmáticas de colesterol total, colesterol HDL (lipoproteínas de alta densidad), triglicéridos, (método colorimétrico, DPP Hitachi), hemoglobina glucosilada (HPLC Menarini) e insulina (radioinmunanálisis9 Sorin).
El síndrome metabólico se definió por los criterios del National Cholesterol Education Group – Adult Treatment Panel III (NCEP –ATPIII)11. El índice HOMA (Homeostatic Model Assessmet) se calculó mediante la fórmula: HOMA=Insulina (mUI/L)* Glucosa (mg/dl) /405 12. Las concentraciones en plasma de testosterona total (valores normales: 2,5-7,9 ng/ml) y de SHBG (valores normales: 18-92 nmol/l) se midieron mediante enzimoinmunoanálisis por electroquimioluminiscencia (Elecsys 2010, Roche Diagnostics). Los coeficientes de variación interensayo fueron de 9,2 y 4%, respectivamente. La testosterona biodisponible fue calculada mediante el algoritmo de Vermeulen13. La determinación de hemoglobina glucosilada se realizó mediante HPLC (cromatografía líquida de alta presión) y los valores de referencia dueron de 4-5,9%.
El estudio fue aprobado por el comité local de ética y todos los participantes dieron su consentimiento informado.
Para el estudio estadístico se utilizó el programa estadístico SPSS 15.0. Los datos descriptivos se expresan como media aritmética y desviación estándar. Se calcularon las correlaciones de Spearman para las variables continuas. Para la comparación de medias de los grupos se utilizó el test de la t de Student. La muestra fue dividida en cuartiles de testosterona total, SHBG y testosterona biodisponible. Se realizó un análisis de regresión logística múltiple, con la “tolerancia alterada a la glucosa o diabetes” como variable dependiente ajustada para el índice de masa corporal (IMC) y el perímetro de cintura. Un valor de p<0,05 en la prueba de dos colas se consideró estadísticamente significativo.
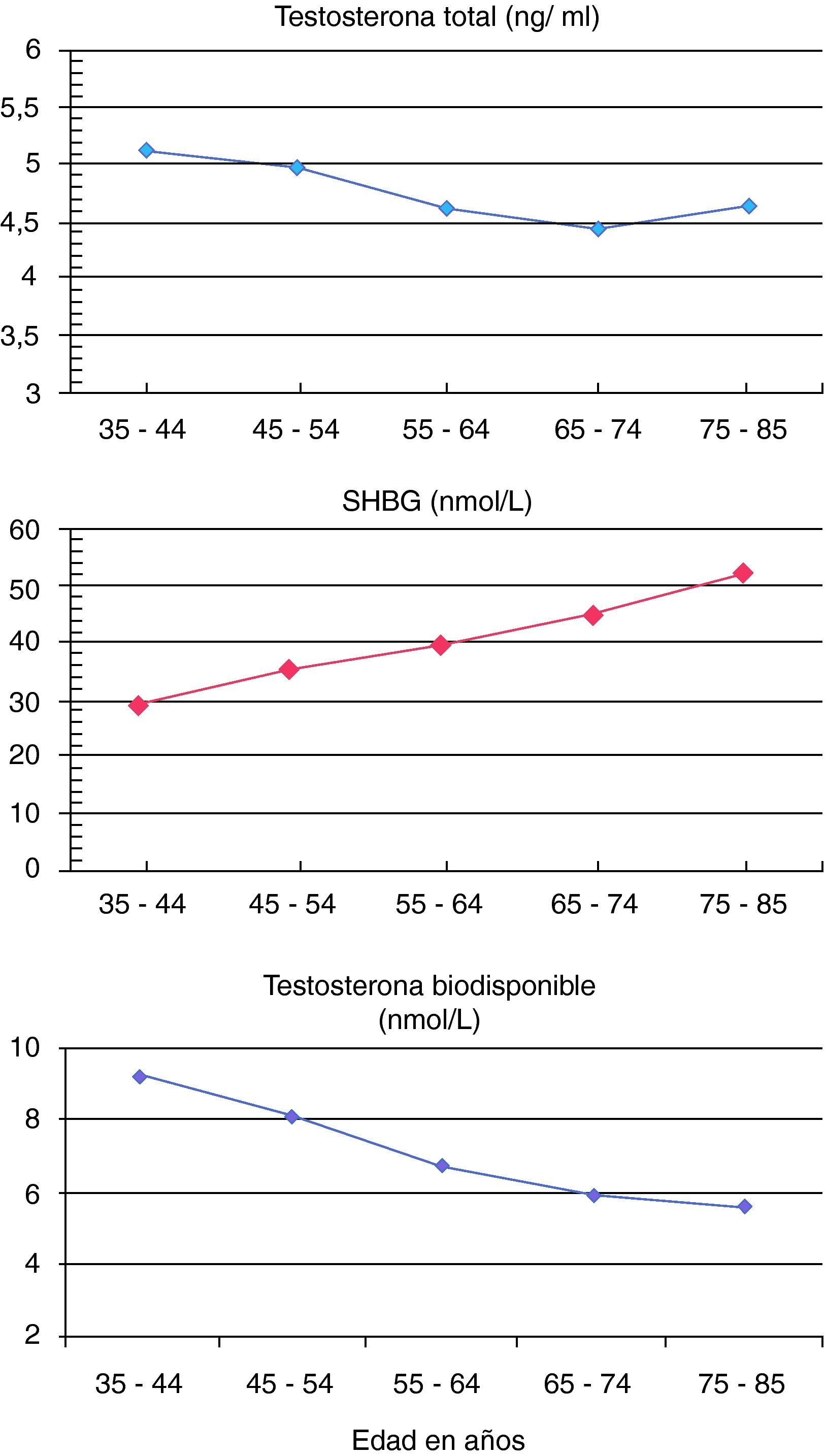
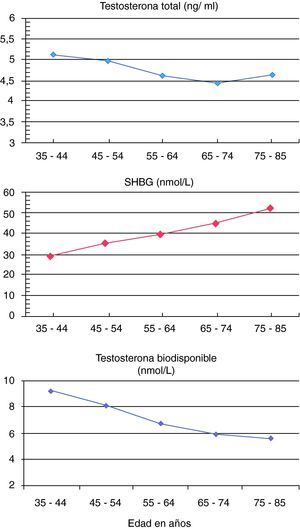
ResultadosEn nuestra muestra de población adulta masculina de Asturias las concentraciones séricas de testosterona y testosterona biodisponible se correlacionaron negativamente con la edad. Por décadas, las concentraciones séricas de testosterona total disminuyeron progresivamente con la edad de los pacientes hasta la década de 75 a 85 años en la que se estabilizaron. Las de SHBG, sin embargo, aumentaron más de un 10% con cada década, de tal forma que las de testosterona biodisponible disminuyeron más de un 10% con cada década hasta los 75 años y un 5% en la década de 75 a 85 años de edad (fig. 1).
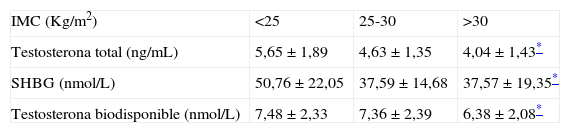
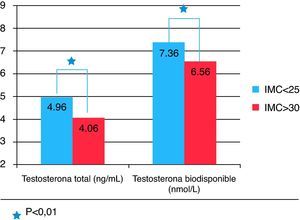
Se observó también una correlación negativa entre el IMC y el perímetro de cintura con las concentraciones de testosterona total, la SHBG y la testosterona biodisponible. Estos 3 valores fueron significativamente más bajos en aquellos varones obesos con IMC >30 que en aquellos en normopeso con un IMC<25 tal como se puede apreciar en la tabla 1.
Concentraciones plasmáticas de testosterona total, proteína transportadora de hormonas sexuales y testosterona biodisponible según grados de índice de masa corporal
| IMC (Kg/m2) | <25 | 25-30 | >30 |
| Testosterona total (ng/mL) | 5,65±1,89 | 4,63±1,35 | 4,04±1,43* |
| SHBG (nmol/L) | 50,76±22,05 | 37,59±14,68 | 37,57±19,35* |
| Testosterona biodisponible (nmol/L) | 7,48±2,33 | 7,36±2,39 | 6,38±2,08* |
IMC: índice de masa corporal; SHBG: proteína transportadora de hormonas sexuales.
Las concentraciones plasmáticas de testosterona y testosterona biodisponible se correlacionaron también negativamente de forma significativa con la glucemia basal, la glucemia a las 2 horas, la hemoglobina glucosilada (HbA1c), la insulinemia, el índice HOMA, y otras variables asociadas al síndrome metabólico como la tensión arterial sistólic) y las concentraciones de triglicéridos plasmáticos. Sin embargo, no existió ninguna asociación de la SHBG con las glucemias, la HbA1c o el índice HOMA.
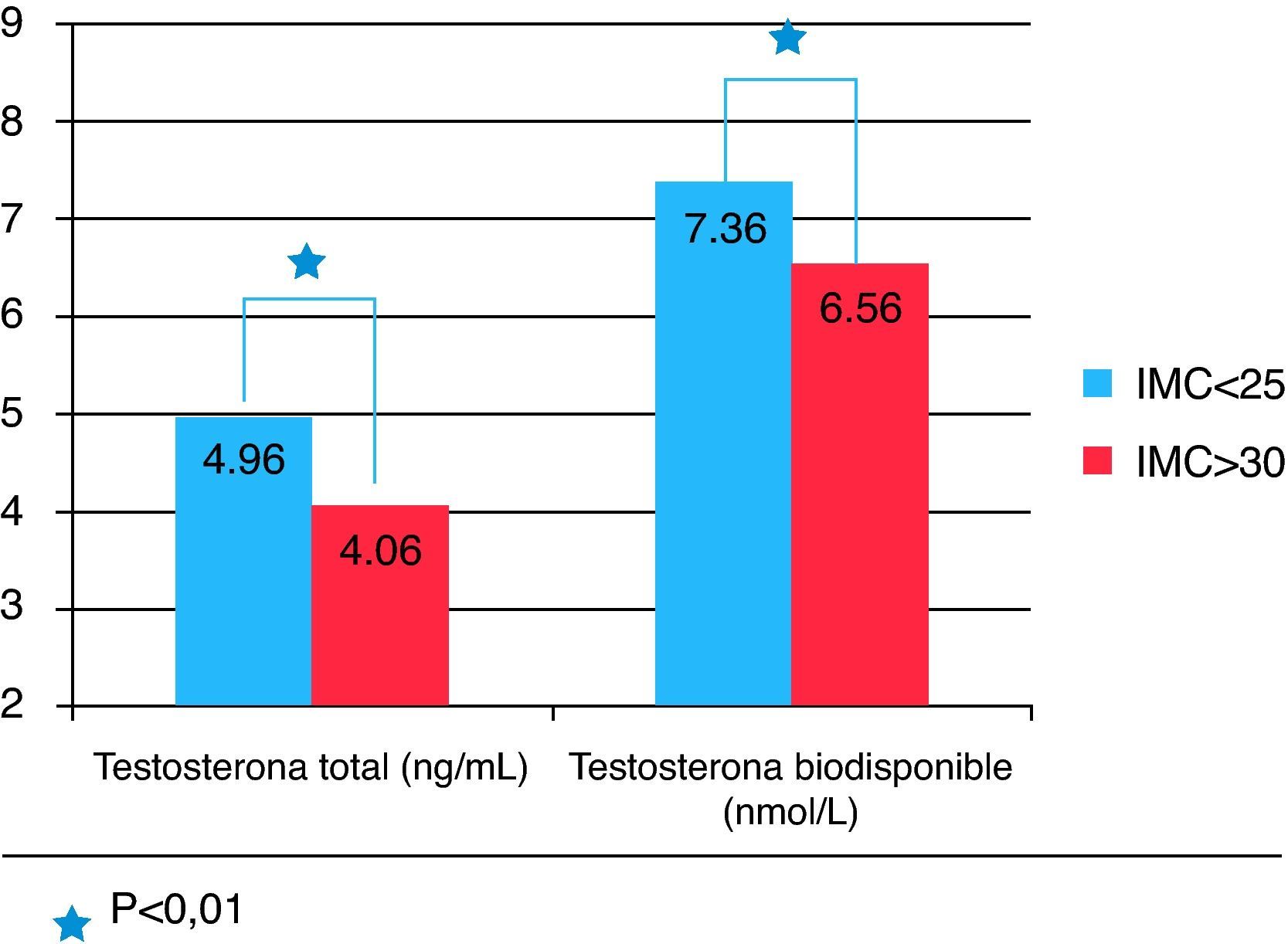
Tenían síndrome metabólico, según los criterios ATPIII, 70 de los 282 pacientes (24,8%) y como se observa en la figura 2 las concentraciones séricas de testosterona total, SHBG y testosterona biodisponible eran significativamente más bajas en este grupo comparado con aquellos sin síndrome metabólico (testosterona total: 4,96±1,59 vs 4,06±1,45 ng/ml, respectivamente; SHBG: 42,53±18,59 vs 34,79±16,88 nmol/l, respectivamente; testosterona biodisponible: 7,36±2,33 vs 6,56±2,27 nmol/l, respectivamente).
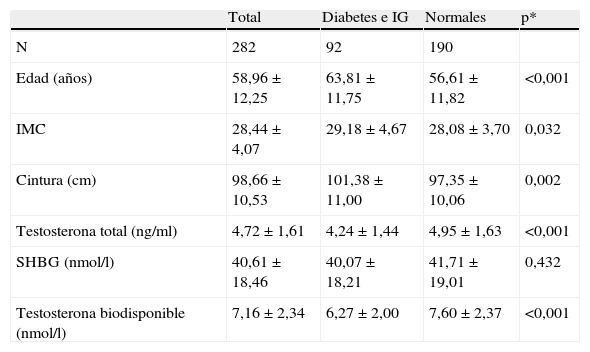
La prevalencia de diabetes en los 282 varones de la cohorte fue del 20,2% (57) y la de intolerancia a la glucosa del 12,4% (35). En total tenían diabetes mellitus tipo 2 o intolerancia a la glucosa 92 pacientes, el 32,6% de la muestra. Como se puede ver en la tabla 2, los hombres con intolerancia a la glucosa o diabetes mellitus tenían una edad media superior, así como un perímetro de cintura y un índice de masa corporal más elevados que aquellos con tolerancia normal a la glucosa. Asimismo, sus concentraciones séricas de testosterona total, SHBG y testosterona biodisponible eran inferiores.
Edad, masa corporal, cintura y concentraciones plasmáticas de testosterona total, proteína transportadora de hormonas sexuales y testosterona biodisponible en pacientes con tolerancia normal a la glucosa y en pacientes con tolerancia a la glucosa alterada (diabetes e intolerancia a la glucosa)
| Total | Diabetes e IG | Normales | p* | |
| N | 282 | 92 | 190 | |
| Edad (años) | 58,96 ± 12,25 | 63,81±11,75 | 56,61±11,82 | <0,001 |
| IMC | 28,44±4,07 | 29,18±4,67 | 28,08±3,70 | 0,032 |
| Cintura (cm) | 98,66±10,53 | 101,38±11,00 | 97,35±10,06 | 0,002 |
| Testosterona total (ng/ml) | 4,72±1,61 | 4,24±1,44 | 4,95±1,63 | <0,001 |
| SHBG (nmol/l) | 40,61±18,46 | 40,07±18,21 | 41,71±19,01 | 0,432 |
| Testosterona biodisponible (nmol/l) | 7,16±2,34 | 6,27±2,00 | 7,60±2,37 | <0,001 |
p*: significación estadística comparando “normales” con “diabetes e IG”.
IG: intolerancia a la glucosa; IMC: índice de masa corporal; SHBG: proteína transportadora de hormonas sexuales.
En nuestro modelo multivariable de regresión logística, tanto la edad (p=0,017) como las concentraciones de testosterona total (p=0,005) fueron factores predictivos independientes de la presencia de diabetes o intolerancia a la glucosa que se mantienen con el IMC y el perímetro de cintura como covariables. Introduciendo la testosterona total como variable categórica en forma de cuartiles y utilizando como referencia el cuartil superior, los pacientes con las concentraciones de testosterona total en el cuartil inferior tienen un riesgo de tener diabetes o intolerancia a la glucosa 2,9 veces superior que los que los tienen en el cuartil superior (intervalo de confianza: 1,30-6,56).
DiscusiónEste estudio transversal en varones de la población general de Asturias confirma los resultados de otros estudios previos14,15 en cuanto a la disminución progresiva de las concentraciones séricas de testosterona total con la edad hasta los 75 años. Este descenso es pequeño y menor del 0,5% anual. Sin embargo, el descenso de las concentraciones de testosterona biodisponible es mucho mayor, de más de un 1% anual, debido al aumento de las concentraciones de SHBG con la edad. Estos resultados son similares a los encontrados en muestras de poblaciones europeas15 y americanas16.
El IMC se asoció en este estudio a una disminución importante y progresiva de las concentraciones de testosterona total en concordancia con estudios previos17 Este efecto del IMC es muy importante y, de hecho, la diferencia en las concentraciones de testosterona total entre personas con IMC normal y obesos supera a la que se ve con la edad. Este efecto del IMC parece independiente de la edad, ya que la disminución de las concentraciones de testosterona total con la edad se produce en todos los estratos de IMC. Las concentraciones de SHBG, por el contrario, disminuyen a medida que lo hace el IMC sin que se altere la correlación positiva con la edad, indicando efectos opuestos y distintos sobre ellas de la edad y la obesidad.
La asociación de la obesidad con las menores concentraciones de testosterona tanto total como biodisponible parece deberse a una respuesta disminuida de la lutropina hipofisaria por afectación del eje hipotálamo hipofisario gonadal15 que puede ser secundaria bien a la producción de adipocinas inflamatorias18, bien a la resistencia a la insulina y la hiperinsulinemia19. Esta última puede inhibir directamente la secreción de testosterona por las células de Leydig, actuando sobre sus receptores específicos en este tipo de células20.
Los varones con hipogonadismo, como es el caso de los pacientes con síndrome de Klinefelter21, tienen un riesgo elevado de desarrollar resistencia a la insulina así como intolerancia a la glucemia y diabetes mellitus, y conocemos que el hipogonadismo hipogonadotropo es más frecuente en hombres con diabetes mellitus tipo 222. Sin embargo, la relación entre las concentraciones séricas de testosterona total en rango normal y el riesgo de tener diabetes o intolerancia a la glucosa aún no está bien caracterizada. En este estudio de una muestra de población general mayor de 36 años con concentraciones normales de testosterona total se observa una asociación independiente de las concentraciones en suero de la testosterona total con la intolerancia a la glucosa o la diabetes, lo que sugiere que las concentraciones bajas de esta hormona, aún dentro del rango de la normalidad, pueden ser un factor de riesgo para esta alteración metabólica. Aunque las concentraciones de testosterona disminuyen a medida que aumenta la edad y también con el incremento del IMC, y lo mismo ocurre con la incidencia de diabetes e intolerancia a la glucosa, en nuestro estudio la correlación de las concentraciones séricas de testosterona total con la presencia de alteración de la tolerancia a la glucosa es independiente de la edad, sumándose a ella como factor predictivo en nuestro modelo multivariable y se mantiene su valor predictivo, introduciendo en el modelo el IMC, lo que indica una asociación que es también independiente del grado de sobrepeso u obesidad.
Estos resultados confirman en nuestra población los resultados de diversos estudios transversales y de un metanálisis6 que han demostrado la asociación entre concentraciones bajas de testosterona y la presencia o desarrollo tanto de síndrome metabólico23 como de diabetes mellitus tipo 2 o intolerancia a la glucosa24-26, y que ocurre también en hombres con concentraciones de testosterona en plasma dentro del rango de la normalidad.
Cuando en nuestra muestra se comparan los cuartiles de testosterona, el riesgo ajustado para edad e IMC de que los hombres con concentraciones de testosterona en el cuartil inferior padezcan intolerancia a la glucosa o diabetes es más de 2,5 veces mayor que el de los que tienen la testosterona plasmática en el cuartil superior.
Este estudio tiene numerosas limitaciones, la principal de todas ellas es que se trata de un estudio transversal por lo que no se puede establecer la direccionalidad de las asociaciones halladas. Estudios longitudinales previos16,27 parecen confirmar, sin embargo, la disminución de los valores de testosterona biodisponible con la edad. La secuencia temporal entre las concentraciones plasmáticas bajas de testosterona y el desarrollo de la intolerancia a la glucosa tampoco pueden establecerse a partir de este estudio de carácter transversal, pero estudios prospectivos en otras poblaciones han demostrado que las concentraciones bajas de testosterona son anteriores al desarrollo de diabetes o intolerancia a la glucosa28-31, y también las bajas concentraciones de SHBG por sí mismas son predictores del riesgo de diabetes en ambos sexos32. El seguimiento de nuestra cohorte nos podría permitir en el futuro confirmar esta hipótesis.
La diabetes mellitus y la intolerancia a la glucosa son factores de riesgo conocidos de enfermedad cardiovascular. En los varones, las consecuencias sobre el riesgo cardiovascular del declinar de las concentraciones de testosterona total y testosterona biodisponible con la edad aún no han sido establecidas con claridad. Aunque algunas evidencias asocian un efecto predictor de las concentraciones bajas de testosterona33,34 sobre la enfermedad cardiovascular en varones, se requieren más estudios para aclarar si parte del aumento de riesgo cardiovascular asociado a la edad se debe al desarrollo de intolerancia a la glucosa en aquellas personas con concentraciones más bajas de testosterona, y si la intervención terapéutica administrando testosterona puede tener algún beneficio.
En conclusión, en el estudio transversal de varones de la población general asturiana se observa cómo aquellos con concentraciones plasmáticas más bajas de testosterona total, aún dentro del rango de normalidad, tienen mayor riesgo de presentar intolerancia a la glucosa o diabetes, riesgo que es independiente de la edad y del IMC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.