Los tumores hipofisarios secretores de tirotropina (TSH) son infrecuentes; la mayoría de las series apuntan a una frecuencia menor del 1%, y por lo tanto son una causa rara de hipertirodismo1. Recientemente se habla de una frecuencia algo más elevada (menos del 2%), con una incidencia de un caso por millón2. Lo que no está claro es si la incidencia ha aumentado o bien si lo que ocurre es que se diagnostican con mayor precisión por la mejoría en las técnicas de diagnóstico.
Las manifestaciones clínicas son similares a otras formas más frecuentes de hipertiroidismo. Bioquímicamente se caracterizan por la presencia de hormonas periféricas elevadas con una TSH normal o elevada. Es importante hacer el diagnóstico diferencial con la resistencia a hormonas tiroideas (RHT), ya sea periférica o hipofisaria, cuya principal diferencia es la ausencia de síntomas en la RHT periférica, mientras que en la hipofisaria si suelen presentar síntomas leves de hipertiroidismo.
Existen pocos casos descritos en la literatura de aparición de tiroiditis subaguda tras la cirugía del adenoma productor de TSH3.
Presentamos el caso de una paciente de 37 años que acudió a la consulta de endocrinología tras presentar clínica de sudoración, vómitos, diarrea y palpitaciones nocturnas de 2 meses de evolución. Entre sus antecedentes personales y familiares no existía enfermedad tiroidea. Reinterrogada específicamente, no refería pérdida de peso ni otra sintomatología asociada, y no ingería sal yodada habitualmente. En la exploración física, la paciente presentaba peso de 62kg, con índice de masa corporal de 26kg/m2, tensión arterial 130/80mmHg, frecuencia cardíaca de 100 latidos por minuto, con ausencia de temblor distal, ni exoftalmos. Presentaba bocio grado 1, elástico, sin nódulos aparentes.
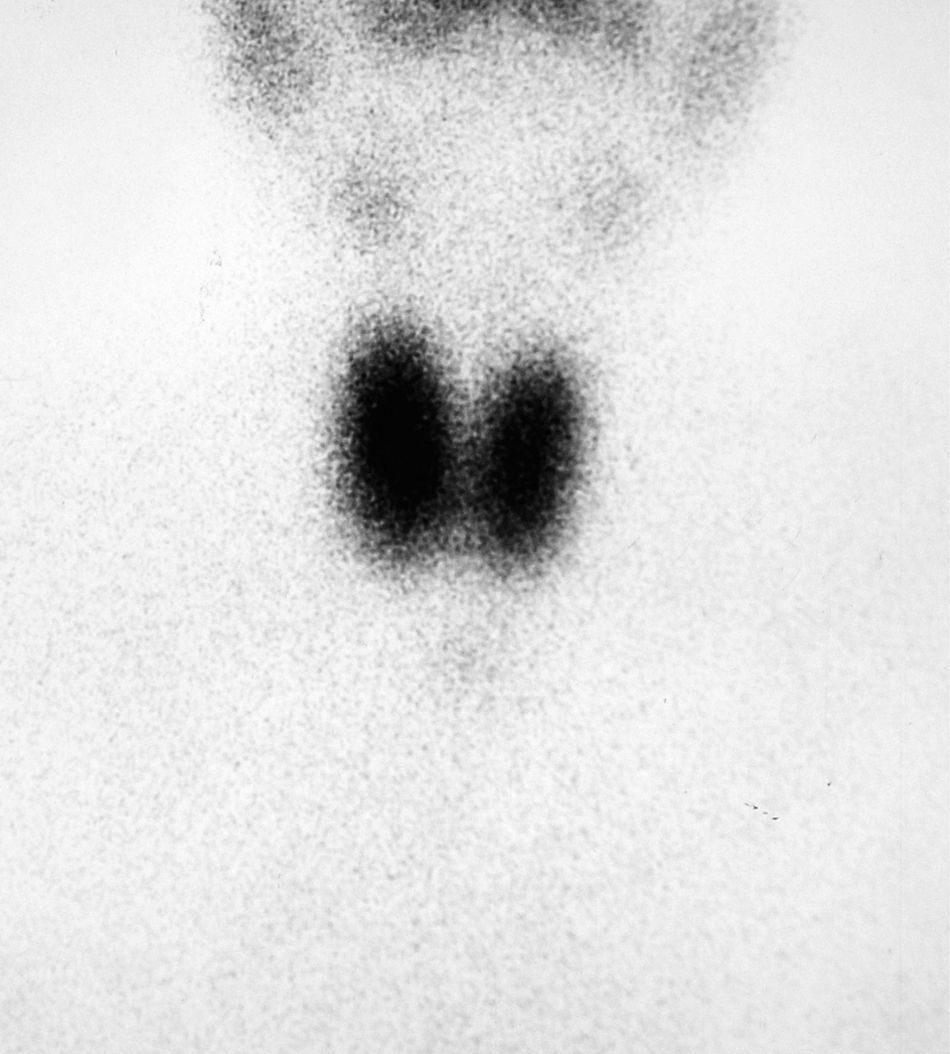
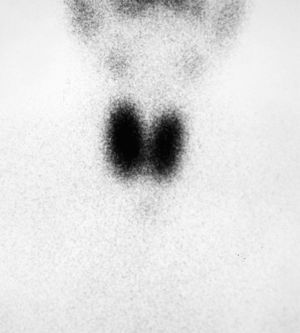
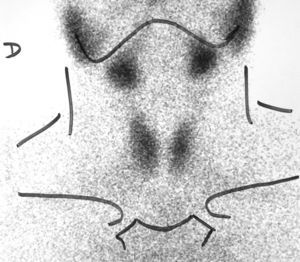
Ante la sospecha de hipertiroidismo, se realizó una analítica y una gammagrafía tiroidea. En la analítica se objetivaron concentraciones de T4 libre por encima de la normalidad [2,2ng/dl (VN 0,9-2)] y TSH inapropiadamente normal [0,72microU/ml (VN 0,3-4,5)] y la gammagrafía con Tc-99 mostraba una hipercaptación difusa (fig. 1).
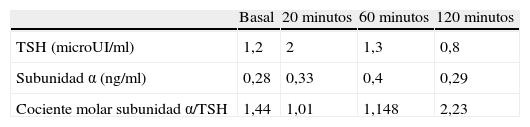
Un mes después se realizó nuevo control analítico donde se confirmaba la misma alteración bioquímica y se solicitaron marcadores de autoinmunidad: anticuerpos (Ac) contra el receptor de TSH (TSI), Ac antitiroglobulina y antiperoxidasa que fueron negativos. También se solicitaron concentraciones de T3 total, encontrándose por encima de la normalidad [169ng/dl (VN 80-160)]. La presencia de hormonas periféricas elevadas, concentraciones de TSH inapropiadamente normales y la clínica del paciente llevaron a la sospecha de tumor hipofisario productor de TSH como primera posibilidad diagnóstica y a la realización de un test de Thyrotropin-releasing hormone (TRH) con 150mcg iv, para su diagnóstico y diagnóstico diferencial con la RHT, así como una resonancia magnética (RM). Se midieron también las concentraciones de la subunidad alfa (VN<0,1ng/ml) y se calculó el cociente molar subunidad α/TSH. El resultado del test de TRH se muestra en la tabla 1.
La ausencia de respuesta de TSH a TRH y la presencia de cociente molar subunidad α/TSH superior a 1 en todos los tiempos apoyaron el diagnóstico de tumor secretor de TSH.
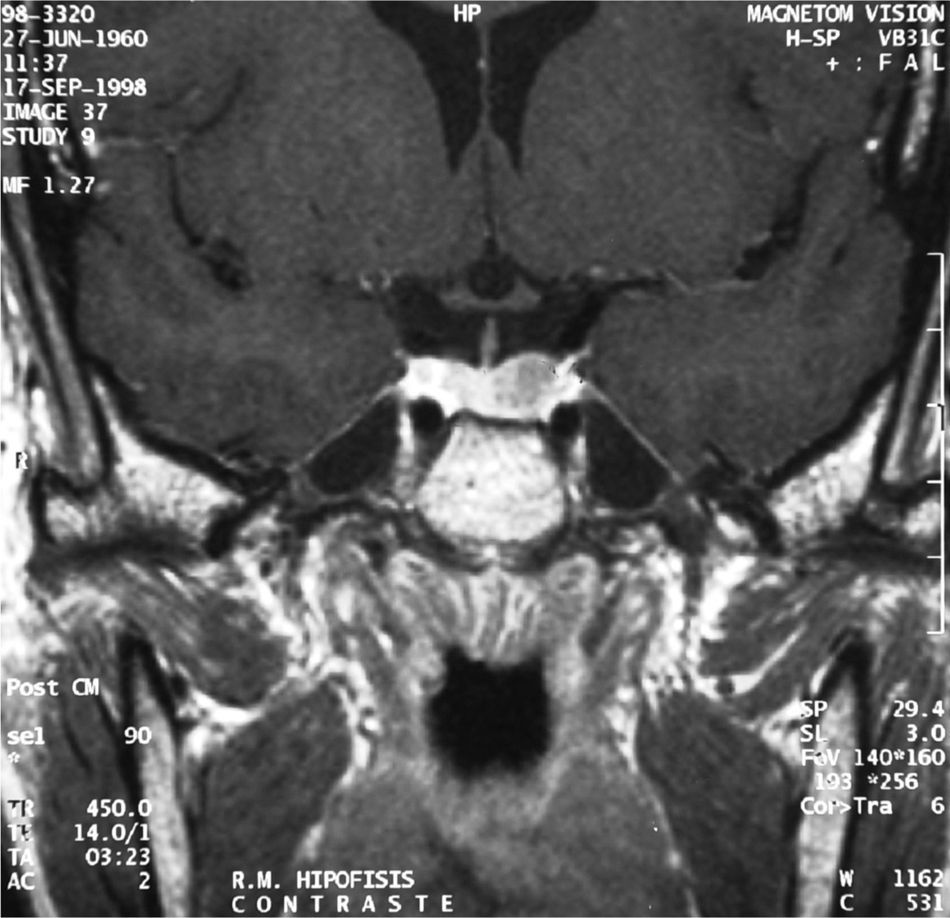
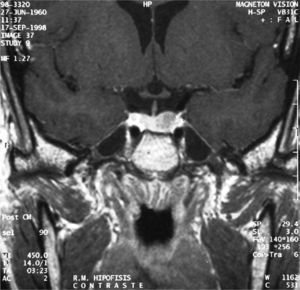
La RM mostraba una glándula hipofisaria agrandada de tamaño en su parte izquierda. No desplazaba tallo, ni producía erosión ni agrandamiento de silla turca, con un tamaño de 1,2cm, compatible con macroadenoma hipofisario (fig. 2).
Se evaluó el resto de la función hipofisaria, así como un estudio campimétrico que fue normal.
La paciente ingresó para ser intervenida, y previamente recibió un ciclo de octreótida (100mcg/8h), para combatir los síntomas del hipertiroidismo. Al ingreso presentaba una T4 libre de 2,1ng/dl con TSH de 1,4microU/ml, y al cuarto día de tratamiento con octreótida, las concentraciones de TSH eran de 0,08microU/ml y T4 libre de 1,5ng/dl. Fue intervenida mediante cirugía transesfenoidal con resección aparentemente total del adenoma. El diagnóstico anatomopatológico e inmunohistoquímico fue compatible con adenoma hipofisario con positividad para TSH, prolactina y GH.
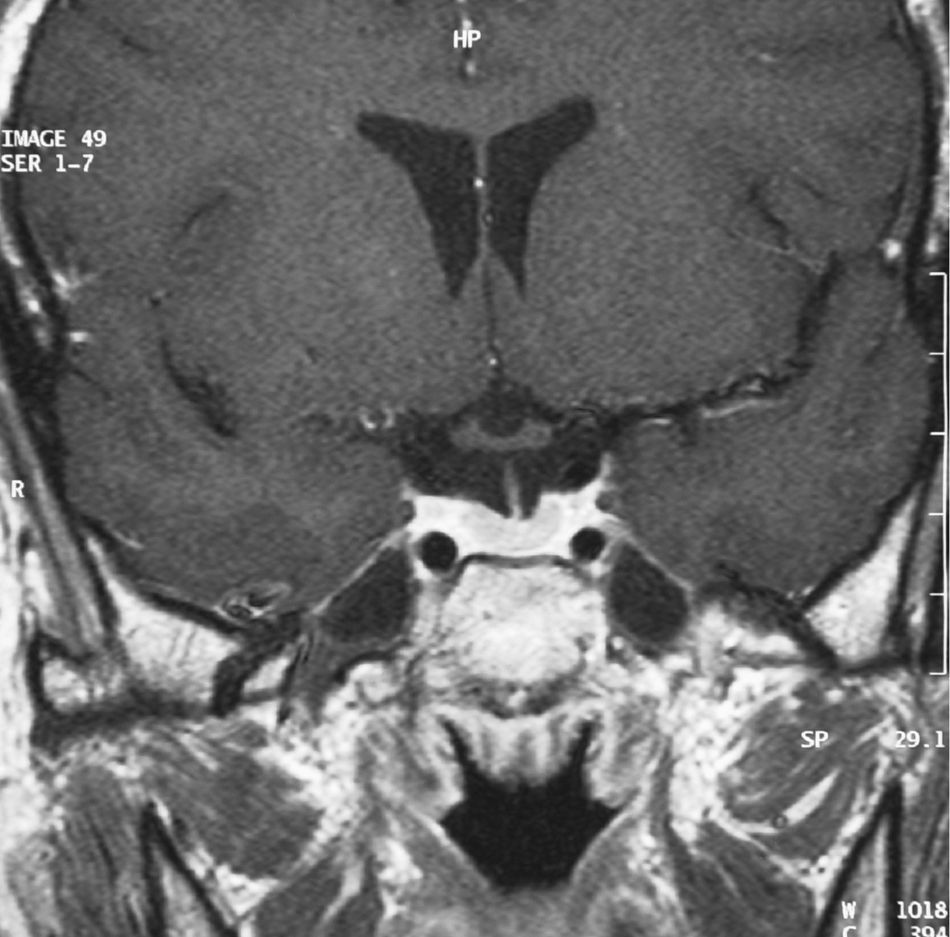
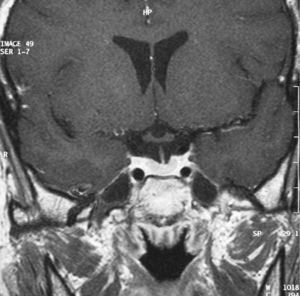
Una semana después de la cirugía, la paciente presentaba una analítica dentro de la normalidad (T4 libre 1,22ng/dl, TSH 0,11microU/ml, T3 total 85ng/dl), junto con ausencia de síntomas, lo que parecía indicativo de curación. Tres meses después, se realizaron pruebas de estimulación para estudiar la funcionalidad del eje hipofisario, con un resultado dentro de la normalidad, y una RM que no mostraba signos de recidiva (fig. 3).
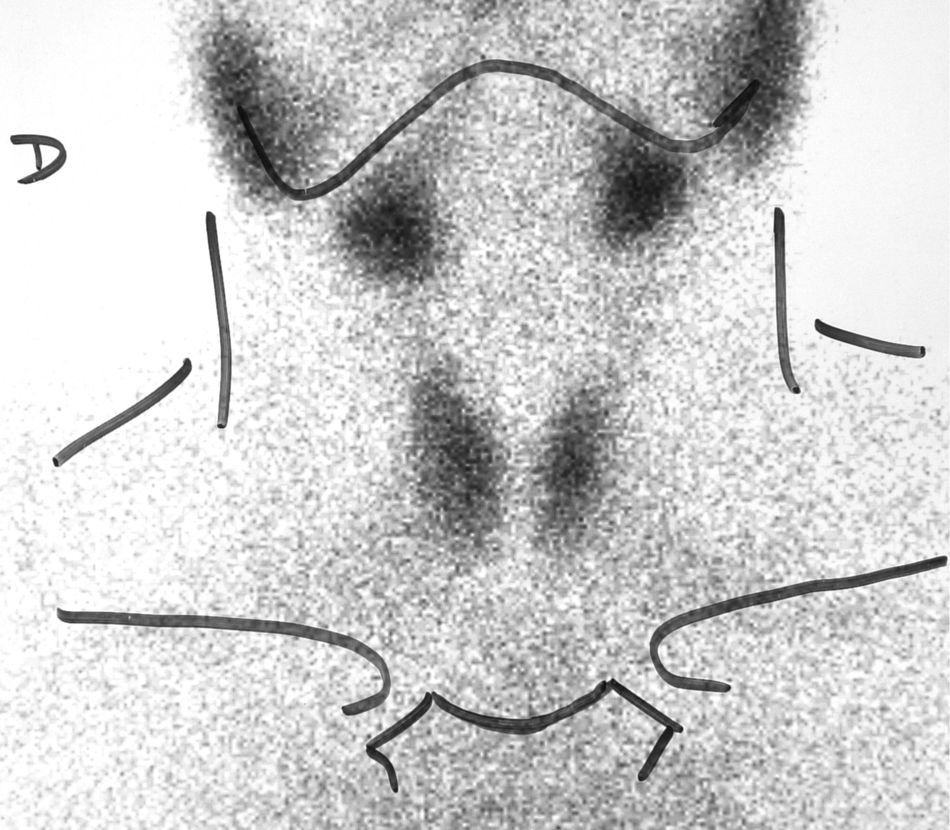
A los 4 meses de ser intervenida, la paciente comenzó con dolor súbito en región cervical derecha y sensación de palpitaciones, nerviosismo y temblor. En analítica destacaba T4 libre elevada (2,6ng/dl), TSH 0,04microU/ml y velocidad sedimentación globular de 53mm/h. A la palpación se apreciaba un aumento del tiroides a expensas del lado derecho y temperatura elevada (de 38,5 grados). Se realizó una gammagrafía con Tc-99 donde se apreciaba hipocaptación difusa homogénea (fig. 4). Ante la sospecha de tiroiditis subaguda se inició tratamiento con aspirina a razón de 500mg/8h, que se fue disminuyendo paulatinamente. Ocho semanas después, la sintomatología local había remitido y refería síntomas leves de hipotiroidismo. En la analítica presentaba T4 libre 0,5ng/dl y TSH 0,1microU/ml. Se decidió esperar sin pautar tratamiento sustitutivo, y 2 meses después la paciente se encontraba asintomática, y los valores analíticos se habían normalizado.
En revisiones posteriores, la paciente ha presentado pruebas de función tiroidea dentro de la normalidad y RM sin datos de recidiva tumoral.
La coexistencia de tiroiditis subaguda y tumor productor de TSH es rara, y ha sido reportada escasamente en la literatura3,4. Se desconoce el mecanismo fisiopatológico de esta asociación y es probable que se trate de una asociación casual. También se han descrito casos de asociación entre enfermedad tiroidea autoinmunitaria y tirotropinomas, siendo esta asociación también infrecuente5.
Como ya señalamos anteriormente, los tumores hipofisarios secretores de TSH o tirotropinomas son los más raros de la adenohipófisis. Las células tirotropas son menos del 5% de todas las células hipofisarias, y de ahí su escasa frecuencia6. Son tumores benignos, tan solo hay un caso de transformación de un TSH benigno en un carcinoma con múltiples metástasis y con pérdida de la subunidad α7. Estos tumores suelen ser grandes, tan solo un 10% son microadenomas8.
Pueden aparecer a cualquier edad, pero son más frecuentes en la edad media de la vida y no tiene mayor prevalencia en la mujer como la mayoría de enfermedades endocrinas.
La mayoría de los tirotropinomas solo secretan TSH; un 25% se caracterizan por la secreción concomitante de otras hormonas hipofisarias, principalmente hormona del crecimiento (GH: 15%) y prolactina (10%)9, puesto que comparten factores de transcripción comunes como PROP-1, Pit-1 y HESX-110,11. Nuestra paciente presentó positividad inmunohistoquímica para TSH, prolactina y GH, aunque funcionalmente solo presentaba aumento de TSH.
Se desconocen los mecanismos moleculares en la formación de estos tumores, pero podría tratarse de mutaciones somáticas puntuales o expresión anómala de oncogenes como en otros tumores.
Clínicamente, los pacientes con tumores secretores de TSH presentan síntomas relacionados o bien con el tamaño del tumor (alteraciones visuales, cefalea,...) o bien con la hiperproducción hormonal. Son frecuentes las palpitaciones, el nerviosismo o el bocio. Muchos pacientes presentan una larga historia de disfunción tiroidea, diagnosticados de enfermedad de Graves, y hasta a un 30% de los pacientes se les llega a realizar la tiroidectomía o ablación con radioyodo12.
El diagnóstico en ocasiones se ve retrasado cuando coexiste un hipotiroidismo autoinmunitario y es la inadecuada supresión de TSH con tratamiento sustitutivo lo que nos debe hacer sospechar de una producción autónoma de TSH. Son frecuentes los desórdenes en el eje gonadal, con alteraciones menstruales y disminución de la líbido.
Aproximadamente dos tercios de los pacientes con tirotropinomas presentan bocio con aumento de captación de radioyodo.
El hallazgo principal de un hipertiroidismo central es la presencia de hormonas tiroideas circulantes elevadas con concentraciones de TSH altas o inapropiadamente normales.
El 80% de los pacientes con tumor productor de TSH presentan una hiperproducción de la subunidad α y el cociente molar subunidad α/TSH superior a 1. Sin embargo, recientemente se ha descrito que hasta en un 60% de los microadenomas la subunidad α es normal2.
La estimulación con TRH sirve para diferenciar la hiperproducción de TSH por un tumor secretor de una resistencia a hormonas tiroideas. En la estimulación, la respuesta de TSH en los tumores está disminuida, mientras que en las personas sanas y en los pacientes con RHT la TSH aumenta como respuesta a la TRH. Durante la prueba suele ser útil determinar la subunidad α, puesto que la relación molar de la subunidad alfa respecto a la TSH es elevada en los pacientes con tumor. Nuestra paciente presentó un test de TRH compatible con tumor productor de TSH.
Otra prueba que puede realizare es el test con T3 (80-100mcg/día durante 8-10 días); en los pacientes con tirotropinomas no se produce inhibición completa de la TSH1.
La prueba de imagen más sensible para detectar el tumor hipofisario es la RM.
El tratamiento de elección en estos tumores es la cirugía, previa normalización de la función tiroidea para evitar complicaciones quirúrgicas. En la actualidad se acepta el tratamiento prequirúrgico del hipertiroidismo con análogos de somatostatina, de acción corta o retardada, que consiguen normalizar las hormonas tiroideas en el 75-95% de los casos, además de una disminución del tamaño tumoral de hasta un 50%13. Los análogos de somatostatina inhiben la amplitud de los pulsos de TSH y pueden suprimir la TRH. No deben usarse fármacos antitiroideos porque pueden aumentar la TSH y estimular el crecimiento tumoral. Nuestra paciente tras 4 días de tratamiento con análogo de acción corta consiguió suprimir los valores de TSH y normalizar las hormonas periféricas.
La radioterapia se ha utilizado como adyuvante de la cirugía cuando esta no consigue la curación.
La cirugía resulta curativa en el 40% de los casos y el porcentaje de remisión tras radioterapia es bajo, por lo que los análogos de somatostatina son también el tratamiento de elección ante el fracaso de la cirugía y de la radioterapia.
La tiroiditis subaguda suele tener una causa vírica y cursa con dolor en región tiroidea de aparición súbita o gradual junto con fiebre en ocasiones. Se produce una apoptosis del epitelio folicular, liberándose tiroglobulina y hormonas periféricas, produciendo clínica de hipertiroidismo. En ese momento la captación de radioyodo es baja y se interrumpe la síntesis de hormonas. En las fases posteriores de la enfermedad, cuando ya se han consumido los depósitos de hormona preformada, disminuyen las concentraciones séricas de T3 y T4, en ocasiones hasta límites de hipotiroidismo y aumenta la TSH. Cuando el cuadro se resuelve, las concentraciones hormonas vuelven casi siempre a la normalidad, como fue el caso de nuestra paciente.