La obesidad aumenta el riesgo de desarrollar arteriosclerosis; sin embargo, el riesgo depende significativamente de la distribución del tejido adiposo en el cuerpo y la acumulación ectópica de tejido adiposo visceral (TAV). Evidencia reciente indica que cada depósito de grasa visceral es anatómica y funcionalmente diferente. Dada la proximidad al órgano, cada depósito de TAV ejerce una modulación local más que un efecto sistémico. Debido a su peculiar localización y sus propiedades biomoleculares, un tejido adiposo no tradicional, el tejido adiposo epicárdico, se ha abierto campo como causante de arteriosclerosis. Este tejido puede ser medido con técnicas de imagen y está clínicamente relacionado con la masa del ventrículo izquierdo, la enfermedad arterial coronaria y el síndrome metabólico. Por tanto, la medición de la grasa epicárdica puede tener un papel en la estratificación del riesgo cardiometabólico y servir como blanco terapéutico.
Obesity increases the risk of development of atherosclerosis. However, this risk significantly depends on adipose tissue distribution in the body and ectopic accumulation of visceral adipose tissue (VAT). Recent evidence suggests that each visceral fat deposit is anatomically and functionally different. Due to proximity to the organ, each visceral fat deposit exerts a local modulation rather than a systemic effect. Because of its unique location and biomolecular properties, a “non-traditional” fat depot – the epicardial adipose tissue – has been considered to play a causative role in atherosclerosis. Epicardial adipose tissue may be measured with imaging techniques and is clinically related to left ventricular mass, coronary artery disease, and metabolic syndrome. Therefore, epicardial fat measurement may play a role in stratification of cardiometabolic risk and may serve as a therapeutic target.
La obesidad se asocia con resistencia a la insulina y enfermedad cardiovascular arterioesclerótica; sin embargo, este riesgo depende de la distribución del tejido adiposo en el cuerpo y principalmente del incremento y acumulación ectópica de grasa visceral1–3. El aumento del tejido adiposo visceral (TAV) conlleva no solo un mayor tamaño del adipocito, sino también una mayor expresión de adipocitoquinas proinflamatorias con efectos deletéreos tanto a nivel local como sistémico4. Es por esto que en los últimos años ha cobrado valor la cuantificación del TAV debido a que permite una mejor estratificación del riesgo cardiometabólico tanto a nivel individual como global.
Recientemente, el interés científico se ha centrado en el estudio de ciertos depósitos de grasa visceral extraabdominal, entre ellos el tejido adiposo epicárdico (TAE), que debido a su íntima relación con el miocardio y las arterias coronarias ha brindado nuevos conocimientos acerca de la asociación entre obesidad y enfermedad cardiovascular5. En este artículo de revisión nos centraremos en las características morfológicas, bioquímicas y clínicas que convierten al TAE en una valiosa herramienta para la evaluación integral del riesgo cardiovascular.
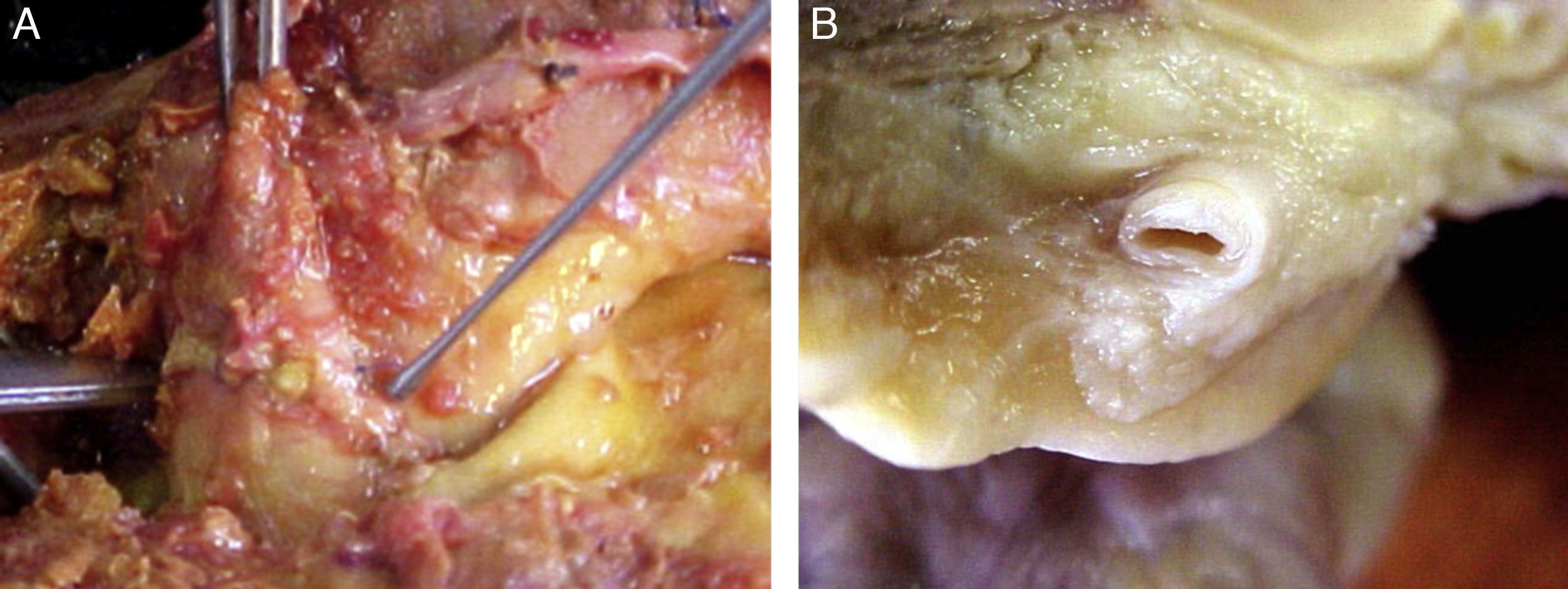
Características morfológicas del tejido adiposo epicárdicoLa presencia del TAE sobre el miocardio y alrededor de las arterias coronarias fue reconocida por los anatomistas a mediados del siglo xix6. Este tejido en la edad adulta tiende a ubicarse en los surcos auriculoventricular e interventricular extendiéndose hacia el ápex. Focos menores de grasa se encuentran localizados a nivel subepicárdico a lo largo de la pared libre de las aurículas7. Dado que el TAE se incrementa en personas obesas o con hipertrofia ventricular, este puede llegar a cubrir los espacios entre los ventrículos y en ocasiones recubrir por completo la superficie epicárdica. Además, una pequeña cantidad de tejido adiposo se extiende de la superficie epicárdica al miocardio, a menudo siguiendo la adventicia de las ramas de las arterias coronarias7,8. Resulta importante destacar que no hay fascia o tejidos similares que separen la grasa epicárdica del miocardio e inclusive de los vasos coronarios (fig. 1), lo cual implica que existe una interacción importante entre estas estructuras5,8. Recientemente, se ha sugerido una distinción anatómica entre la grasa epicárdica del miocardio y la grasa epicárdica pericoronaria9; sin embargo, se desconoce si estos 2 componentes del TAE son funcionalmente diferentes.
Localización del tejido adiposo epicárdico. A) Se observa la íntima relación anatómica que existe entre la grasa epicárdica y el miocardio. B) Tejido adiposo epicárdico alrededor de una de las arterias coronarias. Nótese que no existe fascia o tejidos similares que separen al tejido adiposo epicárdico de estas estructuras.
Histológicamente, el TAE está compuesto por adipocitos, tejido nervioso y ganglionar, así como células inflamatorias, estromales e inmunológicas10. Los adipocitos del TAE son de menor tamaño que los adipocitos subcutáneos y los de otros depósitos de TAV, siendo el tamaño un determinante de particular importancia en la expresión de adipocitoquinas por parte del TAE11,12.
Otro depósito de grasa localizado a nivel cardíaco es el tejido adiposo pericárdico (TAP), el cual a diferencia del TAE se localiza fuera del pericardio visceral y sobre la superficie externa del pericardio parietal13. El origen embriológico de ambos tejidos es distinto: el TAE se origina de la hoja esplacnopleural del mesodermo, mientras que el TAP se origina del mesénquima torácico primitivo que se divide para formar el pericardio parietal y la pared torácica externa. La circulación local es diferente también en ambos tejidos. La grasa epicárdica es irrigada por ramas de las arterias coronarias (comparte la misma microcirculación del miocardio) y la grasa pericárdica por las ramas pericardiofrénicas de la arteria mamaria interna13,14. Es debido a estas diferencias anatómicas y embriológicas que el TAE constituye el verdadero depósito de grasa visceral del corazón.
Características bioquímicas del tejido adiposo epicárdicoEl TAE tiene una serie de propiedades bioquímicas que lo diferencian de otros depósitos de grasa visceral. Entre ellas destacan su elevada tasa de captación y liberación de ácidos grasos libres, lo cual resulta de particular importancia ya que el miocardio usa y metaboliza ácidos grasos mediante el proceso de β-oxidación, siendo este el responsable del 50-70% de la energía del músculo cardíaco15. Además, el TAE expresa proteína fijadora de ácidos grasos tipo 4, la cual pudiera participar en el transporte de ácidos grasos desde el TAE hasta el miocardio16. Curiosamente, en sujetos con síndrome metabólico existe un incremento en la expresión de esta proteína16 y de igual forma se ha demostrado clínicamente que el aumento del TAE se relaciona con un mayor contenido lipídico intramiocárdico, lo cual condiciona a esteatosis cardíaca y finalmente a pérdida de función del miocardiocito17,18. De hecho, la sobrecarga de ácidos grasos en el corazón provoca hiperactivación de la β-oxidación, que conlleva a una excesiva formación de especies reactivas de oxígeno (ROS, del inglés reactive oxygen species), resultando en la modulación de la ATPasa del retículo sarcoplásmico, el cual es un contribuyente temprano en la disfunción diastólica del miocardio con resistencia a la insulina19. De igual forma, en modelos animales con sobreexpresión de la enzima acetil CoA sintetasa, la disfunción del ventrículo izquierdo ocurre en paralelo a una sobreestimulación de la oxidación y la formación de ROS y ceramida20. Estos hallazgos permiten sugerir que el TAE, en condiciones fisiológicas, actúa como un buffer que protege al corazón contra la lipotoxicidad y, además, provee al miocardio de los lípidos necesarios para la obtención de energía mediante la β-oxidación de ácidos grasos. En condiciones patológicas, como en el caso del síndrome metabólico, ocurre una disfunción del TAE que conlleva a una pérdida de su efecto cardioprotector21.
Tejido adiposo epicárdico y termogénesisEl tejido adiposo pardo está especializado en la disipación de energía a través de la producción de calor. Investigaciones recientes han demostrado que incluso los adultos presentan tejido adiposo pardo metabólicamente activo y que el mismo es capaz de tener un papel importante en la homeostasis energética22.
La característica principal de los adipocitos pardos es su alto contenido en mitocondrias23. Dichas organelas se encargan de producir energía mediante un gradiente de protones a través de la membrana mitocondrial interna. Esta energía es usada para sintetizar adenosín trifosfato (ATP) por medio de la enzima ATP sintasa. Los adipocitos pardos son clave en el proceso termogénico basados en la actividad de la proteína desacoplante 1 (UCP1, del inglés uncoupling protein 1), la cual es responsable del desacoplamiento de la fosforilación oxidativa y la cadena respiratoria, ocasionando la producción de calor debido a la pérdida de protones24. Recientemente, se ha descrito que la expresión de UCP-1 en el TAE es mayor que en otros depósitos de grasa, lo cual sugiere que este tejido podría servir para defender al miocardio y las arterias coronarias contra la hipotermia25. Esta hipótesis tiene soporte en modelos animales como los osos polares que cuentan con una importante adiposidad cardíaca que puede ser usada como depósito y fuente de energía durante los períodos de hibernación, y de igual forma puede defender al miocardio y las arterias coronarias contra las bajas temperaturas polares26.
Tejido adiposo epicárdico como órgano endocrinoEl TAE es un órgano metabólicamente activo que produce una serie de citoquinas, denominadas en conjunto adipocitoquinas, capaces de modular sustancialmente la morfología y la función cardiovascular10,27,28. Debido a su proximidad anatómica con el corazón y la ausencia de fascia o tejidos similares, el TAE puede interactuar localmente con las arterias coronarias a través de mecanismos de secreción paracrinos. Es plausible que la secreción paracrina de citoquinas desde el TAE periadventicio pueda atravesar la pared coronaria por difusión de afuera hacia adentro e interactuar con células en cada una de sus capas29. El fenómeno de arteriosclerosis por «difusión de afuera hacia adentro» ha sido propuesto desde el año 1989 por la observación de migración leucocitaria desde afuera hacia la pared del vaso30. Además, estudios in vivo realizados en cerdos han demostrado que la aplicación externa de citoquinas inflamatorias como interleucina 1β (IL-1β) y el factor quimioatrayente de monocitos tipo 1 (MCP-1, del inglés monocyte chemoattractant protein-1) en las arterias coronarias indujo incremento en el espesor de la íntima y remodelado arterial31,32. Otro mecanismo factible es la liberación de adipocitoquinas y ácidos grasos libres directamente desde el TAE hasta la vasa vasorum para ser transportado en la pared arterial de acuerdo con un mecanismo de secreción vasocrino29.
El perfil metabólico del TAE es francamente antagónico dependiendo del contexto metabólico del paciente. En condiciones fisiológicas, el TAE es capaz de sintetizar y secretar adiponectina, la cual posee propiedades antiaterogénicas y antiinflamatorias, muchas de ellas mediadas por la proteinquinasa dependiente de AMP (AMPK, del inglés AMP-activated protein kinase)33,34, relacionándose en diversos estudios con un menor riesgo de infarto agudo al miocardio35,36. Consistente con lo anterior, se ha descrito en pacientes con enfermedad arterial coronaria una disminución en la expresión de adiponectina por parte del TAE37, lo cual podría ser un factor contribuyente en la génesis del proceso arteriosclerótico. De igual forma, el TAE expresa adrenomedulina, una hormona peptídica con efectos pleiotrópicos a nivel vascular38 y que se encuentra aumentada en enfermedades como arteriosclerosis39, hipertensión arterial40, insuficiencia cardíaca41, diabetes mellitus42 y enfermedad renal crónica43, posiblemente como mecanismo compensatorio ante el proceso de disfunción endotelial presente en estas enfermedades. Recientemente, hemos descrito en pacientes con síndrome metabólico una asociación significativa entre el espesor del TAE medido por ecocardiografía y los niveles plasmáticos de adrenomedulina44; sin embargo, en pacientes con enfermedad arterial coronaria la evidencia es contradictoria ya que Iacobellis et al.45 describieron una disminución en la expresión de adrenomedulina por parte del TAE de pacientes con enfermedad arterial coronaria, mientras que Silaghi et al.46 encontraron una mayor expresión de adrenomedulina por parte de este tejido en la misma situación clínica. Las razones para estas diferencias pudieran estar en que el grupo de pacientes estudiados por Iacobellis et al. era de mayor edad y más delgados que los estudiados por Silaghi et al., siendo plausible que la edad y la masa grasa interfieran en la expresión de esta adipocitoquina por parte del TAE.
Por otra parte, en condiciones patológicas como la obesidad, el TAE se expande tornándose hipóxico y disfuncional y es invadido por células fagocíticas47,48. Los cambios en el tamaño del adipocito epicárdico y el incremento en el número de macrófagos y linfocitos T aumentan la secreción de citoquinas proinflamatorias como factor de necrosis tumoral alfa (TNF-α, del inglés tumor necrosis factor-alpha), MCP-1, IL-1β, IL-6, resistina y muchos otros que contribuyen al entorno inflamatorio propio de la arterogénesis10,49,50. De igual forma, el TAE pericoronario es capaz de secretar leptina e inducir disfunción endotelial mediante la inhibición de la sintasa de óxido nítrico, a través de vías dependientes de la proteinquinasa C (PKC, del inglés protein kinase C)51,52. Estos hallazgos confirman que el TAE podría tener un papel determinante en el inicio del proceso arterioesclerótico, en virtud de la íntima relación anatómica entre estas estructuras. Se postula que un mecanismo dependiente de la masa del TAE sea el que regule el perfil metabólico de este tejido (fig. 2)27; sin embargo, algunos factores pueden de igual manera influir en tal equilibrio. Recientemente, se ha descrito en modelos animales que la deficiencia de vitamina D se asocia con un incremento en la expresión de marcadores inflamatorios a nivel del TAE53. Si este mecanismo opera de igual manera en los humanos se desconoce.
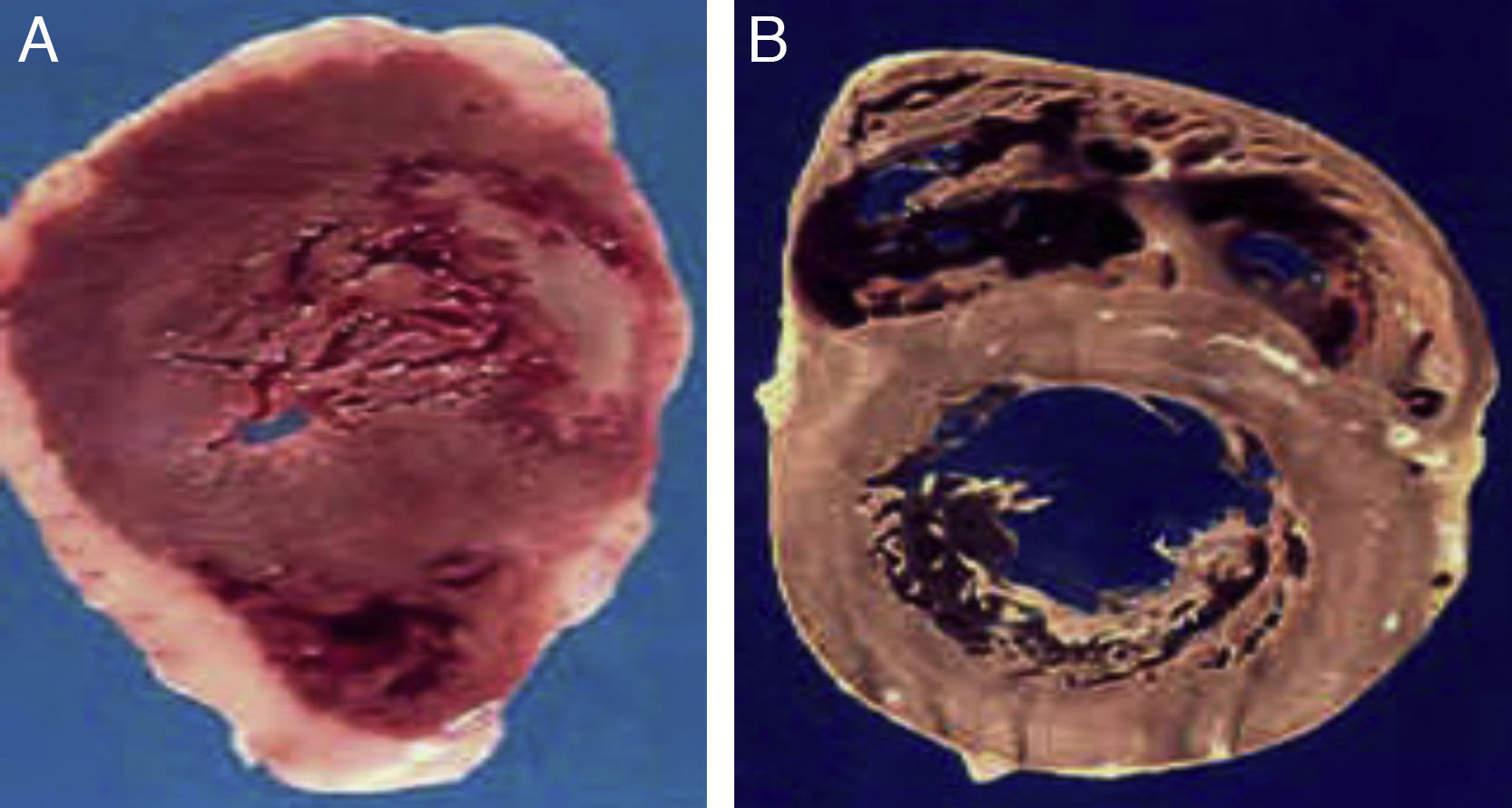
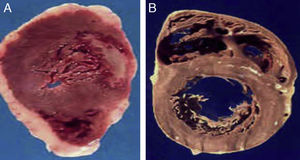
A) Corazón de un paciente de 48 años, obeso y diabético de tipo 2 que falleció de infarto agudo al miocardio. B) Corazón de un paciente de 45 años, sin factores de riesgo, quien falleció por causas violentas. Nótese el gran espesor del tejido adiposo epicárdico en el paciente A comparado con el paciente B.
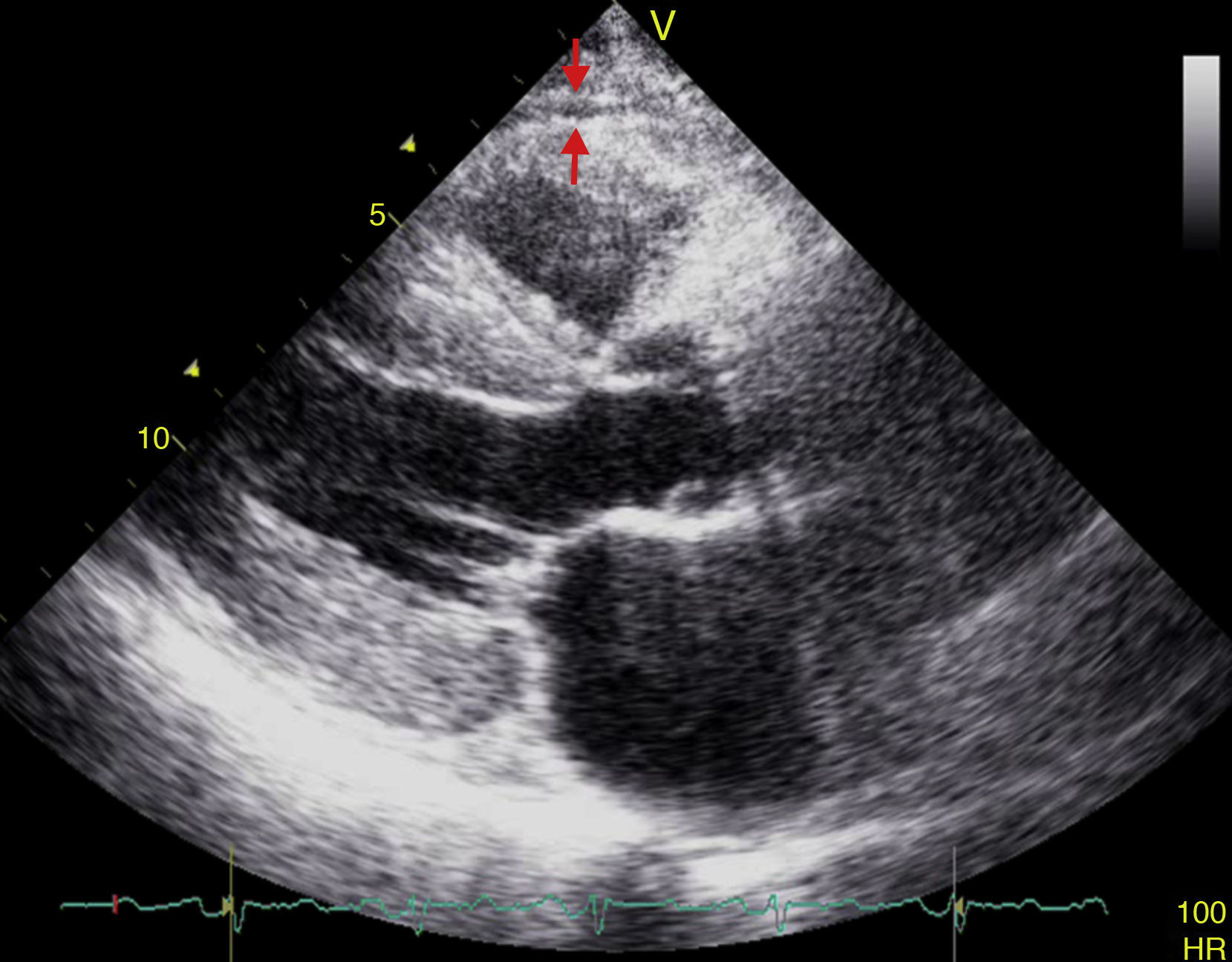
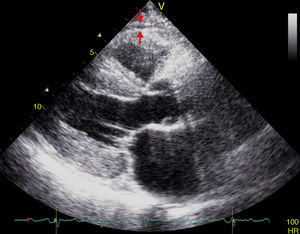
El espesor del TAE puede ser medido con ecocardiografía transtorácica bidimensional (2D) estándar, usando para ello equipos disponibles comercialmente tal y como fue propuesto y validado por Iacobellis et al.54,55. La vista en eje paraesternal largo y paraesternal corto en 2D permite medir con mayor exactitud el espesor de la grasa epicárdica en el ventrículo derecho56. Ecocardiográficamente, el TAE se identifica como el espacio entre la pared externa del miocardio y la capa visceral del pericardio. Este espesor es medido perpendicularmente sobre la pared libre del ventrículo derecho al final de la sístole en 3 ciclos cardíacos (fig. 3)57. La razón por la cual la grasa epicárdica debe ser medida al final de la sístole es que durante la diástole esta es comprimida, dando lugar a medidas poco exactas. Posteriormente, se obtiene el valor promedio que resulta de la medición ecocardiográfica del TAE en 3 ciclos cardíacos y este se considerará el valor de espesor de grasa epicárdica del paciente en cuestión56,57.
Los estudios poblacionales han demostrado poca variabilidad intraobservador e interobservador55,58. Además, la medición ecocardiográfica del espesor del TAE es un método no invasivo, confiable, fácilmente reproducible y constituye una medida directa de la verdadera grasa visceral del corazón, que puede ser realizado de rutina en pacientes considerados de alto riesgo cardiometabólico sin ningún costo adicional, ya que no requiere preparación previa y se realiza en una vista ecocardiográfica paraesternal larga o paraesternal corta utilizadas a menudo para evaluar otros parámetros cardiovasculares tradicionales. Indudablemente, la medición de la circunferencia abdominal es el marcador de grasa visceral más económico y accesible; sin embargo, este resulta poco sensible y específico para medir adiposidad visceral ya que incluye adiposidad subcutánea, la cual no se asocia con riesgo cardiometabólico59. A pesar de estas ventajas, la ecocardiografía puede no ser la técnica óptima para la cuantificación del TAE, dado que este método nos permite obtener medidas lineales en una localización simple y por ende no refleja el volumen del TAE, a diferencia de otros métodos de imágenes más sensibles y específicos como la tomografía computarizada multicorte (TCM) y la resonancia magnética (RM), las cuales son consideradas las pruebas de oro para la cuantificación del TAV en virtud de la exactitud en las medidas, la baja variabilidad y alta reproducibilidad de los resultados, teniendo pocas ventajas un método con respecto al otro60. Con la TCM es posible cuantificar el TAE en términos de volumen, así como también obtener información acerca de la calcificación de las arterias coronarias y visualizar los sitios de estenosis y su distribución a lo largo de estos vasos61. La medición del volumen del TAE por TCM se realiza a menudo mediante el trazado de regiones de interés en una vista de eje corto. Los voxels de tejido adiposo se identifican habitualmente entre -190 a -30 unidades Houndsfield y el volumen del TAE se obtiene sumando áreas trazadas medidas desde el ápex del corazón al centro de la aurícula izquierda. A pesar de la alta resolución espacial de la TCM, este método cuenta con desventajas importantes como la exposición a radiaciones ionizantes, su laboriosidad y sobre todo su alto costo, lo cual lo convierte en un método poco práctico y accesible para el médico clínico en su praxis diaria. Al igual que con la TCM, con la RM se realiza un trazado de los contornos del TAE y los voxels de tejido adiposo en los cortes son sumados a fin de calcular el volumen de este tejido; sin embargo, este también constituye una técnica de imagen muy laboriosa, e inclusive de mayor costo que la TCM, y además estudios como el realizado por Iacobellis et al.62 han demostrado una buena correlación entre la medición del TAE por ultrasonido y el TAV por RM.
Tejido adiposo epicárdico y síndrome metabólicoEl corazón y las arterias coronarias están rodeados por una cantidad significativa de tejido adiposo. El espesor del TAE a nivel de la pared libre del ventrículo derecho es normalmente inferior a 7mm en sujetos sanos y delgados57; sin embargo, el volumen de grasa alrededor del corazón es mayor en hombres que en mujeres y, al igual que la circunferencia abdominal, varía de acuerdo al grupo étnico57,63.
El síndrome metabólico constituye un grupo de hallazgos clínicos y bioquímicos con un mecanismo patogénico común, que es el incremento de la adiposidad visceral y la resistencia insulínica64,65. Se ha demostrado una relación positiva entre el TAE y los componentes del síndrome metabólico44,62. De hecho, el volumen de grasa epicárdica se incrementa gradualmente con el número de componentes del síndrome metabólico61,66 e, incluso cuando otros parámetros cardiometabólicos son considerados por separado, el TAE se asocia independientemente con la presión arterial62, el colesterol de lipoproteína de baja densidad (LDL, del inglés low density lipoprotein)62, la glucemia en ayuna67 y la resistencia insulínica68. Destaca que en niños con obesidad el TAE ha demostrado ser un buen indicador de adiposidad visceral pero no un predictor independiente del síndrome metabólico, lo cual sugiere que el valor pronóstico de este tejido difiere de acuerdo al grupo etario69.
Grasa epicárdica y cambios en la morfología cardíacaEn los últimos años ha sido objeto de estudio la relación entre el TAE y los cambios en la morfología y función del corazón. Se ha demostrado que existe una fuerte asociación entre hipertrofia del ventrículo izquierdo y el espesor del TAE independientemente del grado de adiposidad general del individuo70. Varios mecanismos pueden explicar esta asociación, entre ellos:
- 1.
El TAE en cantidades excesivas constituye una carga para el corazón, lo cual puede conllevar al remodelado cardíaco compensatorio71.
- 2.
El incremento en el TAE se asocia con un mayor contenido lipídico intramiocárdico y por ende con esteatosis miocárdica y lipotoxicidad, que pueden provocar adaptaciones estructurales y funcionales adversas incluyendo cardiomiopatía17,18,72.
- 3.
El TAE puede afectar la morfología cardíaca a través del efecto tanto local como sistémico de las adipocitoquinas que sintetiza ya que algunas de ellas son capaces de inducir remodelado cardíaco10,29. Además, a nivel sistémico, el TAE puede producir resistencia a la insulina, la cual serviría como intermediaria entre la grasa visceral y la hipertrofia del ventrículo izquierdo a través de la acción mitogénica directa de la insulina en la célula miocárdica, la activación del sistema nervioso simpático y el sistema renina angiotensina, particularmente la angiotensina ii cuya acción sobre los receptores AT1 es capaz de producir proliferación celular miocárdica y a nivel de la capa glomerular de la corteza suprarrenal estimular la síntesis y secreción de aldosterona produciendo reabsorción de agua y sodio, expansión del volumen extracelular y por último hipertrofia ventricular73,74.
De igual forma, el espesor del TAE se relaciona significativamente con el tamaño de la cavidad del ventrículo derecho e inclusive con las dimensiones auriculares y el riesgo de fibrilación auricular en individuos obesos75–77.
Tejido adiposo epicárdico y su relación con la enfermedad arterial coronariaEn la mayoría de los estudios clínicos el aumento del TAE se ha asociado con estenosis de las arterias coronarias. En el estudio llevado a cabo por Jeong et al.78 en 203 pacientes con criterios angiográficos de enfermedad arterial coronaria se utilizó el score de Gensini para evaluar la extensión y el grado de severidad de la misma, encontrando que los pacientes con mayor espesor de grasa epicárdica medida por ecocardiografía (≥7,6mm) presentaban un mayor score de Gensini (p=0,014). Más aún, Yun et al.79 evaluaron 153 pacientes quienes ingresaron para angiografía coronaria por dolor torácico, excluyendo del estudio aquellos con infarto agudo al miocardio previo, insuficiencia cardíaca congestiva y miocardiopatías. A estos pacientes se les realizó la medición del TAE mediante ecocardiografía transtorácica, demostrando que los pacientes sin estenosis significativa presentaron un espesor de TAE de 1,76±1,36mm vs. 3,39±1,64mm en pacientes con enfermedad coronaria de un solo vaso y 4,12±2,03mm en pacientes con enfermedad coronaria de múltiples vasos (p<0,001).
Es conocido que los pacientes con diabetes mellitus de tipo 2 presentan un mayor riesgo de enfermedad arterial coronaria. En tal sentido, Wang et al.80 compararon un total de 49 pacientes con diabetes mellitus de tipo 2 y 78 controles no diabéticos. Se determinó el volumen del TAE por TCM, el score de Gensini y la calcificación de las arterias coronarias y se relacionaron con los criterios clínicos y bioquímicos del síndrome metabólico, encontrando que los pacientes con diabetes de tipo 2 presentaron un mayor volumen de TAE en comparación con los controles no diabéticos (166,1±60,6cm3 vs. 123,4±41,8cm3, p<0,0001). Además, el volumen del TAE se asoció con los componentes del síndrome metabólico y con mayor severidad de arteriosclerosis coronaria.
Recientemente, 2 estudios longitudinales81,82 parecen apoyar la hipótesis de señalización «de afuera hacia adentro» como causa de arteriosclerosis. En ellos, se midió el volumen del tejido adiposo intratorácico y epicárdico, encontrando que un incremento en el volumen de los mismos se asoció con una mayor incidencia de enfermedad arterial coronaria y con mayores eventos cardíacos adversos. Se destaca el hallazgo reciente de que la relación entre el espesor del TAE y la enfermedad arterial coronaria es independiente de la presencia o no de obesidad83. De igual forma, los estudios in vivo han demostrado una fuerte asociación entre espesor íntima media carotídeo, como marcador de arteriosclerosis subclínica, y espesor de TAE medido por ecocardiografía84,85. Es importante destacar que el volumen del TAE es un determinante independiente de la presencia de oclusión total de las arterias coronarias66,86 y por ende, debido a que la oclusión total de las coronarias causa inestabilidad de la placa, es posible que el TAE se asocie con mayor vulnerabilidad de la misma. Esta hipótesis es reforzada por el hecho de que se ha demostrado un mayor volumen de grasa epicárdica en pacientes con placas no calcificadas comparado con pacientes con placas calcificadas87, lo cual influye en el desarrollo del síndrome coronario agudo ya que las placas no calcificadas tienden a menudo a ser más vulnerables.
A pesar de lo contundente de estos estudios, permanece poco claro si el TAE tiene un papel causal en el desarrollo de arteriosclerosis coronaria ya que, por ejemplo, pacientes con lipodistrofia congénita generalizada desarrollan arteriosclerosis coronaria aún en ausencia de un exceso de adiposidad visceral, incluyendo el TAE8; sin embargo, existen tanto en humanos como en animales variantes anatómicas denominadas puentes intramiocárdicos que consisten en arterias coronarias con un trayecto intramiocárdico no rodeado de tejido adiposo perivascular, los cuales se mantienen libres de arteriosclerosis, mientras que el segmento proximal al puente presenta arteriosclerosis abundante, mucho más cuando el puente es largo y grueso, posiblemente debido a factores hemodinámicos88,89. Además, un metaanálisis reciente que incluyó 2.872 pacientes demostró que el espesor y el volumen del TAE es mayor en pacientes con enfermedad coronaria y aquellos pacientes en el tercil más alto del TAE estuvieron más propensos a presentar enfermedad arterial coronaria en comparación con aquellos en el tercil más bajo90.
Tejido adiposo epicárdico, ¿un nuevo blanco terapéutico?El creciente interés en el TAE no solo se limita a su importancia como marcador de riesgo cardiometabólico, sino también a su posible uso como blanco terapéutico. La pérdida de peso se asocia con una disminución sustancial de TAV, lo cual mejora el perfil cardiometabólico de los pacientes obesos. Esta reducción de peso puede alcanzarse a través de programas nutricionales basados en dietas hipocalóricas, ejercicio aeróbico, cirugía bariátrica y en menor cuantía a través de tratamiento farmacológico64,91. En tal sentido, Kim et al.92 demostraron que una dieta hipocalórica (con reducción del 26,8% de la ingesta calórica diaria) en sujetos obesos a lo largo de 12 semanas produjo una reducción del 17,2% (p<0,001) de espesor del TAE determinado por ecocardiografía transtorácica. Se destaca que en este estudio la reducción del espesor de grasa epicárdica fue más rápida y mayor que la disminución en otros índices de adiposidad tradicionales como la circunferencia abdominal (-9%) y el índice de masa corporal (IMC) (-11%), siendo estos resultados similares a los reportados en otros estudios93. De igual forma, el ejercicio aeróbico en pacientes obesos disminuye significativamente el espesor del TAE y además esta disminución se relaciona con una mejoría en la presión arterial sistólica y en la sensibilidad insulínica en este grupo de pacientes94.
La cirugía bariátrica también ha demostrado ser efectiva para reducir el espesor del TAE. Willens et al.95 demostraron en 23 pacientes con obesidad mórbida, quienes perdieron posterior a la cirugía un promedio de 40±14kg, que lograban reducir su espesor del TAE de 5,2±2,4mm a 4,0±1,6mm (p<0,001), lo cual demuestra el beneficio de este procedimiento quirúrgico en el perfil cardiometabólico de los pacientes obesos.
Resulta interesante que fármacos con beneficio comprobado en la reducción del riesgo cardiovascular como la atorvastatina han demostrado ser capaces de reducir el espesor del TAE, aunque el mecanismo de tal efecto se desconoce96; y por su parte, pioglitazona en pacientes con síndrome metabólico y diabetes de tipo 2 con enfermedad coronaria es efectiva en la modulación de genes pro y antiinflamatorios en el TAE97.
El uso del TAE como blanco terapéutico también ha sido evaluado en otras enfermedades como el déficit de hormona de crecimiento, tanto en edad infantil como en edad adulta, en los cuales se ha demostrado que el tratamiento sustitutivo con hormona de crecimiento recombinante es capaz de reducir el espesor del TAE debido a su efecto lipolítico98,99. Asimismo, pacientes infectados con el virus de inmunodeficiencia humana (VIH) en terapia antiretroviral presentan un mayor espesor del TAE en comparación con pacientes infectados por el VIH sin terapia100.
ConclusionesA pesar de que la presencia del TAE sobre el miocardio y las arterias coronarias es conocida desde el siglo xix, es recientemente cuando se le ha comenzado a prestar atención como una novedosa herramienta para la estratificación del riesgo cardiometabólico. Aún con los avances tecnológicos de nuestro siglo, es mucho lo que aún se desconoce acerca de este extraordinario depósito de grasa visceral, cuyo estudio a futuro continuará brindando nuevas luces tanto a médicos clínicos como investigadores en la comprensión de la obesidad como agente causal de enfermedad cardiovascular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.