Pese a sus efectos beneficiosos, se desconoce si el ácido linoleico conjugado (conjugated linoleic acid, CLA) podría producir efectos adversos al ser administrado de forma crónica. Considerando este hecho y dada la controvertida eficacia del CLA en humanos, en los últimos años el ácido linolénico conjugado (CLNA, conjugated linolenic acid) se ha descrito como alternativa al CLA, con un potencial funcional para la prevención de la obesidad, además de tener otros efectos positivos relacionados con la misma.
A la vista de los resultados descritos, en lo que respecta a la obesidad, no parece que el CLNA sea una molécula más prometedora que el CLA, dado que el efecto generalmente tiene lugar a dosis más elevadas que las dosis efectivas de CLA. No obstante, dado el escaso número de estudios realizados hasta la fecha, todavía resulta difícil llegar a conclusiones claras acerca del potencial uso de estos CLNA en obesidad y alteraciones relacionadas con ella (resistencia a la insulina, dislipidemias o inflamación).
Despite its benefits, conjugated linoleic acid (CLA) may cause side effects after long-term administration. Because of this and utsthe controversial efficacy of CLA in humans, alternative biomolecules that may be used as functional ingredients have been studied in recent years. Thus, conjugated linolenic acid (CLNA) has been reported to be a potential anti-obesity molecule which may have additional positive effects related to obesity.
According to the results reported in obesity, CLNA needs to be given at higher doses than CLA to be effective. However, because of the few studies conducted so far, it is still difficult to reach clear conclusions about the potential use of these CLNAs in obesity and its related changes (insulin resistance, dyslipidemia, or inflammation).
El término general de ácidos grasos conjugados hace referencia a isómeros posicionales y geométricos de ácidos grasos con dobles enlaces conjugados. Hasta la fecha, los más estudiados han sido los isómeros del ácido linoleico conjugado, recogidos bajo el acrónimo de CLA (conjugated linoleic acid). Son numerosos los efectos fisiológicos beneficiosos atribuidos a este conjunto de ácidos grasos (anticancerígeno, antiaterogénico, mejora de la función inmune, disminución de la acumulación de grasa, disminución de la inflamación y aumento de la masa muscular). Estos efectos se han asociado al sistema de doble enlace conjugado y se deben frecuentemente a la acción individual de sus 2isómeros más abundantes cis-9,trans-11 y trans-10,cis-12.
Es importante resaltar que, pese a sus efectos beneficiosos, el CLA podría producir efectos adversos. Si bien pocos estudios se han centrado en analizar esta posible toxicidad, varios autores han descrito, en animales de experimentación, efectos tales como resistencia a la insulina, aumento en la proteína C reactiva o esteatosis hepática1,2. No obstante, en 2010 la European Food Safety Authority (EFSA) puso de manifiesto que en humanos con normopeso, sobrepeso y sin antecedentes de diabetes la administración de una mezcla equimolecular de los isómeros cis-9,trans-11 y trans-10,-12 del CLA a una dosis de 3,5g durante 6meses no producía efectos adversos a niveles de sensibilidad a la insulina y control glucémico o función hepática3. A pesar de ello, son necesarios más estudios para determinar tanto los efectos a más largo plazo como la seguridad para pacientes diabéticos tipo2. De hecho, según concluyó el panel de expertos de la EFSA, en el caso concreto de este tipo de pacientes la mezcla equimolecular de isómeros de CLA parecía afectar de forma negativa a los marcadores dinámicos (ISI, OGIS) y estáticos (HOMA-IR) de sensibilidad a la insulina e incrementó algunos indicadores de inflamación subclínica (15-keto-dihidroprostaglandinaF2 y proteína C reactiva).
Numerosos estudios han demostrado que el CLA, y más concretamente los isómero cis-9,trans-11 y trans-10,cis-12, producen efectos beneficiosos en diferentes especies animales (ratón, rata, hámster, cerdo)4,5. Por el contrario, la efectividad del CLA en humanos es más controvertida (tabla 1)6-15. A modo de ejemplo cabe destacar que mientras varios autores han observado efectos como la reducción en la acumulación grasa, otros no los han encontrado6-9. Además, cuando este efecto ha sido descrito es menos prominente que en roedores.
Efectos del CLA en humanos
| Isómero | Tiempo de tratamiento/dosis | Efecto | Autor | Modelo estudio |
| Efectos en la reducción de grasa en humanos obesos | ||||
| cis-9,trans-11-CLA | 12 semanas; 3g CLA/d | Aumento significativo en peso corporal | Risérus et al. (2004)6 | 25H |
| Mezcla de isómeros CLA (Clarinol®) | 6meses; 3,4g CLA/d | Disminución de la masa grasa 1% a los 3meses y 3,4% a los 6meses | Gaullier et al. (2007)7 | 93M/93H |
| Mezcla de isómeros CLA | 16semanas; 6,4g CLA/d | Reducción IMC y masa grasa | Norris et al. (2009)8 | 35M |
| Productos cárnicos y lácteos enriquecidos con CLA procedentes de ganado de pastoreo | 56días; 1,17g CLA/d | Ausencia de efecto en el peso corporal, la masa grasa y la muscular | Brown et al. (2011)9 | 18M |
| Efectos en la lipidemia | ||||
| Mezcla de isómeros CLA | 8semanas; 0,7g CLA/d: semanas 1-4, y 1,4g CLA/d: semanas 5-8 | Disminución significativa de colesterolHDL | Mougios et al. (2001)10 | 13H/9M |
| Mezcla de isómeros CLA o 80:20 cis-9,trans-11 y trans-10,cis-12-CLA | 8semanas; 3g 50:50 CLA/d o 3g 80:20 CLA/d | Disminución de TG en el caso de la mezcla 50:50 y disminución de VLDL en el caso de la mezcla 80:20 | Noone et al. (2002)11 | 18H/33M |
| Productos cárnicos y lácteos enriquecidos con CLA procedentes de ganado de pastoreo | 56días; 1,17g CLA/d | Ausencia de cambios en CT, TG, HDL, LDL, VLDL o IDL | Brown et al. (2011)9 | 18M |
| Efectos en la resistencia a la insulina y diabetes | ||||
| Mezcla de isómeros CLA o trans-10,cis-12-CLA | 12semanas; 3,4g CLA/d o t-10,c12- CLA/d | t10,c12-CLA: aumento de resistencia a la insulina y glucemia | Risérus et al. (2002)12 | 57H |
| cis-9,trans-12-CLA | 12semanas; 3g CLA/d | c9,t11-CLA: aumento de resistencia a la insulina en hombres obesos | Risérus et al. (2004)6 | 25H |
| Mezcla de isómeros CLA | 8 semanas; 4g CLA/d | Mejora de resistencia a la insulina a través de una disminución de la liberación de insulina en ayuno | Eyjolfson et al. (2004)13 | 4H/12M |
| Efectos en la inflamación | ||||
| cis-9,trans-11-CLA o trans-10,cis-12-CLA | 13 semanas ; 3g c9,t11-CLA o t10,c12-CLA/d | Ausencia de cambios en PCR, IL-6, IL-8 y TNFα | Ramakers et al. (2005)14 | 38H/38M |
| Mezcla de isómeros CLA | 12semanas; 3g CLA/d | Disminución en de citoquinas proinflamatorias, TNFα e IL-1β. Aumento de citoquina antiinflamatoria: IL-10 | Song et al. (2005)15 | 8H/20M |
CT: colesterol total; H: hombres; IL: interleucina; IMC: índice de masa corporal; M: mujeres; Mezcla de isómeros CLA: 50:50 cis-9, trans-11- y trans-10, cis-12-CLA; TG: triglicéridos, TNF: factor de necrosis tumoral.
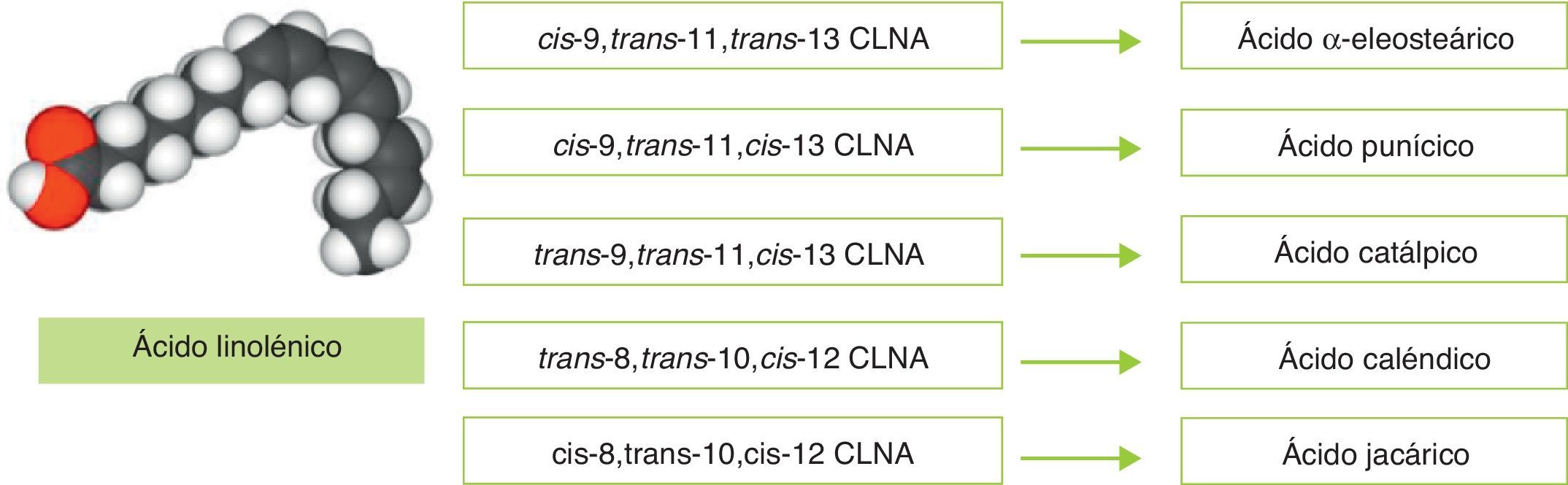
Considerando la controvertida eficacia del CLA en humanos y la ausencia de información fiable acerca de los efectos del CLA administrado de forma prolongada (en períodos superiores a 6meses), se hace conveniente la búsqueda de biomoléculas alternativas que puedan utilizarse como ingredientes funcionales en la prevención de la obesidad. En esta línea el ácido linolénico conjugado (CLNA, conjugated linolenic acid) se ha presentado como una molécula con capacidad para reducir la grasa corporal, además de tener otros efectos positivos sobre la salud. En realidad, CLNA es un término colectivo que describe un grupo de isómeros posicionales y geométricos del ácido linolénico (C18:3), en los cuales al menos 2dobles enlaces están conjugados (contiguos), no separados por grupos metileno como ocurre en el ácido linolénico (fig. 1)16. Este grupo de isómeros únicamente se diferencia de los isómeros del CLA en que poseen un tercer doble enlace.
La presencia de 3dobles enlaces en la molécula de ácido linolénico hacen que existan múltiples isómeros posicionales y geométricos. Cabe reseñar que los trabajos de Bassaganya-Riera et al. indican que la presencia de dobles enlaces conjugados en los ácidos grasos incrementa su actividad biológica y los habilita para actuar como agonistas de receptores nucleares17. Más concretamente, estudios in vitro han propuesto que ciertos isómeros de CLNA derivados de plantas —caso del ácido punícico y del ácido α-eleosteárico— pueden actuar como agonistas naturales de receptores activados por proliferadores de peroxisomas (PPAR)18,19.
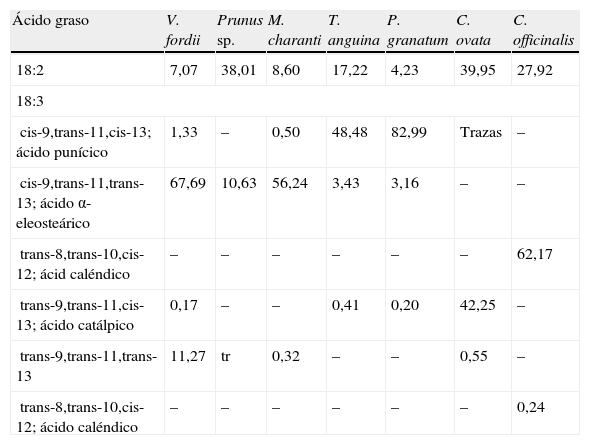
Mientras que el CLA se encuentra de forma natural en los alimentos obtenidos de animales rumiantes (ganado vacuno, ovino y caprino principalmente), y en la leche y sus derivados en cantidades muy pequeñas que representan hasta el 0,65% del total de ácidos grasos20, los isómeros de CLNA aparecen en cantidades más elevadas en los alimentos y productos de origen vegetal. Tal y como Takagi e Itabashi (1981)21 documentaron, los aceites de semilla de Tung (Vernicia fordii) y melón amargo (bitter gourd, Momordica charantia) contienen 67,7 y 56,2% de ácido α-eleosteárico (cis-9,trans-11,trans-13 CLNA) respectivamente, mientras que los extraídos de granada (pomegranate, Punica granatum), catalpa (Catalpa ovata) y caléndula (pot marigold, Calendula officinalis) contienen 83% de ácido punícico (cis-9,trans-11,cis-13 CLNA), 42,3% de ácido catálpico (trans-9,trans-11,cis-13 CLNA) y 62,2% de ácido caléndico (trans-8,trans-10,cis-12 CLNA), respectivamente (tabla 2).
Contenido de isómeros de ácidos linoleico conjugado y ácido linolénico conjugado en varios aceites de semilla
| Ácido graso | V. fordii | Prunus sp. | M. charanti | T. anguina | P. granatum | C. ovata | C. officinalis |
| 18:2 | 7,07 | 38,01 | 8,60 | 17,22 | 4,23 | 39,95 | 27,92 |
| 18:3 | |||||||
| cis-9,trans-11,cis-13; ácido punícico | 1,33 | – | 0,50 | 48,48 | 82,99 | Trazas | – |
| cis-9,trans-11,trans-13; ácido α-eleosteárico | 67,69 | 10,63 | 56,24 | 3,43 | 3,16 | – | – |
| trans-8,trans-10,cis-12; ácid caléndico | – | – | – | – | – | – | 62,17 |
| trans-9,trans-11,cis-13; ácido catálpico | 0,17 | – | – | 0,41 | 0,20 | 42,25 | – |
| trans-9,trans-11,trans-13 | 11,27 | tr | 0,32 | – | – | 0,55 | – |
| trans-8,trans-10,cis-12; ácido caléndico | – | – | – | – | – | – | 0,24 |
Valores expresados en porcentaje.
Modificado de Takagi e Itabashi21.
Teniendo en cuenta, como ya se ha señalado, que la eficacia del ácido linoleico conjugado como molécula anti-obesidad para seres humanos sigue siendo una cuestión sometida a debate, algunos trabajos científicos han empezado a centrarse en la investigación de isómeros del CLNA eficaces para prevenir esta enfermedad (tabla 3).
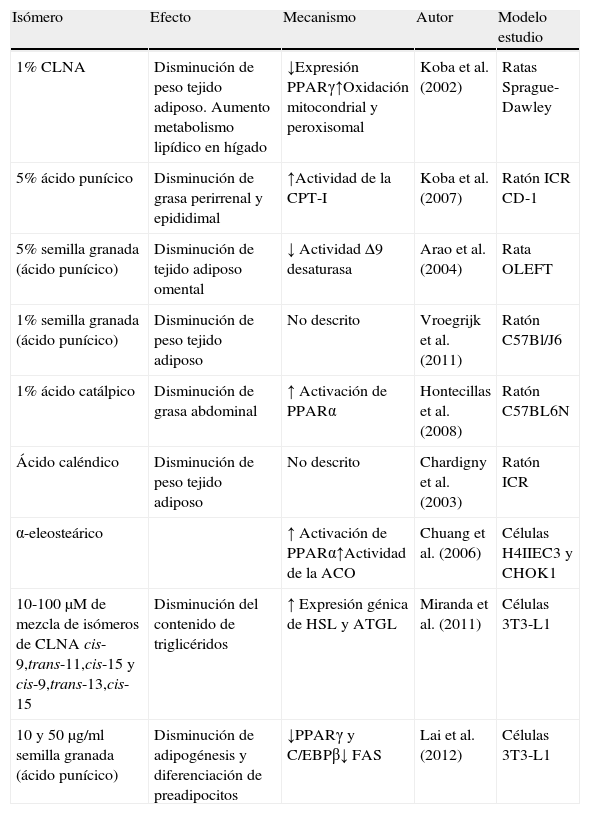
Resumen de efectos positivos de isómeros del CLNA sobre reducción de grasas
| Isómero | Efecto | Mecanismo | Autor | Modelo estudio |
| 1% CLNA | Disminución de peso tejido adiposo. Aumento metabolismo lipídico en hígado | ↓Expresión PPARγ↑Oxidación mitocondrial y peroxisomal | Koba et al. (2002) | Ratas Sprague-Dawley |
| 5% ácido punícico | Disminución de grasa perirrenal y epididimal | ↑Actividad de la CPT-I | Koba et al. (2007) | Ratón ICR CD-1 |
| 5% semilla granada (ácido punícico) | Disminución de tejido adiposo omental | ↓ Actividad Δ9 desaturasa | Arao et al. (2004) | Rata OLEFT |
| 1% semilla granada (ácido punícico) | Disminución de peso tejido adiposo | No descrito | Vroegrijk et al. (2011) | Ratón C57Bl/J6 |
| 1% ácido catálpico | Disminución de grasa abdominal | ↑ Activación de PPARα | Hontecillas et al. (2008) | Ratón C57BL6N |
| Ácido caléndico | Disminución de peso tejido adiposo | No descrito | Chardigny et al. (2003) | Ratón ICR |
| α-eleosteárico | ↑ Activación de PPARα↑Actividad de la ACO | Chuang et al. (2006) | Células H4IIEC3 y CHOK1 | |
| 10-100μM de mezcla de isómeros de CLNA cis-9,trans-11,cis-15 y cis-9,trans-13,cis-15 | Disminución del contenido de triglicéridos | ↑ Expresión génica de HSL y ATGL | Miranda et al. (2011) | Células 3T3-L1 |
| 10 y 50μg/ml semilla granada (ácido punícico) | Disminución de adipogénesis y diferenciación de preadipocitos | ↓PPARγ y C/EBPβ↓ FAS | Lai et al. (2012) | Células 3T3-L1 |
ACO: acil-CoA oxidasa; ATGL: triglicérido lipasa; C/EBP: proteínas que se ligan al elemento CAAT del promotor. CPT-I: carnitina palmitoiltransferasa-I; FAS: ácido graso sintasa; HSL: lipasa sensible a hormonas; PPAR: receptor activado por proliferadores de peroxisomas.
Estudios in vitro llevados a cabo con adipocitos 3T3-L1 y con células HepG2 han puesto de manifiesto el efecto activador del ácido punícico y del ácido α-eleosteárico sobre receptores nucleares PPARα y PPARγ17-19. En investigaciones llevadas a cabo por nuestro grupo de investigación hemos encontrado efectos semejantes con la mezcla de isómeros de CLNA cis-9,trans-11,cis-15 y cis-9,trans-13,cis-15 en células HEK293. Estos isómeros fueron capaces de activar el elemento respondedor de PPAR en células que sobre-expresan la proteína PPARα22. Estos resultados sugieren que los isómeros de CLNA pueden incrementar la tolerancia a la glucosa, aumentar la oxidación de ácidos grasos y reducir el fenómeno de inflamación relacionado con la obesidad.
Recientemente, Lai et al.23 han demostrado una reducción de la expresión de genes que controlan el proceso de diferenciación, tales como PPARγ, y C/EBPβ, y de la ácido graso sintasa, un enzima que incrementa la acumulación de triglicéridos, en pre-adipocitos 3T3-L1 tratados con ácido punícico. En el mencionado estudio de nuestro grupo de investigación han permitido proponer otro mecanismo de acción para los isómeros del CLNA. Concretamente se ha demostrado que diferentes dosis (10-100μM) de los isómeros de CLNA cis-9,trans-11,cis-15 y cis-9,trans-13,cis-15 reducen el contenido de triglicéridos de adipocitos 3T3-L1, aumentando la expresión génica de enzimas clave en la lipólisis22.
En un estudio realizado con el fin de comparar los efectos del CLA y del CLNA en ratas, Koba et al.24 observaron que la inclusión al 1% de una mezcla de isómeros de CLNA sin identificar en la dieta producía una reducción del peso del tejido adiposo incluso mayor que la inducida por el CLA. Del mismo modo, la ingesta de CLNA afectaba de forma mucho más acusada que el propio CLA al metabolismo lipídico en hígado. En concreto, incrementaba en mayor medida la oxidación de ácidos grasos, tanto mitocondrial como peroxisomal.
El mismo grupo de investigación realizó posteriormente más estudios con CLNA, pero en este caso con un isómero concreto, el ácido punícico (cis-9,trans-11,cis-13CLNA)25. En un estudio llevado a cabo con ratones ICR CD-1 durante 4semanas, se constató que para observar un efecto reductor de la grasa corporal se debía incorporar este ácido graso al 5% en la dieta, una dosis más elevada que la que habitualmente produce reducciones significativas de la grasa corporal en el caso del CLA (0,5-1%). Además se observó que el ácido punícico reducía la producción de leptina y aumentaba la actividad de la enzima carnitina palmitoiltransferasa (CPT-I)25.
Arao et al.26 llevaron a cabo otro estudio de 2semanas de duración con ratas Otsuka Long Evans Tokushima Fatty (OLETF) con una suplementación del 5% en la dieta, pero en este caso no del ácido punícico, sino de un aceite procedente de semillas de granada, rico en este ácido graso. Con esta dosis observaron una reducción significativa del tejido adiposo omental; sin embargo, una suplementación al 2% no fue suficiente para producir variaciones en este tejido. La misma ausencia de efecto a nivel del tejido adiposo fue la que Yamasaki et al.27 documentaron en ratones C57BL/6N con dietas suplementadas con aceite de granada que aportaban 0,12 y 1,2% de ácido punícico, durante 3semanas. Nuestro grupo de investigación también ha obtenido resultados similares en ratas alimentadas durante 6semanas con una dieta hipergrasa suplementada con 0,5% de aceite de semillas de granada (datos sometidos a publicación).
En este rango de dosis más bajas, McFarlin et al.28 tampoco observaron variación en la masa grasa, aunque sí lo hicieron en la ganancia de peso, en ratones CD-1 alimentados durante 14semanas con una dieta rica en grasas que contenía 61,79mg de aceite de semillas de granada. Por el contrario, en otro estudio de parecida duración (12semanas) llevado a cabo también en ratones, en este caso alimentados con una dieta suplementada con un 1% de aceite de semillas de granada, sí se observó una reducción de la masa grasa y del peso corporal29. Igualmente se documentó una mejora en la sensibilidad a la insulina.
Si bien el ácido punícico es uno de los isómeros más ampliamente estudiados, existen otros isómeros que también poseen este efecto. Así, Hontecillas et al.17 observaron que el ácido catálpico, trans-9,trans-11,cis-13CLNA, incluido en la dieta al 1%, reducía la acumulación de grasa abdominal en ratones C57BL/6N tras 78días de tratamiento.
Chardigny et al.30, por su parte, también encontraron que el isómero trans-8,trans-10,cis-12 del CLNA (ácido caléndico) disminuía la grasa corporal de ratones macho en mayor porcentaje que en los animales alimentados con dieta control. No obstante, es importante señalar que el isómero trans-8,trans-10,cis-12 del CLNA produjo una menor reducción de la grasa corporal que el isómero trans-10,cis-12 del CLA.
Mención especial merece el ácido jacárico. Al igual que ácido caléndico, este ácido graso mantiene la estructura trans-10,cis-12 junto con el grupo carboxilo en el primer carbono, estructura propuesta como indispensable para la inhibición de la actividad de lipoproteína lipasa (LPL) que es uno de los mecanismos de acción más importantes propuestos para justificar la reducción de grasa corporal en el caso del CLA31. Pese a ello, el ácido jacárico no muestra efecto reductor sobre la grasa corporal32. Esta falta de efecto, sumado al hecho de que este ácido graso altera la función insulínica, hace que el ácido jacárico no pueda ser propuesto como molécula anti-obesidad.
Otros efectos beneficiosos de los isómeros del ácido linolénico conjugado relacionados con la obesidadResistencia a la insulinaLa obesidad es un trastorno crónico que se asocia a diversos procesos, la mayor parte crónicos, que pueden aumentar la mortalidad con respecto a la población no obesa y producir una importante disminución de la calidad de vida del paciente. Estudios epidemiológicos han demostrado una clara relación entre la obesidad y la resistencia a la insulina33. Esta alteración metabólica se define como la disminución de la capacidad de la insulina para ejercer sus acciones biológicas en tejidos diana como el músculo esquelético, el hígado o el tejido adiposo. Se ha constatado que el aumento de la concentración de ácidos grasos libres y la disminución de la concentración de adiponectina —hormona de sensibilización insulínica— contribuyen a este estado de resistencia.
Como ya se ha indicado anteriormente, los isómeros CLNA pueden, además de reducir la grasa corporal, presentar otros efectos beneficiosos sobre la salud. En este sentido cabe señalar que uno de los efectos más notorios del melón amargo es su potencial hipoglucemiante, demostrado en ratas normales34 y diabéticas35,36 y en pacientes diabéticos tipo224. Si bien su mecanismo de acción sigue sin estar totalmente esclarecido, parece que inhibe la absorción intestinal de glucosa, promueve su utilización hepática e incluso incrementa el número de células beta en el páncreas. En esta línea, recientemente se ha identificado en el melón amargo al ácido α-eleosteárico como activador de PPARα y como posible responsable de los efectos hipoglucemiantes18. Es importante señalar la existencia de estudios que relacionan los agonistas de PPARα con la protección de las células beta del páncreas ante la sobreactivación de producción de insulina derivada de una dieta rica en ácidos grasos saturados37, previniendo de este modo la diabetes mellitus tipo2 como consecuencia de una hiperinsulinemia. Finalmente señalar que, tal y como se ha indicado en el apartado anterior, Vroegrijk et al.29 observaron una mejora en la sensibilidad a la insulina en ratones alimentados con una dieta suplementada con un 1% de aceite de semillas de granada durante 12semanas.
Del mismo modo, el ácido catálpico17 también parece mejorar las concentraciones séricas de glucosa e insulina en ayunas, además de aumentar la capacidad de los ratones para normalizar los valores de glucosa plasmática tras un test de tolerancia a la glucosa. Se cree que los efectos de este isómero de CLNA sobre la glucosa pueden estar mediados por un mecanismo dependiente de PPARα. De hecho, el ácido catálpico aumenta la expresión de este factor de transcripción, así como la de los genes que controla17,18.
La citoquina proinflamatoria TNF-α es uno de los principales responsables de la resistencia a la insulina inducida por la inflamación. Concretamente el TNF-α inhibe la señal de la insulina mediante la fosforilación de la serina en el receptor de insulina, inhibiendo por tanto la capacidad de este para unirse al sustrato de receptor de insulina1 (IRS1). Según los resultados obtenidos por el grupo de Bassaganya Riera, el ácido punícico se muestra efectivo en el tratamiento de la resistencia a la insulina asociada a la obesidad mediante la activación de PPARγ y disminuyendo en consecuencia la expresión de TNF-α19.
Diversas investigaciones han demostrado que la reducción de grasa corporal producida por el CLA puede verse acompañada de una drástica reducción de las concentraciones séricas, tanto de leptina como de adiponectina, en el caso de los ratones38 (adipocinas relacionadas con el control glucémico). Los estudios realizados con ácido punícico parecen indicar que este no modifica las concentraciones séricas de estas adipocinas, ni varia la insulinemia ni la glucemia en ratones25, lo cual, hace pensar que nos encontramos ante una molécula más segura que el CLA. No obstante, no se debe olvidar que los diferentes isómeros del CLNA pueden ser metabolizados a CLA39,40.
InflamaciónEn los últimos años se ha sabido que los pacientes obesos presentan un estado inflamatorio crónico de bajo grado. Esta situación parece consecuencia del incremento en la masa del tejido adiposo que lleva a un aumento en la producción de mediadores pro-inflamatorios que son conjuntamente estimulados por señales de origen exógeno y/o endógeno41. El tejido adiposo contiene fibroblastos, preadipocitos, adipocitos y macrófagos; son precisamente estos últimos los que contribuyen de manera importante al proceso inflamatorio sistémico con la producción de mediadores pro-inflamatorios como citoquinas inflamatorias (TNF-α, IL-6, IL-1β, IL-8, IL-18)42.
Según se ha constatado, la ingesta excesiva de calorías, algunas infecciones y el estrés oxidativo pueden provocar un aumento en los niveles de secreción de estas citoquinas que conducen a la inflamación crónica en tejido adiposo blanco favoreciendo la activación y la infiltración de macrófagos maduros. El hecho de que estos macrófagos comiencen a secretar citoquinas y quimiocinas, unido a que los adipocitos y otros tipos celulares también lo hagan, permite mantener el bucle sin fin de reclutamiento de macrófagos y producción de mediadores proinflamatorios que lleva en un inicio a una inflamación primaria local en el tejido adiposo y que puede desencadenar la inflamación sistémica de bajo grado observada en la obesidad43.
Los ácidos grasos conjugados han sido directamente relacionados con propiedades antiinflamatorias. Si bien hasta el momento estas propiedades se atribuían mayoritariamente a los isómeros de CLA, según indican recientes investigaciones existen isómeros de CLNA con idéntico efecto. Al igual que ocurría en el caso de los CLA (donde a día de hoy existen discrepancias), 3parecen ser los mecanismos propuestos para explicar el efecto del CLNA sobre la respuesta inflamatoria:
- a)
Disminución de la génesis de eicosanoides inducibles implicados en la respuesta inflamatoria, tales como las prostaglandinas y los leucotrienos.
Las prostaglandinas son un grupo de ácidos grasos oxigenados presentes en la mayoría de los tejidos de mamíferos y correlacionados de forma positiva con la inflamación44. Según documentaron Nugteren y Christ-Hazelhof en el año 198745, diversos isómeros de CLNA (ácido jacárico, ácido caléndico, ácido punícico, ácido catálpico y ácido eleosteárico) poseen una actividad antiinflamatoria mediada por la inhibición de la actividad de ciclooxigenasas, enzimas catalizadoras de la síntesis de prostaglandinas. Parte de estos datos fueron confirmados en un estudio posterior, en el que se concluyó que el extracto de granada rico en ácido punícico inhibía de forma acusada tanto la actividad de la lipogenasa como la de la ciclooxigenasa46.
- b)
Interacción con los PPARγ.
PPARγ se expresa en el tejido adiposo y en los macrófagos, desempeñando un importante papel en la regulación de la inflamación47. De hecho, se ha constatado que PPAR es un regulador negativo de la activación de los macrófagos y que inhibe la expresión de genes relacionados con la respuesta inmune48. Del mismo modo, la activación PPARγ inhibe la producción de citoquinas pro-inflamatorias como TNF-α e IL-649. A lo largo de la presente revisión ha quedado patente el efecto activador y agonista del ácido punícico sobre receptores PPARγ, por lo que tal y como una reciente publicación ha demostrado, el ácido punícico se puede mostrar efectivo en la reducción de la inflamación crónica que subyace en la obesidad19.
- c)
Inactivación de la señal de transducción del NF-κβ (factor nuclear potenciador de las cadenas ligeras kappa de las células β activadas).
El NF-κB es un factor de trascripción nuclear. Su activación ante la exposición de la célula a estímulos externos, como estrés oxidativo o radiación ultravioleta, induce la expresión de genes celulares asociados a inflamación50 que incluyen diferentes citoquinas (TNF-α, IL-1, IL-6) y quimioquinas (IL-8 y proteína inflamatoria de macrófagos).
Hallazgo de gran interés es, por tanto, que según demuestran varias investigaciones, el extracto de granada es capaz de disminuir e inhibir la activación de NF-κB, además de inhibir la fosforilación de citoquinas relacionadas con la inflamación y proteín-quinasas activadas por mitógenos (MAPK)51,52. Tampoco debemos pasar por alto el hecho de que pacientes con periodontitis (inflamación a nivel bucal) respondan al tratamiento con extracto de granada reduciendo citoquinas con marcado carácter inflamatorio (IL-1β y IL-6)53. Por el momento no se ha identificado la molécula responsable del efecto antiinflamatorio en el extracto de granada, pero conviene recordar que el ácido punícico es una de las moléculas funcionales más importantes que contiene dicho extracto. De hecho, según han confirmado Hontecillas et al.19, el ácido punícico disminuye la inflamación relacionada con la obesidad activando PPARγ, y por tanto inhibiendo la expresión de TNF-α y la actividad de NF-κB. Considerando que se ha demostrado que los agonistas de PPAR reducen la expresión de citoquinas pro-inflamatorias antagonizando la actividad de NF-κB, es lógico pensar que otros isómeros de CLNA agonistas de estos receptores PPAR, caso del ácido α-eleosteárico, puedan resultar efectivos en la inhibición de este factor de transcripción nuclear, y por tanto se muestren efectivos en la disminución de la inflamación asociada a la obesidad48,54,55.
Un claro ejemplo lo encontramos en los experimentos llevados a cabo por Saha et al.56,57 en ratas diabéticas (diabetes inducida con estreptozotocina) tratadas con 0,5% de α-eleosteárico y 0,5% de ácido punícico. En estas, el incremento de expresión de citoquinas inflamatorias tales como el factor de necrosis tumoral (TNF-α) y la interleucina6 (IL-6) en sangre, y la expresión hepática del factor de transcripción NF-kB tras el tratamiento con estreptozotocina, debido al aumento de la inflamación, fue restaurado con la administración de los isómeros de CLNA.
LipidemiaEn personas obesas, el incremento de la grasa corporal, especialmente la grasa visceral, puede conducir a hiperglucemia y resistencia a la insulina, pero también puede afectar al metabolismo lipídico. Así, entre las alteraciones metabólicas que suelen acompañar a la obesidad central se pueden mencionar la llegada masiva al hígado de ácidos grasos libres, un estímulo de la síntesis hepática de triglicéridos y la secreción de lipoproteínas de muy baja densidad (VLDL); menor aclaramiento de lipoproteínas ricas en triglicéridos, presencia de lipoproteínas de baja densidad (LDL) pequeñas y densas, y concentraciones reducidas de lipoproteínas de alta densidad (HDL). Este descenso de HDL, junto con el aumento de LDL, capaces de penetrar en la pared arterial donde son oxidadas, crea las condiciones metabólicas apropiadas para el desarrollo del proceso aterogénico58.
En relación con este tema, investigaciones llevadas a cabo en los últimos años sugieren que algunos isómeros de CLNA podrían resultar efectivos en el control del perfil lipídico. De este modo el isómero cis-9,trans-11,cis-13 de CLNA parece reducir la secreción de apoB100 en células hepáticas humanas HepG2, lo cual podría deberse a una disminución de triglicéridos en este tipo de células59. Esta disminución, según apuntan estudios como el de Koba et al.25, se debería a un marcado aumento de la β-oxidación de ácidos grasos. Este efecto no es difícil de esperar, teniendo en cuenta el potencial efecto activador que demuestran isómeros del CLNA al nivel del PPARα, regulador principal de la β-oxidación en peroxisomas y mitocondrias18. Así pues, la reducción de la producción de apoB100 podría estar relacionada con una reducción de las VLDL in vivo.
No obstante, parece que el efecto del CLNA no solo se centra en la secreción de apoB100, sino que también ejerce un papel protector ante la peroxidación de lípidos plasmáticos. Los lípidos plasmáticos, LDL y de membrana eritrocitaria son susceptibles de sufrir peroxidación, la cual puede conducir al desarrollo de aterosclerosis y complicaciones diabéticas vasculares60. Según el estudio llevado a cabo por Dhar et al.61, en el que se pretendía valorar la peroxidación lipídica y el efecto antioxidante de 2concentraciones (0,1 y 0,05%) de ácido α-eleosteárico en sujetos diabéticos y no diabéticos, el citado CLNA se mostró efectivo reduciendo la oxidación a ambas dosis, siendo la de 0,1% la más efectiva.
Además, en el estudio llevado a cabo por Arao et al.59, el isómero cis-9,trans-11,cis-13 de CLNA se relacionó con una mejora en la relación de ácidos grasos saturados y monoinsaturados, importante indicador no solo de problemas cardiovasculares sino también de síndrome metabólico. Según postulan los autores de esta investigación, el resultado de esta mejora se correspondería, al igual que lo era en caso del trans-10,cis-12 de CLA, con una inhibición de la estearoil CoA desaturasa por parte del isómero cis-9,trans-11,cis-13 de CLNA.
En el estudio de Saha y Ghosh56, ratas que mostraban una hipercolesterolemia inducida vieron normalizados sus concentraciones plasmáticas de colesterol, así como el contenido de colesterol de los tejidos, tras la alimentación con una dieta enriquecida al 0,5 y al 1% con una mezcla de isómeros de CLNA. Este efecto se debió a una disminución de la síntesis hepática de colesterol, asociada a una inhibición de la hidroximetil-glutaril coenzimaA reductasa, la enzima limitante de la colesterogénesis.
En el estudio de Mirmiran et al.62, si bien los pacientes con dislipidemia tratados durante 4semanas con 400mg de aceite de semillas de granada no experimentaron cambios en las concentraciones plasmáticas de colesterol total y colesterolLDL, sí vieron reducidas sus concentraciones de triglicéridos, así como las relaciones triglicéridos/ colesterolHDL y colesterol total/colesterolHDL, con la consiguiente reducción del riesgo cardiovascular.
No obstante, hay que señalar que existen estudios realizados en ratas y hámsteres en los que los isómeros de CLNA analizados no ejercieron ningún efecto sobre los lípidos séricos63, o incluso los empeoraron, aumentando los niveles de colesterol total, la relación LDL/HDL y los triglicéridos64. Estas discrepancias pueden tener su origen en las diferencias existentes entre los modelos experimentales y en el empleo de diferentes dosis e isómeros del CLNA.
ConclusionesLas investigaciones llevadas a cabo durante los últimos años han presentado los isómeros del ácido linolénico conjugado como potenciales ingredientes funcionales para la prevención de la obesidad y de sus patologías asociadas. A tenor de los estudios in vitro realizados, los resultados obtenidos demuestran que el ácido punícico y el ácido α-eleosteárico actúan como agonistas naturales de PPARα, lo que sugiere que pueden ser eficaces en la reducción de la grasa corporal, además de tener otros efectos positivos relacionados con la obesidad. Estos resultados prometedores in vitro tuvieron su continuidad en el estudio in vivo realizado por Koba et al. con la inclusión al 1% de una mezcla de isómeros de CLNA sin identificar en la dieta. Sin embargo, es importante señalar que en esta mezcla existía una presencia de isómeros de CLA, pudiendo enmascarar de este modo el efecto real de los isómeros de CLNA sobre la reducción de la grasa corporal.
Las posteriores investigaciones realizadas con isómeros aislados de CLNA han señalado que el efecto reductor sobre la grasa generalmente tiene lugar a dosis más elevadas que las dosis efectivas de CLA (0,5-1%). Por tanto, en lo que respecta a la obesidad, no parece que el CLNA sea una molécula más prometedora que el CLA. No obstante, considerando la cantidad de isómeros que se engloban dentro del término ácido linolénico conjugado, se hacen necesarios más estudios experimentales para descartar definitivamente los isómeros del CLNA como potenciales ingredientes funcionales en la prevención de la obesidad mediante la reducción de la grasa corporal.
La obesidad es un trastorno crónico que se asocia a diversos procesos, la mayor parte crónicos, que pueden aumentar la mortalidad con respecto a la población no obesa y producir una importante disminución de la calidad de vida del paciente. En lo concerniente al uso de estos ácidos grasos conjugados en la prevención de alteraciones que subyacen en la obesidad conviene recordar que, por el momento, son escasos los estudios realizados (tablas 4 y 5). Así, todavía resulta difícil llegar a conclusiones claras acerca del potencial uso del CLNA en resistencia a la insulina, dislipidemias o inflamación.
Resumen de los efectos positivos de isómeros del CLNA sobre la diabetes y la resistencia a la insulina
| Isómero | Efecto | Mecanismo | Autor | Modelo estudio |
| Melón amargo (ácido α-eleosteárico y ácido catálpico) | Mejora las concentraciones séricas de glucosa e insulina en ayunas | Activación de expresión PPARα | Welihinda et al. (1986) | Rata |
| Melón amargo (ácido α-eleosteárico y ácido catálpico) | Disminuye las concentraciones séricas de glucosa | Incremento de la utilización de glucosa en hígado | Sarkar et al. (1996) | Rata diabética |
| Melón amargo (ácido α-eleosteárico y ácido catálpico) | Mejora la resistencia a la insulina, disminuye los niveles séricos de insulina y leptina | No descrito | Chen et al. (2003) | Rata |
| Melón amargo (ácido α-eleosteárico y ácido catálpico) | Mejora la tolerancia a la glucosa. Efecto hipoglucemiante | No descrito | Leatherdale et al. (1981) | Rata diabética |
| Ácido catálpico | Mejora las concentraciones séricas de glucosa e insulina en ayunas | Activación PPARα | Hontecillas et al. (2008) | Ratón obeso |
| Melón amargo (ácido α-eleosteárico y ácido catálpico) | Mejora la homeostasis de glucosa y lípidos | Activación PPARα | Chuang et al. (2006) | Células H4IIEC3 |
| Semilla granada (ácido punícico) | Mejora en la sensibilidad a la insulina periférica | No descrito | Vroegrijk et al., 2011 | Ratón C57Bl/J6 |
| Ácido punícico | Mejora la tolerancia a la glucosa, mejorando la diabetes | Activación PPARα y PPARγ | Hontecillas et al. (2009) | Células 3T3-L1 y ratón obeso |
PPAR: receptor activado por proliferadores de peroxisomas.
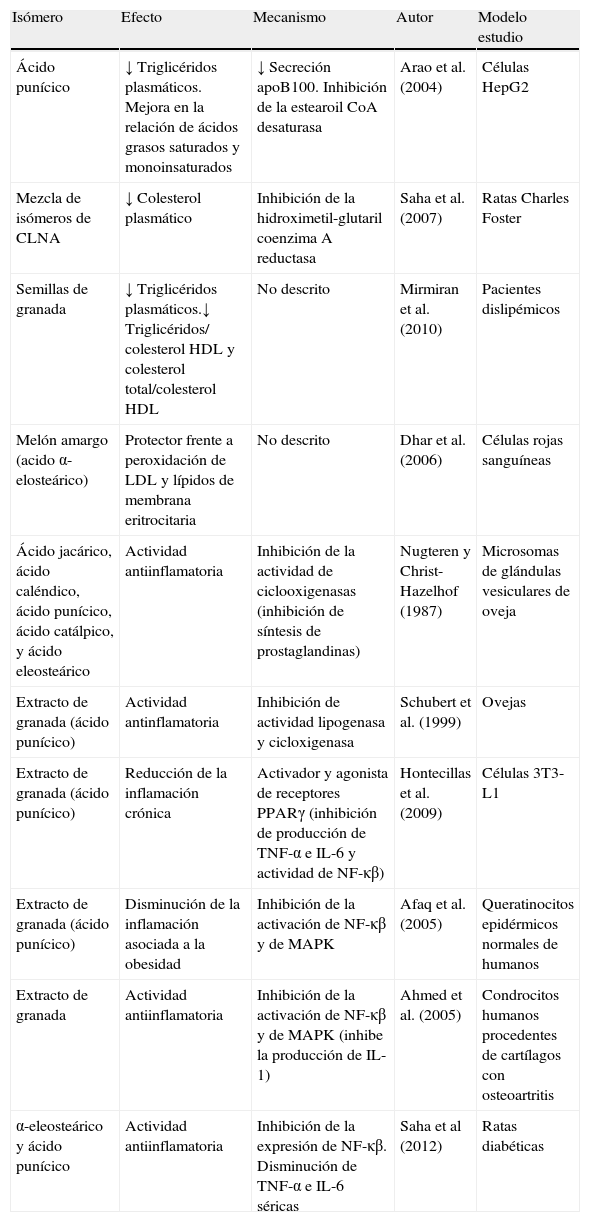
Resumen de efectos positivos de isómeros del CLNA sobre la lipidemia y sobre la inflamación que subyace en la obesidad
| Isómero | Efecto | Mecanismo | Autor | Modelo estudio |
| Ácido punícico | ↓ Triglicéridos plasmáticos. Mejora en la relación de ácidos grasos saturados y monoinsaturados | ↓ Secreción apoB100. Inhibición de la estearoil CoA desaturasa | Arao et al. (2004) | Células HepG2 |
| Mezcla de isómeros de CLNA | ↓ Colesterol plasmático | Inhibición de la hidroximetil-glutaril coenzimaA reductasa | Saha et al. (2007) | Ratas Charles Foster |
| Semillas de granada | ↓ Triglicéridos plasmáticos.↓ Triglicéridos/ colesterolHDL y colesterol total/colesterolHDL | No descrito | Mirmiran et al. (2010) | Pacientes dislipémicos |
| Melón amargo (acido α-elosteárico) | Protector frente a peroxidación de LDL y lípidos de membrana eritrocitaria | No descrito | Dhar et al. (2006) | Células rojas sanguíneas |
| Ácido jacárico, ácido caléndico, ácido punícico, ácido catálpico, y ácido eleosteárico | Actividad antiinflamatoria | Inhibición de la actividad de ciclooxigenasas (inhibición de síntesis de prostaglandinas) | Nugteren y Christ-Hazelhof (1987) | Microsomas de glándulas vesiculares de oveja |
| Extracto de granada (ácido punícico) | Actividad antinflamatoria | Inhibición de actividad lipogenasa y cicloxigenasa | Schubert et al. (1999) | Ovejas |
| Extracto de granada (ácido punícico) | Reducción de la inflamación crónica | Activador y agonista de receptores PPARγ (inhibición de producción de TNF-α e IL-6 y actividad de NF-κβ) | Hontecillas et al. (2009) | Células 3T3-L1 |
| Extracto de granada (ácido punícico) | Disminución de la inflamación asociada a la obesidad | Inhibición de la activación de NF-κβ y de MAPK | Afaq et al. (2005) | Queratinocitos epidérmicos normales de humanos |
| Extracto de granada | Actividad antiinflamatoria | Inhibición de la activación de NF-κβ y de MAPK (inhibe la producción de IL-1) | Ahmed et al. (2005) | Condrocitos humanos procedentes de cartílagos con osteoartritis |
| α-eleosteárico y ácido punícico | Actividad antiinflamatoria | Inhibición de la expresión de NF-κβ. Disminución de TNF-α e IL-6 séricas | Saha et al (2012) | Ratas diabéticas |
IL: interleucina; MAPK: proteín-quinasas activadas por mitógenos; NF-κβ: factor nuclear potenciador de las cadenas ligeras kappa de las células β activadas; PPAR: receptor activado por proliferadores de peroxisomas; TNF: factor de necrosis tumoral.
Los autores declaran no tener ningún conflicto de intereses.