En el contexto actual de recursos económicos y sanitarios limitados tiene una gran importancia la eficiencia de los tratamientos farmacológicos, analizando sus efectos clínicos y sus costes directos asociados. La liraglutida es un agonista del receptor del péptido de tipo 1 similar al glucagón (GLP-1) aprobada para el tratamiento de la diabetes mellitus tipo 2 (DM2), que además de su acción normoglucemiante induce mejorías significativas en el peso corporal y sobre diversos factores de riesgo cardiovascular. El objetivo de esta revisión breve es resumir la evidencia disponible acerca de los efectos de la liraglutida sobre los factores de riesgo cardiovascular y cómo estos mejoran su perfil de coste-efectividad. A pesar de su coste farmacológico, relativamente superior al de otras alternativas terapéuticas, la liraglutida ha demostrado ser coste-efectiva cuando se analizan los indicadores clínicos y los costes totales asociados al abordaje de la DM2.
In the current context of limited economic and health resources, efficiency of drug treatments is of paramount importance, and their clinical effects and related direct costs should therefore be analyzed. Liraglutide is a glucagon-like peptide-1 (GLP-1) receptor agonist approved for the treatment of type 2 diabetes mellitus (T2DM) which, in addition to its normoglycemic effects, induces a significant improvement in body weight and several cardiovascular risk factors. The aim of this narrative review is to summarize the available evidence about the effects of liraglutide upon cardiovascular risk factors and how these improve its cost-effectiveness profile. Despite the relatively higher cost of liraglutide as compared to other alternative therapies, liraglutide has been shown to be cost-effective when clinical indicators and total costs associated to T2DM management are analyzed.
El recientemente publicado estudio di@betes muestra una elevada prevalencia de la diabetes en España, que afecta al 13,8% de la población1. Este aumento, con respecto a las estimaciones previas, lleva asociado un incremento de la morbimortalidad que supone una carga económica significativa para los sistemas de salud debido al incremento de los costes directos médicos asociados. Por otra parte, en el contexto actual, con recursos económicos y sanitarios limitados, tiene más importancia si cabe no solo prevenir las complicaciones de la diabetes por la carga económica que representan, sino también evaluar la eficiencia de los tratamientos farmacológicos analizando tanto sus costes médicos directos como los indirectos. Además, un 50% del coste total generado por la diabetes se relaciona con las complicaciones cardiovasculares2, lo que hace necesario una reflexión acerca de la idoneidad de los tratamientos antidiabéticos actuales no solo en cuanto al control glucémico, sino también en cuanto a valorar en conjunto los efectos sobre otros factores que determinan su coste, como los efectos en el peso corporal, la presión arterial sistólica (PAS), los lípidos y el riesgo de hipoglucemia que representan.
La liraglutida es un agonista del receptor del péptido de tipo 1 similar al glucagón (GLP-1) de origen recombinante, que además de su efecto hipoglucemiante tiene efectos positivos sobre el peso corporal y diferentes factores de riesgo cardiovascular, como la presión arterial y los parámetros lipídicos3. La potencia antidiabética es similar a la de la insulina basal4, y presenta como ventajas adicionales su prácticamente nulo riesgo de hipoglucemia y su capacidad para inducir pérdida ponderal3. Las reacciones adversas más frecuentes son las complicaciones gastrointestinales, principalmente náuseas, que suelen aparecer en las primeras semanas de iniciarse el tratamiento y son generalmente de carácter leve y transitorio5. Los potenciales efectos beneficiosos de la liraglutida en particular, y del grupo de agonistas del receptor de GLP-1 en general, presentan como principal factor limitante su coste superior al de otras posibilidades terapéuticas. Aun así, existen datos consistentes, y resultados de evaluación por agencias internacionales, que muestran que los fármacos de este grupo terapéutico pueden reducir el coste final que supone el tratamiento de la diabetes mellitus tipo 2 (DM2) en comparación con otros fármacos6,7.
Efectos sobre el coste del tratamientoCostes del fármaco vs. coste total del tratamientoSegún el estudio Cost Of Diabetes in Europe (CODE-2), el coste medio directo de la diabetes en el año 1999 fue de 1.305 € por paciente y año, correspondiendo un 42% a gastos de farmacia, un 32% a costes de hospitalización y un 26% a costes ambulatorios8. A su vez, dentro del gasto farmacéutico, el 4,6% corresponde a hipoglucemiantes orales, el 4,7% a insulinas, el 14% a fármacos para alteraciones cardiovasculares y el 0,6% a tiras reactivas. Según este estudio, la mayor parte de los costes asociados al paciente con diabetes son debidos a los gastos derivados de la hospitalización y al tratamiento de las comorbilidades, mientras que el coste del tratamiento antidiabético (fármacos orales e insulinas) es inferior al 10%. Existen datos recientes acerca del coste de la diabetes en España. En un estudio realizado en Cataluña en 2011, el coste anual medio estimado por paciente diabético fue 3.362,8 € frente a 2.156,5 € por paciente no diabético (diferencia absoluta 1.206,3 €, incremento relativo de 59,9%)9. La diferencia absoluta del coste medio anual de las hospitalizaciones fue de 340,2 € (incremento del 38,4%) y en el caso del coste farmacéutico la diferencia absoluta fue de 435,8 € (incremento del 89%)9. Con los datos publicados en 2 estudios nacionales8,10 y 2 regionales11,12 se han estimado recientemente los siguientes costes anuales asociados a la DM2 en España en el año 2009: coste directo anual por paciente (1.660 €), coste anual por la pérdida de productividad (916 €) y coste directo anual por complicaciones micro y macrovasculares (2.930 €, de los cuales el 40,2% corresponde a la hospitalización, el 38,5% al tratamiento farmacéutico y el 21,3% al seguimiento ambulatorio)13.
Efectos sobre el gasto sanitario relacionado con las hipoglucemiasEl objetivo general de control metabólico definido por las recomendaciones actuales para la DM2 es una hemoglobina glucosilada (HbA1c) inferior o igual al 7%14. Este objetivo de control puede ser más ambicioso (HbA1c<6,5%) en pacientes jóvenes, con una corta duración de la diabetes y sin presencia de complicaciones micro o macrovasculares, y siempre que este se consiga sin un aumento de los episodios de hipoglucemia14. Por el contrario, se consideran adecuadas concentraciones de HbA1c superiores (7,5-8%) en pacientes de edad avanzada, con enfermedad cardiovascular o complicaciones crónicas de la diabetes ya establecidas14. Sin embargo, y a pesar de la amplia difusión de estas recomendaciones, es conocido que un elevado porcentaje de pacientes no alcanzan estos objetivos de control. Así, en España se calcula que un 45% de los pacientes con DM2 en tratamiento no insulínico presentan una HbA1c superior al 7%15. La baja adherencia a medidas higiénico-dietéticas16 y el mayor riesgo de hipoglucemia al intensificar el tratamiento para la diabetes17 constituyen los principales factores limitantes para conseguir un control óptimo. A esta situación también contribuye la inercia terapéutica de los profesionales sanitarios que puede retrasar el inicio de la intensificación del tratamiento18.
En este contexto, disponer de tratamientos con un efecto hipoglucemiante potente pero un escaso riesgo de hipoglucemia puede ayudar a conseguir un adecuado control metabólico en un mayor número de pacientes, con una repercusión positiva en el riesgo futuro de complicaciones microvasculares y, posiblemente, también en las complicaciones macrovasculares19. En el programa de ensayos clínicos Liraglutide Effect and Action in Diabetes (LEAD), la liraglutida, en diferentes combinaciones de tratamiento, indujo un cambio de HbA1c entre 0,2 y 1,3%, con una baja tasa de hipoglucemias (0,03 y 1,9 episodios por paciente y año)3.
Además de favorecer un adecuado control metabólico, el uso de fármacos con menor riesgo de hipoglucemia puede reducir también el coste directo derivado de esta complicación. En cuanto al coste directo de las hipoglucemias, el mayor coste está asociado a los episodios de hipoglucemia grave según datos publicados en el año 2004 (3.597 €)20. Las hipoglucemias leves tienen un menor impacto económico, aunque por su mayor frecuencia también tienen una repercusión significativa como consecuencia de cambios en la medicación, aumento del consumo de tiras reactivas, incremento de las visitas a enfermería, mayor necesidad de educación sanitaria y más absentismo laboral. El coste medio de un episodio de hipoglucemia leve se estima entre 30 y 35 €20. Por lo tanto, una mayor atención a los tratamientos que reduzcan las hipoglucemias leves podría conseguir un impacto positivo sobre el gasto sanitario.
Repercusión sobre consumo de tiras reactivasLa Sociedad Española de Diabetes, en sus recomendaciones del año 2012 acerca de la automonitorización de glucemia capilar (AMGC)21, recomienda que los pacientes con DM2 en tratamiento dietético o en tratamiento antidiabético oral no necesitan realizar AMGC, salvo los casos con control inestable que deberían realizar un control al día o un perfil semanal de 6 puntos. En pacientes en tratamiento con fármacos con riesgo de hipoglucemia, como las sulfonilureas, se recomienda un control semanal (un control al día o un perfil semanal de 6 puntos en caso de control inestable). Los pacientes tratados con insulina basal deben realizar 3 controles semanales si presentan un control glucémico estable, y 2 o 3 por día en caso contrario. De acuerdo con estas recomendaciones, el uso de agonistas de GLP-1 supone un ahorro en el gasto relacionado con el consumo de tiras reactivas al precisar una menor frecuencia de autoanálisis; así se evitaría el consumo de 3 tiras reactivas semanales que supondría el tratamiento con insulina basal o una tira reactiva semanal con sulfonilureas.
Otros efectos secundarios de la liraglutidaLas reacciones adversas más frecuentes asociadas a la liraglutida son de carácter gastrointestinal. Entre ellos, las náuseas y la diarrea son los más frecuentes, seguidos de vómitos, estreñimiento, dolor abdominal y dispepsia que se presentan con una baja frecuencia. Estas reacciones se producen al inicio del tratamiento con liraglutida y suelen disminuir a las pocas semanas de iniciarse. Las reacciones adversas graves son poco frecuentes. La incidencia de pancreatitis aguda notificada en ensayos clínicos es baja, inferior al 0,2%, y hasta la fecha no se ha podido establecer ni excluir una relación causal entre el tratamiento con liraglutida y los episodios pancreáticos5,22.
Efectos sobre el consumo de fármacos en los procesos asociados a la diabetesLos agonistas del GLP-1 ejercen un efecto beneficioso sobre diferentes factores de riesgo cardiovascular entre los que se encuentran los parámetros lipídicos, la presión arterial y el peso, además de otros marcadores de riesgo como proteína C reactiva y el inhibidor del activador del plasminógeno-13. El efecto sobre estos factores de riesgo cardiovascular se incluye en los estudios farmacoeconómicos para determinar la eficiencia de estos tratamientos, y es responsable en parte de su relación coste-eficacia positiva, a pesar de su precio relativamente mayor comparado con otros fármacos. El mayor gasto en el conjunto del tratamiento de la DM2 procede del gasto relacionado con los fármacos para el tratamiento de la hipercolesterolemia y de la hipertensión arterial8,23, por lo que el uso de tratamientos antidiabéticos con efectos positivos sobre la presión arterial y los lípidos podría contribuir a un ahorro en este capítulo de gasto. El tratamiento con liraglutida ha demostrado inducir de forma consistente un descenso de la PAS que varía entre 2,1 y 6,7mmHg a lo largo de los estudios LEAD 1-54,15–19,24–27. Un reciente metaanálisis28 ha evaluado los efectos sobre la presión arterial de los agonistas de GLP-1. En los pacientes tratados con liraglutida 1,2mg se observó una reducción de la PAS comparada con placebo (−5,6mmHg; intervalo de confianza al 95% [IC 95%], −5,85 a −5,36; p<0,001) y glimepirida (−2,38mmHg; IC 95%, −4,75 a −0,01; p=0,05). En el grupo tratado con liraglutida 1,8mg también existió un descenso significativo de la PAS comparado con el grupo placebo (−4,49mmHg; IC 95%, −4,73 a −4,26; p<0,001) y glimepirida (−2,62mmHg; IC 95%, −2,91 a −2,33; p<0,001).
Este efecto sobre la presión arterial es equiparable al conseguido por algunos fármacos hipotensores29. Así, se ha demostrado, aunque en estudios de mayor duración, que en pacientes con DM2 una reducción de la PAS de 5,6mmHg se asocia a una reducción del riesgo de episodios micro y macrovasculares del 9% y a un 18% de reducción del riesgo de muerte por causas cardiovasculares30. En cuanto a los efectos sobre el perfil lipídico, durante el tratamiento con liraglutida se observó un descenso de las concentraciones de triglicéridos (28-36mg/dl) y en algunos, pero no todos los estudios, una disminución de colesterol LDL que varió entre 9 y 11mg/dl27,31.
Visitas para educación/ajustes del tratamientoOtra ventaja potencial de los agonistas de GLP-1 es el menor consumo de recursos sanitarios relacionado con las visitas por profesional sanitario. Cuando se comienza un tratamiento con insulina basal, la dosis inicial debe ajustarse según la glucemia, y aunque las pautas de autoajuste por el paciente han demostrado ser seguras y eficaces32, con frecuencia los pacientes no comprenden estas indicaciones o no aumentan suficientemente la dosis de insulina, por lo que precisan frecuentes visitas con el médico y/o con enfermería. Por su prácticamente nulo riesgo de hipoglucemia y dado que no necesitan ajuste de dosis en función de las cifras de glucemia, el tratamiento con agonistas de GLP-1 debería traducirse en un menor número de visitas.
Evaluación económicaAnálisis de coste-efectividadEn un contexto de recursos sanitarios limitados, tanto los profesionales como las autoridades sanitarias demandan cada vez más las evaluaciones económicas de actuaciones terapéuticas y farmacológicas para optimizar dichos recursos. Ello justifica la incorporación de criterios económicos en la toma de decisiones que impliquen la utilización de medicamentos.
Durante décadas, el potencial terapéutico de los nuevos medicamentos se ha establecido a partir de los resultados de eficacia y seguridad recogidos en los ensayos clínicos. Sin embargo, las propias limitaciones de los ensayos clínicos han obligado a tener en cuenta la efectividad de los medicamentos en la práctica clínica habitual mediante los estudios observacionales.
El análisis coste-efectividad realizado con liraglutida en pacientes con DM2 se ha llevado a cabo a través del modelo IMS CORE, un modelo computarizado de simulación de enfermedad desarrollado para proyectar los resultados en salud a largo plazo y estimar las consecuencias económicas de las intervenciones33. Este modelo es una herramienta analítica validada, no específica de producto, que proporciona simulaciones en tiempo real teniendo en cuenta los tratamientos de la diabetes, las estrategias de cribado y tratamiento de las complicaciones macro y microvasculares, las estrategias de tratamiento de las complicaciones en estadios avanzados y las intervenciones multifactoriales. Los algoritmos de tratamiento son específicos para el tipo de diabetes y tienen en cuenta los fracasos terapéuticos y/o los efectos adversos asociados, y son completamente modificables para considerar los patrones de tratamiento locales. Este modelo permite calcular la incidencia de complicaciones, expectativa de vida ajustada por calidad expresada en años (años de vida ajustados por calidad [AVAC] o quality-adjusted life years [QALY]) y los costes totales de la intervención. En la mayoría de los estudios de coste-efectividad publicados en nuestro país, los autores recomiendan la adopción de la intervención cuando dicho ratio está por debajo de 30.000 € por QALY34.
En un trabajo reciente, financiado por la empresa fabricante de la liraglutida, se ha evaluado el coste-utilidad de liraglutida frente a sulfonilurea o sitagliptina, añadidos a metformina en pacientes con DM27. Los resultados demuestran que la liraglutida es un tratamiento coste/efectivo ya que los ratios obtenidos de 9.449 £/QALY y 16.501 £/QALY, para la dosis de 1,2 y 1,8mg, respectivamente vs. glimepirida, y 9.851 £/QALY (1,2mg) y 10.465 £/QALY (1,8mg) respectivamente vs. sitagliptina son inferiores a los umbrales de decisión establecidos por las agencias de evaluación para considerar que una intervención es coste-efectiva (30.000 €/QALY). Esta relación coste/efectividad es similar a la obtenida para el tratamiento con estatinas en prevención primaria (5.400-13.300 £) y secundaria (3.800-13.300 £)35.
La liraglutida fue positivamente evaluada por el National Institute for Health and Clinical Excellence (NICE) en Gran Bretaña a través del modelo CORE36. A partir de los datos de los estudios LEAD y el estudio 1860 (liraglutida vs. sitagliptina), el comité de evaluación del NICE llegó a la conclusión de que la liraglutida es eficaz en términos de control de la glucemia y se asoció con efectos beneficiosos sobre el peso corporal en relación con otros comparadores. Además, el RCEI para liraglutida vs. exenatida en triple terapia fue según el comité el más sólido con un valor de 10.000 £ por QALY ganado. El NICE recomienda el uso de la liraglutida como tratamiento para pacientes con DM2, en particular para aquellos que han agotado el primer escalón de tratamiento (basado en 2 antidiabéticos orales) con problemas de peso o para los cuales está recomendada la reducción ponderal, o aquellos que no pueden beneficiarse del tratamiento con 2 antidiabéticos orales o con tiazolidinedionas e inhibidores de la dipeptidilpeptidasa tipo iv.
Resultados comunicados por los pacientes (patient reported outcomes)Las directrices actuales de tratamiento de la diabetes recomiendan a la hora de elegir un fármaco antidiabético no solo considerar su eficacia, sino también tener en cuenta las características del paciente y sus preferencias14. Diferentes estudios han evaluado la satisfacción de los pacientes en tratamiento con liraglutida. En general, prefieren este tratamiento frente a otras alternativas al percibirlo como una opción terapéutica con un escaso riesgo de hipoglucemia, mayor efecto normoglucemiante y con efectos positivos sobre el peso. Así, Hermansen et al.37 muestran mejores índices de satisfacción en pacientes tratados con liraglutida respecto a los tratados con metformina. Del mismo modo, en pacientes con DM2 insuficientemente controlados con metformina a los que se añadió liraglutida (1,2 o 1,8mg/día) o bien sitagliptina (100mg/día), aquellos tratados con liraglutida lo percibieron como un tratamiento que induce mayor control de la hiperglucemia, por lo que fue el tratamiento de elección de los pacientes38. En otro estudio que evaluó la disposición a pagar de los pacientes por una serie de atributos de los tratamientos actuales de la diabetes, se demostró que los pacientes están dispuestos a asumir cierto coste adicional por conseguir pérdida ponderal, disminuir o evitar episodios hipoglucémicos y por mayor reducción de la HbA1c39.
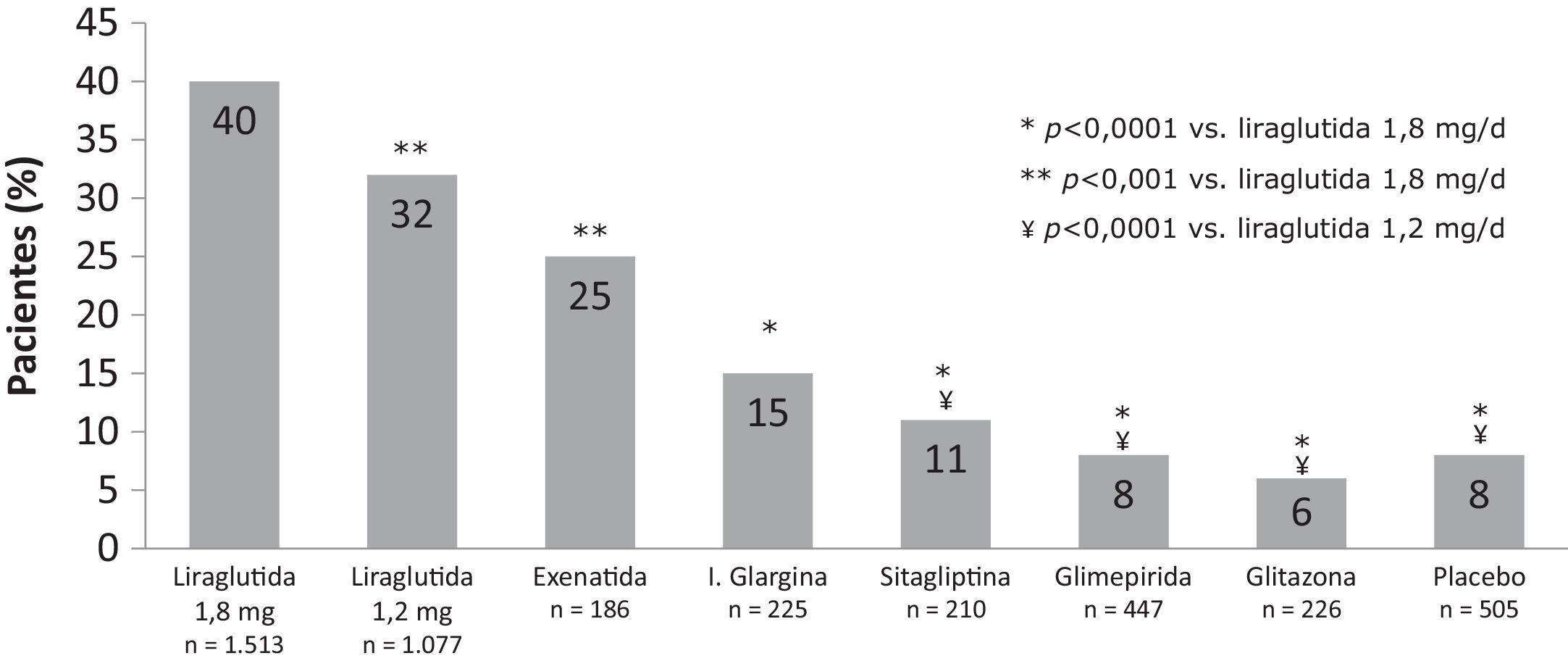
Coste que implica controlar la diabetesEl «coste de controlar la diabetes» es una metodología que permite relacionar el coste de los tratamientos con la eficacia combinada de los 3 indicadores relevantes del control de la diabetes (control glucémico, neutralidad en peso e inexistencia de hipoglucemias). De esta manera, se analiza el coste de llevar a los pacientes a objetivos de control, aunque no solo de control glucémico (HbA1c<7%), sino que se incluyen 2 parámetros fijados en los estándares 2013 de cuidado de la diabetes de la American Diabetes Association (ADA)32,40, como son el riesgo de hipoglucemias, tanto leves como moderadas, y el riesgo de aumento de peso. En este sentido, un reciente metaanálisis41 de los estudios LEAD y el ensayo frente a sitagliptina (1860), muestra que tras 26 semanas de tratamiento, un 40% de los pacientes tratados con liraglutida 1,8mg y un 32% de los tratados con liraglutida 1,2mg alcanzaron el objetivo compuesto de HbA1c inferior al 7%, sin aumento de peso ni hipoglucemia, comparado con un 6-25% de pacientes que alcanzaron este objetivo con los fármacos comparadores (6% rosiglitazona, 8% glimepirida, 15% glargina, 25% exenatida, 11% sitagliptina y 8% placebo) (fig. 1).
Porcentaje de pacientes que consiguen el objetivo compuesto de HbA1c <7%, sin hipoglucemia y sin aumento de peso. (Adaptada de Zinman et al., 201233).
El «coste de controlar la diabetes» se expresa a través de un índice que compara el ratio coste/efectividad de liraglutida con el de los distintos tratamientos utilizados como comparadores activos en los ensayos clínicos del programa LEAD y 1860, mediante la siguiente fórmula:
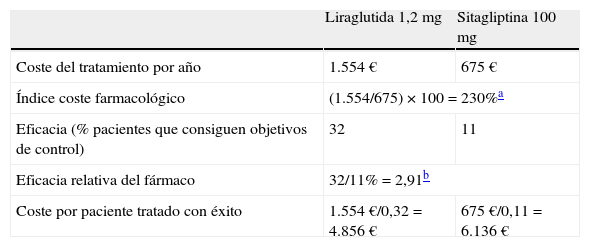
Un valor de 100 indica igualdad en términos de eficiencia de la liraglutida con el tratamiento con el que se compara. Si el índice está por debajo de 100, significa que el comparador requiere de un mayor gasto relativo para alcanzar los mismos resultados en salud que se alcanzan con la liraglutida y, por lo tanto, ese comparador es menos coste-efectivo. Por el contrario, si el tratamiento que se compara con la liraglutida tiene un índice por encima de 100 exhibe una mayor eficiencia relativa que el tratamiento con la liraglutida. Si lo aplicamos a los datos extraídos del programa LEAD y del estudio 1860, podemos apreciar que para obtener los mismos resultados en salud (control combinado de los 3 indicadores clínicos), el uso de la liraglutida resulta más coste-efectivo frente al uso de la sitagliptina. Es decir, el coste farmacológico asociado a la liraglutida por paciente controlado (4.856 €) es inferior al de la sitagliptina (6.136 €) (tabla 1)42.
Coste de controlar la diabetes con liraglutida comparado con el de sitagliptina
| Liraglutida 1,2 mg | Sitagliptina 100 mg | |
| Coste del tratamiento por año | 1.554 € | 675 € |
| Índice coste farmacológico | (1.554/675) × 100=230%a | |
| Eficacia (% pacientes que consiguen objetivos de control) | 32 | 11 |
| Eficacia relativa del fármaco | 32/11%=2,91b | |
| Coste por paciente tratado con éxito | 1.554 €/0,32=4.856 € | 675 €/0,11=6.136 € |
Nota: Cálculos en función del precio de venta al público, incluyendo el descuento del 7,5% según el Real Decreto Ley 8/2010.
Fuente: Elaboración propia a partir de Zinman et al., 201241 e información sobre los productos incluidos en la prestación farmacéutica del Sistema Nacional de Salud (dispensables a través de oficinas de farmacia)42.
En función de los datos expuestos podemos concluir la importancia del análisis farmacoeconómico de las intervenciones terapéuticas en diabetes para asegurar una correcta evaluación de sus costes y beneficios clínicos. La agencia de evaluación británica recomendó en el año 200936 el uso de la liraglutida en función de criterios de coste-efectividad, para pacientes que han agotado las posibilidades de tratamiento con los tratamientos de primera línea y para los que además esté recomendada la reducción de peso. En esta evaluación se analizaron los costes totales (costes farmacológicos y médicos) y los beneficios clínicos globales (incluidas las complicaciones micro y macrovasculares asociadas a la diabetes) en diferentes horizontes temporales, y en relación con los comparadores relevantes. Asimismo, el rendimiento en términos de coste-efectividad de la liraglutida se observa cuando se considera a la diabetes desde un abordaje multifactorial. En este sentido, un control simultáneo de los 3 indicadores relevantes para el control de la diabetes (HbA1c<7%, neutralidad de peso e inexistencia de hipoglucemias) se consigue con un coste farmacológico inferior por paciente y año en el caso de la liraglutida en comparación con la sitagliptina en DM2.
Conflicto de interesesEl Dr. Pedro Mezquita Raya declara los siguientes conflictos de intereses: ponencias esponsorizadas (Bristol Myers Squibb, Astra Zeneca, Esteve, FAES, GSK, Lilly, MSD, Novartis, NovoNordisk, Sanofi-Aventis); labores de consultoría (Bristol Myers Squibb, Astra Zeneca, FAES, NovoNordisk); proyectos de investigación (Amgen, Boehringer-Ingelheim, Lilly, MSD, NovoNordisk, Pfizer, Roche,Sanofi-Aventis, Tolerx-GSK).
La Dra. Rebeca Reyes García declara los siguientes conflictos de intereses: ponencias esponsorizadas (Esteve, FAES, GSK, NovoNordisk, Sanofi-Aventis); proyectos de investigación (Amgen, Boehringer-Ingelheim, NovoNordisk, Roche, Tolerx-GSK).