El péptido YY (PYY) tiene 36 aminoácidos y lo sintetizan fundamentalmente las células L del intestino. El PYY aumenta tras las comidas y alcanza su nadir tras el ayuno. Tras la ingestión se liberan dos formas: PYY1-36 y PYY3-36. Se ha demostrado que el PYY3-36 reduce la ingesta en humanos y roedores. Hay poca información sobre los valores plasmáticos de PYY, especialmente de PYY3-36, en respuesta a la ingestión y su relación con la respuesta de ghrelina.
ObjetivosEstudiar la respuesta secretora de PYY1-36 y PYY3-36 en sujetos normales tras ingerir una comida mixta y su relación con la secreción de ghrelina total y acilada.
Sujetos y métodosEstudiamos a 8 sujetos sanos, 4 mujeres y 4 varones, con una mediana de edad de 53 (intervalo, 36-59) años. Tras el ayuno nocturno, recibieron en 2 días diferentes y de forma aleatoria: una comida oral mixta estándar, que consistía en 400ml de Isosource Energy (159kcal/100ml) o placebo por vía oral (400ml de agua). Se obtuvieron muestras sanguíneas en los tiempos 0, 30, 45, 60 y 120 min para la determinación de PYY1-36, PYY3-36, ghrelina total y ghrelina acilada. Las comparaciones se realizaron mediante la prueba de Wilcoxon. Las correlaciones numéricas se analizaron mediante la prueba de correlación de Spearman. Se consideró significativo un valor de p≤0,05.
ResultadosTras ingerir la comida, se produce un máximo de PYY1-36 (mediana [intervalo]) de 141,5 (81-198) pg/ml y no hay respuesta tras placebo, con un máximo de 92,5 (46-219) pg/ml (p=0,04). Los valores del área bajo la curva (ABC) de PYY1-36 tras la ingesta fueron 14.865 (8.032-19.822) pg/ml/min y tras placebo, 8.992 (4.455- 21.382) pg/ml/min (p=0,06). Tras ingerir la comida se produce un máximo de PYY3-36 de 92,5 (59-135) pg/ml y no hay respuesta tras placebo, con un máximo de 46,5 (30- 66) pg/ml (p=0,02). Los valores del ABC de PYY3-36 tras la ingesta fueron 9.086 (6.412-14.970) pg/ml/min y tras placebo, 4.984 (3.142-6.772) pg/ml/min (p=0,012). El cociente nadir de ghrelina total/máximo de PYY1-36 disminuye de forma marcada tras la ingestión; los valores preprandiales son 7,44 (3,64-14,56) y los posprandiales, 3,55 (1,64-7,16) (p=0,03), mientras que no se modifica tras placebo. El cociente nadir de ghrelina acilada/máximo de PYY3-36 disminuye de forma marcada tras la ingestión, y los valores preprandiales son 2,03 (0,92-3) y los posprandiales, 0,73 (0,26-1,27) (p=0,02), mientras que no se modifican tras placebo.
ConclusionesEn sujetos normales, PYY1-36 y PYY3-36 aumentan de forma paralela tras ingerir una comida mixta; simultáneamente, los valores de ghrelina total y acilada disminuyen. El cociente entre el nadir de ghrelina acilada y el máximo de PYY3-36 disminuye tras ingerir una comida mixta. Este conjunto de datos indica su posible participación en la regulación aguda del apetito tras la comida.
Peptide YY (PYY) is a 36 amino acid peptide synthesized mostly by intestinal L cells. This peptide reaches its nadir during fasting and increases immediately after meals. After food intake, two molecular forms are released, PYY1-36 and PYY3-36. PYY3-36 reduces food intake in both humans and rodents. There is scarce information about plasmatic concentrations of PYY, especially of PYY3-36, after food ingestion, and their relationship to ghrelin.
ObjectivesTo study PYY1-36 and PYY3-36 secretory response after a mixed meal, and its relationship to total and acylated ghrelin secretion in healthy subjects.
Subjects and methodWe studied eight healthy subjects, 4 women and 4 men, with a median age of 53 (range, 36-59) years. After an overnight fast, the subjects received either a mixed standard meal (400ml Isosource Energy® [159kcal/100ml]) or placebo (400ml of water) orally in random order on two different days. Blood samples were obtained at 0, 30, 45, 60 and 120 min for measurement of PYY1-36, PYY3-36, total ghrelin and acylated ghrelin. Comparisons were made by Wilcoxon's test. Numerical correlations were performed using Spearman's test. P-values ≤ 0.05 were considered significant.
ResultsAfter a mixed meal, PYY1-36 reached a peak of (median [range]) 141.5 (81-198) pg/ml. There was no response to placebo, with a peak of 92.5 (46-219) pg/ml (p=0.04). The area under the curve (AUC) of PYY1-36 levels after a mixed meal were 14,865 (8,032-19,822) pg/ml/min and after placebo were 8,992 (4,455-21,382) pg/ml/min (p=0.06). After ingestion of a mixed meal, PYY3-36 reached a peak of 92.5 (59-135) pg/ml, with no response to placebo (46.5 [30-66] pg/ml) (p = 0.02). The AUC of PYY3-36 levels after a mixed meal were 9,086 (6,412-14,970) pg/ml/min, and after placebo were 4,984 (3,142-6,772) pg/ml/min (p=0.012). The quotient between nadir total ghrelin/peak PYY1-36 was markedly diminished after food ingestion, with preprandial values of 7.44 (3.64-14.56) and postprandial values of 3.55 (1.64-7.16) (p=0.03). The former quotient was unmodified by placebo. The quotient between nadir acylated ghrelin/peak PYY3-36 was markedly diminished after ingestion of a mixed meal, with preprandial values of 2.03 (0.92-3) and postprandial values of 0.73 (0.26-1.27) (p=0.02). This quotient was unmodified by placebo.
ConclusionsIn healthy subjects, blood levels of both PYY1-36 and PYY3-36 increase after ingestion of a mixed meal. Simultaneously, total and acylated ghrelin levels diminish. The quotient between nadir acylated ghrelin/peak PYY3-36 diminishes after a mixed meal. All these data suggest the possible contribution of these peptides to appetite regulation after ingestion.
El péptido al que actualmente se concede mayor importancia como regulador fisiológico precoz de la ingesta probablemente sea el péptido YY (PYY). PYY tiene 36 aminoácidos y lo sintetizan fundamentalmente las células L del intestino. El PYY se encuentra por todo el intestino, pero sus mayores concentraciones se producen en los segmentos distales1. Tras comer se liberan dos formas1-3: PYY1-36 y PYY3-36. Batterham et al4,5 han demostrado que PYY3-36 reduce la ingesta en humanos y roedores, aunque una publicación reciente ha encontrado que el PYY es incapaz de inhibir la ingesta en roedores6. Más recientemente se ha visto que para la demostración del efecto anorexigénico del PYY se require la habituación de los animales a la manipulación e inyección4,7,8. El PYY, por lo tanto, puede ser un factor fundamental en el control de la saciedad posprandial9,10. La concentración plasmática posprandial de PYY es proporcional a la cantidad de comida1, y en algún estudio se alcanza el máximo plasmático sobre unas 2 h después de la comida4,5. Se han descrito elevadas cantidades de PYY en ayunas en diversas enfermedades gastrointestinales asociadas con disminución del apetito11,12. La concentración de PYY en ayunas más baja se ha encontrado en los pacientes obesos5. Las diferencias en la concentración de PYY en ayunas son controvertidas13; sin embargo, parece que la duración del ayuno antes de un estudio afecta de forma muy importante a las concentraciones plasmáticas de PYY14. Aunque se ha demostrado una disminución de la respuesta posprandial del PYY en pacientes obesos5,13,15, en pacientes obesos se asocia con disminución de la saciedad16.
Hay poca información publicada sobre la concentración plasmática de PYY en respuesta a cambios en el balance energético. El PYY aumenta tras las comidas y alcanza su nadir tras el ayuno. Según transcurre el día, la concentración de PYY es menor en ayunas y aumenta tras el desayuno, la comida y la cena17. Tras ingerir una comida de prueba, la concentración aumenta a los 15 min de forma proporcional a la cantidad de calorías ingeridas, alcanza el máximo sobre los 90 min y permanece elevada hasta 6 h después1. De las dos formas del péptido que se secretan tras la ingesta –PYY1-36 y PYY3-36–, la segunda tiene una acción anorexígena fisiológica. Igualmente existen pocos estudios sobre la secreción de PYY3-36, la forma fisiológicamente activa en sujetos normales tras la ingestión y se han realizado en un escaso número de pacientes16,18. No se ha establecido tras la ingestión la relación de las dos formas circulantes del PYY con la ghrelina acilada.
La ghrelina es un péptido de 28 aminoácidos sintetizado por el estómago y presenta un grupo éster N-octanoil en la serina 319-23. La actividad orexigénica de la ghrelina se descubrió por primera vez en un modelo animal24,25. La ghrelina actúa, fundamentalmente, uniéndose al receptor de los secretagogos de GH 1a (GHS-R1a) en el núcleo arcuato. Este receptor participa en la regulación de la secreción de GH, la regulación de la ingesta y la adiposidad26. La infusión de ghrelina aumenta el hambre a corto plazo en el humano27. Existen diferentes formas moleculares de ghrelina circulantes. La forma activa de ghrelina, desde el punto de vista endocrino y metabólico, necesita un grupo N-octanoil en la serina 328-30, pues la forma no acilada no se une al receptor GHS-R1a19,30,31.
El objetivo de este trabajo es estudiar la respuesta secretora de PYY1-36 y PYY3-36 en sujetos normales tras ingerir una comida mixta y su relación con la secreción de ghrelina total y acilada.
SUJETOS Y MÉTODOHemos estudiado en sujetos sanos los valores basales en ayunas y la respuesta aguda de PYY1-36 y PYY3-36 tras ingerir una comida mixta o placebo, mediante un diseño aleatorio. Por lo tanto, en cada sujeto se realizaron dos pruebas (comida mixta o placebo) de forma aleatoria, y cada sujeto sirvió como su propio control. Las pruebas comenzaban a las nueve de la mañana tras el ayuno nocturno, con los sujetos en decúbito supino. Se insertaba un catéter en el antebrazo para las extracciones sanguíneas. El protocolo de estudio fue aprobado por el comité ético de nuestro centro y se obtuvo consentimiento informado de todos los sujetos.
Estudiamos a 8 sujetos sanos, 4 mujeres y 4 varones, con una mediana (intervalo) de edad de 53 (36-59) años. La mediana del índice de masa corporal (IMC) fue 25,1 (20,1-29,3). Ninguno de los sujetos presentaba diabetes mellitus u otros problemas médicos ni tomaba fármacos. Este estudio se ha realizado en sujetos de mediana edad, entre 35 y 65 años, porque la mayoría de los estudios se han realizado en sujetos más jovenes. Todos los sujetos presentaban valores en ayunas dentro del rango de la normalidad en glucemia, 97 (85-103) mg/dl; colesterol, 218 (179-236) mg/dl; triglicéridos, 134 (103-148) mg/dl; insulinemia, 9,6 (3,7-15,1) μU/ml, y valor HOMA (Homeostasis Model Assessment), 2,4 (0,6-3,9).
Los sujetos fueron aconsejados para que mantuvieran una dieta normocalórica, con el objeto de mantener el peso estable en las semanas previas a los estudios.
Tras el ayuno nocturno, a las 9.00 los sujetos permanecían en reposo en decúbito y se les colocaba una vía venosa periférica; 30 min más tarde recibían en 2 días diferentes:
- –
Una comida oral mixta estándar, que consistía en 400 ml de Isosource Energy® (Novartis, Zúrich, Suiza), con 5,7 g de proteína, 6,2 g de lípidos y 20 g de hidratos de carbono cada 100 ml (159 kcal/100 ml).
- –
Placebo: 400 ml de agua por vía oral.
Se obtuvieron muestras sanguíneas en los tiempos 0, 30, 45, 60 y 120 min para la determinación de PYY1-36, PYY3-36, ghrelina total y ghrelina acilada. Los datos en relación con la respuesta de ghrelina total, ghrelina acilada, leptina, insulina y GH durante la misma prueba han sido publicados previamente32.
Todas las muestras sanguíneas fueron específicamente recogidas en tubos en frío con aprotinina y EDTA-Na e inmediatamente centrifugadas a 4 °C, separadas en alícuotas y congeladas a −80 °C.
Las determinaciones hormonales se realizaron mediante los siguientes métodos comerciales: PYY1-36 con RIA (Linco, St. Charles, Misuri, Estados Unidos), con coeficientes de variación intraanalítica e interanalítica del 2,9 y el 5,5% respectivamente y un límite de detección de 10 pg/ml; PYY3-36 con RIA (Linco), con coeficientes de variación intraanalítica e interanalítica del 6,4 y el 7% respectivamente y un límite de detección de 20 pg/ml; ghrelina total con RIA (Phoenix Pharmaceuticals, Belmont, California, Estados Unidos), con coeficientes de variación intraanalítica e interanalítica del 5,3 y el 13,6% respectivamente; ghrelina acilada con RIA (Linco), con coeficientes de variación intraanalítica e interanalítica del 6,5 y el 9,6% respectivamente y un límite de detección de 10 pg/ml.
La respuesta temporal de los valores de PYY1-36 y PYY3-36 tras las diferentes pruebas se analizaron en valores absolutos. El área bajo la curva (ABC) se determinó por el método trapezoidal.
Todas las comparaciones se realizaron mediante pruebas no paramétricas. El grado de concordancia entre las estimaciones basales se analizó mediante el coeficiente de correlación de Spearman y la prueba de la t de Student para datos apareados (sesgo sistemático). Las comparaciones se realizaron mediante la prueba de Wilcoxon. Las correlaciones numéricas se analizaron mediante la prueba de correlación de Spearman. Se consideró significativo un valor de p ≤ 0,05. Los valores numéricos se presentan en forma de mediana (intervalo). Los valores gráficos se presentan en forma de media ± error estándar de la media (EEM). El análisis estadístico se realizó mediante el programa estadístico SPSS 14.0.
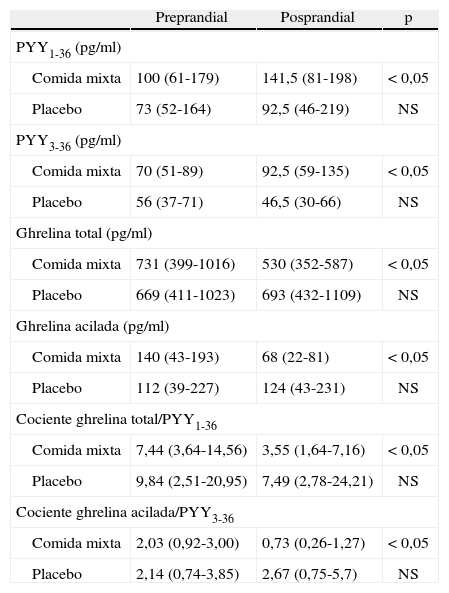
RESULTADOSLos valores basales preprandiales y posprandiales tras las dos pruebas se presentan en la tabla 1.
Valores preprandriales y posprandiales y relaciones de PYY1-36, PYY3-36, ghrelina total y ghrelina acilada
| Preprandial | Posprandial | p | |
| PYY1-36 (pg/ml) | |||
| Comida mixta | 100 (61-179) | 141,5 (81-198) | < 0,05 |
| Placebo | 73 (52-164) | 92,5 (46-219) | NS |
| PYY3-36 (pg/ml) | |||
| Comida mixta | 70 (51-89) | 92,5 (59-135) | < 0,05 |
| Placebo | 56 (37-71) | 46,5 (30-66) | NS |
| Ghrelina total (pg/ml) | |||
| Comida mixta | 731 (399-1016) | 530 (352-587) | < 0,05 |
| Placebo | 669 (411-1023) | 693 (432-1109) | NS |
| Ghrelina acilada (pg/ml) | |||
| Comida mixta | 140 (43-193) | 68 (22-81) | < 0,05 |
| Placebo | 112 (39-227) | 124 (43-231) | NS |
| Cociente ghrelina total/PYY1-36 | |||
| Comida mixta | 7,44 (3,64-14,56) | 3,55 (1,64-7,16) | < 0,05 |
| Placebo | 9,84 (2,51-20,95) | 7,49 (2,78-24,21) | NS |
| Cociente ghrelina acilada/PYY3-36 | |||
| Comida mixta | 2,03 (0,92-3,00) | 0,73 (0,26-1,27) | < 0,05 |
| Placebo | 2,14 (0,74-3,85) | 2,67 (0,75-5,7) | NS |
Las comparaciones se realizan con la prueba de Wilcoxon entre valores preprandiales y posprandiales.
Los valores de PYY1-36 y PYY3-36 presentaban una buena correlación. Sin embargo, de forma un tanto sorprendente, los valores basales de PYY3-36 fueron menores durante la prueba de placebo que tras la ingestión (tabla 1). La correlación entre los valores plasmáticos basales de PYY1-36 y PYY3-36 en la prueba de ingesta oral fue r = 0,38 (p = 0,31) y en la prueba de placebo, r = 0,78 (p = 0,03).
No encontramos correlaciones claras entre los valores basales de PYY1-36 y PYY3-36, por un lado, y los valores de ghrelina total y acilada, por el otro. No encontramos correlación aparente entre los valores basales de PYY1-36 y PYY3-36, por un lado, y las variables demográficas, por otro (edad, sexo, IMC), posiblemente en parte por el pequeño número de sujetos estudiados para este objetivo.
Los cocientes entre los valores basales de ghrelina y PYY se presentan en la tabla 1. Estos cocientes, que se podría interpretar como una puntuación orexigénica, disminuyen marcadamente tras la ingestión.
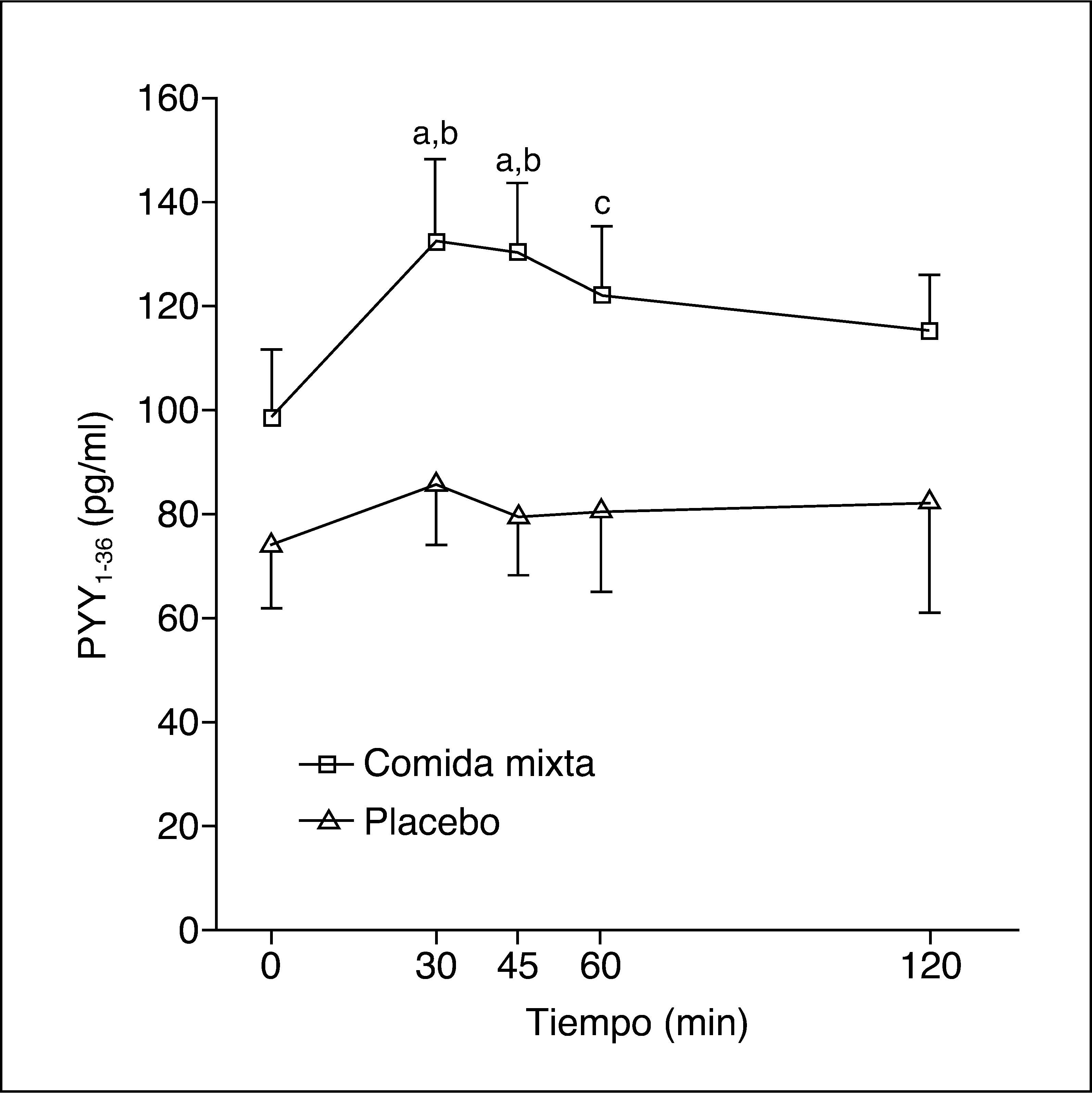
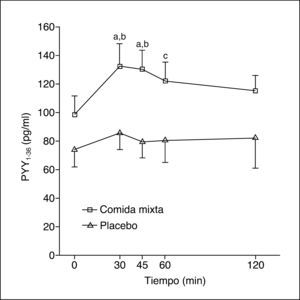
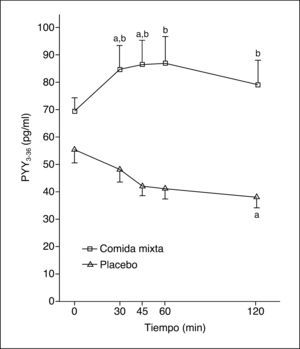
Los valores plasmáticos de PYY1-36 tras una comida mixta o placebo se muestran en la figura 1. La ingestión de una comida mixta causa un claro incremento en los valores de PYY1-36.
Tras la comida se produce un máximo valor de PYY1-36 –141,5 (81-198) pg/ml–, pero no hay respuesta tras placebo, con un máximo de 92,5 (46-219) pg/ml (p = 0,04). Los valores del ABC de PYY136 tras la ingesta fueron 14.865 (8.032-19.822) pg/ml/min y tras placebo, 8.992 (4.455-21.382) pg/ml/min (p = 0,06).
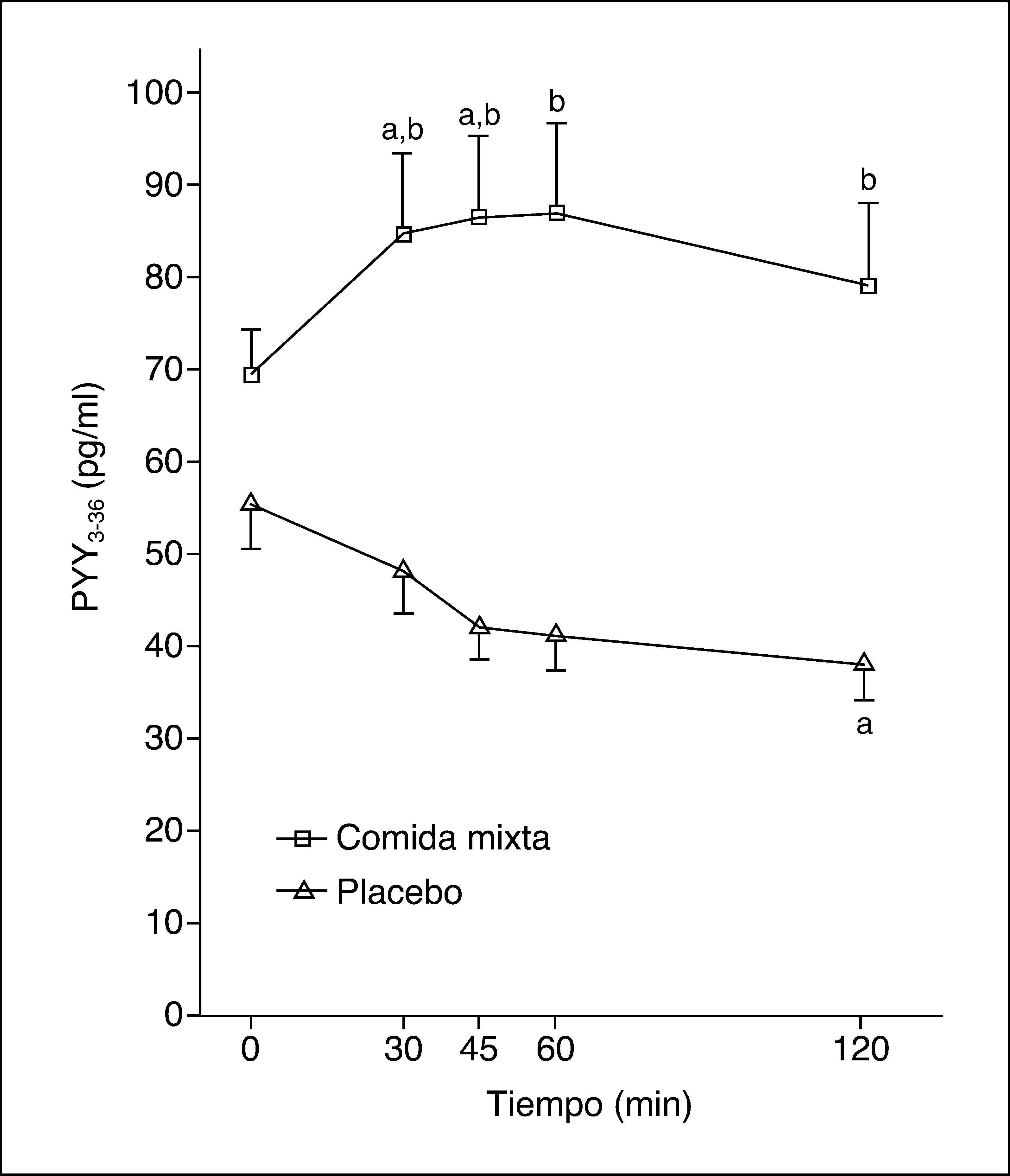
Los valores plasmáticos de PYY3-36 tras una comida mixta o placebo se muestran en la figura 2. La ingestión de una comida mixta causa un claro incremento en los valores de PYY3-36.
Tras ingerir la comida se produce un máximo de PYY3-36 de 92,5 (59-135) pg/ml, pero no hay respuesta tras placebo, con un máximo de 46,5 (30-66) pg/ml (p = 0,02). Los valores del ABC de PYY3-36 tras la ingesta fueron 9.086 (6.412-14.970) pg/ml/min y tras placebo, 4.984 (3.142-6.772) pg/ml/min (p = 0,012).
Estudiamos la relación entre el ABC de PYY1-36 por un lado y el ABC de los valores de glucemia, insulina, ghrelina total, ghrelina acilada, GH o leptina, por otro, sin encontrar correlaciones estadísticamente significativas.
Estudiamos la relación entre el ABC de PYY3-36 por un lado y el ABC de los valores de glucemia, insulina, ghrelina total, ghrelina acilada, GH o leptina, por otro, sin encontrar correlaciones estadísticamente significativas.
No encontramos relación entre los valores de PYY1-36 o PYY3-36 tras la comida y la respuesta de insulina, glucosa, ghrelina total, ghrelina acilada, GH o leptina, lo que indica que ninguno de los referidos factores participa en la regulación del PYY.
El cociente nadir de ghrelina total/máximo de PYY1-36 disminuye de forma marcada tras la comida, y los valores preprandiales son 7,44 (3,64-14,56) y los posprandiales, 3,55 (1,64-7,16) (p = 0,03), pero no se modifican tras placebo (tabla 1).
El cociente nadir de ghrelina acilada/máximo de PYY3-36 disminuye de forma marcada tras la comida, y los valores preprandiales son 2,03 (0,92-3) y los posprandiales, 0,73 (0,26-1,27) (p = 0,02), pero no se modifican tras placebo (tabla 1).
DISCUSIÓNEn nuestro estudio, las concentraciones de PYY1-36 y PYY3-36 en sujetos sanos aumentan de forma paralela tras la ingestión de una comida mixta, y simultáneamente las de ghrelina total y acilada disminuyen. El cociente entre el nadir de ghrelina acilada y el máximo de PYY3-36 disminuye tras una comida mixta.
Es objeto de creciente interés el papel de los péptidos gastrointestinales como reguladores primordiales de la ingesta33-36. El PYY pertenece a la familia del polipéptido pancreático (PP) y el neuropéptido Y (NPY). El ARNm del PYY ha sido identificado en el tracto gastrointestinal y el páncreas, y al igual que otras hormonas gastrointestinales, se ha identificado en neuronas características del tronco cerebral37. El PYY es metabolizado por la enzima dipeptidilpeptidasa IV que transforma el precursor PYY1-36 a PYY3-36. Debido a la intensidad y la rapidez de este proceso, la forma primordial circulante en el plasma humano tras la comida es PYY3-36, que posee una importante actividad biológica3.
La demostración de la acción anorexígena del PYY336 ha resultado sorprendente, pues la administración directa en el sistema nervioso central de PYY1-36 o PYY336 aumenta la ingesta38. Para explicar esta paradoja se ha formulado un modelo basado en los subtipos de receptores Y y su disponibilidad4. El PYY1-36 activa todos los receptores Y, y sus efectos orexigénicos están mediados por su interacción con los receptores Y1R e Y5R, que se expresan en el núcleo paraventricular hipotalámico y se cree que median el efecto orexigénico del NPY39. El PYY3-36 activa selectivamente Y2R e Y5R, y la administración intracerebroventricular de este péptido puede aumentar la ingesta a través de Y5R. Sin embargo, se cree que el PYY3-36 circulante accede selectivamente al Y2R en el núcleo arcuato del hipotálamo, que se encuentra fuera de la barrera hematoencefálica. En el hipotálamo, el Y2R es un receptor presináptico autoinhibitorio de las neuronas orexigénicas que expresan NPY y la proteína relacionada con agouti (AGRP). Por lo tanto, este modelo propone que el PYY3-36 reduce la ingesta inhibiendo las neuronas NPY/AGRP a través de la activación del Y2R, al mismo tiempo que disminuye la represión de las neuronas anorexígenas adyacentes productoras de melanocortina, que se encuentran inhibidas por las neuronas NPY/AGRP4. Coherente con este modelo, el efecto de PYY3-36 estimulador de la ingesta se anula con el bloqueo farmacológico o genético del Y2R4,40. La inyección en el núcleo arcuato de PYY3-36 inhibe la ingesta, mientras que la administración intracerebroventricular tiene el efecto contrario4. A pesar de estos hallazgos que confirmarían un mecanismo de acción hipotalámico de la administración periférica de PYY3-36, se ha propuesto también una mediación vagal41. Los efectos anorexígenos de PYY3-36 no han sido demostrados por todos los grupos6, aunque sí por la mayoría de ellos7,40,42. Recientes estudios en humanos con PYY3-36 administrado por vía intranasal no han podido arrojar resultados concluyentes, posiblemente en parte por mala tolerancia a las dosis anorexígenas clínicamente eficaces43.
En el presente estudio, tras la ingestión de una comida mixta de 600 kcal, los valores de PYY1-36 alcanzan un máximo a los 30 min. Los de PYY3-36 lo alcanzan a los 45 min, y permanecen elevados hasta el final de la prueba, a los 120 min. En el estudio de le Roux et al16, los valores máximos de PYY se alcanzan a los 90 min, aunque las determinaciones se realizan cada 30 min y la ingestión calórica fue variable, entre 250 y 3.000 kcal. El PYY es sintetizado y liberado por células endocrinas especializadas (células L) que se encuentran fundamentalmente en el tracto gastrointestinal distal. En nuestro estudio, en respuesta a la ingestión de nutrientes, los valores plasmáticos tanto de PYY1-36 como de PYY3-36 responden de forma precoz, y después permanecen elevados los de PYY3-36. El incremento inicial se produce antes de que los nutrientes alcancen las células L, lo que implica mecanismos neurales, posiblemente vagales y endocrinos. La liberación más sostenida posiblemente se deba al efecto directo del contenido intraluminal gástrico en las células L44. Otros autores16,18,45 han encontrado resultados similares, aunque con un diseño experimental diferente. El estudio actual aporta, fundamentalmente, información adicional sobre el posible papel de la forma activa circulante del PYY, PYY3-36, como factor de la regulación aguda de la ingesta.
Los valores de PYY3-36 estaban moderada aunque significativamente elevados antes de la ingestión de la comida mixta, comparado con los valores antes de la ingestión del placebo. Este hallazgo podría deberse a un aumento de la actividad vagal, activado por la anticipación de la comida; algo similar se ha encontrado para la concentración de insulina tras el ayuno46. Igualmente se ha demostrado que el sham-feeding, en el que se visualiza, se huele, se mastica y se saborea, pero no se deglute la comida, es capaz de disminuir la cantidad total de ghrelina47.
Es igualmente importante el papel de la ghrelina en la regulación de la ingesta en humanos, pues la infusión aguda de ghrelina aumenta el hambre a corto plazo27. Los valores plasmáticos de ghrelina se correlacionan de forma negativa con el índice de masa corporal, la masa grasa, la leptina, la insulina y la glucosa28,48-50. La concentración de ghrelina circulante aumenta antes de las comidas y disminuye tras ellas51. La distensión gástrica con agua no disminuye la cantidad de ghrelina52,53; sin embargo, la ingestión de fibra no nutritiva reduce la ghrelina54. La ghrelina acilada disminuye igualmente tras la ingestión de una comida mixta55-57. Nuestro grupo estudia desde hace años el papel de la ghrelina y otros péptidos en situaciones con alteración del balance nutricional22,58-61. Nosotros hemos encontrado que la ghrelina total y la acilada disminuyen tras la ingestión de una comida mixta en sujetos normales y que esta respuesta se correlaciona inversamente con la secreción de insulina62. El PYY se secreta de forma inversa a la forma activa de la ghrelina en el apetito, la ghrelina acilada. Estos datos indican que ambos péptidos podrían actuar de forma coordinada para regular de forma aguda la ingesta. No encontramos relación entre los valores de PYY1-36 o los de PYY3-36 tras la comida y la respuesta de insulina, glucosa, ghrelina total, ghrelina acilada, GH o leptina, lo que indica que ninguno de esos factores participa en la regulación del PYY. Estos datos contrastan en parte con los de Giménez-Palop et al63, que encuentran una correlación inversa entre el incremento de PYY y la disminución de ghrelina a los 60 y los 120 min tras la ingestión, aunque las condiciones del estudio no son superponibles. Los valores de PYY tras la sobrecarga oral de glucosa se han encontrado más elevados en la mujer que en el varón. Por otra parte, en ese mismo estudio no se encontró correlación entre los valores de PYY en ayunas o tras la ingestión y el IMC64.
En resumen, en sujetos sanos, las concentraciones de PYY1-36 y PYY3-36 aumentan de forma paralela tras una comida mixta y simultáneamente las de ghrelina total y las de acilada disminuyen. El cociente entre el nadir de ghrelina acilada y el máximo de PYY3-36 disminuye tras una comida mixta. Este conjunto de datos indica su posible participación en la regulación aguda del apetito tras la ingestión.
Financiado en parte por FIS del Instituto de Salud Carlos PI051024 y PI070413, Xunta de Galicia, PGIDT05PXIC91605PN, PS07/12 y Redes 2006/27.