La terapia con bomba de insulina asociada a monitorización continua de glucosa ha demostrado tener un impacto clínico positivo en el control de la diabetes y en la reducción de los episodios de hipoglucemia. Aunque existen descripciones del rendimiento del dispositivo en otras poblaciones, se desconoce su desempeño en Colombia y Latinoamérica en el contexto de la terapia ambulatoria usual.
MétodosSe analizaron los registros de 33 pacientes con diabetes mellitus tipo 1 y 2 en terapia con monitorización continua de glucosa integrada al infusor de insulina con suspensión automática en hipoglucemia (MiniMed Paradigm® Veo™) utilizando el Sensor Sof-Sensor™ (Medtronic, Northridge, California) manejados en el Hospital Universitario San Ignacio (Bogotá, Colombia) y que venían recibiendo tratamiento ambulatorio. Se compararon datos simultáneos provenientes de glucometría capilar y monitorización continua de glucosa, calculando su validez por diferentes técnicas, incluyendo un análisis clínico utilizando la gradilla de error de Clarke.
ResultadosBasados en 2.262 datos pareados se encontró una media de la diferencia absoluta relativa para todas las mediciones del 20,1%, siendo mayor a 23% en las mediciones ≤75mg/dl. El cumplimiento global de los criterios ISO fue de 64,9%, siendo mejor en las mediciones >75mg/dl (68,3%, 1.308 de 1.916 lecturas), que en aquellas ≤ 75mg/dl (49,4%, 171 de 346 lecturas). El porcentaje combinado en zonas A y B de la gradilla de error de Clarke fue del 91,77% (75,6% para hipoglucemia).
ConclusionesSe observó un buen desempeño numérico para las determinaciones intersticiales en situaciones de normo- e hiperglucemia, persistiendo poca precisión en el rango de hipoglucemia. La precisión clínica del dispositivo es adecuada, sin comprometer de forma significativa la seguridad de los pacientes.
Insulin pump therapy associated with continuous glucose monitoring has shown a positive clinical impact on diabetes control and reduction of hypoglycemia episodes. There are descriptions of the performance of this device in other populations, but its precision and accuracy in Colombia and Latin America are unknown, especially in the routine outpatient setting.
MethodsData from 33 type 1 and type 2 diabetes patients with sensor-augmented pump therapy with threshold suspend automation, MiniMed Paradigm® Veo™ (Medtronic, Northridge, California), managed at Hospital Universitario San Ignacio (Bogotá, Colombia) and receiving outpatient treatment, were analyzed. Simultaneous data from continuous glucose monitoring and capillary blood glucose were compared, and their precision and accuracy were calculating with different methods, including Clarke error grid.
ResultsAnalyses included 2,262 continuous glucose monitoring -reference paired glucose values. A mean absolute relative difference of 20.1% was found for all measurements, with a value higher than 23% for glucose levels ≤75mg/dL. Global compliance with the ISO criteria was 64.9%. It was higher for values >75mg/dl (68.3%, 1,308 of 1,916 readings), than for those ≤ 75mg/dl (49.4%, 171 of 346 readings). Clinical accuracy, as assessed by the Clarke error grid, showed that 91.77% of data were within the A and B zones (75.6% in hypoglycemia).
ConclusionsA good numerical accuracy was found for continuous glucose monitoring in normo and hyperglycemia situations, with low precision in hypoglycemia. The clinical accuracy of the device was adequate, with no significant safety concerns for patients.
Diferentes estudios clínicos han demostrado los beneficios de la intensificación de la terapia en diabetes mellitus, demorando el inicio o progresión de las complicaciones asociadas a la diabetes1–5. Sin embargo, el costo de un mejor control metabólico fue la presentación de 3 veces más episodios de hipoglucemia en el grupo de manejo intensivo vs. convencional, lo cual convierte a la hipoglucemia y el temor a la hipoglucemia en las principales limitantes para alcanzar reducciones significativas de HbA1c2–4. El desarrollo de sistemas de monitorización continua de glucosa intersticial (MCG o CGM por las siglas en inglés de Continuous Glucose Monitoring System) y su integración a la terapia con bomba de insulina, también conocida como Sensor Augmented Pump Therapy (SAP) busca reducir este riesgo, en especial en el caso de episodios inadvertidos en los cuales existe un riesgo de hipoglucemia severa con serias consecuencias6. Esta herramienta toma mucha más relevancia si se toma en cuenta que la hipoglucemia se puede presentar en forma inadvertida hasta en un 57% de los pacientes7,8.
La precisión del MCG depende de condiciones como el equilibrio de glucosa entre el líquido intersticial, el plasma y la sangre completa, existiendo un tiempo de demora para la difusión de la glucosa del plasma al líquido intersticial (lag time)9–11. Durante los cambios rápidos en las concentraciones de glucosa las mediciones intersticiales pueden dar como resultado valores discordantes (mayores o menores) al compararlos con las concentraciones venosas plasmáticas, e igualmente los dispositivos tienen la tendencia a una menor precisión en el rango inferior de glucemia (< 70mg/dl o 3,9mmol/L)12–15. Recientemente se han desarrollado dispositivos de monitorización como el Sof-sensor (Medtronic, Northridge, CA) y el Enlite™ (Medtronic, Northridge, CA), que se integran a bombas de insulinas con nuevos algoritmos de calibración capaces de incorporar los datos previos y futuros en los cálculos de cada valor de glucosa, por lo que son una aproximación al «tiempo real», utilizando un modelo de promedio de regresión «suavizado» a partir de la tendencia de la medición cada 5 minutos de la glucometría intersticial16. Con estas mejoras los nuevos sistemas incluyen la posibilidad de ajustar el umbral de alarmas que alertan al usuario no solo cuando se alcanzan los niveles programados, sino también cuando un valor extrapolado predictivo va a alcanzar el nivel de alerta en un tiempo programado con anterioridad (baja prevista), así como la programación de la función de suspensión de la infusión de insulina cuando se alcanza un valor programado de glucemia (suspensión automática en hipoglucemia)15,17–19.
Dentro de la práctica clínica diaria en el Hospital Universitario San Ignacio se percibía que la precisión del sistema de MCG en los pacientes con terapia SAP podría ser inferior a la registrada en la literatura internacional, y considerado que no teníamos estudios previos se decidió evaluar formalmente con el presente trabajo. Este es el primer estudio que evalúa, en Colombia y Latinoamérica, la precisión del sistema de monitorización continua de glucosa integrado al infusor de insulina con suspensión automática en hipoglucemia (MiniMed Paradigm® Veo™), utilizando el Sensor Sof-Sensor™ (Medtronic, Northridge, CA) bajo las condiciones de la vida diaria, no en el ámbito de un estudio controlado para verificación de la terapia en el «mundo real».
MétodosEl estudio se realizó en 33 pacientes con diabetes en SAP en contexto ambulatorio, con entrenamiento y manejo en la Unidad de Endocrinología del Hospital Universitario San Ignacio. Al ingreso al estudio se solicitó consentimiento informado. Se contó con la aprobación del comité de ética institucional.
Los criterios de inclusión fueron pacientes diabéticos tipo 1 y 2 en manejo con infusor de insulina con sistema de monitorización continuo de glucosa integrado con suspensión automática en hipoglucemia, MiniMed Paradigm® Veo™ (Medtronic Inc, Northridge, CA), con utilización del dispositivo al menos durante 3 meses antes de la inclusión, sin importar el valor de HbA1c, ni la presencia de complicaciones micro- o macrovasculares. Se excluyeron pacientes embarazadas y registros con menos de 2 glucometrías de calibración, y/o pérdida de señal por tiempo mayor de 12 horas.
Los pacientes utilizaron los sensores para CGM Sof-Sensor™ (Medtronic, Northridge, CA) por un periodo total de al menos 6 días (rango 6-12 días) con intervalos de uso de cada sensor de 3 días, según la recomendación del fabricante. La calibración se realizó utilizando glucómetros (Optium Xceed® y One touch®). Se les indicó a los pacientes la calibración del sensor entre tres a cuatro veces cada día, ya que esto brinda un mejor rendimiento. El primer día se indicó calibrar el sistema a las 2, 6 y 12 horas, y en los días siguientes tres a cuatro veces teniendo en cuenta que la glucosa no estuviera experimentando cambios importantes (como después de un bolo de insulina, después de comer, durante o después de realizar actividad física), durante un episodio de hipoglucemia, o si en la pantalla gráfica del sensor se observaba una o dos flechas indicando elevación o disminución de la glucosa a velocidad de 1 a 2mg/dL por minuto o a más de 2mg/dL por minuto.
Se instruyó la realización del registro de las glucometrías capilares y los valores simultáneos de glucemias intersticiales por escrito, en un instrumento diseñado para este fin (con las categorías de preprandiales, posprandiales, hiperglucemia, hipoglucemia, y suspensión automática en hipoglucemia), el cual debían entregar a la finalización del seguimiento.
La obtención de los registros se hizo simultáneamente del instrumento y mediante la descarga de información del dispositivo a través del software CareLink Pro Versión 3.0 (Medtronic, Northridge, CA), esta última se realizó en el Hospital Universitario San Ignacio. No se realizaron intervenciones adicionales a la terapia que el paciente recibía dentro de su atención médica usual.
Análisis estadísticoLa diferencia de los valores entre la glucometría intersticial y la capilar se analizó realizando una prueba t para diferencia de medias, comparando la glucometría capilar medida por el dispositivo usual de terapia de cada paciente en forma simultánea a la medición intersticial por MCG (sin superar un intervalo de 5 minutos entre ambas) en diferentes situaciones, incluyendo determinaciones preprandiales, posprandiales y durante la activación de alarmas de hipoglucemia, hiperglucemia y suspensión automática en hipoglucemia.
Para el análisis de precisión numérica se tomaron en cuenta los requerimientos para MCG planteados por la Organización Internacional para la estandarización (ISO). Se calculó la diferencia relativa de la media absoluta (MARD, por las siglas en inglés de mean absolute relative difference), a partir de la media de las diferencias aritméticas del valor intersticial y capilar ([glucometría capilar - glucometría intersticial/glucometría capilar] x 100) para datos pareados en los diferentes contextos clínicos de hiperglucemia (glucemia mayor de 180mg/dl), hipoglucemia (glucemia menor de 70mg/dl con o sin síntomas) y suspensión automática en hipoglucemia (activación programada para cada paciente, en general menor de 55mg/dl). De igual forma se consideró el cumplimiento según los criterios ISO por una variación positiva o negativa de 15mg/dl cuando el valor de glucometría es ≤ 75mg/dl y del 20% cuando es ≥ 75mg/dl14,17. Adicionalmente se calcularon las medias de valores de glucometría capilar e intersticial y el valor de P por estadístico t mediante MedCalc® versión 11.5.1.0 (MedCalc Software, Ostend, Bélgica).
La precisión clínica se realizó según lo recomendado en diferentes guías por medio de la gradilla de error de Clarke14,19,20. Para dicha evaluación se consideraron datos pareados excluyendo los valores>400mg/dl de glucometría capilar por ser 400mg/dl el límite superior de detección del sistema de MCG. Estos se clasificaron según las regiones de la gráfica así: A: valores intersticiales dentro del 20% del rango de glucometría capilar; B: valores de glucemia intersticial fuera del 20% del rango capilar pero que no llevan a tratamiento inapropiado; C: valores de glucemia intersticial que llevan a tratamiento innecesario; D: valores intersticiales que indican una falla potencialmente peligrosa para detectar hipoglucemia o hiperglucemia; E: valores de glucemia intersticial que llevarían a confundir manejo de hipoglucemia por hiperglucemia o viceversa12,14,19,20. Se utilizó para el cálculo un código específico de error de Clarke empleando Matlab® Versión 7.14.0.739 (MathworksInc, Natick, MA, EE. UU.).
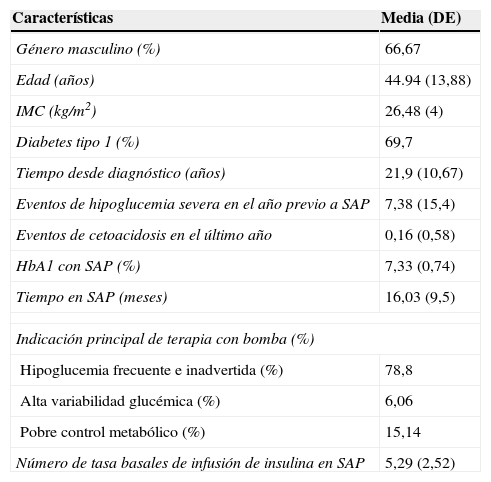
ResultadosLas características basales de los 33 pacientes incluidos en el estudio se presentan en la tabla 1. En su mayoría se trata de pacientes con diabetes tipo 1 (69,7%), de sexo masculino (66,7%) con diabetes de larga duración y que venían recibiendo terapia con bomba de insulina por más de un año. La principal indicación de la terapia fue la presencia de hipoglucemia frecuente e inadvertida (78,8%). Los 10 pacientes con diabetes tipo 2 tenían características discretamente diferentes a las encontradas a aquellos con diabetes tipo 1, específicamente se encontró un mayor porcentaje de hombres (80%), mayor media de edad 58,3 años (±3,39), y la indicación de bomba más frecuente fue el mal control metabólico (60%), los niveles medios de HbA1c, y la tasa de eventos previos de hipoglucemia fueron similares en ambos subgrupos de pacientes.
Características generales de los pacientes (n=33)
| Características | Media (DE) |
|---|---|
| Género masculino (%) | 66,67 |
| Edad (años) | 44.94 (13,88) |
| IMC (kg/m2) | 26,48 (4) |
| Diabetes tipo 1 (%) | 69,7 |
| Tiempo desde diagnóstico (años) | 21,9 (10,67) |
| Eventos de hipoglucemia severa en el año previo a SAP | 7,38 (15,4) |
| Eventos de cetoacidosis en el último año | 0,16 (0,58) |
| HbA1 con SAP (%) | 7,33 (0,74) |
| Tiempo en SAP (meses) | 16,03 (9,5) |
| Indicación principal de terapia con bomba (%) | |
| Hipoglucemia frecuente e inadvertida (%) | 78,8 |
| Alta variabilidad glucémica (%) | 6,06 |
| Pobre control metabólico (%) | 15,14 |
| Número de tasa basales de infusión de insulina en SAP | 5,29 (2,52) |
DE: desviación estándar; IMC: índice de masa corporal; SAP: sensor augmented pump therapy.
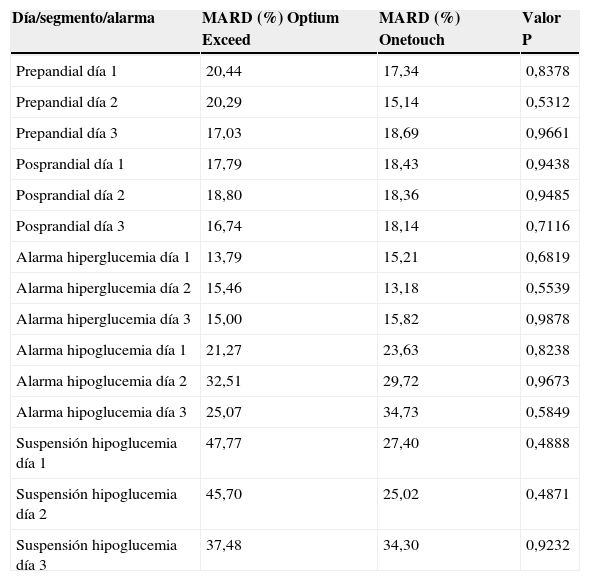
Para el análisis numérico se analizaron 2.262 pares de datos válidos. Dado que se usaron dos glucómetros en los diferentes pacientes (Optium Xceed® y One touch®) se procedió a realizar un análisis diferencial del MARD para cada uno de los dispositivos, sin encontrar diferencias significativas (p=0,9531, tabla 2).
Comparación según tipo de glucómetro de la MARD
| Día/segmento/alarma | MARD (%) Optium Exceed | MARD (%) Onetouch | Valor P |
|---|---|---|---|
| Prepandial día 1 | 20,44 | 17,34 | 0,8378 |
| Prepandial día 2 | 20,29 | 15,14 | 0,5312 |
| Prepandial día 3 | 17,03 | 18,69 | 0,9661 |
| Posprandial día 1 | 17,79 | 18,43 | 0,9438 |
| Posprandial día 2 | 18,80 | 18,36 | 0,9485 |
| Posprandial día 3 | 16,74 | 18,14 | 0,7116 |
| Alarma hiperglucemia día 1 | 13,79 | 15,21 | 0,6819 |
| Alarma hiperglucemia día 2 | 15,46 | 13,18 | 0,5539 |
| Alarma hiperglucemia día 3 | 15,00 | 15,82 | 0,9878 |
| Alarma hipoglucemia día 1 | 21,27 | 23,63 | 0,8238 |
| Alarma hipoglucemia día 2 | 32,51 | 29,72 | 0,9673 |
| Alarma hipoglucemia día 3 | 25,07 | 34,73 | 0,5849 |
| Suspensión hipoglucemia día 1 | 47,77 | 27,40 | 0,4888 |
| Suspensión hipoglucemia día 2 | 45,70 | 25,02 | 0,4871 |
| Suspensión hipoglucemia día 3 | 37,48 | 34,30 | 0,9232 |
MARD: media de diferencia absoluta relativa.
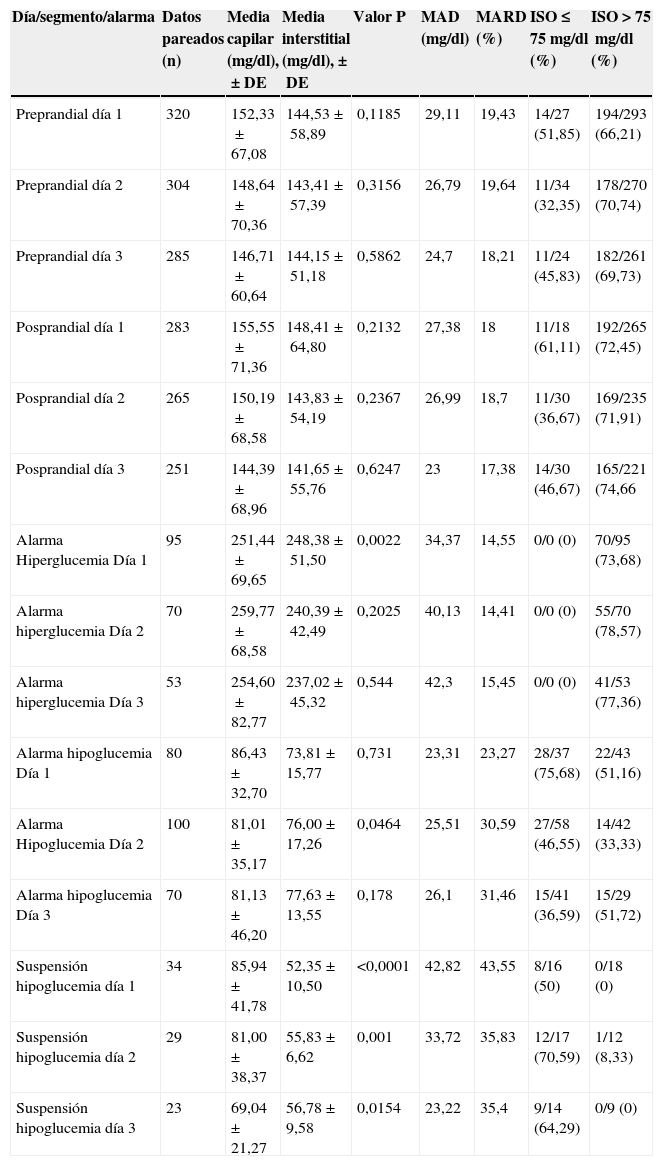
La MARD de todas las mediciones (n=2262) fue del 20,1% y el cumplimiento ISO del 64,94%. La tabla 3 realiza una descripción detallada del comportamiento en la precisión numérica de cada segmento y alarma considerados. Se evaluó adicionalmente la MARD de forma diferencial en los pacientes con diabetes tipo 1 y tipo 2 sin encontrar diferencia entre ellas (20,43 vs. 19,85%, p=0,75), evidenciando que el tipo de diabetes no impacta en la precisión del sensor.
Comparación general valores capilares vs. intersticiales de acuerdo al día de uso del sensor
| Día/segmento/alarma | Datos pareados (n) | Media capilar (mg/dl),±DE | Media interstitial (mg/dl),±DE | Valor P | MAD (mg/dl) | MARD (%) | ISO ≤ 75mg/dl (%) | ISO>75mg/dl (%) |
|---|---|---|---|---|---|---|---|---|
| Preprandial día 1 | 320 | 152,33±67,08 | 144,53±58,89 | 0,1185 | 29,11 | 19,43 | 14/27 (51,85) | 194/293 (66,21) |
| Preprandial día 2 | 304 | 148,64±70,36 | 143,41±57,39 | 0,3156 | 26,79 | 19,64 | 11/34 (32,35) | 178/270 (70,74) |
| Preprandial día 3 | 285 | 146,71±60,64 | 144,15±51,18 | 0,5862 | 24,7 | 18,21 | 11/24 (45,83) | 182/261 (69,73) |
| Posprandial día 1 | 283 | 155,55±71,36 | 148,41±64,80 | 0,2132 | 27,38 | 18 | 11/18 (61,11) | 192/265 (72,45) |
| Posprandial día 2 | 265 | 150,19±68,58 | 143,83±54,19 | 0,2367 | 26,99 | 18,7 | 11/30 (36,67) | 169/235 (71,91) |
| Posprandial día 3 | 251 | 144,39±68,96 | 141,65±55,76 | 0,6247 | 23 | 17,38 | 14/30 (46,67) | 165/221 (74,66 |
| Alarma Hiperglucemia Día 1 | 95 | 251,44±69,65 | 248,38±51,50 | 0,0022 | 34,37 | 14,55 | 0/0 (0) | 70/95 (73,68) |
| Alarma hiperglucemia Día 2 | 70 | 259,77±68,58 | 240,39±42,49 | 0,2025 | 40,13 | 14,41 | 0/0 (0) | 55/70 (78,57) |
| Alarma hiperglucemia Día 3 | 53 | 254,60±82,77 | 237,02±45,32 | 0,544 | 42,3 | 15,45 | 0/0 (0) | 41/53 (77,36) |
| Alarma hipoglucemia Día 1 | 80 | 86,43±32,70 | 73,81±15,77 | 0,731 | 23,31 | 23,27 | 28/37 (75,68) | 22/43 (51,16) |
| Alarma Hipoglucemia Día 2 | 100 | 81,01±35,17 | 76,00±17,26 | 0,0464 | 25,51 | 30,59 | 27/58 (46,55) | 14/42 (33,33) |
| Alarma hipoglucemia Día 3 | 70 | 81,13±46,20 | 77,63±13,55 | 0,178 | 26,1 | 31,46 | 15/41 (36,59) | 15/29 (51,72) |
| Suspensión hipoglucemia día 1 | 34 | 85,94±41,78 | 52,35±10,50 | <0,0001 | 42,82 | 43,55 | 8/16 (50) | 0/18 (0) |
| Suspensión hipoglucemia día 2 | 29 | 81,00±38,37 | 55,83±6,62 | 0,001 | 33,72 | 35,83 | 12/17 (70,59) | 1/12 (8,33) |
| Suspensión hipoglucemia día 3 | 23 | 69,04±21,27 | 56,78±9,58 | 0,0154 | 23,22 | 35,4 | 9/14 (64,29) | 0/9 (0) |
Criterios International Standardization Organization (ISO): diferencia de valor de sensor dentro de ±15mg/dl cuando glucosa capilar ≤ 75mg/dl o dentro del ±20% cuando glucosa capilar>75mg/dl.
% Criterios ISO: número de lecturas del sensor dentro del criterio/lecturas capilares totales según valor capilar ≤75 o >75mg/dl (%).
Los límites personalizados de alarmas de hipoglucemias e hipoglucemias inadvertidas se programaron en un rango amplio (inclusive valores mayores de 75mg/dl).
DE: desviación estándar; MAD: media de diferencia absoluta; MARD: media de diferencia absoluta relativa.
En forma general la MARD fue menor del 20% para los registros preprandiales y posprandiales agrupados (tabla 3). Por las características del sensor se calculó la precisión según el día, desde la inserción del dispositivo (días 1, 2 y 3) sin encontrar diferencias significativas. El 65% de las lecturas preprandiales cumplieron el criterio ISO (590 de 909 mediciones). Se obtuvieron 85 registros pareados para el rango ≤ 75mg/dl con un porcentaje de cumplimiento ISO del 42,4% (36 de 85 lecturas). En las mediciones posprandiales (n=799) se cumplieron los criterios ISO en 70,34% de los casos (>75mg/dl 526 de 721 lecturas, 72,95%; ≤ 75mg/dl 36 de 78 lecturas, 46,15%).
Para las alarmas de hipoglucemia (n= 250) el cumplimiento global de lineamientos ISO se observó en 121 datos, correspondientes al 48,4%. En este caso el promedio de MARD fue de 28,5%.
En los registros de suspensión automática en hipoglucemia solo el 34,9% de las lecturas cumplieron criterios ISO, con valores de MARD entre 35 y 43%, sin embargo es importante tener en cuenta el número limitado de mediciones (n=86).
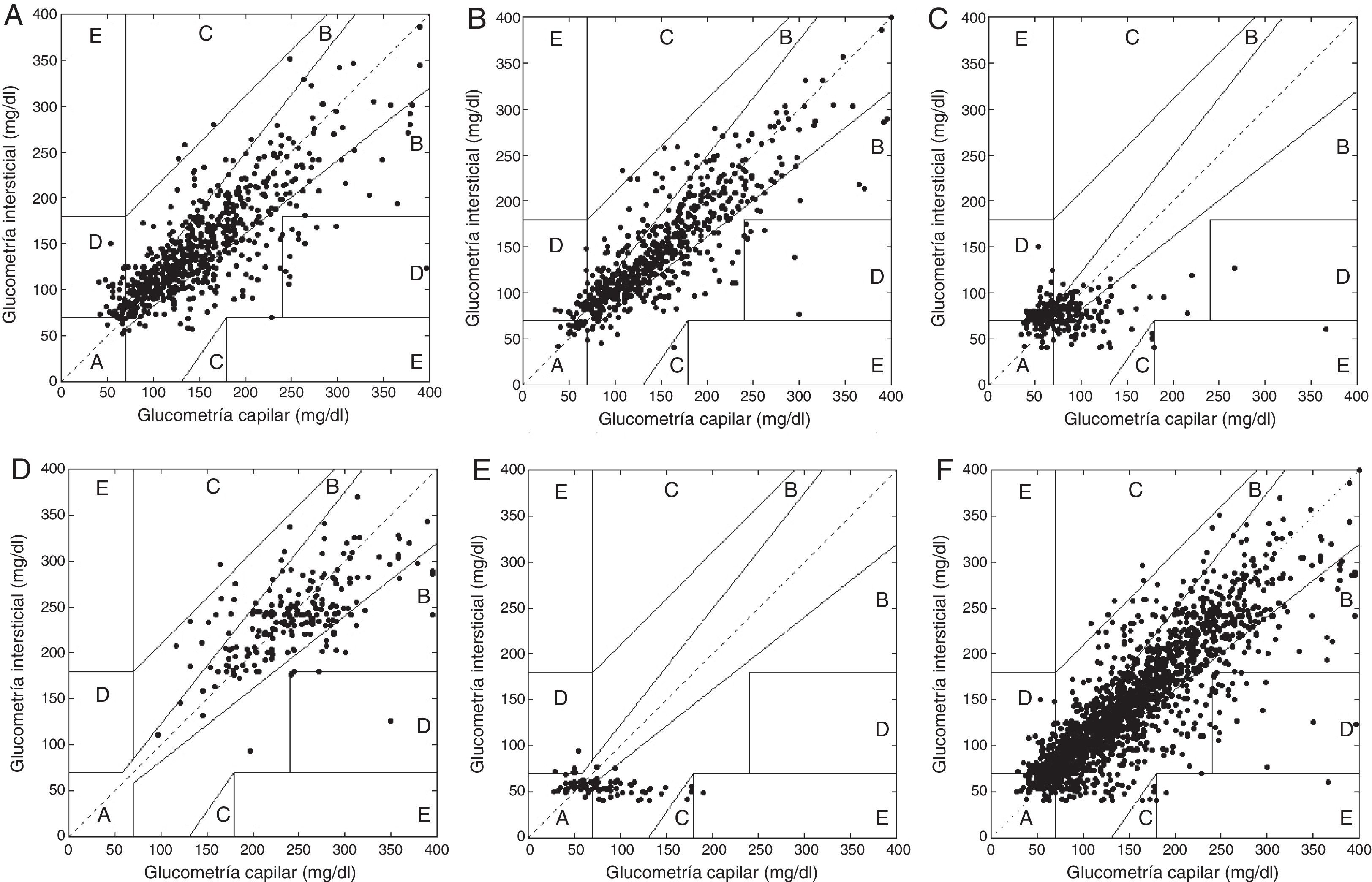
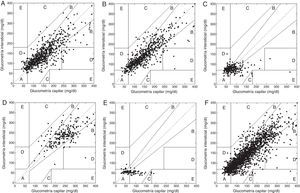
Precisión clínicaSe consideraron 2.247 pares de datos tras la exclusión de los valores glucométricos capilares mayores de 400mg/dl por el límite de sensibilidad del sensor. El porcentaje combinado en zonas A y B de la gradilla de error de Clarke (clínicamente aceptables) fue del 93,2% para datos preprandiales, 93,8% para datos posprandiales, 75,6% para registros de hipoglucemia, 97,6% para registros de hiperglucemia y 89,5% para los registro de suspensión automática en hipoglucemia. En forma conjunta para todos los valores el porcentaje en zonas A+B fue de 91,77% y en zona E de 0,18%. La figura 1 demuestra el comportamiento comparativo glucémico capilar e intersticial de acuerdo a la gradilla de error de Clarke.
Análisis de gradilla de error de Clarke.
A) Valores pareados preprandiales (valores en zona A+B 93,27%). B) Valores posprandiales (zona A+B 93,84%). C) Alarma hipoglucemia (zona A+B 75,6%). D) Alarma hiperglucemia (zona A+B 97,62%). E) Suspensión por hipoglucemia (zona A+B 89,54%). F) Valores totales (zona A+B 91,77%, zona E 0,18%). Al interior de cada gráfica se presentan los datos pareados en cada una de las zonas propuestas por Clarke así: A) valores intersticiales dentro del 20% del rango de glucometría capilar; B) valores de glucometría intersticial fuera del 20% del rango capilar pero que no llevan a tratamiento inapropiado; C) valores de glucometría intersticial que llevan a tratamiento innecesario; D) valores intersticiales vs. capilares que indican una falla potencialmente peligrosa para detectar hipoglucemia o hiperglucemia; E) valores de glucometría intersticial que llevarían a confundir manejo de hipoglucemia por hiperglucemia o viceversa.
No se reportaron episodios de cetoacidosis tras los eventos de suspensión automática en hipoglucemia, ni tras activación de alarmas de hiperglucemia. De igual forma, ninguno de los pacientes tuvo requerimiento de manejo médico por hipoglucemia durante el periodo de registro.
DiscusiónSon múltiples las publicaciones que han reportado el beneficio de la utilización de la monitorización continua de glucosa asociada a la terapia con bomba de insulina21–24. Sin embargo este es el primer estudio que evalúa la precisión numérica y clínica de dispositivos que incluyen la función de suspensión automática en hipoglucemia en población latinoamericana.
Publicaciones previas han demostrado que el algoritmo de calibración del sistema MiniMed Paradigm® Veo™ (Medtronic Inc, Northridge, CA) es más preciso en el rango de 81 a 120mg/dl y ha presentado una mejoría significativa entre 40 y 80mg/dl12. Las validaciones iniciales plantean un aumento en la detección de hipoglucemia de un 54,9 a un 82,3% al incluir el nuevo proceso matemático, pasando hasta un 90 a 94% al considerar las herramientas de alertas predictivas que permitió el desarrollo de la herramienta de suspensión automática en hipoglucemia. Para dicho estudio la MARD, de acuerdo a los rangos de detección se encuentra en el rango de 14 a 18% para los valores de 80 a 240mg/dl, y cerca del 25% para los valores de 40 a 80mg/dl12, datos similares a los que encontramos en el presente estudio. En nuestro caso particular evidenciamos un mejor desempeño en relación a criterios ISO y MARD en las determinaciones en el marco de normo- e hiperglucemia, aunque en el caso de la suspensión automática en hipoglucemia más del 50% de las mediciones en el nivel ≤ 75mg/dl no cumplieron con los lineamientos.
A pesar de las reducciones numéricas en los cálculos de MAD y MARD, no existe un consenso con respecto a las categorías de precisión para esta u otras determinaciones estadísticas descritas12,15, y aún en diferentes consensos no existe una definición clara de los valores para establecer un adecuado desempeño, pues aunque los criterios ISO se han aceptado como medida general, estos se adaptaron a partir de la evaluación de los sistemas de glucometría capilar18,19.
De acuerdo a varios autores y guías de consenso12,16,18,19 por encima del concepto de precisión numérica prima la precisión clínica, definida por el análisis de la gradilla de error de Clarke. La fortaleza de este método es la definición de desenlaces clínicos por la identificación del resultado de la intervención realizada con los datos obtenidos por el sensor intersticial y las propiedades dinámicas del análisis al incluir la dirección y cambio de los valores glucémicos15,18–25. Las modificaciones en los procesos de calibración y algoritmos de los dispositivos han llevado a una mejoría significativa en el aspecto clínico, haciendo que el porcentaje de determinaciones ubicadas en las zonas A y B del error de Clarke se encuentren entre 76 y 89% para los valores inferiores, y 93 a 99% en los rangos de normo- e hiperglucemia13,19. Los hallazgos en nuestra población coinciden con dicho comportamiento con un desempeño global en zonas A y B del 91,7%, aun en los rangos de hipoglucemia e hiperglucemia los valores se aproximan a los descritos en otros estudios (75,6% para hipoglucemia y 97,6% para hiperglucemia en nuestro caso). De forma significativa solo en un caso se encontró un porcentaje elevado en la zona E que es la de mayor riesgo potencial (1,16% para suspensión automática por hipoglucemia), situación posiblemente asociada al bajo número de determinaciones totales, siendo llamativo el número de episodios tomando en cuenta las características de alto riesgo para hipoglucemia de nuestra población. Lo anterior puede reflejar una posible mejoría asociada al uso de los dispositivos en materia de frecuencia de hipoglucemia.
Este comportamiento se correlaciona con la descripción en la literatura de la reducción de valores en la zona E de la tecnología integrada, la cual se encuentra en el rango de 0,12 a 0,18%, límite en el cual se encuentra el desempeño global en nuestro estudio. Estos elementos sumados a la ausencia de hiperglucemias asociadas a cetoacidosis o requerimiento de manejo médico-hospitalario postsuspensión o por hipoglucemias severas, sugieren en conjunto una detección más temprana y precisa de los eventos de hiper- e hipoglucemia, mejorando la seguridad para el paciente y aumentando el espacio de autotratamiento de las potenciales complicaciones asociadas a estas. Como beneficio adicional nuestros hallazgos plantean un primer análisis en el contexto ambulatorio, por fuera de las condiciones controladas de un estudio clínico, indicando los resultados favorables del desempeño del dispositivo en el mundo real.
ConclusiónAunque se observó un mejor desempeño numérico para las determinaciones intersticiales en situaciones de normo- e hiperglucemia, la precisión clínica establecida a través de la gradilla de error de Clarke demuestra que la mayoría de las determinaciones se encuentran en categorías clínicamente adecuadas, con un mínimo de datos en los grupos con riesgo asociado por intervenciones definidas con la monitorización continua. De esta forma se demuestra un adecuado rendimiento clínico del MCG, contribuyendo al manejo de los pacientes al incluir las herramientas de tendencias en las variaciones glucémicas sin comprometer la seguridad de los mismos.
El presente trabajo constituye la primera descripción latinoamericana del comportamiento de esta terapia en nuestra población específica y establece un punto de partida para la comparación con nuevas modificaciones en miras de la mejoría de los dispositivos actuales para el manejo de la diabetes.
Conflicto de interesesAna María Gómez ha actuado como Speaker de Novo-Nordisk, Elli Lilly, MSD Novartis y Medtronic, y ha recibido apoyo financiero para investigación de Medtronic, Sanofi Aventis y Abbott.
Alejandro Marín Sánchez ha actuado como Speaker de Medtronic.
Los demás autores declaran no tener ningún conflicto de intereses.