La infusión de Hibiscus sabdariffa (H. sabdariffa) es una bebida muy popular en muchos lugares del mundo. Su composición fitoquímica se asocia a efectos antioxidantes, hipotensores y antiateroscleróticos. No obstante, no se conocen con profundidad los mecanismos moleculares implicados en estos procesos. El objetivo de la presente revisión fue describir las evidencias científicas que apoyan que el consumo regular de H. sabdariffa reduce el estrés oxidativo, la aterosclerosis, el perfil lipídico y la tensión arterial.
Material y métodosSe realizó una búsqueda de publicaciones recientes en las siguientes bases de datos electrónicas especializadas: Elsevier Journal, SciELO, FSTA, Science Direct, Springer Link y NCBI. Se describieron los resultados de trabajos llevados a cabo en ensayos clínicos en humanos, modelos animales y cultivos celulares. Las palabras clave utilizadas fueron Hibiscus sabdariffa, estrés oxidativo, polifenoles, hipertensión, aterosclerosis y perfil lipídico.
ResultadosLos resultados de los diferentes artículos evidenciaron un posible efecto terapéutico de los extractos de H. sabdariffa sobre el estrés oxidativo, el perfil lipídico, la hipertensión y la aterosclerosis, gracias a su composición rica en compuestos fenólicos. Las antocianinas reducen significativamente la oxidación de la lipoproteína LDL, inhiben la adipogénesis mediante la regulación de las vías de señalización adipogénicas y factores transcripcionales, y modulan la expresión génica de determinados microARN. No se comunicaron acontecimientos adversos ni efectos secundarios.
ConclusionesSon necesarios más estudios en humanos, estudios más homogéneos y controlados con placebo, para poder aseverar que H. sabdariffa posee eficacia terapéutica en humanos.
Infusion of Hibiscus sabdariffa (H. sabdariffa) is a very popular drink in many parts of the world. Its phytochemical composition is associated to antioxidant, hypotensive, and antiatherosclerotic effects. However, the molecular mechanisms involved in these processes are not well known. The aim of this review was to report the scientific evidence supporting that regular use of H. sabdariffa decreases oxidative stress, atherosclerosis, lipid profile, and blood pressure.
Material and methodsA search of recent publications was made in the following specialized electronic databases: Elsevier Journal, SciELO, FSTA, Science Direct, Springer Link, and NCBI. Results of research conducted in clinical trials in humans and in animal models and cell cultures were recorded. Keywords used included Hibiscus sabdariffa, oxidative stress, polyphenols, hypertension, atherosclerosis, and lipid profile.
ResultsResults of the different articles suggested a possible therapeutic effect of H. sabdariffa extracts on oxidative stress, lipid profile, hypertension, and atherosclerosis thanks to its composition rich in phenolic compounds. Anthocyanins significantly decrease LDL oxidation, inhibit adipogenesis by regulating adipogenic signaling pathways and transcription factors, and modulate gene expression of certain microRNAs. No adverse events or side effects were reported.
ConclusionsFurther more homogeneous, placebo-controlled studies in humans are needed to state that H. sabdariffa has therapeutic efficacy in humans.
Los radicales libres altamente reactivos (RLO) son átomos o grupos de átomos con un electrón desapareado o libre. Para conseguir su estabilidad electroquímica, los RLO inician una reacción en cadena que puede provocar daño a macromoléculas biológicas como lípidos, proteínas, hidratos de carbono y ácidos nucleicos, y desequilibrar la homeostasis del organismo1. La mayoría de los RLO son resultado del metabolismo normal de las células2. No obstante, la producción de RLO también puede aumentar debido al metabolismo de determinadas sustancias exógenas, por la exposición a la radiación solar o a radiaciones ionizantes, pesticidas y metales pesados3. Otros factores que afectan la producción de RLO están asociados con la exposición a la acción de ciertos xenobióticos (cloroformo, paracetamol, tetracloruro de carbono), el humo de tabaco o una dieta inadecuada, tanto por exceso de sustancias nocivas como por defecto de antioxidantes3. Todos estos factores pueden producir un exceso de RLO en las células y aumentar la susceptibilidad al desarrollo de procesos patológicos como el cáncer, el envejecimiento celular, la aterosclerosis, la hipertensión arterial (HTA) o la hiperlipidemia1,4.
La HTA es un factor de riesgo cardiovascular muy importante y frecuente en la sociedad moderna5,6. En efecto, la HTA es uno de los principales factores de riesgo para el desarrollo de la enfermedad cardiovascular, conjuntamente con el tabaquismo, las dislipidemias, y en especial, los niveles plasmáticos elevados de colesterol transportado en las lipoproteínas de baja densidad (LDL)7–11. A estos factores hay que añadir otros factores de riesgo predisponentes, como la obesidad y el sedentarismo, que ejercen su acción a través de factores de riesgo intermedios, causales o condicionales8,9. Las enfermedades cardiovasculares son la primera causa de muerte en España, originando casi el 40% de todas las defunciones12. En el 90% de los casos se desconoce el mecanismo que inicia la HTA, aunque han surgido evidencias que parecen indicar que el aumento de la producción de RLO está relacionado con su patogénesis13–15. De hecho, se ha observado que en los individuos con HTA se puede producir una elevación de la concentración sanguínea de ácido tiobarbitúrico, un indicador de peroxidación lipídica, y una reducción de las actividades antioxidantes de las enzimas superóxido dismutasa, glutatión peroxidasa y catalasa16,17. Además, Ward et al.18 encontraron una disminución de antioxidantes no enzimáticos, como la vitamina E y el glutatión reducido, en pacientes con HTA. La patogénesis de la HTA también se ha asociado con anomalías metabólicas19–21, factores hormonales22 y variaciones genéticas. Específicamente, a partir de estudios epidemiológicos y familiares se ha estimado que el componente genético sería la causa de cerca del 40% de la variabilidad interindividual de los valores de hipertensión23. El papel central que tiene el metabolismo lipídico en la homeostasis de la hipertensión justifica que las variedades genéticas de aquellos genes que codifican para las proteínas de este sistema hayan sido extensamente analizados. La atención ha sido máxima en aquellos polimorfismos relacionados con modificaciones funcionales de las proteínas que codifican, por ejemplo, los polimorfismos en el gen de la apolipoproteína B24 y A524, de la CD36 (en inglés, cluster of differentiation 36)25, de la USF1 (en inglés, upstream transcription factor 1)26,27, de la FADS3 (en inglés, fatty acid desaturase 3)27, y GCKR (en inglés, glucokinase regulatory protein)24. La enfermedad isquémica del corazón y la enfermedad cerebrovascular o ictus son la manifestación de la aterosclerosis28. Su lesión característica es la placa de ateroma compuesta por lípidos, tejido fibroso y células del sistema inmune. Uno de los episodios más tempranos de la aterosclerosis es la acumulación de LDL en la pared arterial. Una de las hipótesis más aceptadas a la hora de dar una explicación al desarrollo de la aterosclerosis es la de la oxidación lenta de las LDL atrapadas en el espacio subendotelial por la acción de los RLO generados por las células vasculares, evidenciando una estrecha relación entre RLO y LDL29. Esta acumulación de lipoproteínas en el endotelio arterial desencadena la activación de los receptores de captación de los macrófagos, dando lugar a la transformación de los macrófagos en células espumosas. La acumulación progresiva de células espumosas contribuye a la evolución de las lesiones30.
Las plantas y los animales presentan sistemas endógenos de antioxidantes para eliminar el exceso de producción de RLO, como el glutatión, la vitamina C y la vitamina E, la catalasa, la superóxido dismutasa y varias peroxidasas31. El glutatión peroxidasa, la superóxido dismutasa, o la catalasa de los peroxisomas son enzimas antioxidantes endógenas o primarias, capaces de metabolizar los RLO generados en los procesos redox celulares. En cambio, el ácido alfa lipoico, las vitaminas C, E, A y los polifenoles se consideran antioxidantes no enzimáticos o secundarios con capacidad para destruir directamente los RLO32.
Los polifenoles constituyen un grupo muy numeroso y heterogéneo de moléculas que comparten la característica de poseer en su estructura varios grupos fenólicos. Numerosos estudios epidemiológicos avalan las propiedades antioxidantes de los polifenoles33–36, aunque su capacidad antioxidante depende de su biodisponibilidad y absorción, y esta a su vez se ve afectada en gran medida por varios factores como el clima, el tipo de suelo, el tipo de cultivo y la exposición al sol, entre otros37. La mayoría de los polifenoles son metabolizados por los microorganismos del colon antes de ser absorbidos y los productos generados por esta fermentación son responsables de parte de sus efectos sistémicos38–42. La capacidad antioxidante de los polifenoles justifica sus acciones vasodilatadoras, antitrombóticas, antiinflamatorias y antiapoptóticas43, así como sus propiedades antilipidémicas44,45 y antiaterogénicas46. La actividad antioxidante de los polifenoles es 10 veces superior a la de la vitamina C, y 100 veces superior a la de la vitamina E o los carotenoides47. Más concretamente, existen estudios que sugieren que los compuestos fenólicos podrían atenuar la oxidación de las LDL y las lipoproteínas de alta densidad (HDL)48–53. En humanos sanos se ha propuesto que el resveratrol, uno de los principales compuestos fenólicos en el vino, podría prevenir la oxidación de las LDL y disminuir la concentración de hidroperóxido lipídico54. Recientemente, Castaner et al.48 han mostrado que los compuestos fenólicos del aceite de oliva podrían reducir la oxidación de las LDL y la expresión del gen CD40L (en inglés, CD40 ligand), así como aquellos genes relacionados con procesos de inflamación en humanos. Los procesos moleculares asociados con las propiedades antilipidémicas y antiaterogénicas de los polifenoles son consecuencia de su capacidad de regulación de la expresión de diferentes genes asociados con el sistema inmunológico y el metabolismo energético, y/o su capacidad de regulación epigenética55 mediante la inducción de cambios en el patrón de metilación de islas CpG del ADN56,57, la acetilación de las histonas58 y la modulación de la expresión de algunos miARN59. A este respecto, por ejemplo, se ha reportado que la quercetina, componente activo de Hibiscus sabdariffa (H. sabdariffa), inhibe la actividad de la histona acetil transferasa en la región promotora de los genes asociados con la manifestación de la inflamación58. Joven et al.60 utilizaron ratones hiperlipidémicos con deficiencia en el receptor de LDL para evaluar el papel de los polifenoles en la prevención de enfermedad hepática a través de la regulación de la expresión de los microARN hepáticos miR103/107 y miR122. En sus resultados destacaron que la administración oral de polifenoles revirtió los cambios producidos en los microARN inespecíficos miR103/107 tras la ingesta crónica de polifenoles, y una falta de respuesta del miARN específico miR122, especulando sobre una posible implicación de los polifenoles en el metabolismo celular. Estos autores señalaron que la modulación de la expresión de los microARN puede constituir un importante y adicional mecanismo de intervención de enfermedades crónicas. Crozier et al.61 han mostrado que puede existir una especificidad extracto polifenólico-miARN, dada la variedad de estructuras y composiciones diferentes que pueden presentar los extractos atendiendo a su origen botánico. Todo y lo dicho, se precisan más estudios en humanos para esclarecer los efectos epigenéticos de los polifenoles.
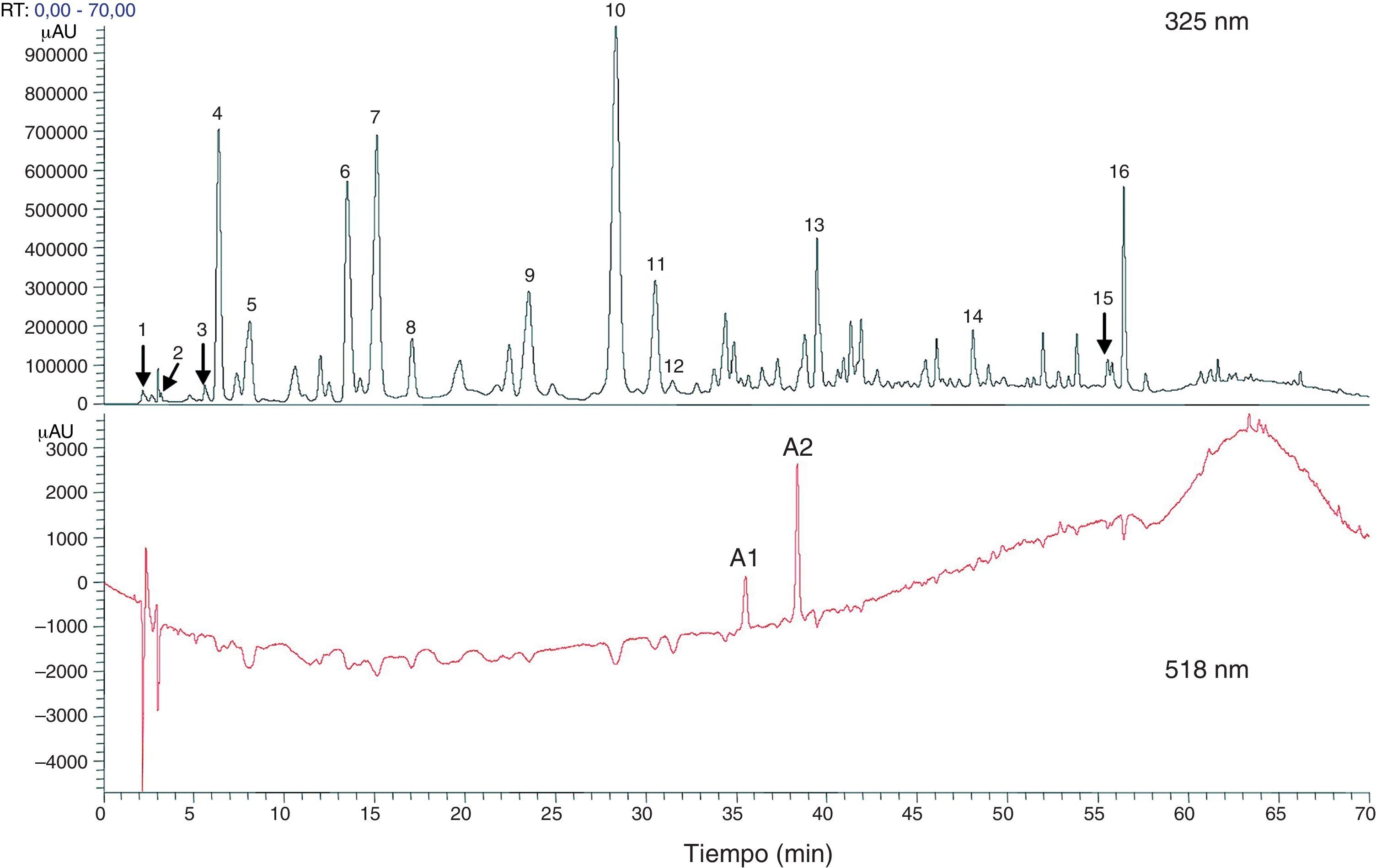
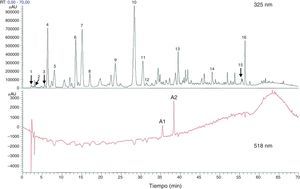
El H. sabdariffa presenta un alto contenido en polifenoles47. Se le conoce también como Rosa de Jamaica, Rosa de Abisinia o Karkade, pertenece a la familia de las Malváceas y es originaria de África tropical, aunque su cultivo se extiende por México, América Central y del Sur y sudeste asiático. Es una planta herbácea anual propia de climas secos, subtropicales, montañosos. Sus cálices, carnosos y de un color rojo intenso, presentan altas concentraciones de ácido L-ascórbico, ácido araquídico, ácido cítrico, ácido esteárico y ácido málico, aparte de pectinas, fitoesteroles (p. ej., β-sitosterol y ergosterol) y polifenoles62. Peng et al.63, en su investigación para determinar el efecto hipoglucemiante e hipolipidémico del extracto polifenólico de H. sabdariffa encontraron al menos 18 compuestos fenólicos diferentes en H. sabdariffa (fig. 1). Es muy común encontrar preparados comerciales de concentrados de cálices, y en ocasiones también de hojas de H. sabdariffa en forma líquida o polvos, para la preparación de bebidas instantáneas o infusiones62. Además, su uso generalizado como tratamiento herbal por parte de la medicina popular ha condicionado su alta aceptación entre el público en general64, sobre todo en países como EE. UU.65, México62,66,67, en algunos países del este de África68–70, Irán71,72, India73, Taiwan63, Brasil74 y Grecia75, entre otros. Los estudios etnobotánicos que se pueden encontrar describen generalmente su origen y las partes de la planta utilizadas, las propiedades que se le atribuyen y su forma de preparación, sin especificar dosificación. No se han encontrado estudios demográficos que avalen su papel en la prevención de enfermedades74,76. Por otro lado, estudios científicos han evidenciado que los efectos antioxidantes de los polifenoles de H. sabdariffa tienen acción antiaterogénica y de reducción de la hipertensión y la hiperlipidemia sin haberse reportado acontecimientos adversos ni efectos secundarios en animales y humanos65–67,72,77–79.
Componentes totales fenólicos y flavonoides estimados con cromatografía líquida de alta eficacia o high performance liquid chromatography (HPLC) a partir de extracto de flores secas de Hibiscus sabdariffa. Los componentes totales fenólicos y flavonoides se estimaron como 58,8±1,34mg y 13,57±0,65mg por gramo de flores secas, respectivamente63.
1 ácido hibiscus, 2 ácido hibiscus éster 6-metilo, 3 ácido gálico, 4 no identificado, 5 5hidroximetilfurfural, 6 ácido protocatéquico, 7 5-ácido caffeoylquinic, 8 feruloil derivatived, 9 ácido clorogénico, 10 4-ácido caffeoylquinic, 11 ácido cafeico, 12 ester galoil, 13 feruloil quinico derivatived, 14 kaempferol-3-glucósido, 15 quercetina derivatived, 16 tilirosida, Al delfinidina-3-sambubiosido, A2 cianidina-3-sambubiosido.
Así, el objetivo de este trabajo es recopilar y unificar las evidencias que demuestran que un consumo regular de H. sabdariffa podría tener un efecto beneficioso sobre la salud humana gracias a la capacidad antioxidante, antihipertensiva e hipolipidemiante que le confieren sus componentes fenólicos.
Material y métodosEn la presente revisión se ha realizado una búsqueda de publicaciones recientes en las siguientes bases de datos electrónicas especializadas: NCBI, Elsevier Journal, SciELO, Science Direct y Springer Link. Se han reunido resultados de trabajos llevados a cabo en ensayos in vitro, modelos animales y estudios en humanos. Adicionalmente se han incluido revisiones que recopilan y analizan la efectividad de H. sabdariffa en determinados tratamientos, como puede ser el hipotensor y el hipolipidemiante, entre otros, y artículos que hacen referencia a los aspectos fitoquímicos, farmacológicos y toxicológicos de H. sabdariffa. También se han analizado los conceptos de estrés oxidativo, capacidad antioxidante, hiperlipidemia, hipertensión y aterosclerosis para describir con más detalle los mecanismos moleculares de H. sabdariffa. Las palabras clave utilizados han sido: Hibiscus sabdariffa, estrés oxidativo, polifenoles, hipertensión, aterosclerosis y perfil lipídico.
Se revisaron en total 104 artículos para el desarrollo del presente trabajo. Los artículos seleccionados se dividieron en las siguientes categorías: (1) artículos genéricos sobre propiedades farmacológicas, químicas y etnobotánicas de H. sabdariffa; (2) artículos sobre la relación del consumo de H. sabdariffa y el estrés oxidativo, su potencial antioxidante, hipotensor, hipolipidémico y antiaterosclerótico.
Resultados y discusiónLos estudios que analizan los efectos terapéuticos de H. sabdariffa y que se han utilizado en la presente revisión se han agrupado en 3 tablas. En cada una de ellas se especifica la parte de H. sabdariffa utilizada y la metodología de extracción del extracto de H. sabdariffa, así como un resumen de los resultados y conclusiones más relevantes. Las tablas 1 y 2 presentan los resultados de los estudios realizados en diferentes líneas celulares y modelos animales, respectivamente. En la tabla 3 se exponen los resultados de los estudios realizados en humanos.
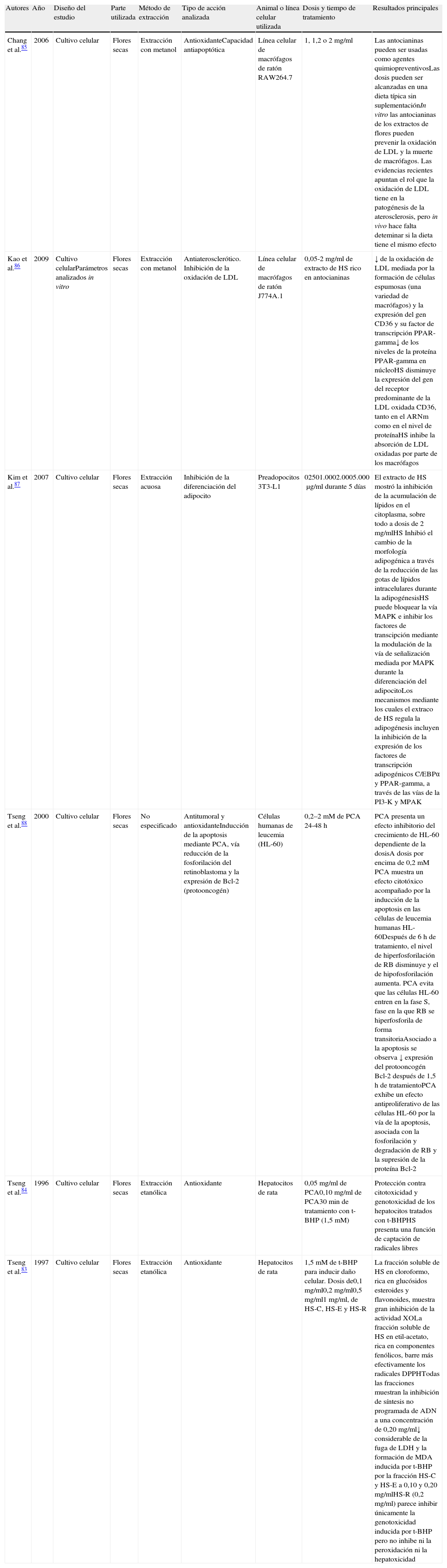
Estudios en cultivos celulares que demuestran los diferentes efectos de Hibiscus sabdariffa
| Autores | Año | Diseño del estudio | Parte utilizada | Método de extracción | Tipo de acción analizada | Animal o línea celular utilizada | Dosis y tiempo de tratamiento | Resultados principales |
| Chang et al.85 | 2006 | Cultivo celular | Flores secas | Extracción con metanol | AntioxidanteCapacidad antiapoptótica | Línea celular de macrófagos de ratón RAW264.7 | 1, 1,2 o 2mg/ml | Las antocianinas pueden ser usadas como agentes quimiopreventivosLas dosis pueden ser alcanzadas en una dieta típica sin suplementaciónIn vitro las antocianinas de los extractos de flores pueden prevenir la oxidación de LDL y la muerte de macrófagos. Las evidencias recientes apuntan el rol que la oxidación de LDL tiene en la patogénesis de la aterosclerosis, pero in vivo hace falta deteminar si la dieta tiene el mismo efecto |
| Kao et al.86 | 2009 | Cultivo celularParámetros analizados in vitro | Flores secas | Extracción con metanol | Antiaterosclerótico. Inhibición de la oxidación de LDL | Línea celular de macrófagos de ratón J774A.1 | 0,05-2mg/ml de extracto de HS rico en antocianinas | ↓ de la oxidación de LDL mediada por la formación de células espumosas (una variedad de macrófagos) y la expresión del gen CD36 y su factor de transcripción PPAR-gamma↓ de los niveles de la proteína PPAR-gamma en núcleoHS disminuye la expresión del gen del receptor predominante de la LDL oxidada CD36, tanto en el ARNm como en el nivel de proteínaHS inhibe la absorción de LDL oxidadas por parte de los macrófagos |
| Kim et al.87 | 2007 | Cultivo celular | Flores secas | Extracción acuosa | Inhibición de la diferenciación del adipocito | Preadopocitos 3T3-L1 | 02501.0002.0005.000μg/ml durante 5 días | El extracto de HS mostró la inhibición de la acumulación de lípidos en el citoplasma, sobre todo a dosis de 2mg/mlHS Inhibió el cambio de la morfología adipogénica a través de la reducción de las gotas de lípidos intracelulares durante la adipogénesisHS puede bloquear la vía MAPK e inhibir los factores de transcipción mediante la modulación de la vía de señalización mediada por MAPK durante la diferenciación del adipocitoLos mecanismos mediante los cuales el extraco de HS regula la adipogénesis incluyen la inhibición de la expresión de los factores de transcripción adipogénicos C/EBPα y PPAR-gamma, a través de las vías de la PI3-K y MPAK |
| Tseng et al.88 | 2000 | Cultivo celular | Flores secas | No especificado | Antitumoral y antioxidanteInducción de la apoptosis mediante PCA, vía reducción de la fosforilación del retinoblastoma y la expresión de Bcl-2 (protooncogén) | Células humanas de leucemia (HL-60) | 0,2–2mM de PCA 24-48h | PCA presenta un efecto inhibitorio del crecimiento de HL-60 dependiente de la dosisA dosis por encima de 0,2mM PCA muestra un efecto citotóxico acompañado por la inducción de la apoptosis en las células de leucemia humanas HL-60Después de 6h de tratamiento, el nivel de hiperfosforilación de RB disminuye y el de hipofosforilación aumenta. PCA evita que las células HL-60 entren en la fase S, fase en la que RB se hiperfosforila de forma transitoriaAsociado a la apoptosis se observa ↓ expresión del protooncogén Bcl-2 después de 1,5h de tratamientoPCA exhibe un efecto antiproliferativo de las células HL-60 por la vía de la apoptosis, asociada con la fosforilación y degradación de RB y la supresión de la proteína Bcl-2 |
| Tseng et al.84 | 1996 | Cultivo celular | Flores secas | Extracción etanólica | Antioxidante | Hepatocitos de rata | 0,05mg/ml de PCA0,10mg/ml de PCA30min de tratamiento con t-BHP (1,5mM) | Protección contra citotoxicidad y genotoxicidad de los hepatocitos tratados con t-BHPHS presenta una función de captación de radicales libres |
| Tseng et al.83 | 1997 | Cultivo celular | Flores secas | Extracción etanólica | Antioxidante | Hepatocitos de rata | 1,5mM de t-BHP para inducir daño celular. Dosis de0,1mg/ml0,2mg/ml0,5mg/ml1mg/ml, de HS-C, HS-E y HS-R | La fracción soluble de HS en cloroformo, rica en glucósidos esteroides y flavonoides, muestra gran inhibición de la actividad XOLa fracción soluble de HS en etil-acetato, rica en componentes fenólicos, barre más efectivamente los radicales DPPHTodas las fracciones muestran la inhibición de síntesis no programada de ADN a una concentración de 0,20mg/ml↓ considerable de la fuga de LDH y la formación de MDA inducida por t-BHP por la fracción HS-C y HS-E a 0,10 y 0,20mg/mlHS-R (0,2mg/ml) parece inhibir únicamente la genotoxicidad inducida por t-BHP pero no inhibe ni la peroxidación ni la hepatoxicidad |
CD36: proteína codante del gen CD36; DPPH: radical 1,1-difenil-2-picrilhidrazilo; HS: Hibiscus sabdariffa; HS-C: fracción soluble de HS en cloroformo; HS-E: fracción soluble de HS etil-acetato; HS-R: fracción residual de HS; LDH: lactato deshidrogenasa; LDL: lipoproteína de baja densidad; MAPK: proteincinasa activada por mitógenos; MDA: malondialdehído; PCA: ácido protocatéquico; RB: retinoblastoma; t-BHP: tert-butil hidroperóxido; XO: actividad xantino oxidasa.
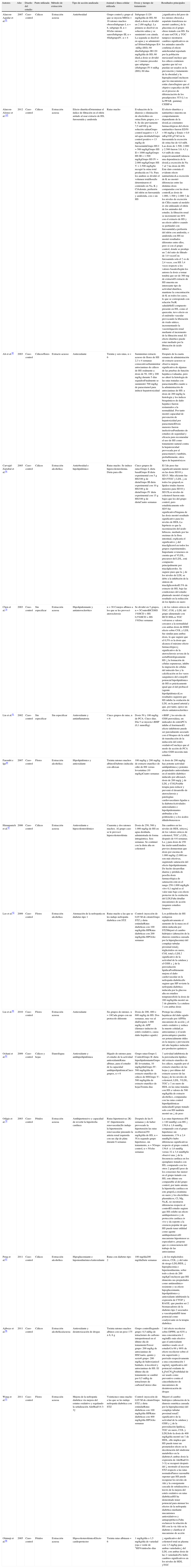
Estudios en modelos animales que demuestran los diferentes efectos de la administración de Hibiscus sabdariffa
| Autores | Año | Diseño del estudio | Parte utilizada | Método de extracción | Tipo de acción analizada | Animal o línea celular utilizada | Dosis y tiempo de tratamiento | Resultados principales |
| Alarcon-Aguilar et al.95 | 2007 | Caso-control | Cálices | Extracción acuosa | Antiobesidad | Grupo control y grupo al que se inyecta MSGn=16 ratones machos obesosSubgrupo I, n=8, subgrupo II, n=8Ocho ratones sanosSubgrupo III, n=4SubgrupoIV, n=4 | Subgrupo I:120mg/kg/día de HS; 60 díasLa dosis se dividió en 2 (60mg/kg). La primera se disolvió en solución salina y se suministró con cánula. La segunda se disolvió en agua y se administró ad libitumSubgrupo II:4ml/kg (ISS); 60 díasSubgrupo III:120mg/kg/día de HS; 60 díasLa dosis se dividió en 2 (mismo proceder que subgrupo i)Subgrupo IV:4ml/kg (ISS); 60 días | ↓significativa del peso de los ratones obesosLa aspartato transferasa no mostró cambios↓ de la glucemia en el grupo obeso tratado con HS. En el sano noCOL y TGC tampoco mostraron cambios significativos en los animales sanosSe confirma el efecto antiobesidad reportado por la población mexicanaConcluye que los cálices contienen agentes que tal vez puedan ser usados en la prevención y tratamiento de la obesidad y la hiperglucemiaConcluyen que los mecanismos no están clarosSugiere que el objetivo específico de HS en el proceso de diferenciación de los preadipocitos 3T3-L1 es la PPAR- gammay C/EBP-α |
| Alarcon-Alonso et al.105 | 2012 | Caso-control | Cálices | Extracción acuosa | Efecto diuréticoDeterminar el índice de filtración en el riñón aislado al usar extracto de HS, furosemida y amilorida | Ratas macho | Evaluación de la diuresis y eliminación de electrolitos en orina:Siete grupos, n=6. Se dio previamente 7,5ml/100g de solución salinaGrupo control negativo=1,5ml agua destiladaGrupo control positivo=13mg/kg de furosemidaGrupo HS I=500mg/kgGrupo HS II=1000mg/kgGrupo HS III=1.500mg/kgGrupo HS IV=2.000mg/kgGrupo HS V=2.500mg/kgSe recogió la orina total producida en 5h. Para los análisis se dividió el volumen total/horaSe determinaron el contenido en Na, K y ClAdemás, perfusión del riñón en furosamida y amilorida, con o sin HS | El efecto diurético y natriurético muestra un comportamiento dependiente de la dosisLas constantes farmacológicas del efecto natriurético fueron ED50=86mg/kg y Emáx=0,9 mEq/100g/5hCon la furosemida la excreción de orina fue de 4,8ml/h. Las dosis de 1.500, 2.000 y 2.500 fueron 3,0; 4,3 y 4,4ml/h de orina respectivamenteEvidencia una dependencia de la dosisLa excreción de Na ↑ al ↑ las dosis de HS. Este dato constata el evidente efecto natriuréuticoLa excreción de K no mostró diferencias entre las distintas dosis comparadas con las dosis controlLas dosis de 1.000, 1.500 y 2.000 ↑ de los niveles de excreción de ClEn cuanto al modelo in situ utilizando el riñón de los animales del estudio, la filtración renal se incrementó un 48% con el extracto de HS y un efecto aditivo cuando se perfundió con furosamidaLa perfusión del riñón con amilorida, o amilorida con HS no mostró resultados diferentes entre ellos, pero sí con el grupo control, donde se produjo un ↑ del ratio de filtrado de 3,9 vecesCon furosamida sola el ↑ es de 2,4 veces, con HS 3,4 veces respecto a los valores basalesSegún los autores la dosis a tomar tendría que ser de 300mg de extractoEl extracto de HS muestra un interesante tipo de actividad diurética, mantiene la concentración de K en todos los casos, lo que se corresponde con relación Na/K saludableEl compuesto presente en HS, como el quercetin, tuvo efecto en el endotelio vascular provocando la liberación de óxido nítrico, incrementando la vasorrelajación renal mediante el incremento de la filtración renal. El efecto diurético puede estar mediado por la liberación de ácido nítrico |
| Ali et al.89 | 2003 | Caso-control | Cálices/flores | Extracto acuoso | Antioxidante | Treinta y seis ratas, n=6 | Suministrar extracto acuoso de flores de HS 2,3 o 4 semanas consecutivasSuministrar antocianinas de cálices de HS oralmente a dosis de 50, 100 y 200mg/kg durante 5 días seguidosFinalmente se suministró 700mg/kg de paracetamol para inducir hepatotoxicidad | Después de la cuarta semana de administración de extracto acuosos se observa mejora significativa de algunas de las pruebas de función hepática evaluadas, pero no alteró la histología de las ratas tratadas con paracetamolEn cuanto a la administración de antocianinas de HS: a dosis de 200mg/kg la histología y los índices bioquímicos de daño hepático fueron restaurados a la normalidad. Por tanto mostró capacidad de prevención de hepatoxicidad por paracetamolDosis menores fueron inefectivasPendientes de estudios de seguridad y eficacia para recomendar el uso de HS como tratamiento natural contra la hepatoxicidad provocada por el paracetamol y también, probablemente, otros tipos de hepatotóxicos |
| Carvajal-Zarrabal et al.94 | 2005 | Caso-control | Cálices | Extracción alcohólica | Antiobesidad e hipolipidémico | Ratas macho. Se induce hipercolesterolemia. Dieta para ello | Cinco grupos de ratas:Grupo I, dieta basalGrupo II dieta experimental con 5g HS/100 g de dietaGrupo III dieta experimental con 10g HS/100 g de dietaGrupo IV dieta experimental con 15g HS/100 g de dietaCuatro semanas | El ↑de peso fue significativamente menor en las dosis SD10 y SD15. Más eficiente fue SD15TGC y LDL ↓ en todos los gruposLos lípidos totales fueron menores para SD10 y SD15Los niveles de colesterol fueron más bajos que los del grupo control, pero estadísticamente solo SD5 fue significativoNinguna de las dosis mostró resultado significativo para los niveles de HDL.La hipótesis es que la racemización del ácido hibiscus, mediado por las enzimas de la flora intestinal, explicaría el significativo ↓ del triacilglicerol en todos los grupos experimentales. Importante si tenemos en cuenta que el VLDL, precursor del LDL, está compuesto principalmente por triacilgliceroles. Se sugiere pues que la ↓ de los niveles de LDL se debe a la inhibición de la síntesis de triacilglicerolesEl 5% de extracto de HS, bajo las condiciones del estudio planteado mostró el mejor resultado en la reducción de los lípidos en suero |
| Chen et al.79 | 2003 | Caso-control | Sin especificar | Extracción acuosa | Hipolipidemiante y antiaterosclerótico | n=30 Conejos albinos a los que se les provocó aterosclerosis | Se dividió en 5 grupos, n=5ControlHCDHS 1%HCD+HS 0,5%HCD+HS 1%Diez semanas | ↓ de los valores séricos de TGC, COL y LDL del grupo alimentado con HCD HSLos TGC volvieron a valores cercanos a la normalidad con ambas dosis de HSEl efecto sobre COL y LDL fue similar para ambas dosis, lo que sugiere que el 0,5% es la dosis que alcanza el máximo efecto farmacológico↓ significativo de la aterosclerosis severa de la aortaHistológicamente HS ↓ la formación de células espumosas, inhibe la migración de células del músculo liso y la calcificación en los vasos sanguíneos del conejoEl potencial hipolipidémico de HS es prácticamente igual que el del probucol (agente hipolipidémico)Los resultados sugieren que HS inhibe la oxidación de LDL en la pared arterial y que, por tanto, ejerce un efecto antiaterosclerótico |
| Liu et al.91 | 2002 | Caso-control | Sin especificar | Sin especificar | Antioxidante y antiinflamatoria | Cinco grupos de ratas, n=6 | Dosis 50 y 100mg/kg de PCA. Cinco días. Día 5 se inyecta t-BHP (0,1mmol/kg) | t-BHP ↓ los niveles de GSH peroxidasa, un indicador de estrésPCA inhibe el fenómenoEl efecto inhibitorio puede ser parcialmente asociado con el bloqueo de la señal de transducción de la inducción del estrés oxidativoConcluye que el modo de acción de PCA sobre GSH necesita más estudios |
| Farombi e Ige69 | 2007 | Caso-control | Flores | Extracción alcohólica | Hipolipidémico y antioxidante | Treinta ratones machos albinosDiabetes inducida con alloxan | 100mg/kg y 200mg/kg de extracto etanólico de cáliz de HS versus lovastatina (10mg/kg)Cuatro semanas | A dosis de 200mg/kg hay potente actividad antilipidémica y potentes propiedades antioxidantes en el modelo diabético inducido por alloxanA dosis de 200mg/g ↓ de LDL y COLPosible terapia para reducir y prevenir el desarrollo de aterosclerosis y patologíias cardiovasculares ligadas a la diabetesActividades antioxidantes e hipolipidemiantes atribuidas a los polifenoles y a los ácidos dihidrobenzoicos |
| Hirunpanich et al.97 | 2006 | Caso-control | Cálices | Extracción acuosa | Antioxidante e hipocolesterolémico | Cuarenta y dos ratones machos. Al grupo caso se le provocó hipercolesterolémia | Dosis de 250, 500 y 1.000mg/kg de HS en agua destilada, administrada de forma intragástrica. Seis semanas. Se continuó con la dieta alta en colesterol | Sin cambios en los niveles de HDL séricos↓ de los valores séricos de colesterol, TGC y LDL, después de 4-6 semanas. La ↓ para dosis de 250 fue irrelevanteEstudios previos demuestran que dosis por encima de 1.000mg/kg (2.000) no son más efectivas, sugiriendo saturación del efecto hipolipidemiante. De hecho desarrollan diarrea y pérdida de pesoSu dosis farmacológica de saturación está en el rango 250-1.000mg/kgIn vitro 0,1mg/ml es el valor más bajo con efecto protector de la oxidación del LDLFalta detallar mecanismos de acción (requiere estudios futuros) |
| Lee et al.92 | 2009 | Caso-control | Flores | Extracción alcohólica | Atenuación de la nefropatía en diabetes tipo 1 | Ratas macho a las que se les indujo nefropatía diabética con STZ | Control: inyección de 0,05M de citratoGrupo STZ y dieta estándarRatas diabéticas con 100mg/kg/día HPRatas diabéticas con 200mg/kg/día HPOcho semanas | Los polifenoles de HS redujeron significativamente el aumento de la masa en el riñón inducida por STZMejoró el cambio hidrópico (alteración de la diuresis osmótica causada por la hiperglucemia) del complejo tubular proximal renal↓ triglicéridos en suero, COL total y LDL↑ significativo de la actividad de la catalasa y el GSH y ↓ de la peroxidación lipídicaPosiblemente mejora el daño cardiovascular en la nefropatía diabéticaSe sugiere que HP revierte la nefropatía diabética inducida por la glucosa alta en estadios tempranosSolo la dosis de 200mg/kg/día mostró un ↑ de glutatión. La catalasa ↑ con ambas dosis |
| Liu et al.90 | 2010 | Caso-control | Flores | Extracción acuosa | Antioxidante | Sis grupos de ratones. n=10Cada grupo con un protocolo diferente | Dosis de 200, 400 o 600mg/kg de HS. Dos semanas, una vez al díaDespués 1.000mg/kg de APP (fármaco inductor de estrés oxidativo, causa daño hepático agudo) | Protege las células hepáticas del daño agudo provocado por APPSu mecanismo de acción ↓ el estrés oxidativo y reduce la muerte celularLas antocianinas y el ácido protocatéquico pueden ser potencialmente útiles en la mejora y prevención del año hepático inducido por productos químicos |
| Ochani et al.82 | 2009 | Caso-control | Cálices y hojas | Etanol/agua | Antioxidante y antihiperlipidémica | Hígado de ratones para el estudio de la actividad antioxidanteRatas albinas, para el estudio de la capacidad antihiperlipidémicaCinco grupos, n=6 | Grupo ratas:Grupo I. ControlGrupo II: dieta hiperlipidemianteGrupo III: lovastatina, 10mg/kg/díaGrupo IV: 500mg/kg/día de extracto etanólico de cálices de HSGrupo V: 500mg/kg/día de extracto etanólico de hojasTreinta días | ↑ actividad inhibitoria de la peroxidación lipídica del extracto etanólico de los cálices, seguido por el extracto etanólico de las hojas y por último del extracto acuoso de las hojas↓ de los niveles de colesterol, LDL, VLDL, TGC y ↑ en suero de HDL en las ratas tratadas con HS a valores de 500mg/kg/día de extracto alcohólico, comparadas con las ratas control hiperlipidémicas inducidasEl grupo tratado solo con HS también mostró un ↓ de peso |
| Odigie et al.70 | 2003 | Caso-control | Pétalos | Extracción acuosa | Antihipertensivo y capacidad de revertir la hipertrofia cardíaca | Ratas hipertensivas 2K-1C (hipertensión renovascular)Se indujo la hipertensión renovascular pinzando la arteria renal izquierda con un clip de plata durante 6 semanas | Después de las 6 semanas y de haber provocado la hipertensión las ratas recibieron250mg/kg/día de HS, n=5Un segundo grupo hipertenso, sin tratamiento, n=5Grupo control, n=5Ocho semanas | Las ratas hipertensas (PS>140mmHg) con HS ↓ 139,6±1,6mmHg, comparado con el grupo hipertenso sin tratamiento, 174±2,4mmHgNo hubo diferencias significativas respecto al grupo control, 139,6 ±1,6mmHg versus 32±3,4mmHgSe observó una ↓ de la frecuencia cardíaca en los ejemplares tratados con HS, comparado con los otros 2 gruposEl peso de los corazones fue menor en el grupo tratado con HS, este último era comparable al del grupo control, por tanto atenúa la hipertrofia cardíaca en este grupoLa creatinina en suero y los electrólitos plasmáticos, Cl, Mg, Na,K, no mostraron diferencias respecto al controlEl estudio sugiere que HS exhibe un efecto antihipertensivo y de protección cardíaca in vivo y da soporte a la creencia popular de que HS puede tener utilidad como agente antihipertensivoEl mecanismo hiportensor es especulativo, propone que es consecuencia del trabajo de las antocianinas |
| Peng et al.63 | 2011 | Caso-control | Cálices | Extracción alcohólica | Hipoglucemiante e hipoinsulinémicoAntioxidante | Ratas con diabetes tipo 2 | 100mg/día200mg/díaSiete semanas | ↓ de los triglicéridos séricos, COL, y del ratio de riesgo LDL/HDL.↓ hiperglucemia e hiperinsulinemia, sobre todo a dosis de 200mg/kgConcluyen que HS dmuestra sus propiedades como antiinsulínico-resistente y su efecto hipoglucemiante, hipolipidémico y antioxidante inhibiendo la expresión de CTGF y RAGE, que pueden ser 2 biomarcadores de la diabetes tipo 2 asociados a vasculopatíaHS tiene potencial como coadyuvante en la terapia diabética |
| Ajiboye et al.96 | 2011 | Caso-control | Cálices | Extracción alcohólica/acuosa | Antioxidante y desintoxicación de drogas | Treinta ratones machos albinos con un peso 175±6, 6g | Grupo controlSegundo grupo: 0,5ml/kg de tetracloruro de carbono interperitoneal en el último día de tratamientoTercer grupo: 200mg/kg de antocianinas de HSCuarto, quinto y sexto6 grupo: 200mg/kg de hidroxianisol butilado, α-tocoferol y antocianinas de HS. El último día de tratamiento se cambió por 0,5ml/kg de tetracloruro de carbonoCatorce días | ↑ del efecto recolector sobre DPPH, un 92% a una concentración 2mg/mlEs más efectivo que el antioxidante sintético usado en el estudioUn 69 y 90% de efecto recolector sobre el ión superóxido y peróxido respectivamente a una concentración 1mg/ml↓ significativa del potencial oxidante de k3Fe(CN)6Posibilidad de ser usado como preventivo contra el cáncerInductor de mecanismos de desintoxicación de drogas |
| Wang et al.93 | 2011 | Caso-control | Flores | Extracción acuosa | Mejora de la nefropatía diabética vía mejora del estatus oxidativo y regulando la señalización Akt/Bad/14-3-3γ | Veinticinco ratas macho a las que se les indujo nefropatía diabética con STZ | Control: inyección de 0,05M de citratoGrupo STZ y dieta estándarRatas diabéticas con 100mg/kg/día HPRatas diabéticas con 400mg/kg/día HPOcho semanas | Mejoró el cambio hidrópico (alteración de la diuresis osmótica causada por la hiperglucemia) del complejo tubular proximal renal↑ significativo de la actividad de la catalasa y GSH y ↓ de la peroxidación lipídica↓ TGC en suero, COL y LDLSolo la dosis de 400mg/kg/día mostró un ↑ de HDL, ello implica que HS puede tener un prometedor efecto en la deceleración del síndrome metabólico en la diabetesA ambas dosis la expresión de Akt/Bad/14-3-3γ se recuperó después del ↓ mostrado al inyectar STZ respecto a las ratas normalesParece razonable suponer que HS puede recuperar los niveles de Akt y la consiguiente cascada de señalización a través de la mejora del estrés oxidativo en ratas diabéticasHS ha demostrado tener potencial para atenuar los efectos de la nefropatía diabética mediante mecanismos antioxidativos y antiapoptóticos.Falta esclarecer la relación de HS con la vía Akt en la diabetes y clarificar el mecanismo de acción |
| Olatunji et al.68 | 2005 | Caso-control | Pétalos | Extracción acuosa | HipocolesterolémicoEfecto cardioprotector | Treinta ratas albinasn=6 | 1mg/kg/día o 1,5mg/kg/día de variedad roja o verde de 1HSVeintiocho días | ↓ significativo del colesterol total en plasma con 1,5mg/kg para ambas variedades↓ del LDL con ambas dosis de las 2 variedadesNo hubo cambios significativos en los niveles de HDL yTGC |
APP: acetaminofeno; COL: dieta alta en grasas; CTGF: factor de crecimiento de tejido conectivo; DPPH: α-difenil-β-picrilhidrazilo; GSH: glutatión; HCD: dieta alta en colesterol; HDL: lipoproteína de alta densidad; HS: Hibiscus sabdariffa; ISS: solución salina; LDL: lipoproteína de baja densidad; MSG: glutamato monosódico; PCA: ácido protocatéquico; PS: presión sanguínea; RAGE: receptor de productos finales de la glucación avanzada; SD: dieta suplementaria (suplementary diet); STZ: injección de estreptozocina; t-BHP: tert-butil hidroperóxido; TGC: triglicéridos; VLDL: lipoproteína de muy baja densidad.
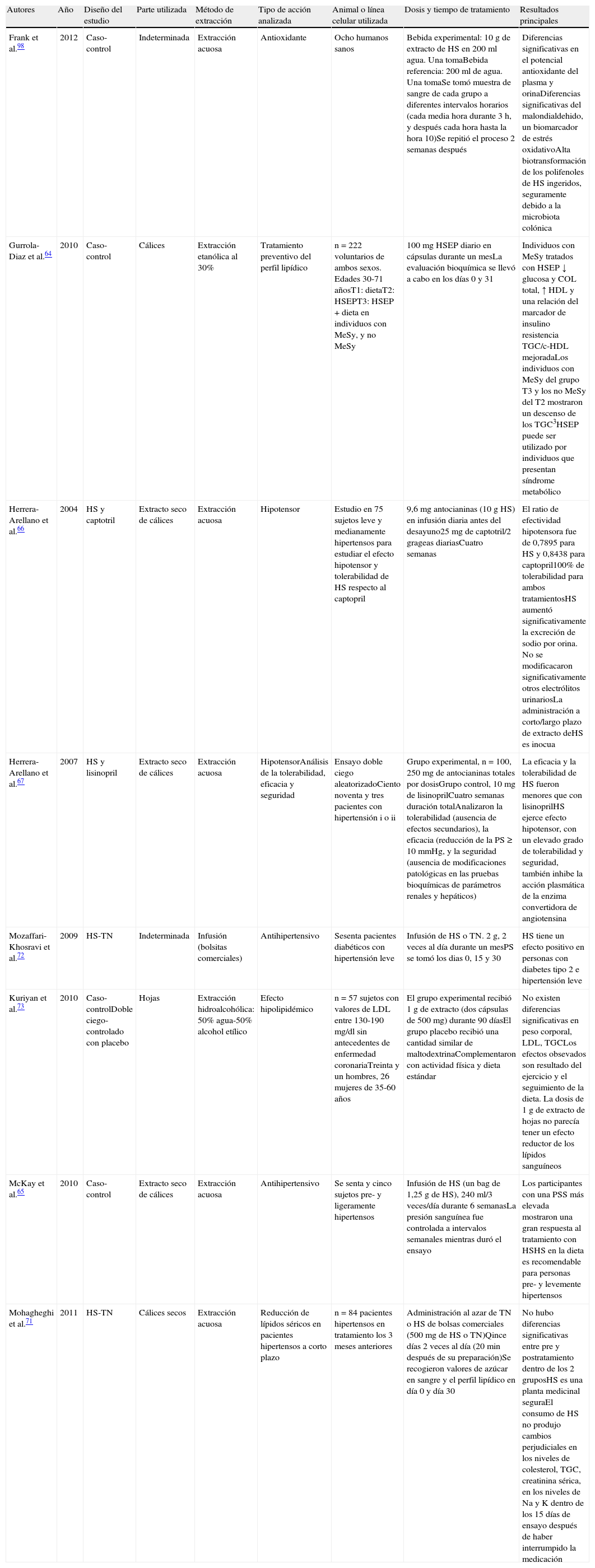
Estudios en humanos que demuestran los diferentes efectos del consumo de Hibiscus sabdariffa
| Autores | Año | Diseño del estudio | Parte utilizada | Método de extracción | Tipo de acción analizada | Animal o línea celular utilizada | Dosis y tiempo de tratamiento | Resultados principales |
| Frank et al.98 | 2012 | Caso-control | Indeterminada | Extracción acuosa | Antioxidante | Ocho humanos sanos | Bebida experimental: 10 g de extracto de HS en 200ml agua. Una tomaBebida referencia: 200ml de agua. Una tomaSe tomó muestra de sangre de cada grupo a diferentes intervalos horarios (cada media hora durante 3h, y después cada hora hasta la hora 10)Se repitió el proceso 2 semanas después | Diferencias significativas en el potencial antioxidante del plasma y orinaDiferencias significativas del malondialdehido, un biomarcador de estrés oxidativoAlta biotransformación de los polifenoles de HS ingeridos, seguramente debido a la microbiota colónica |
| Gurrola-Diaz et al.64 | 2010 | Caso-control | Cálices | Extracción etanólica al 30% | Tratamiento preventivo del perfil lipídico | n=222 voluntarios de ambos sexos. Edades 30-71 añosT1: dietaT2: HSEPT3: HSEP+dieta en individuos con MeSy, y no MeSy | 100mg HSEP diario en cápsulas durante un mesLa evaluación bioquímica se llevó a cabo en los días 0 y 31 | Individuos con MeSy tratados con HSEP ↓ glucosa y COL total, ↑ HDL y una relación del marcador de insulino resistencia TGC/c-HDL mejoradaLos individuos con MeSy del grupo T3 y los no MeSy del T2 mostraron un descenso de los TGC3HSEP puede ser utilizado por individuos que presentan síndrome metabólico |
| Herrera-Arellano et al.66 | 2004 | HS y captotril | Extracto seco de cálices | Extracción acuosa | Hipotensor | Estudio en 75 sujetos leve y medianamente hipertensos para estudiar el efecto hipotensor y tolerabilidad de HS respecto al captopril | 9,6mg antocianinas (10g HS) en infusión diaria antes del desayuno25mg de captotril/2 grageas diariasCuatro semanas | El ratio de efectividad hipotensora fue de 0,7895 para HS y 0,8438 para captopril100% de tolerabilidad para ambos tratamientosHS aumentó significativamente la excreción de sodio por orina. No se modificacaron significativamente otros electrólitos urinariosLa administración a corto/largo plazo de extracto deHS es inocua |
| Herrera-Arellano et al.67 | 2007 | HS y lisinopril | Extracto seco de cálices | Extracción acuosa | HipotensorAnálisis de la tolerabilidad, eficacia y seguridad | Ensayo doble ciego aleatorizadoCiento noventa y tres pacientes con hipertensión i o ii | Grupo experimental, n=100, 250mg de antocianinas totales por dosisGrupo control, 10mg de lisinoprilCuatro semanas duración totalAnalizaron la tolerabilidad (ausencia de efectos secundarios), la eficacia (reducción de la PS≥ 10mmHg, y la seguridad (ausencia de modificaciones patológicas en las pruebas bioquímicas de parámetros renales y hepáticos) | La eficacia y la tolerabilidad de HS fueron menores que con lisinoprilHS ejerce efecto hipotensor, con un elevado grado de tolerabilidad y seguridad, también inhibe la acción plasmática de la enzima convertidora de angiotensina |
| Mozaffari-Khosravi et al.72 | 2009 | HS-TN | Indeterminada | Infusión (bolsitas comerciales) | Antihipertensivo | Sesenta pacientes diabéticos con hipertensión leve | Infusión de HS o TN. 2g, 2 veces al día durante un mesPS se tomó los dias 0, 15 y 30 | HS tiene un efecto positivo en personas con diabetes tipo 2 e hipertensión leve |
| Kuriyan et al.73 | 2010 | Caso-controlDoble ciego-controlado con placebo | Hojas | Extracción hidroalcohólica: 50% agua-50% alcohol etílico | Efecto hipolipidémico | n=57 sujetos con valores de LDL entre 130-190mg/dl sin antecedentes de enfermedad coronariaTreinta y un hombres, 26 mujeres de 35-60 años | El grupo experimental recibió 1g de extracto (dos cápsulas de 500mg) durante 90 díasEl grupo placebo recibió una cantidad similar de maltodextrinaComplementaron con actividad física y dieta estándar | No existen diferencias significativas en peso corporal, LDL, TGCLos efectos obsevados son resultado del ejercicio y el seguimiento de la dieta. La dosis de 1g de extracto de hojas no parecía tener un efecto reductor de los lípidos sanguíneos |
| McKay et al.65 | 2010 | Caso-control | Extracto seco de cálices | Extracción acuosa | Antihipertensivo | Se senta y cinco sujetos pre- y ligeramente hipertensos | Infusión de HS (un bag de 1,25g de HS), 240ml/3 veces/día durante 6 semanasLa presión sanguínea fue controlada a intervalos semanales mientras duró el ensayo | Los participantes con una PSS más elevada mostraron una gran respuesta al tratamiento con HSHS en la dieta es recomendable para personas pre- y levemente hipertensos |
| Mohagheghi et al.71 | 2011 | HS-TN | Cálices secos | Extracción acuosa | Reducción de lípidos séricos en pacientes hipertensos a corto plazo | n=84 pacientes hipertensos en tratamiento los 3 meses anteriores | Administración al azar de TN o HS de bolsas comerciales (500mg de HS o TN)Qince días 2 veces al día (20min después de su preparación)Se recogieron valores de azúcar en sangre y el perfil lipídico en día 0 y día 30 | No hubo diferencias significativas entre pre y postratamiento dentro de los 2 gruposHS es una planta medicinal seguraEl consumo de HS no produjo cambios perjudiciales en los niveles de colesterol, TGC, creatinina sérica, en los niveles de Na y K dentro de los 15 días de ensayo después de haber interrumpido la medicación |
COL: colesterol; HDL: lipoproteína de alta densidad; HS: Hibiscus sabdariffa; HSEP: extracto en polvo; LDL: lipoproteína de baja densidad; MeSy: síndrome metabólico; PS: presión sanguínea; PSD: presión sanguínea diastólica; PSS: presión sanguínea sistólica; TGC: triglicéridos; TN: té negro; T1, T2, T3: tratamiento.
Es importante resaltar la parte de la planta utilizada y la metodología de extracción dado que las diferentes partes de H. sabdariffa, el color de las mismas, el modo de recolección y la metodología de extracción de sus componentes fitoquímicos parecen tener una gran influencia en la composición volátil del extracto y esto influye en la dosificación80. Cabe destacar, por ejemplo, que la capacidad antioxidante más elevada se ha encontrado en las flores recolectadas 35 días después de su maduración si se compara con flores más inmaduras81. La extracción con etanol de los componentes de los cálices facilita la capacidad antioxidante de H. sabdariffa, comparado con la extracción etanólica de las hojas o la extracción acuosa de las 2 partes82. No obstante, la extracción acuosa es la que presenta mayor interés a la hora de testar la efectividad de las diferentes partes de la planta, debido a que es la manera tradicional de preparación y en consecuencia su importancia respecto a su implicación en la salud pública es más notable66,67,71.
Específicamente, la tabla 1 presenta estudios realizados en diferentes líneas celulares. Las líneas celulares seleccionadas para llevar a cabo los experimentos fueron diversas, desde hepatocitos de rata83,84, líneas celulares de macrófagos de ratón RAW264.785 y J774A.186, línea de preadipocitos 3T3-L187, hasta células humanas de leucemia HL-6088. La mayoría de estos estudios se centraron en valorar la capacidad antioxidante de H. sabdariffa, ya sea por efecto de su contenido en antocianinas85,86,88, por la acción del ácido protocatéquico84,88, o por la acción biológica de otras moléculas de H. sabdariffa83. Utilizando líneas celulares de hepatocitos de ratas tratadas previamente con el compuesto citotóxico t-BHP, Tseng et al.83 demostraron el efecto antioxidante (especialmente protección citotóxica y genotóxica) de las diferentes fracciones solubles de H. sabdariffa mediante la eliminación de radicales libres e inhibición de la síntesis no programada de ADN. El efecto antioxidante de H. sabdariffa se atribuyó sobre todo a las antocianinas. La capacidad antiaterosclerótica de las antocianinas de H. sabdariffa, mediante la inhibición de la oxidación de la LDL, fue analizada por Kao et al.86 utilizando macrófagos de ratón. Su objetivo fue evaluar la acción de las antocianinas en la formación de células espumosas, y en la expresión del gen del receptor predominante para la LDL oxidada CD36 y su factor de transcripción PPAR-gamma (en inglés, peroxisome proliferator-activated receptors gamma). Los autores mostraron que H. sabdariffa inhibe la absorción de LDL-oxidada por parte de los macrófagos mediante una disminución de la expresión del gen del receptor CD36. En la misma línea, Chang et al.85 señalan el papel in vitro de las antocianinas de H. sabdariffa en la inhibición de la oxidación de la LDL y, en consecuencia, en la prevención de la aterosclerosis. Kim et al.87 analizaron la capacidad del extracto de H. sabdariffa en la inhibición de la diferenciación del adipocito y su posible beneficio en la prevención de la obesidad. Sugirieron que H. sabdariffa puede inhibir la adipogénesis mediante la inhibición de 3 vías diferentes: (1) inhibición de los factores de transcripción adipogénicos C/EBPα (en inglés, enhancer binding protein α) y PPAR-gamma (en inglés, peroxisome proliferator-activated receptors gamma) (2) inhibición de las vías de la PI3K (en inglés, phosphoinositide 3-kinase) y (3) inhibición de las rutas metabólicas asociadas con MAPK (en inglés, map kinase). El tratamiento con extracto de H. sabdariffa durante el proceso de diferenciación adipogénico demostró una reducción significativa de la expresión de la proteína y mARN de los factores C/EBPα y PPAR-gamma. Además, describieron una disminución del mARN de la hormona leptina, hormona reguladora de la ingesta y del gasto energético, y que es parcialmente activada por C/EBPα a nivel transcripcional. Añadir también que el extracto de H. sabdariffa inhibió la fosforilación y la expresión de PI3K durante la adipogénesis. Debido a estos resultados, los autores afirmaron que H. sabdariffa tiene capacidad para bloquear la vía de señalización PI3K, la vía de señalización de MAPK y la inhibición de los factores transcripcionales durante las fases tempranas de diferenciación de los adipocitos. Por todo lo dicho, los autores avanzaron que el extracto de H. sabdariffa es beneficioso para la prevención de la obesidad, y que puede conducir a la pérdida de grasa corporal in vivo. En resumen, de la tabla 1 destaca la constatación del efecto antioxidante de H. sabdariffa atribuido sobre todo a las antocianinas, que hace hipotetizar sobre su capacidad de captación de RLO y, entre otras propiedades, la inhibición de síntesis no programada de ADN y los cambios epigenéticos que se pudieran derivar. Estos resultados abren el camino para continuar con las investigaciones en modelos animales y en humanos para dar validez a las hipótesis postuladas.
En los modelos animales de la tabla 2 se utilizaron ejemplares de animales sanos68,89–91 o previamente manipulados para provocarles diabetes o aterosclerosis69,92,93, hipercolesterolemia o hiperlipidemia82,94, obesidad94,95 o hipertensión70 y estudiar los efectos del consumo de H. sabdariffa. Ajiboye et al.96 describieron el potencial de captura de H. sabdariffa sobre el radical di-fenil-2,4,6-trinitrofenil iminoazanio y 2,2-difenil-1-picrilhidracilo a dosis de 2mg/ml de extracto de antocianinas de H. sabdariffa, así como el potencial de captura de H. sabdariffa sobre el ión superóxido y peróxido de hidrógeno a una concentración de 1mg/ml. El potencial antioxidante de H. sabdariffa se analizó en la sangre e hígado de ratas albinas. Liu et al.90 demostraron que dosis de 200, 400 y 600mg/kg de extracto acuoso de flores de H. sabdariffa provocaban una reducción de la peroxidación lipídica e incrementaban la actividad de la catalasa y los niveles de GSH, en plasma y tejido hepático de ratones. Ali et al.89 señalaron que dosis de 200mg/kg de extracto acuoso de cálices mostraban restauración a la normalidad de los índices bioquímicos de daño hepático provocado por paracetamol en ratones, demostrando una capacidad de prevención de daño hepático por parte de H. sabdariffa. Olatunji et al.68 evidenciaron que la ingesta crónica durante 28 días de 1-1,5mg/kg/día de extracto acuoso de pétalos de H. sabdariffa muestra una disminución significativa del valor de LDL en el plasma de ratas experimentales. Solamente la dosis de 1,5mg/kg/día de extracto acuoso de pétalos de H. sabdariffa mostró una reducción significativa de los valores plasmáticos de colesterol total, sin cambios significativos en los niveles de HDL ni de triglicéridos totales68. Tampoco hubo cambios relevantes en los niveles séricos de HDL tras el consumo de H. sabdariffa en experimentos llevados a cabo en modelos hipercolesterolémicos, hiperlipidémicos o con obesidad inducida63,69,94,97, pero sí hubo mejoras significativas en los valores de colesterol total, LDL, y/o triglicéridos totales. En paralelo, Hirunpanich et al.97 mostraron dicha efectividad a dosis superiores a los 250mg/kg/día tras 6 semanas de ingesta de extracto acuoso de cálices. Los mismos autores destacaron que una dosis por encima de 1.000mg/kg no implicaba más efectividad, sugiriendo saturación del efecto hipolipidemiante. Los autores mostraron que la dosis farmacológica de extracto acuoso de cálices oscila dentro del rango 250-1.000mg/kg/día. Por el contrario, Ochani y D’Mello82 y Wang et al.93 demostraron que dosis de 500mg/kg/día de extracto alcohólico de hojas y cálices, y de 400mg/kg/día de extracto acuoso de flores, respectivamente, no solo reducían los valores de colesterol total, LDL y triglicéridos totales séricos sino que además incrementaban los de HDL. En modelos de ratas con diabetes inducida, los extractos alcohólicos de flores o cálices de H. sabdariffa mostraron reducción de los niveles séricos de colesterol total, LDL y/o triglicéridos totales69,92. Aún no existen artículos que relacionen el consumo de H. sabdariffa con modificaciones epigenéticas. Por ello son necesarios más estudios para comprender los mecanismos moleculares asociados al consumo de H. sabdariffa y la patogénesis de la enfermedad, especialmente en humanos. Continuando con el estudio de los efectos de H. sabdariffa en la regulación del metabolismo energético y celular, Chen et al.79 trabajaron con un modelo de conejos aterogénicos para evaluar el efecto antiaterosclerótico e hipolipidemiante del extracto de H. sabdariffa. Demostraron a nivel histológico que la exposición, durante 10 semanas, a dosis de 0,5-1%/dieta de extracto acuoso de H. sabdariffa, se traducía en una disminución de la formación de las denominadas células espumosas y una inhibición de la calcificación de los vasos sanguíneos, además de un descenso de los valores séricos de colesterol total, LDL y triglicéridos. Así, los autores concluyeron que la actividad antiaterosclerótica de H. sabdariffa se relaciona con la prevención de la oxidación de las LDL en la pared arterial y que su consumo podía resultar beneficioso en la reducción de la incidencia de la enfermedad. Wang et al.93 señalaron mecanismos antioxidativos y antiapoptóticos como posible explicación de la reducción de colesterol total, LDL y triglicéridos totales. Lee et al.92 constataron un aumento de la actividad de la catalasa y glutatión, a dosis de 200mg/kg, y una disminución de la peroxidación lipídica como mecanismos para regular los niveles de lípidos plasmáticos. Los resultados de los estudios en animales muestran el efecto hipotensor y antioxidante de H. sabdariffa. No obstante, los resultados sobre el efecto del consumo de H. sabdariffa en el metabolismo del colesterol, y en consecuencia sobre los parámetros de las patologías asociadas, son más variables. A este respecto, cabe destacar la heterogeneidad de resultados por lo que respecta a los valores de HDL después del consumo de H. sabdariffa, puesto que solo un número reducido de estudios muestran un incremento significativo de los mismos a dosis altas de extracto de H. sabdariffa, mientras que por lo general sus valores no experimentan cambios. Resulta difícil obtener una conclusión única de los resultados debido a la elevada diversidad metodológica, el número de individuos utilizados en cada grupo y las dosis empleadas en los diferentes protocolos experimentales.
La tabla 3 muestra los resultados de los estudios sobre humanos. Se presentan estudios observacionales, con placebo65 y sin placebo98, epidemiológicos de intervención aleatorizada caso-control, con placebo73 y sin placebo66,67,72, y estudios aleatorizados64,71.
En los diferentes estudios se han evaluado los efectos antioxidantes, hipolipidemiantes e hipotensores de H. sabdariffa en pacientes sanos98, personas con síndrome metabólico64, pacientes diabéticos con hipertensión leve72, sujetos pre- y levemente hipertensos65,66,72, sujetos hipertensos previamente tratados con medicación hipotensora tradicional66,67 y sujetos con hiperlipidemia73. Frank et al.98 en su estudio sobre la capacidad antioxidante de H. sabdariffa suministraron una toma de 10g de extracto de H. sabdariffa en forma de infusión a un grupo experimental compuesto por 8 sujetos sanos. Después de la ingesta, y durante 24h, se efectuaron extracciones de sangre y se recogió la orina de los participantes. Los autores demostraron un descenso significativo del malondialdehído, un biomarcador de estrés oxidativo, además de un aumento notable del potencial antioxidante del plasma y orina humanos. También constataron un incremento significativo de la excreción de ácido hipúrico por orina, lo que evidencia una elevada biotransformación de los polifenoles de H. sabdariffa ingeridos, apuntando el papel de la microbiota colónica en dicha transformación. Gurrola-Diaz et al.64 focalizaron su estudio en el efecto preventivo y de mejora del perfil lipídico de H. sabdariffa en sujetos con o sin síndrome metabólico. Los datos más significativos del estudio mostraron que los sujetos que presentaban evidencias de síndrome metabólico y que habían recibido tratamiento experimental con extracto secos de cálices de H. sabdariffa mostraban una reducción significativa de los niveles de glucosa y colesterol total en sangre, un aumento de los niveles de la HDL y una mejora en la relación del marcador de insulino-resistencia triglicéridos totales/HDL. Estos autores mostraron que las antocianinas de H. sabdariffa podían regular la función de los adipocitos, tal y como postulaba Tsuda99. Posteriormente, y también en la misma línea, Mohagheghi et al.71 analizaron la eficacia del consumo de extracto de cálices de H. sabdariffa a corto plazo sobre la reducción de los valores séricos de glucosa y lípidos en pacientes hipertensos con historial de tratamiento convencional hipotensor, respecto al consumo de la misma cantidad de té negro. En ambos tratamientos se observó un aumento de los valores de colesterol total, y de las lipoproteínas ligadas al colesterol (LDL y HDL). El incremento de colesterol total y HDL respecto a los valores iniciales fueron significativos en los 2 casos. No se observaron variaciones de carácter nocivo para la salud en los niveles de colesterol, triglicéridos totales, creatinina sérica, Na+ y K+ dentro de los 15 días después de la interrupción de la medicación. A este respecto concluyen que H. sabdariffa es una planta medicinal segura. Kuriyan et al.73 no pudieron demostrar el efecto hipolipidémico de las hojas de H. sabdariffa en pacientes con dieta estándar y ejercicio físico. Los autores constataron una disminución del peso corporal, de la concentración sanguínea de LDL y triglicéridos totales en los pacientes control y los tratados, sugiriendo que los resultados observados eran consecuencia del ejercicio y de la dieta.
En cuanto al efecto hipotensivo de H. sabdariffa, Mckay et al.65 demostraron que el consumo diario de 3 tazas de té de H. sabdariffa reducía significativamente la presión sistólica en individuos pre- y medianamente hipertensos. Ajay et al.100 evidenciaron que el efecto antihipertensivo con efectos vasodilatadores y/o de descenso del ritmo cardíaco de H. sabdariffa podría asociarse a su composición rica en antocianinas. Wahabi et al.78 en su metaanálisis sobre la calidad de los estudios realizados sobre la efectividad de H. sabdariffa en el tratamiento de la hipertensión en humanos pre- y ligeramente hipertensos describieron que no existen suficientes evidencias científicas para validar las propiedades hipotensoras de H. sabdariffa. De hecho, los autores destacaron que se trataba de investigaciones de calidad insuficiente, de corta duración y diversidad metodológica elevada, hecho que no permitía evaluar convenientemente los posibles efectos adversos de la toma continuada de H. sabdariffa.
Los resultados presentados en las diferentes tablas sugieren que H. sabdariffa tiene potencial antioxidante, capacidad para atenuar la hipertensión y las patologías asociadas a la obesidad y a la diabetes, como nefropatía, aterosclerosis, y patologías cardiovasculares. La diversidad observada sobre los efectos de H. sabdariffa en los seres humanos se puede atribuir a la diferencia de concentración de polifenoles en H. sabdariffa y otros nutrientes concomitantes, al solvente utilizado en su extracción, al período y forma de administración, y al escaso número de estudios de los que se dispone, heterogeneidad metodológica (p. ej., empleo de té negro como control, en lugar de placebo), diferencia en tamaño poblacional y heterogeneidad interindividual.
Por último, algunos autores sugieren que los extractos de H. sabdariffa presentan un bajo grado de toxicidad aguda con la dosis letal media (LD50), con un rango que varía desde 2.000 a más de 5.000mg/kg/día77,101. No obstante, se ha observado un posible efecto adverso a nivel hepático a altas dosis77 (tabla 4). Akindahunsi y Olaleye102 señalaron que existe toxicidad hepática con la ingesta crónica de dosis superiores a los 3.000mg/kg de extracto de cálices de H. sabdariffa. Fakeye et al.103 apuntaron que el consumo prolongado de altas dosis de extracto de flores puede conducir a reacciones tóxicas e incluso confundirse con episodios de hepatitis crónica. De hecho, dosis de 2.000mg/kg/día durante 90 días provocaron pérdidas severas de peso y diarreas en sus animales experimentales. En sentido contrario, la experimentación con dosis comprendidas entre los 50-100mg/kg hizo hipotetizar que las fracciones etanólicas y acuosas de los extractos de flores de H. sabdariffa pueden ser susceptibles de convertirse en entidades farmacológicas para estimular la inmunidad104.
Estudios sobre toxicidad y seguridad de HS
| Autores | Año | Diseño del estudio | Parte utilizada | Mét. de extracción | Tipo de acción analizada | Animal o línea celular utilizada | Dosis y tiempo de tratamiento | Resultados principales |
| Akindahunsi et al.102 | 2003 | Caso-control | Cálices | Metanol-agua(4:1) | Toxicidad | Seis grupos, n=4, de ratas Wistar albinas | Grupo I: 0, salino fisiológico soloG II: una dosis de 250mg/gG III: 3 dosisG IV: 5 dosisG V: 10 dosisG VI: 15 dosisSin especificar duración del tratamiento | AST, ALT ↑ significativamente en todos los grupos respecto al grupo controlLos estudios histopatológicos no mostraron daños patológicos en hígado y corazón en todos los gruposUna administración prolongada de la dosis 15 puede causar daño hepáticoConcluye que aunque el consumo promedio diario de 150-180mg/kg parece seguro, el extracto debe tomarse con precaución pues dosis más elevadas pueden provocar daño hepático |
| Fakeye104 | 2008 | Caso-control | Flores | Acuosa-etanólica(50:50) | Estudio de las propiedades immunomoduladoras y el perfil de toxicidad subaguda de 2 fracciones de extracto alcohólico acuoso de cálices de HS | Ratones albinos macho | Tres grupos, n=4, se les administró:50mg/kg,100mg/kgde fracción soluble de acetato de etilo100mg/kg de la parte residualGrupo 4. ControlSiete días | No se encontró toxicidad en las dosis empleadas, en las que se demuestra que poseen actividades inmunoestimulantesLas fracciones poseen una impresionante actividad inmunoestimuladoraLa fracción residual soluble en agua sí causó una considerable ↓ de peso comparada con el grupo controlLas 2 fracciones causaron una considerable ↓ de basófilosLa fracción acuosa residual causó ↓ de neutrófilosSe determina que ambas fracciones pueden ser susceptibles de convertirse en entidades medicamentosas |
| Fakeye et al.103 | 2009 | Caso-control | Flores | Acuosa-etanólica(50:50) | Estudio de la toxicidad a nivel hematológico,bioquímico e histopatológico por el consumo oral de HS | Treinta y cinco ratas albinas. Divididas en 7 grupos, n=5 | Administración- 50:50 agua/etanol- 100% etanolDe ambos extractos se administraron 300mg/kg y 2.000mg/kg/día. Noventa díasEl séptimo grupo, control. 2ml de agua/día | La muerte de los animales fue precedida de una pérdida severa de peso, acompañada de diarrea en animales con dosis de 2.000mg/kgLa actividad de la AST mejoró con la administración del extracto acuoso y 50% de etanol, con un significativo ↑ de su nivel a dosis más altasLos niveles de ALT y creatinina se vieron significativamente afectados por los 2 tipos de extractos a diferentes dosis. El extracto acuoso exhibe un significativo ↑ de los niveles de creatinina a dosis más altasLos niveles de colesterol no se vieron significativamente afectados por los extractosNo se observaron cambios histopatológicos significativos↓ del número de eritrocitos. No de leucocitosEl consumo prolongado de altas dosis provoca un ↑ de los niveles de enzimas hepáticas y sus efectos se pueden confundir con una hepatitis crónica, sin daños apreciables en los hepatocitos |
AST: aspartato aminotransferasa; ALT: alanina aminotransferasa; HS: Hibiscus sabdariffa.
El consumo tradicional de H. sabdariffa en forma de infusión se ha asociado a diferentes propiedades terapéuticas. Específicamente, los resultados de la presente revisión nos indican que H. sabdariffa tiene capacidad de captura de radicales libres, inhibiendo, por ejemplo, la oxidación de la LDL. Además, el consumo diario de extracto de H. sabdariffa parece que podría mejorar de manera significativa la presión sanguínea en pacientes pre- y medianamente hipertensos, y con diabetes tipo 2. Por otro lado, el consumo de H. sabdariffa podría mejorar el perfil lipídico, reduciendo los valores séricos de colesterol total, LDL y triglicéridos totales. Las antocianinas de H. sabdariffa han mostrado capacidad para inhibir la oxidación de la LDL y la posible reducción del riesgo de aterosclerosis. Aunque existen diferentes estudios que intentan demostrar los efectos antioxidantes, hipotensores e hipolipidemiantes del consumo regular de H. sabdariffa en humanos, modelos animales y celulares, los mecanismos celulares y biológicos, así como epigenéticos, de los efectos específicos de H. sabdariffa aún deben dilucidarse. Con los resultados publicados hasta la fecha no es posible definir una dosis de H. sabdariffa asociada a sus propiedades terapéuticas. La falta de homogeneidad en el diseño experimental de los diferentes estudios, así como el bajo número de sujetos y la heterogeneidad interindividual, podrían ser algunas de las causas de la falta de consistencia de los resultados. Aun así, dichos resultados representan interesantes descubrimientos que deben ser estudiados extensamente, pues el conocimiento de la distribución y funcionalidad de los polifenoles de H. sabdariffa en pacientes con diferentes patologías puede ser útil para conseguir un tratamiento terapéutico. De igual interés será seguir investigando en el campo de tratamientos no farmacológicos alternativos como son los alimentos funcionales. Hasta la fecha solo se han estudiado un número limitado de extractos de H. sabdariffa, y dado que los efectos de diferentes componentes no son equivalentes, los resultados no pueden ser generalizados. Así pues, futuros estudios a gran escala, controlados en dosis, componentes activos, biodisponibilidad y otras variables críticas, serán cruciales para aportar la evidencia científica necesaria requerida para determinar la eficacia de la estrategia terapéutica con H. sabdariffa y sus dosis.
Conflicto de interesesLas autoras declaran no tener ningún conflicto de intereses.