El objetivo de este estudio fue comparar diversos regímenes de administración de la insulina detemir (IDet) en pacientes con diabetes tipo I y mal control metabólico.
Material y métodosEstudio abierto aleatorizado de 24 semanas de duración. Se incluyeron 39 pacientes con diabetes mellitus (DM) tipo I aleatorizados a una inyección de IDet antes de la comida (14,24±00,36[±SD]h) o IDet antes de acostarse (23,19±0,42h). Si no se alcanzaban los objetivos de glucemia, se cambió a la pauta con 2 inyecciones (IDet-12h). En las comidas se administró insulina aspart.
ResultadosEn la semana 24 solamente un 12,2% de los pacientes permanecían en el grupo IDet antes de acostarse y un 30,3% en el grupo IDet antes de la comida. El 57,5% restantes pasaron al grupo de IDet-12h. No hubo diferencias entre el grupo de IDet antes de la comida e IDet antes de acostarse. Un subanálisis incluyendo los 3 grupos demostró un mejor control metabólico en el grupo IDet antes de la comida (hemoglobina glicosilada (HbA1c) 7,1±0,2 vs. 7,6±0,4 y 8,1±0,2%, en IDet antes de la comida, IDet antes de acostarse e IDet-12h, respectivamente; p<0,05). El valor de HbA1c inferior a 7%, fue alcanzado en un 30,3% de los pacientes, un 15,2% en el grupo IDet antes de la comida, un 3,3% en el grupo IDet antes de acostarse y 11,5% en grupo IDet-12h. No se encontraron diferencias entre los grupos del tratamiento respecto a la calidad de vida.
ConclusiónUna inyección de IDet administrada antes de la comida podría mejorar el control metabólico. Sin embargo, la mayoría de pacientes requiere 2 inyecciones de IDet.
To compare different administration times of insulin detemir (IDet) in patients with type 1 diabetes and poor metabolic control.
Material and MethodsThis 24-week open study included 39 people with type 1 diabetes mellitus (DM) randomized to one injection of IDet before lunch (mean 14.24±00.36 (±SD) h) or at bedtime (23.19±0.42h). Whenever target glycemia levels were not reached, the regimen was switched to insulin therapy with two injections (IDet-12h). Insulin aspart was used before main meals.
ResultsAt week 24, only 12.2% of patients remained in the IDet bedtime group and 30.3% in the IDet before lunch group. The remaining 57.5% joined the IDet-12h group. There were no differences between the IDet before lunch and IDet bedtime groups. A subanalysis including the three groups demonstrated better metabolic control in the IDet before lunch group (glycosylated hemoglobin (HbA1c) 7.1±0.2 vs. 7.6±0.4 and 8.1±0.2% in IDet before-lunch, IDet bedtime and IDet-12h, respectively; p<0.05). An HbA1c value below 7% was achieved in 30.3% of the patients: 15.2% in the IDet before-lunch group, 3.3% in the IDet bedtime group and 12.2% in IDet-12h group. Quality of life did not differ among treatment groups.
ConclusionsOne injection of IDet administered before lunch could improve metabolic control. However, most patients required two injections of IDet.
Diferentes estudios han demostrado que la terapia intensiva con insulina en pacientes con diabetes mellitus (DM) tipo I, con el objetivo de conseguir un control glucémico estricto, reduce la incidencia y retrasa la progresión de las complicaciones microvasculares1–3.
La terapia insulínica bolo-basal pretende optimizar el control glucémico limitando la hiperglucemia posprandial mediante análogos de insulina de acción corta y asegurando los niveles de insulinemia basal con un análogo de insulina de acción lenta. Este tratamiento pretende reproducir el patrón fisiológico de secreción de insulina en sujetos no diabéticos. En el caso de las insulinas basales, las formulaciones tradicionales, como insulina neutral protamine hagedorn (NPH) y ultralenta, se han caracterizado por presentar picos en la concentración plasmática que pueden dar lugar a hipoglucemias, especialmente durante la noche, y a la necesidad de realizar pequeñas ingestas de alimentos como prevención4.
Además, las diferencias en el tamaño de cristalización y la resuspensión inadecuada de la insulina NPH modifican la absorción y alteran la precisión de la dosificación con resultados variables que conducen a niveles imprevisibles de glucosa5. Los análogos insulina de acción retardada (glargina y detemir), que actúan como insulina basal, se han desarrollado para permitir a pacientes con diabetes mantener niveles basales de insulina más estables con menos variación inter e intra-sujeto.
La insulina detemir ([IDet] [N-tetradecanoyl] DES LysB29 [B30] insulina humana) es un análogo soluble de insulina de acción prolongada. Su duración se debe a una combinación del aumento en la autoasociación (estabilización del hexámero e interacción hexámero-hexámero) y a la unión con la albúmina por un fenómeno de acetilación del aminoácido lisina en la posición B29 con un ácido graso 14C (ácido mirístico). La IDet se une a la albúmina en líquido intersticial y plasma6, y se ha demostrado útil para conseguir una acción metabólica prolongada, con un inicio lento de la acción y un pico menos pronunciado comparado con el observado para la insulina NPH7,8. Los estudios de las características farmacocinéticas y farmacodinámicas han demostrado un efecto lineal de la IDet que es dependiente de la dosis. Así, la duración de la acción de detemir parece modificarse desde 5,7, a 12,1, a 19,9, a 22,7 y a 23,2h para 0,1, 0,2, 0,4, 0,8, y 1,6UI/kg, respectivamente9.
En la mayoría de los estudios publicados en DM tipo I utilizando detemir y análogos de acción corta, se emplean 2 dosis diarias de IDet10–12. La aparente relación entre duración y dosis empleada plantea la posibilidad de utilizar una sola dosis de detemir administrada como insulina basal en DM tipo I. En tal caso, se hace necesario conocer qué momento del día sería más óptimo para su administración. Esto es aún más importante si tenemos en cuenta las peculiaridades de las costumbres en cuanto a horarios y cantidad de ingesta en los diferentes momentos del día y en las diferentes sociedades. Hay pocos estudios que comparen los efectos de detemir según el momento de administración. El objetivo del presente estudio fue evaluar la utilidad de 2 pautas de IDet asociada a insulina aspart en pacientes diabéticos tipo I en nuestro medio.
Material y métodosEstudio de intervención abierto aleatorizado de pacientes con DM tipo I, según los criterios de la Asociación Americana de Diabetes, que se inició con 2 brazos de tratamiento, como se describe en la sección de grupos de tratamiento. En él participaron 2 centros y la duración total del estudio fue de 24 semanas.
Treinta y nueve sujetos fueros reclutados. Todos ellos recibían 3 dosis diarias de insulina premezclada 30/70 aspart/NPH con las comidas por lo menos durante los 6 meses previos y habían sido diagnosticados de diabetes tipo I hacía al menos 2 años antes (criterios de la Asociación Americana de Diabetes)13. Todos eran caucásicos con un intervalo de edad de 18–55 años. Se seleccionaron aquellos pacientes con mal control metabólico de su diabetes (hemoglobina glicosilada (HbAlc) >7,0% en 2 determinaciones en los últimos 6 meses). Entre los criterios de exclusión se encontraban la retinopatía proliferativa en fase aguda; función hepática deteriorada (transaminasas y/o fosfatasas alcalinas al menos 2 veces superior al nivel normal); función renal deteriorada (creatinina >1,50mg/dl); insuficiencia cardíaca descompensada; angina de pecho inestable; infarto de miocardio durante el último año; hipertensión no controlada (presión arterial sistólica y/o diastólica superiores a 180 y 100mmHg, respectivamente); hipoglucemias inadvertidas, recurrentes o graves; alergia a la insulina o a cualquier componente de la misma, así como los que presentaban antecedente de abuso de alcohol o drogas; toma de corticoesteroides, β-bloqueantes, u hormonas sistémicas dentro del último mes; o gestación, lactancia o posibilidad de embarazo. Los sujetos que hubieran participado en estudios o ensayos clínicos en los 3 últimos meses o tratados previamente con IDet también fueron excluidos. El estudio fue realizado de acuerdo con la buena práctica clínica y la declaración de Helsinki. Se obtuvo el consentimiento informado de cada sujeto antes de entrar en el estudio.
Grupos de tratamientoLos pacientes fueron aleatorizados de forma consecutiva 1:1 a recibir una dosis diaria de IDet subcutánea (Levemir® 100UI/ml, Novo Nordisk A/S) antes de la comida —IDet antes de la comida (14:00–16:00h)— o antes de acostarse —IDet antes de acostarse (22:00–00:00h). Como insulina prandial se utilizó un análogo de insulina de acción corta, insulina aspart (NovoRapid® 100UI/ml, Novo Nordisk A/S) antes de cada comida principal. El paso de insulina premezclada fue manteniendo la dosis total de insulina requerida: 60% de detemir y un 40% de aspart. Los pacientes recibieron asistencia telefónica cada 4 semanas para ajustar la dosis de insulina. No hubo diferencias entre los 2 centros para este algoritmo.
Control de glucemiaLos sujetos fueron informados de los objetivos de glucemia en sangre capilar (ayuno, 70–130mg/dl; posprandial, 90–160mg/dl; 03:00, 70–130mg/dl), instruidos en el uso del dispositivo FlexPen® (Novo Nordisk Pharma) y en la calibración y el uso de la medición de glucosa (mediante el glucómetro portátil One Touch UltraSmart (LifeScan, Johnson&Johnson®). Los 2 centros disponían del software correspondiente al glucómetro OneTouch (Programa One Touch de gestión de datos en diabetes, LifeScan, Johnson&Johnson®), y los niveles de glucosa fueron revisados en cada visita. Se indicó a los pacientes que midieran la glucemia en sangre capilar antes de la administración de insulina y que realizaran un perfil de 7 puntos una vez a la semana. Asimismo, se les indicó que se realizaran un control de glucemia capilar siempre que experimentaran síntomas de hipoglucemia.
La hipoglucemia se definió como un valor de glucosa en sangre capilar <60mg/dl con o sin síntomas. Los episodios fueron clasificados como leves o moderados si los pacientes solventaron el episodio por si mismos y como graves si requirieron la ayuda de otras personas o de un tratamiento intravenoso con glucosa o glucagón.
Los pacientes con presencia de glucemia capilar >250mg/dl en más de 3 ocasiones en la comida previa a la última dosis de detemir pasaban a administrarse 2 dosis de IDet en desayuno y cena, cada 12h. Los objetivos de la glucemia basal y de la pre-cena fueron establecidos para el grupo IDet antes de acostarse o el grupo IDet antes de la comida, respectivamente. La titulación de la dosis de detemir fue basada en las concentraciones capilares de la glucosa basal a partir de los 3 días previos para alcanzar niveles inferiores a 130mg/dl (basado en el estudio de Diabetes Control and Complications Trial [DCCT])14. Se disminuyó detemir en 2 unidades si la glucemia capilar era<80mg/dl, sin cambios si la glucemia era 80–129mg/dl, se aumentaron 2 unidades si la glucemia era 130–179mg/dl, 4 unidades si la glucemia era 180–200mg/dl y 6 unidades si era la glucemia >200mg/dl. La hipoglucemia de repetición fue otro criterio para administrar 2 inyecciones diarias de detemir.
Calidad de vidaLa calidad de vida respecto al tratamiento fue valorada utilizando un cuestionario validado de satisfacción de la terapia con insulina (cuestionario ITSQ) Copyright 2001 Novo Nordisk A/S), que fue cumplimentado por el paciente en la visita basal y a las 24 semanas de la misma. El cuestionario consta de 22 ítems divididos en 2 partes. Se valora de 1–7 puntos los inconvenientes del régimen insulínico utilizado, la flexibilidad para la vida cotidiana, el control glucémico, el control de las hipoglucemias (parte 1), y la satisfacción con el dispositivo de autoinyección (parte 2). Una menor puntuación indica una mejoría en la calidad de vida percibida respecto al tratamiento con insulina.
DeterminacionesLa HbA1c, el peso corporal y la dosis de insulina fueron registrados al principio del estudio (aleatorización) y después de 12 y 24 semanas del tratamiento. La HbA1c (con intervalo de referencia del análisis: 3,8–5,8; coeficiente de variación: <2,0) fue medido por cromatografía (HPLC) de intercambio de ion (Bio-Rad Diamat; laboratorios Bio-Rad, Hércules, California, USA).
Análisis estadísticoPara analizar las diferencias de calidad de vida, HbA1c, glucemia basal, peso corporal y dosis de insulina entre las semanas 0–24 se utilizó una prueba t de Student para muestras apareadas. Se utilizó un modelo de ANOVA para analizar las diferencias entre grupos de tratamiento, estudiando las modificaciones en la calidad de vida, HbA1c, dosis de insulina y peso corporal después de 24 semanas del tratamiento. El área bajo la curva del perfil glucémico diario fue calculada usando el método trapezoidal y comparada usando ANOVA. La prueba de la Cochran-Mantel-Haenzel estratificada por centro fue utilizada para comprobar las diferencias en el índice de hipoglucemia. Los resultados fueron expresados como medias y DE. La diferencia fue considerada significativa con una p<0,05.
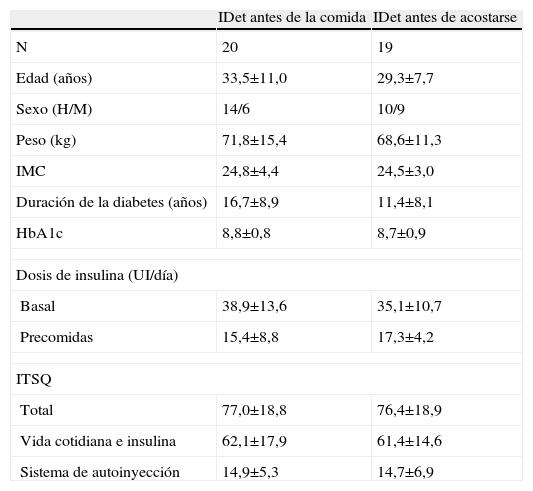
ResultadosCaracterísticas de los pacientes y retiradas del estudioUn total de 39 pacientes fueron incluidos de acuerdo con los criterios de inclusión y exclusión. Todos los pacientes fueron aleatorizados y recibieron tratamiento en un período que abarcó desde julio de 2005 a junio de 2006. De todos los pacientes, 19 del grupo de detemir antes de acostarse y 16 del grupo detemir en la comida completaron el estudio. No hubo diferencias en las características basales entre los 2 grupos (tabla 1). Los pacientes que se retiraron del estudio lo hicieron por: abandono del protocolo (2 personas), miedo a episodio hipoglucémico (una persona) y reacción adversa grave (una persona que presentó 3 episodios de hipoglucemia grave, uno de los cuales requirió asistencia hospitalaria).
Características basales de los pacientes por grupo de tratamiento. No hubo diferencias entre los parámetros analizados
| IDet antes de la comida | IDet antes de acostarse | |
| N | 20 | 19 |
| Edad (años) | 33,5±11,0 | 29,3±7,7 |
| Sexo (H/M) | 14/6 | 10/9 |
| Peso (kg) | 71,8±15,4 | 68,6±11,3 |
| IMC | 24,8±4,4 | 24,5±3,0 |
| Duración de la diabetes (años) | 16,7±8,9 | 11,4±8,1 |
| HbA1c | 8,8±0,8 | 8,7±0,9 |
| Dosis de insulina (UI/día) | ||
| Basal | 38,9±13,6 | 35,1±10,7 |
| Precomidas | 15,4±8,8 | 17,3±4,2 |
| ITSQ | ||
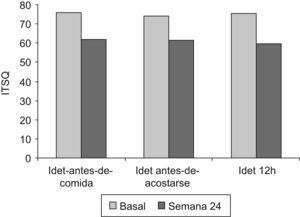
| Total | 77,0±18,8 | 76,4±18,9 |
| Vida cotidiana e insulina | 62,1±17,9 | 61,4±14,6 |
| Sistema de autoinyección | 14,9±5,3 | 14,7±6,9 |
H: hombre; HbA1c: hemoglobina glicosilada; IDet: insulina detemir; IMC: índice de masa corporal; ITSQ: cuestionario de calidad de vida referente a tratamiento con insulina; M: mujer; UI: unidades internacionales.
En la semana 24 solo 4 pacientes permanecían en el grupo IDet antes de acostarse por 10 en el grupo IDet-antes de la comida. Los 21 restantes pasaron al grupo IDet-12h. El tiempo medio para cambiar a los pacientes al grupo IDet-12h fue de 71,1±18,8 días (7–160), unas 10 semanas.
Dosis de insulinaHubo un incremento en las necesidades de insulina al pasar de la terapia inicial con insulina premezclada a la pauta bolo-basal con detemir, a expensas tanto de la insulina basal (37,6±3,0 vs. 45,3±3,6UI/paciente/día; p<0,05) como del análogo rápido pre-comidas (16,8±1,6 vs. 22,4±3,9UI/paciente/día; p<0,05). No se hallaron diferencias por grupo de tratamiento. Los requerimientos diarios de insulina no se relacionaron con la utilización de una o 2 dosis de detemir (tabla 2). Las dosis de insulina por peso fueron de 0,54±0,07UI/kg en el grupo IDet antes de la comida, 0,78±0,11UI/kg en el grupo IDet antes de acostarse, y 0,66±0,06UI/kg en el grupo IDet-12h.
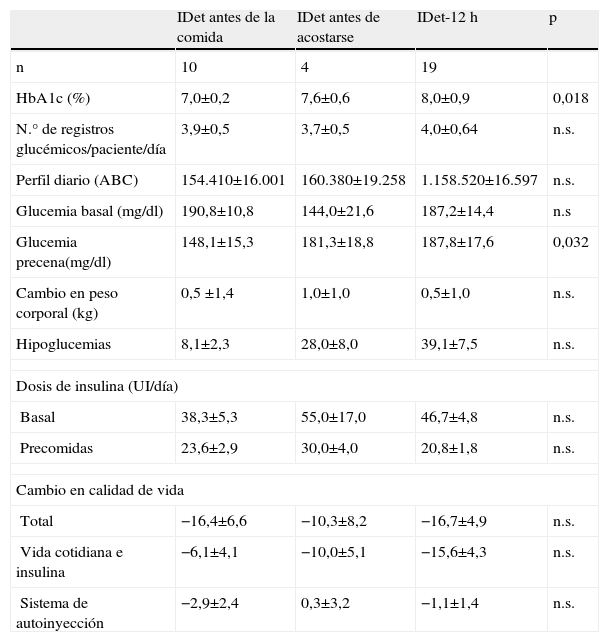
Diferencias por grupos de tratamiento en la semana 24
| IDet antes de la comida | IDet antes de acostarse | IDet-12h | p | |
| n | 10 | 4 | 19 | |
| HbA1c (%) | 7,0±0,2 | 7,6±0,6 | 8,0±0,9 | 0,018 |
| N.° de registros glucémicos/paciente/día | 3,9±0,5 | 3,7±0,5 | 4,0±0,64 | n.s. |
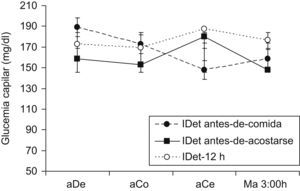
| Perfil diario (ABC) | 154.410±16.001 | 160.380±19.258 | 1.158.520±16.597 | n.s. |
| Glucemia basal (mg/dl) | 190,8±10,8 | 144,0±21,6 | 187,2±14,4 | n.s |
| Glucemia precena(mg/dl) | 148,1±15,3 | 181,3±18,8 | 187,8±17,6 | 0,032 |
| Cambio en peso corporal (kg) | 0,5 ±1,4 | 1,0±1,0 | 0,5±1,0 | n.s. |
| Hipoglucemias | 8,1±2,3 | 28,0±8,0 | 39,1±7,5 | n.s. |
| Dosis de insulina (UI/día) | ||||
| Basal | 38,3±5,3 | 55,0±17,0 | 46,7±4,8 | n.s. |
| Precomidas | 23,6±2,9 | 30,0±4,0 | 20,8±1,8 | n.s. |
| Cambio en calidad de vida | ||||
| Total | −16,4±6,6 | −10,3±8,2 | −16,7±4,9 | n.s. |
| Vida cotidiana e insulina | −6,1±4,1 | −10,0±5,1 | −15,6±4,3 | n.s. |
| Sistema de autoinyección | −2,9±2,4 | 0,3±3,2 | −1,1±1,4 | n.s. |
ABC: área bajo la curva; HbA1c: hemoglobina glicosilada; IDet: insulina detemir; n.s: no significativo; UI: unidades internacionales.
Al final del estudio se observó una mejoría en el control glucémico, reduciéndose la HbA1c media con respecto a la basal (8,7±0,1% vs. 7,7±0,2%; p<0,05). La reducción de la HbA1c se produjo en todos los grupos y no hubo diferencias entre el grupo de IDet antes de la comida y IDet antes de acostarse (tabla 2).
En el análisis secundario, incluyendo IDet-12h grupo, el grupo IDet antes de la comida alcanzó un HbA1c más baja en la semana 24 (HbA1c 7,0±0,2%, 7,6±0,6% y 8,0±0,9%; p<0,05 para IDet antesde la comida, IDet antes de acostarse y IDet-12h, respectivamente). Un buen control metabólico, definido por una HbA1c ≤7%, se consiguió en 10 pacientes, 5 del grupo IDet antes de la comida, uno del grupo IDet antes de acostarse y 4 del grupo IDet-12h.
La glucemia basal fue más baja en el grupo de IDet antes de acostarse, si bien el número escaso de pacientes que finalizaron con esta pauta de tratamiento hizo que no se alcanzara la significación estadística (tabla 2).
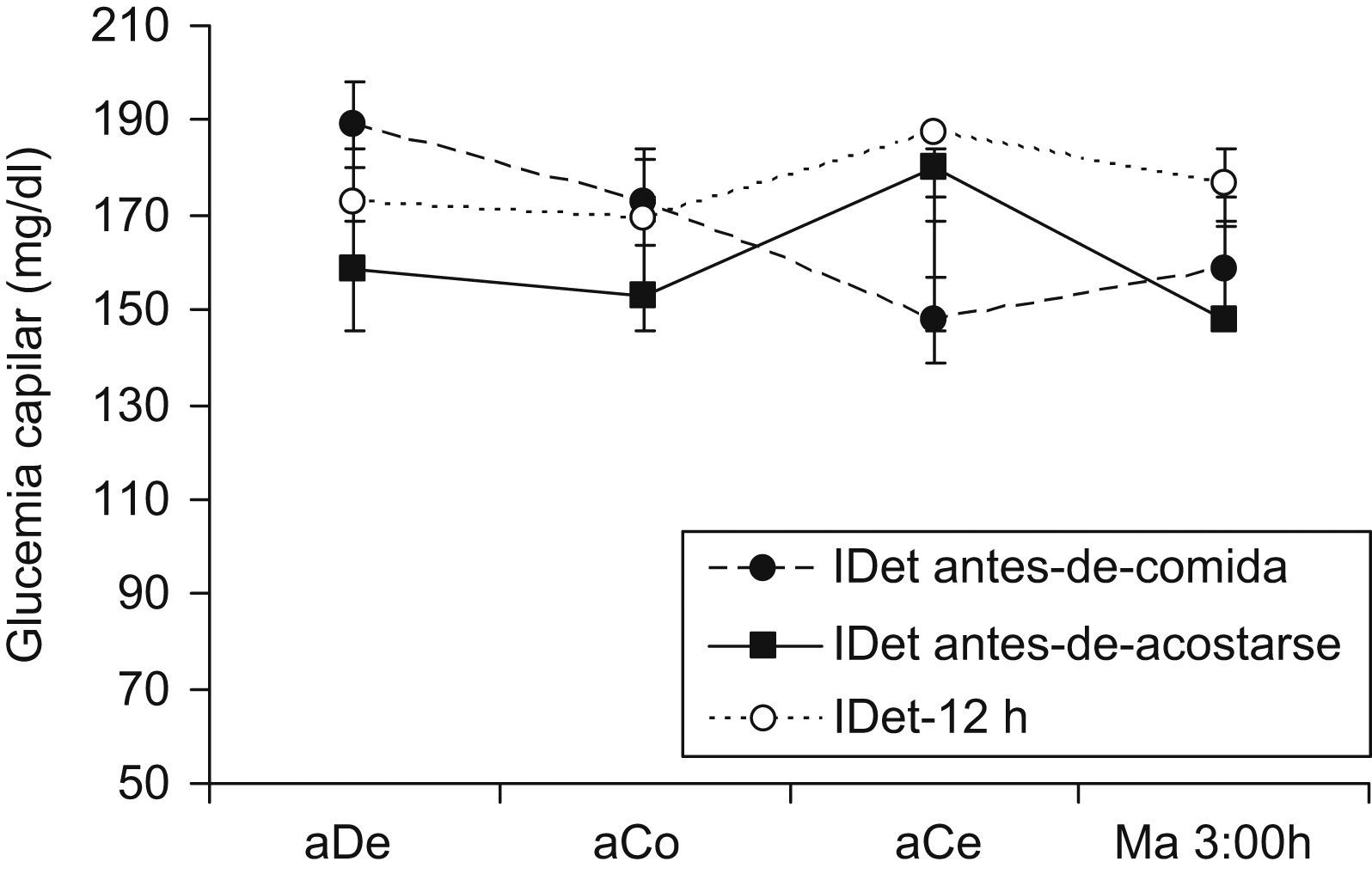
Automonitorización de glucosaSe analizaron un total de 22.486 registros de glucemia capilar medida con el glucómetro OneTouch UltraSmart, correspondiendo una media de 3,6 registros de glucemia/paciente/día. No hubo diferencias en el número de registros por paciente y grupo de tratamiento. El número de registros por grupo fue: 576,1±108,1 en el grupo IDet antes-de-comida, 447,7±61,6 en el IDet antes de acostarse y 701,2±103,7 en IDet-12h. La mayoría de pacientes no realizaron el perfil glucémico de siete puntos y, en algunos casos, la hora de la medida de la glucemia posprandial era heterogénea. Por esta razón se analizó el perfil glucémico diario utilizando solo las mediciones precomidas y de madrugada, como se presenta en la figura 1. El cálculo del área bajo la curva utilizando dicho perfil, no demostró diferencias entre grupos (tabla 2).
HipoglucemiasNo se encontraron diferencias entre los 2 grupos en episodios de hipoglucemias. Si bien la incidencia de hipoglucemias leves fue menor en el grupo de IDet antes de la comida, no se alcanzó significación estadística. Se presentaron 5 episodios de hipoglucemia grave: 2 en sujetos del grupo IDet-12h y 3 en un mismo paciente del grupo IDet antes de acostarse, lo que obligó a retirarlo del estudio. Otro paciente en el IDet antes de acostarse grupo decidía retirarse del estudio debido a la frecuencia de hipoglucemias, aunque no se registró ningún episodio grave.
Peso corporalEl peso no se modificó a lo largo del estudio (69,4±2,4kg vs. 69,7±2,6kg; p no significativa), ni hubo diferencias por grupo de tratamiento (tabla 2).
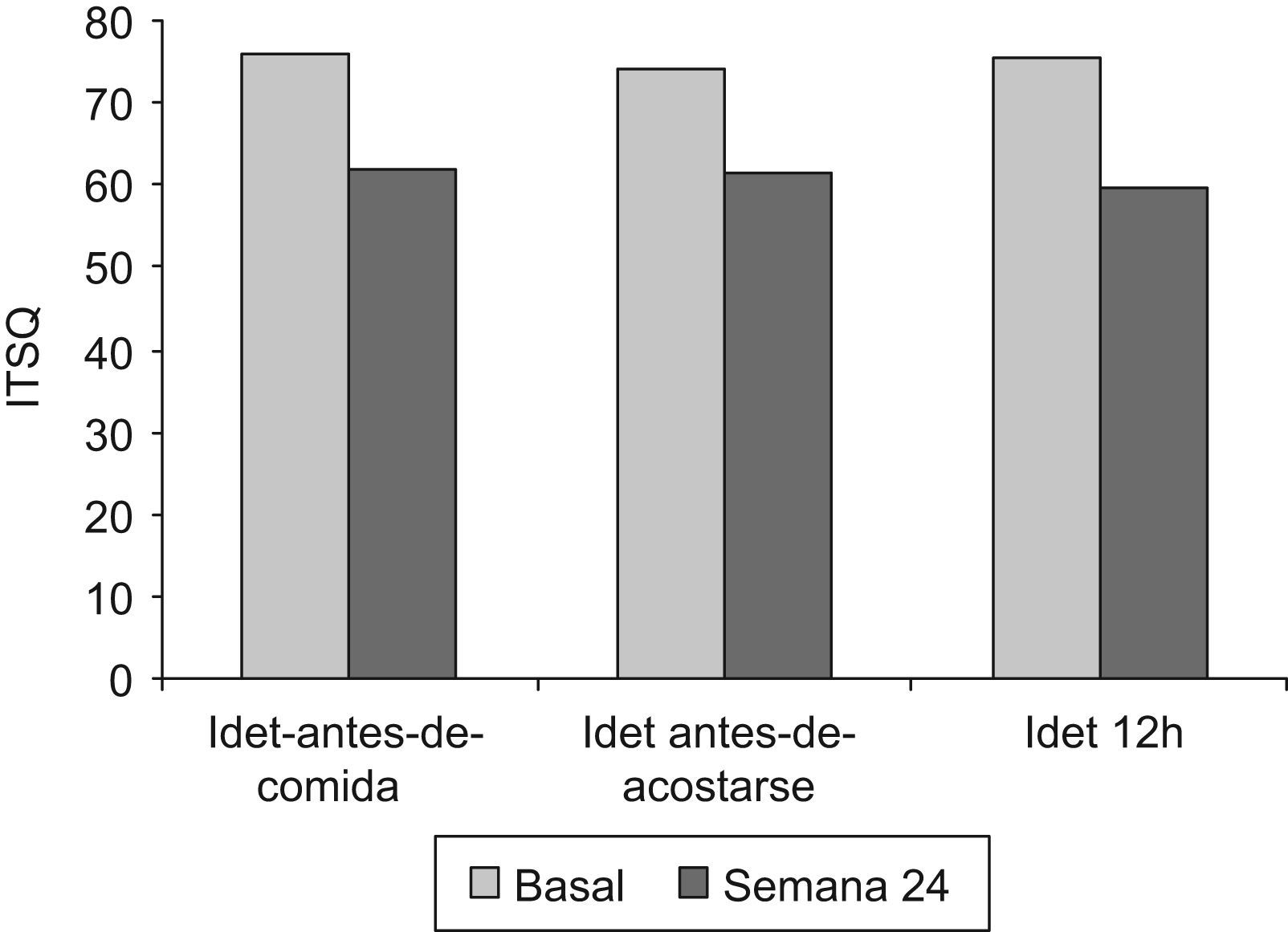
Test de calidad de vidaSe demostró una mejoría global en la calidad de vida respecto a la situación basal (75,5±3,2 vs. 60,5 el±2,9; p<0,001) (fig. 2). La diferencia se correspondió con el apartado de «Vida cotidiana y tratamiento con insulina» (61,0±2,7 vs. 45,0 el±2,4; p<0,001). No hubo diferencias entre los grupos de IDet antes-de-comida e IDet antes-de-acostarse en la semana 24 (46,4±13,8 vs. 51,1 el±9,5; p=n.s.). No se encontraron diferencias en el apartado que evalúa el «Sistema de autoinyección». En el análisis secundario la mejoría se confirmó en los 3 brazos de tratamiento con detemir y no hubo diferencias entre ellos (fig. 2).
DiscusiónNuestro trabajo pretendía analizar diferentes estrategias de terapia bolo-basal utilizando IDet en pacientes con DM tipo I. En la mayoría de estudios en sujetos con diabetes tipo I, la insulina detemir ha sido administrada 2 veces al día, utilizando diferentes regímenes como su administración antes del desayuno y de acostarse o en intervalos de 12h10–12,15,16. El momento óptimo para la administración de la insulina basal se ha estudiado con otros análogos largos, como glargina, sin que se observaran diferencias en eficacia o seguridad con una inyección por la mañana, en la hora del almuerzo o por la tarde17–19. La mayoría de los trabajos eran en poblaciones del norte de Europa, con unos horarios de comida diferentes a los españoles.
Solo se ha publicado un trabajo con IDet administrada en una dosis diaria antes de acostarse que se combinaba con insulina regular como insulina preprandial20. La duración del efecto de IDet sigue siendo un tema de discusión. Los estudios anteriores han demostrado que depende de la dosis administrada y que puede exceder de las 20h en los sujetos que requieren más de 0,4UI/kg/día9. Un estudio reciente ha confirmado este efecto dosis-dependiente comparando la IDet con glargina en 27 sujetos con DM tipo II, con un estudio hecho del perfil farmacocinético de ambas insulinas. El efecto fue similar para glargina y detemir cuando las dosis usadas estaban entre 0,4–0,8UI/kg/día, dosis usadas generalmente para los pacientes con DM tipo I. Solamente con dosis más altas se ha demostrado la mayor duración del efecto de la insulina glargina21. Sin embargo, otro estudio en pacientes con DM tipo I, también comparando detemir con glargina, demuestra la duración más corta de detemir y confirma nuestros resultados con un régimen de 2 inyecciones al día en 21 de 39 pacientes22.
Este estudio tiene algunas limitaciones: el número pequeño de pacientes no permite encontrar diferencias significativas y, siguiendo el objetivo de tratamiento, la mayoría de los pacientes requirió 2 inyecciones de detemir. La inclusión de la administración de 2 inyecciones de detemir al día requiere un análisis secundario post hoc y no puede proporcionar conclusiones definitivas. Sin embargo, nuestros resultados también indican que es posible mantener una sola dosis en algunos pacientes con diabetes tipo 1, especialmente cuando se administra antes de la comida. Por esta razón es necesario adaptar las comidas, particularmente el desayuno, y el uso de insulina rápida antes de esta comida para mantener la glucemia durante la mañana. En la cultura española, con clara diferencia de los hábitos europeos norteños, la comida se realiza generalmente después de las 14:00h y representa generalmente un aporte considerable de carbohidratos mientras que, por otra parte, el desayuno es generalmente bajo en carbohidratos y la primera ingesta notable de carbohidratos es generalmente con una toma después de las 9:00h. La administración de un análogo rápido de insulina con esa toma de comida puede mantener la normoglucemia hasta la hora de comer, substituyendo o consolidando la acción de detemir. Además, la cena se realiza a menudo cerca del suplemento de antes de acostarse (21:30–22:00 y 23:00h, respectivamente, basadas en un examen de nuestra muestra) y esto significa que la IDet administrada a esta hora tiene que cubrir prácticamente 24h. La necesidad de cubrir un período de tiempo más largo justificaría el hecho de que la mayor parte de los pacientes de este grupo han necesitado la administración de detemir 2 veces al día. En nuestro estudio, sin embargo, la mayor parte de los pacientes han terminado con la administración de 2 dosis diarias de IDet con el objetivo de alcanzar niveles más constantes de insulinemia10.
La IDet ha demostrado ser eficaz en la mejoría del control glucémico en sujetos con DM tipo I, al ser comparada con NPH14. Nuestro estudio no fue diseñado para demostrar diferencias entre la terapia bolo-basal empleada y la pauta de 3 dosis de insulina premezclada, si bien se objetivó una clara mejoría de control glucémico con la combinación detemir-aspártica. El mejor control se consiguió en el grupo que recibió detemir antes de la comida, lo que demuestra que la administración en este momento del día, en aquellos sujetos que no precisen 2 dosis, puede ser eficaz en nuestro medio.
En cuanto al perfil glucémico se consiguió una menor glucemia basal con la pauta de detemir antes de acostarse, si bien este dato aislado es insuficiente para considerar el control global, especialmente por el escaso número de sujetos que finalizaron en este grupo de tratamiento.
La modificación de la terapia con insulina y la mejoría de control glucémico no se acompañó de modificaciones en el peso. La IDet ha demostrado una menor ganancia de peso con respecto a otras insulinas basales, especialmente NPH23. La razón de estas diferencias no está aclarada todavía.
La terapia bolo-basal con detemir proporcionó una mejoría en la calidad de vida percibida respecto al tratamiento previo con insulina premezclada. Algunos estudios ya han demostrado mejorías en la calidad de vida con el empleo de detemir como insulina basal24, si bien la mayoría de tratamientos con insulina que mejoran el control glucémico se asocian a una mejor calidad de vida percibida25–27. Solamente en el grupo de IDet antes de acostarse no hubo diferencias estadísticamente significativas, probablemente por el bajo número de sujetos que terminó en este grupo. En general, la administración de 2 dosis al día de detemir fue bien aceptada por los pacientes, y su calidad de vida no se vio deteriorada.
Aunque no se alcanzaron diferencias estadísticas en los episodios hipoglucémicos, probablemente por las diferencias en el número de sujetos por grupo, se produjeron menos hipoglucemias en el grupo de detemir antes de la comida. Los 2 pacientes que abandonaron el estudio por episodios de hipoglucemias graves y el paciente con miedo a las hipoglucemias eran del grupo IDet antes de acostarse. Trabajos previos han comparado detemir con NPH, con una evidente reducción de las hipoglucemias, especialmente nocturnas15,16,28, y con insulina glargina, no existiendo diferencias en la incidencia de hipoglucemia con respecto a esta última29. Son necesarios estudios que aporten nuevos datos en este apartado.
En conclusión, nuestro estudio demuestra la eficacia, seguridad y mejoría en la calidad de vida, de diferentes estrategias de tratamiento con insulina bolo-basal utilizando IDet. Según los resultados de este estudio, en nuestro medio debería recomendarse iniciar la terapia con IDet en DM tipo I utilizando una dosis diaria antes de la comida, dado que se ha demostrado un mejor control metabólico global, con un índice de hipoglucemias bajo. No obstante, sería aconsejable un control cuidadoso del paciente, puesto que existe la posibilidad de que al tercer mes no se alcancen los objetivos y deba pasar a 2 dosis de detemir. Si bien la pauta de 2 dosis diarias parece ser la más frecuentemente empleada, debieran realizarse estudios con una administración diaria de IDet que aporten nuevas evidencias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.