La orbitopatía tiroidea es el síntoma no tiroideo más prevalente en el síndrome de Graves. Presenta una alta incidencia, afectando especialmente a mujeres jóvenes. Existe una clara relación causal con el tabaco, que se halla implicado tanto en su desarrollo como en su evolución y en la respuesta a los diferentes tratamientos. Se trata de un proceso autoinmune que suele evolucionar de manera benigna e independiente del hipertiroidismo, aunque cuando es grave y progresiva representa un gran reto terapéutico. Su evaluación clínica presenta grandes dificultades al no existir una escala de valoración realmente objetiva y representativa de la actividad de la enfermedad. En esta línea pueden ser útiles nuevos marcadores moleculares o de inflamación. En la presente revisión se describen nuevos hallazgos sobre su fisiopatología, así como las diferentes técnicas utilizadas para su tratamiento a lo largo del tiempo. La discusión se centra especialemente en el papel inmunomodulador de la radioterapia, así como en su papel junto con los corticoides.
Thyroid orbitopathy is the most prevalent non-thyroid symptom in Graves’ syndrome. It has a high incidence and particularly affects young women. Smoking is clearly involved in its development and progress, and in its response to different treatments. This autoimmune condition usually has a benign course, independent from hyperthyroidism, but its severe, progressive forms represent a major therapeutic challenge. Clinical evaluation poses great difficulties, as there is no truly objective rating scale representing disease activity. New molecular or inflammation markers may prove to be useful in this regard. This review reports new findings about its pathophysiology and the different techniques used for treatment over time. Discussion particularly focuses on the immunomodulatory role of radiotherapy, as well as on its role together with corticosteroids.
El síndrome de Graves o Basedow se caracteriza por la tríada clásica de hipertiroidismo con bocio difuso, orbitopatía y dermopatía. Los síntomas pueden aparecer en conjunto a lo largo de la enfermedad o de manera aislada e independiente entre sí.
Se estima una incidencia de afectación orbitaria de entre un 25 a un 50% de los pacientes afectos de síndrome de Graves. Esta afectación puede ir desde manifestaciones leves a síntomas mayores. Únicamente un 5% de los pacientes con orbitopatía tiroidea (OT) requerirá por ello un tratamiento más agresivo, como glucocorticoides o radioterapia. La existencia de algún grado de orbitopatía en el síndrome de Graves corresponde a una incidencia en la población general de unas 16 mujeres y 3 hombres por cada 100.000 habitantes, con una relación mujeres:hombres de 5:11,2. Suele iniciarse entre la tercera y cuarta décadas de vida. Su presentación clínica puede ser más severa en ancianos y en hombres, y más leve en asiáticos2,3.
Existe una clara relación con el hábito tabáquico, tanto en su génesis y su evolución como en la respuesta a los tratamientos y en su reactivación tras los mismos4–6. Esta relación se sugirió desde la primera descripción de la OT, y es algo mayor en mujeres. El nexo entre tabaquismo y orbitopatía podría deberse a la hipoxia tisular, la modulación mediada por citocinas y la acentuación en la expresión de HLA-DR por parte de los fibroblastos. Dejar de fumar es uno de los pilares básicos del tratamiento de esta enfermedad7.
Los factores genéticos desempeñan un papel esencial; se detecta un aumento en la frecuencia de los haplotipos HLA B8, DRw3, Bw36, Bw46 y el polimorfismo de un solo nucleótido (PSN) rs179247, lo que señala una clara predisposición familiar8.
La OT puede afectar de manera uni o bilateral, siendo esta última su presentación más frecuente, aunque la gravedad con la que afecta a cada órbita puede ser independiente. Su manifestación clínica es gradual y suele existir correlación débil con la disfunción tiroidea y su tiempo de evolución. Un 80-90% de los pacientes presentan hipertiroidismo durante su comienzo2. Su evolución como resultado del tratamiento tiroideo puede ser la mejoría en un 50-64% de los afectos, o la estabilización en el 22-33%9,10. Aunque las manifestaciones oculares se acompañen de tirotoxicosis, debe descartarse la posibilidad de enfermedades intraorbitarias o intracraneales. Por ello se debe realizar el diagnóstico diferencial con la trombosis del seno cavernoso, el meningioma del ala esfenoidal, los tumores retrobulbares e intracraneales (incluido linfomas orbitarios), la enfermedad inflamatoria orbitaria idiopática o pseudotumor ocular, la hiperplasia linfoidea, la uremia, la hipertensión maligna, el alcoholismo crónico, la enfermedad pulmonar obstructiva crónica, la obstrucción mediastínica alta, la fístula carótido-cavernosa y el síndrome de Cushing.
En caso de dudas sobre su etiología, la detección de títulos significativos de inmunoglobulinas estimuladoras del tiroides, inmunoglobulinas inhibidoras de la unión de TSH, anticuerpos antiperoxidasa, la estimulación anómala con hormona liberadora de tirotropina o las pruebas de supresión tiroidea sugieren que el origen sea una OT. Se debe resaltar que existen pacientes eutiroideos e incluso hipotiroideos con OT que no presentan alteraciones de estos indicadores2.
La orbitopatía, cuando es grave y progresiva, representa el elemento más difícil de tratar de la OT. La mayor parte de las veces este trastorno sigue una evolución benigna e independiente del hipertiroidismo, e incluso en los casos moderados-severos puede autolimitarse con el tiempo, persistiendo únicamente cierto grado de exoftalmos y oftalmoplejía2,9. A hora de tomar decisiones terapéuticas se debe tener en consideración que el mayor pico de actividad se registra entre los 13 y 24 meses tras su inicio; posteriormente la mayoría de pacientes (hasta un 80-90%) pueden mejorar o permanecer estables11. Por otro lado, hasta un 5% puede presentar reactivación tardía2.
No se ha confirmado que la ablación completa del tiroides mediante cirugía o terapia metabólica con iodo-131 resulten más beneficiosos para la enfermedad oftálmica respecto al uso de fármacos antitiroideos; sin embargo, existe consenso en cuanto a la necesidad de controlar adecuadamente la función tiroidea7,12.
FisiopatologíaRecientemente se han descrito importantes avances en el conocimiento de la fisiopatología de esta enfermedad. En este sentido se producen 2 procesos de interés: el desarrollo de linfocitos T reactivos frente al receptor de la tirotropina (TSH-R) y el establecimiento de una compleja red de interacciones celulares mediadas por citocinas, donde participan multitud de células del sistema inmunitario.
Inicialmente existiría un fallo en el control inmunológico que permitiría el desarrollo de autoinmunidad contra el TSH-R. Al respecto se ha encontrado un PSN, el rs179247 en el intrón 1 del gen del TSH-R8. Cuando se produce en el timo la inducción de tolerancia mediante la eliminación de todos los linfocitos T reactivos contra antígenos propios (el 95% de todos los linfocitos T), entre ellos el TSH-R, la presencia de dicho polimorfismo induce una baja expresión del TSH-R que impide su correcto reconocimiento antigénico y la consiguiente supresión de la población linfocitaria que lo reconoce. Sin embargo, esos mismos linfocitos podrán reconocer el TSH-R más adelante, cuando circulen a nivel sistémico8.
El proceso inmunológico se continuaría con la internalización del TSH-R y su degradación por parte de células presentadoras de antígenos. Estas presentarían los péptidos resultantes, junto con el complejo mayor de histocompatibilidad de clase ii (CMHII), a los linfocitos T colaboradores (LTC), que se activarían interaccionando con células B autorreactivas. Los LTC segregarían interleucina 2 (IL2) e interferón gamma (IFγ). Estas citocinas inducirían la diferenciación de las células B en células plasmáticas, que a su vez producirían anticuerpos anti-TSH-R (Ac anti-TSH-R). En el tiroides estos anticuerpos estimulan los TSH-R en las células foliculoepiteliales, generando hiperplasia y producción de hormonas tiroideas, triyodotironina (T3) y tiroxina (T4).
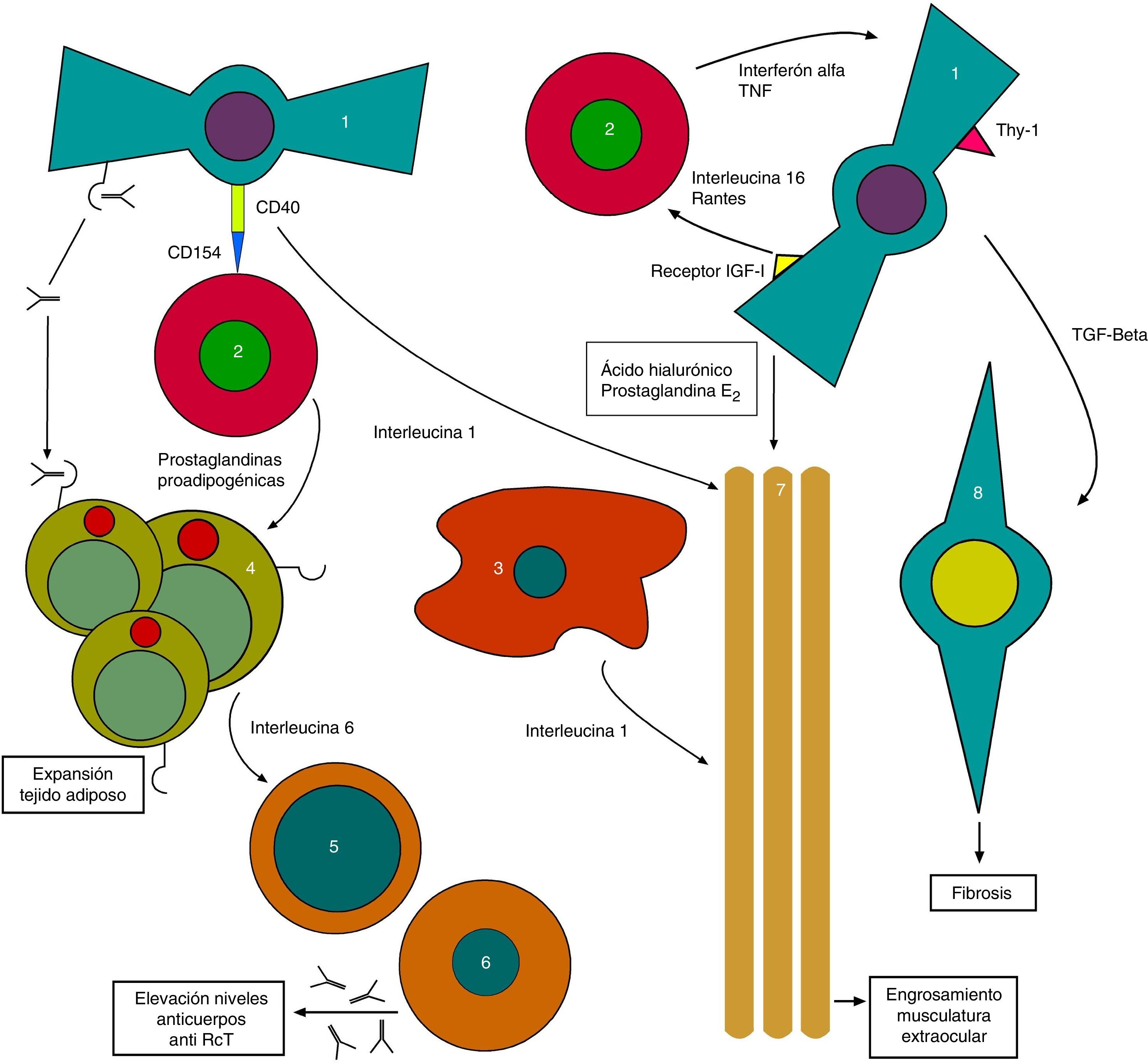
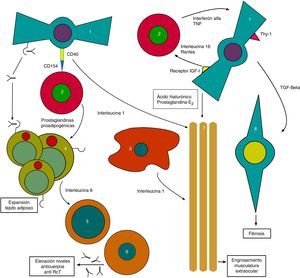
Por otra parte, los Ac anti-TSH-R también actúan sobre los TSH-R existentes en los fibroblastos orbitarios, que juntamente con las sustancias liberadas por los LTC inician los cambios tisulares característicos de la OT con expansión de los tejidos orbitarios13 (fig. 1).
El proceso continúa con la estimulación por los Ac anti-TSH-R de unos fibroblastos denominados preadipocitos, que se diferencian en adipocitos con una elevada expresión de TSH-R. Entretanto, otros fibroblastos portadores del antígeno Thy1 (FPA-Thy1) son estimulados por las citocinas TNF (factor de necrosis tumoral) e IFγ, e incrementan su producción de ácido hialurónico que liberan al entorno.
Además, el receptor de factor de crecimiento similar a la insulina 1 (IGF1-R) expresado en fibroblastos orbitarios también se estimula, con producción de IL16 y regulated upon activation normal T-cell expressed and secreted (RANTES), que a su vez estimulan el reclutamiento de LTC y otras células mononucleares en la órbita, contribuyendo a retroalimentar dicho escenario, además de promover la adipogénesis orbitaria presente en la orbitopatía14.
También existen interconexiones directas entre los LTC y los fibroblastos que generan una producción conjunta de IL1. La IL1 es además liberada por macrófagos, que junto a TNF e IFγ liberados por los LTC generan nueva estimulación de los fibroblastos, que a su vez liberan ácido hialurónico y prostaglandina E2 (PGE2). El ácido hialurónico, de carácter altamente hidrofílico, se acumulará en el espacio orbitario alrededor de la musculatura extraocular y entre los adipocitos. Todo ello genera un ensanchamiento de los tejidos orbitarios.
El círculo continúa retroactivándose al producir los LTC prostaglandinas proadipogénicas que estimulan a los preadipocitos, contribuyendo al exoftalmos por ocupación de volumen.
Los adipocitos también participan generando, junto a los fibroblastos, IL6 que a su vez hace madurar a las células B incrementando su producción de Ac anti-TSH-R. Por último, los fibroblastos también producirán factor beta transformante del crecimiento (TGF-β), que estimula tanto la producción de ácido hialurónico como la transformación de los FPA-Thy1 en miofibroblastos, que participarán en el desarrollo de la fibrosis, en especial en etapas avanzadas de la enfermedad15.
Como vemos se ha avanzado en el conocimiento de la compleja red de señales autocrinas y paracrinas que comunican las diferentes células implicadas (fig. 2).
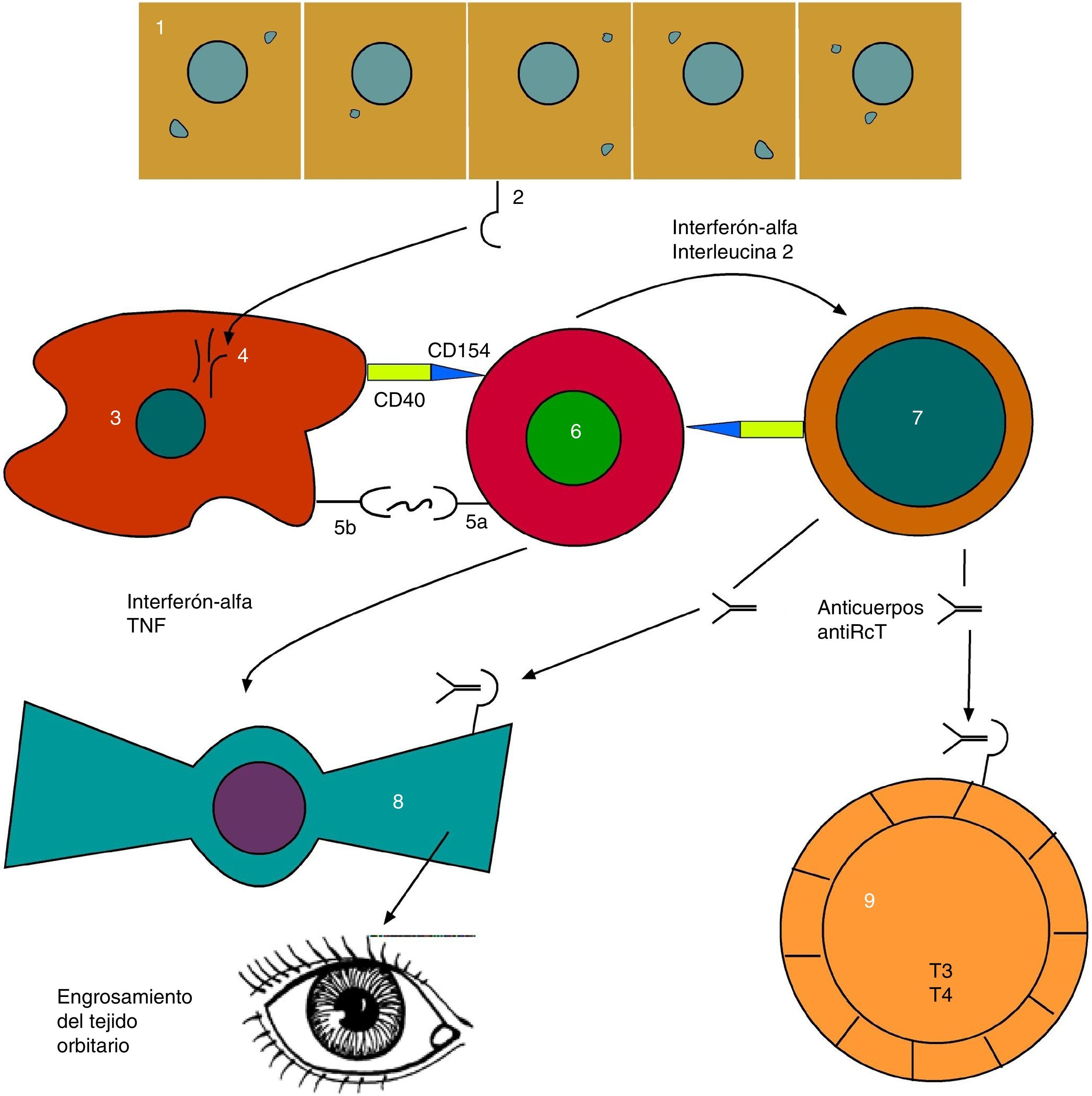
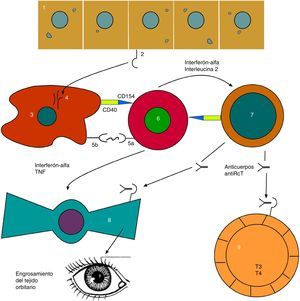
Mecanismo fisiopatológico evolucionado de la orbitopatía tiroidea
1: célula endotelial folicular tiroidea; 2: receptor tirotropina (RcT); 3: célula presentadora de antígeno; 4: péptidos de degradación del RcT; 5a: receptor linfocito T; 5b: CMH clase ii; 6:linfocito T colaborador; 7: linfocito B; 8: fibroblasto orbitario; 9: folículo hiperplásico tiroideo.
Basada en: Bahn15
Todos ellos se desarrollan por un proceso inflamatorio/infiltrativo con fenómenos congestivos:
Signos- ∘
Retracción palpebral.
- ∘
Movimientos palpebrales lentos.
- ∘
Restricción de los movimientos oculares con limitación de la mirada superior y la insuficiencia de la convergencia.
- ∘
Hiperemia palpebral y conjuntival.
- ∘
Edema palpebral.
- ∘
Quemosis conjuntival y de carúncula.
- ∘
Proptosis/exoftalmos.
- ∘
Ptosis.
- ∘
Opacidad corneal.
- ∘
Papiledema.
- ∘
Lagoftalmos.
- ∘
Úlceras corneales.
- ∘
Déficits visuales.
- ∘
Alteraciones en la percepción del color.
- ∘
Diplopía (inicialmente intermitente).
- ∘
Visión borrosa.
- ∘
Hipersensibilidad a la luz.
- ∘
Dolor con los movimientos oculares.
- ∘
Dolor ocular o retro-ocular en reposo.
- ∘
Sensación de cambio de imagen.
Existen multitud de escalas de medición que hacen hincapié en diferentes aspectos de esta enfermedad; en muchas de ellas no se refleja adecuadamente el grado de actividad. Esta ausencia de una valoración realmente objetiva podría contribuir a la miríada de resultados dispares en los estudios publicados hasta la fecha. A todo ello se suma la gran variabilidad clínica, la tendencia a la mejoría espontánea y factores moduladores de la respuesta al tratamiento, tales como hábito tabáquico, edad, sexo, diabetes mellitus, estatus tiroideo, tratamientos previos o enfermedades de larga evolución11.
Se precisan escalas de medición adecuadas y consensuadas para una correcta interpretación de la efectividad de los tratamientos. En la actualidad carecemos de métodos de valoración realmente objetivos y reproducibles. En esta línea, los nuevos marcadores biológicos o de inflamación, e incluso la utilización de la resonancia magnética nuclear, pueden ayudar a mejorar el diagnóstico y gradación de esta enfermedad16–18.
Entre las escalas utilizadas podemos encontrar:
- •
ENOSPECS: es la más utilizada en EE. UU., dividida en clases y grados. Es subjetiva, difícil de completar y su utilización requiere una formación previa19.
- •
Clinical Activity Score (ECAS): más utilizada en España y Europa. Evalúa el dolor y los hallazgos inflamatorios en los tejidos blandos. Esta escala ha demostrado su eficacia a la hora de valorar la respuesta al tratamiento tanto corticoideo como radioterápico20. Según Gorman algunos de sus ítems (edema periorbitario, de carúncula y quemosis) son difíciles de definir porque su causa podría ser congestiva y no inflamatoria, al estar ambos procesos íntimamente relacionados1,11. A pesar de ser más objetiva sigue planteando dudas en los pacientes con grado 2-3 respecto a decisiones terapéuticas.
- •
Otras escalas de valoración: VISA, EUGOGO, OI, STI, EMR, GAG, MRI, Octreoscan21,22.
- •
Escalas de valoración de la calidad de vida23:
- ∘
Generales: MOS SF-24 y SF-36.
- ∘
Específica: GO-QoL.
- ∘
- •
En la fase inicial de la enfermedad están indicadas medidas sintomáticas tales como: lubricación ocular, protección lumínica, compresas frías, elevación del cabecero de la cama, oclusión palpebral nocturna, toxina botulínica en caso de retracción palpebral superior y prismas si existe diplopía11,24.
- •
El cese del hábito tabáquico también debe figurar en primera línea entre las acciones terapéuticas de esta enfermedad4–7.
- •
Existe consenso sobre la importancia de controlar el hipertiroidismo, ya sea mediante fármacos antitiroideos o cualquier tipo de ablación tiroidea15, aunque se ha puesto en evidencia que los fármacos antitiroideos y la tiroidectomía no modifican la evolución de la enfermedad, mientras que el tratamiento con iodo-131 puede agravar su estado25. Se recomienda el uso de baja dosis de corticoides profilácticas tras la ablación con iodo-131, sobre todo en fumadores activos, para prevenir la progresión de la OT durante la radioablación7,25,26.
- •
Durante largo tiempo se ha venido utilizando la corticoterapia para el tratamiento de la OT, con diferentes pautas y vías de administración. La finalidad es disminuir el componente inflamatorio-infiltrativo. Se ha descrito un control de síntomas hasta en un 65-85% de los casos27,28.
La vía más utilizada actualmente es la sistémica por medio de bolus intravenoso. Los fármacos utilizados son la metilprednisolona y la prednisona27–29. Se utilizan altas dosis con progresiva reducción hasta la dosis mínima eficaz y un mantenimiento prolongado. La pauta de administración más usada actualmente en Estados Unidos y Europa es metilprednisolona 500mg intravenosa semanal durante 6 semanas, seguido de 250mg intravenosa semanal por otras 6 semanas. Si tras este periodo de tiempo el paciente no ha respondido se ha de valorar el inicio de otras terapias. Dosis mayores solo han demostrado algo más de respuesta a corto plazo, asociada a una mayor toxicidad30. Antes de su administración se aconseja una adecuada selección del paciente, teniendo en cuenta sus comorbilidades, y sobre todo una adecuada valoración hepática27. En ausencia de neuropatía compresiva se aconseja no superar la dosis acumulada de 8g27,31.
Se ha observado que la administración sistémica de corticoides tiene mayor eficacia que la inyección retrobulbar32. Por otro lado, evidencias procedentes de ensayos aleatorizados y de 2 metaanálisis demuestran mayor eficacia y menor iatrogenia de los glucocorticoides en bolus intravenoso respecto a la administración de dosis altas y mantenidas por vía oral27,28,33–35.
Tras retirar la corticoterapia suelen producirse reactivaciones de la clínica orbitaria en un elevado porcentaje de pacientes30,36. En concreto, en un trabajo del Grupo europeo sobre la orbitopatía de Graves (EUGOGO) donde se estudiaban 3 diferentes pautas de dosis acumulada de metilprednisolona intravenosa para el tratamiento de la OT de moderada a grave, el porcentaje de recidiva a las 24 semanas, tras la mejoría inicial experimentada, era del 33%, 21% y 40%, respectivamente, con dosis de 7,47- 4,98 y 2,25g30 (fig. 3).
Por último, debemos tener presentes los efectos secundarios de la corticoterapia prolongada: hiperglucemia, hipertensión arterial, compromiso inmunológico, miopatía de predominio proximal, fragilidad capilar, remodelación de la distribución grasa, erupción cutánea, trastornos psiquiátricos, osteoporosis, hepatopatía, etc., incluyendo eventos fatales27,31.
- •
La descompresión quirúrgica orbitaria se debe reservar para la neuropatía óptica compresiva de rápida evolución que no responde a corticoterapia y radioterapia37. Además estará indicada en pacientes sin actividad clínica con secuelas funcionales o estéticas severas37, una vez transcurrido un plazo sensato de 6-12 meses y en situación eutiroidea24. Consiste en la extracción, mediante diferentes vías de abordaje, de parte del componente óseo orbitario para aliviar la presión intraorbitaria; las vías más utilizadas son transpalpebral y transconjuntival37,38. Respecto a la extracción exclusiva de la grasa orbitaria se ha mostrado menos efectiva, con un índice elevado de recidivas39. En fases inactivas de la enfermedad se logra una apreciable reducción del exoftalmos/proptosis. Está descrita su eficacia y seguridad en progresiones tras tratamiento médico y radioterápico, o en la resolución del estrabismo por fibrosis muscular establecida37,40. También se debe señalar que puede empeorar estrabismos previos, situación de difícil resolución.
- •
Se han utilizado otros tratamientos tales como la azatioprina y el metronidazol, sin resultados satisfactorios. También se ha empleado el sulfato de guanetidina tópica al 5-10% con escasa efectividad y efectos secundarios indeseables, en forma de queratitis punteada irritación en el área de la instilación41. Recientes estudios aleatorizados con placebo han valorado el papel del octeótrido, por su efecto inhibidor de la proliferación y activación linfocitaria, sin demostrar eficacia alguna21,42.
- •
En los últimos años, en función de un mayor conocimiento fisiopatológico, se están evaluando nuevos fármacos dirigidos a numerosas nuevas dianas terapéuticas15. Especialmente tocilizumab43 y rituximab44 han mostrado resultados prometedores.
- •
En un reciente estudio aleatorizado a doble ciego45, donde se compara un suplemento de selenio (100μg 2 veces al día) durante 6 meses con pentoxifilina (600mg 2 veces al día) y placebo (2 veces al día) en pacientes con orbitopatía leve, se pone en evidencia una mejora en la calidad de vida y la afectación ocular, así como una menor progresión de la OT en los pacientes tratados con selenio, pero no en los que recibieron pentoxifilina. Los efectos son evidentes entre los 6 y 12 meses de seguimiento. No se observaron efectos adversos con el uso de selenio, pero sí con pentoxifilina, que produjo problemas gastrointestinales. Se debe señalar que el uso prolongado de selenio determina un mayor riesgo de desarrollo de DM tipo 2 (con dosis de 200μg al día), de enfermedad vascular periférica, de mortalidad por cualquier causa y de glaucoma, así como su posible interacción con antiagregantes y anticoagulantes46,47. Por ello no debe ser utilizado más allá de 6 meses. Curiosamente, un estudio australiano demostraba una menor concentración sérica de selenio en los pacientes afectos de OT48.
La radioterapia (RT) se utiliza de manera habitual en esta enfermedad desde los años 40, con una larga experiencia en su uso. Debemos remontarnos a 1913 para encontrar el primer tratamiento publicado49, aunque no es hasta los trabajos de Donaldson en 1973, con la generalización del megavoltaje (aceleradores lineales y bombas de cobalto), cuando se establece el esquema de tratamiento radioterápico seguido hasta la actualidad en la gran mayoría de centros50. Este esquema administra una dosis total de 20Gy, en fracciones de 2Gy, 5 veces por semana (normofraccionamiento).
La indicación inicial de la radioterapia era empírica32,36,51–53. Recién en 1993 aparece el primer ensayo aleatorizado54. En la actualidad disponemos de metaanálisis que respaldan su eficacia55–58. De la revisión de la literatura se obtiene una serie de conclusiones que exponemos a continuación. Los niveles de evidencia y grados de recomendación empleados para describir su eficacia se basan en los criterios de la U.S. Preventive Services Task Force (USPSTF) actualizados en 200159.
Indicaciones de la radioterapia- 1.
La RT no tiene cabida en el tratamiento meramente estético de la OT11.
- 2.
La RT no está indicada en los casos de actividad leve.
- 3.
La RT estaría indicada para el tratamiento de la orbitopatía moderada-severa32,34,55–58.
- 4.
La neuropatía compresiva es indicación de corticoides a altas dosis y posterior RT, ya que en esta fase es muy difícil la cirugía60. Si a pesar de ello no se resuelve la compresión neural se procederá a la descompresión quirúrgica11.
- 5.
La RT también está indicada tras la descompresión quirúrgica con resolución incompleta de la clínica16.
Contraindicaciones de la RT: retinopatía previa o diabetes mal controlada61.
Eficacia- 1.
En estudios retrospectivos y metaanálisis la RT se muestra efectiva en el control de los signos inflamatorios de tejidos blandos (eritema, quemosis, edema periorbitario), con respuestas en torno a un 80%. Es asimismo efectiva en la recuperación de la pérdida de visión por causa compresiva en las fases activas de la enfermedad (41-71%). También actúa recuperando la movilidad de la musculatura extraocular afecta (61%). Finalmente, las remisiones de la proptosis son poco frecuentes (23-51% de los pacientes), con respuestas de escasos milímetros y repercusión estética mínima o dudosa6,36,52,53,55,57,58,62–65. Nivel evidencia i, grado recomendación B.
- 2.
En un importante estudio retrospectivo se observó que con el uso conjunto de corticoterapia y RT se obtenía una disminución importante del riesgo de desarrollo de neuropatía óptica frente al uso único de corticoterapia62. Recientes metaanálisis también avalan dicha eficacia55,57. Nivel evidencia i, grado recomendación B.
- 3.
Existen al menos 5 revisiones sistemáticas sobre la eficacia de la RT en el tratamiento de la OT, incluyendo una revisión de la colaboración Cochrane55–58. Cabe señalar que muchos de los estudios aleatorizados adolecen de una serie de sesgos metodológicos que restan potencia a la hora de poder emitir conclusiones inequívocas tras dichas revisiones. La propia evolución de la enfermedad, los criterios de selección de los pacientes, la medición de diferentes objetivos más centrados en escalas de valoración de la actividad y no tanto en la calidad de vida, etc., dificultan la realización de estas revisiones y la obtención de claras recomendaciones. En general de todas ellas se obtienen las siguientes conclusiones sobre su eficacia:
- •
Mayor eficacia con RT 20Gy más glucocorticoides frente a solo glucocorticoides.
- •
Mayor eficacia con RT 20Gy frente a RT simulada.
- •
Mayor eficacia con RT 20Gy más glucocorticoides intravenosos frente a RT 20Gy más glucocorticoides orales.
- •
No existen diferencias entre RT 20Gy frente a solo glucocorticoides.
- •
No existe evidencia de que RT más glucocorticoides endovenosos sea más eficaz que solo glucocorticoides endovenosos.
- •
Finalmente, no se observan diferencias en cuanto a la calidad de vida, presión intraocular o costes con RT respecto a corticoterapia. Nivel evidencia i, grado recomendación B.
- •
- 4.
Según series publicadas, tras finalizar la RT concurrente con la corticoterapia es posible la retirada completa y muchas veces indefinida de la corticoterapia en un alto porcentaje de pacientes (entre un 71% a un 90%)51–53. Nivel evidencia ii-iii, grado recomendación B.
- 5.
Se estima una necesidad de alrededor del 20% de cirugía descompresiva de rescate tras la RT con o sin corticoterapia, asociada en gran medida a la persistencia del hábito tabáquico6,37. Nivel evidencia iii, grado recomendación B.
- 6.
Cuanto más instaurado está el proceso inflamatorio-fibrótico y más desarrollada está la orbitopatía, menor es la eficacia de la RT11,57,58. Nivel evidencia i, grado recomendación B.
- 7.
La mejoría tras la RT a veces se presenta transcurrido un tiempo (>6 meses)50. Nivel evidencia ii-iii, grado recomendación B.
- 8.
Finalmente, la reirradiación presenta unas buenas tasas de respuesta a pesar de la resistencia inicial, o tras la recidiva de los síntomas, aparentemente sin incremento de la morbilidad53. Nivel evidencia ii-iii, grado recomendación B.
No se encuentran diferencias en cuanto a tratar con 20 o 30Gy fraccionado a 2Gy/sesión en estudios retrospectivos51. Solo existen 2 trabajos aleatorizados que comparan dosis total (DT). Uno de ellos compara 2,4 frente a 16Gy a 0,3 y 2Gy/sesión respectivamente, sin encontrar diferencias significativas entre ambos fraccionamientos66. El otro compara 3 ramas de 20Gy (1Gy/semanal), 10Gy (1Gy/día) y 20Gy (2Gy/día), los 2 últimos en 2 semanas. La primera rama obtiene una mejoría estadísticamente significativa en relación con las otras 2 en cuanto a los síntomas oculares, la hendidura palpebral, la presión intraocular, la proptosis, la agudeza visual, la movilidad ocular, el engrosamiento muscular y en los parámetros de la escala NOSPECS. Asimismo, se objetivó una menor toxicidad radioinducida y un mayor grado de satisfacción de los pacientes con el primer esquema terapéutico60. Sin embargo, a pesar de tratarse de un estudio bien balanceado, adolece de tener una muestra pequeña. Por último, según un reciente metaanálisis no existen diferencias entre RT 20Gy y otros esquemas de RT55.
Efectos secundariosNo se han descrito complicaciones graves con la RT, excepto alteraciones visuales o ceguera en el contexto de retinopatía diabética previa, por lo que este tratamiento está contraindicado si existe retinopatía previa o diabetes mal controlada61. El efecto secundario principal más frecuente son las cataratas, aunque esta alteración también puede ser debida al tratamiento previo con altas dosis de corticoides6,63.
En algunos pacientes se produce alopecia de la cola de las cejas por la entrada de los campos de irradiación, con recuperación posterior completa. En un porcentaje mínimo se puede producir cierta sequedad ocular6,53,63.
En seguimientos prolongados no se ha observado un gran número de segundos tumores radioinducidos1,67. Se ha descrito algún caso excepcional de carcinoma basal pigmentado68. El riesgo teórico calculado tras la irradiación retrobulbar con 20Gy es de 0,3 a 1,2%69. De ahí que algunos autores aboguen por no tratar a pacientes jóvenes (<35años)24.
Se recomienda un seguimiento mínimo de 3 años tras finalizar la RT, aunque existen series controladas a más largo plazo sin mostrar toxicidad relevante6,36,53,61,63,67. Es frecuente que se requiera corrección quirúrgica de la diplopía, desarrollada tras la radioterapia debido a los efectos sobre la musculatura o los párpados de la misma enfermedad y del tratamiento24,37,53. Dicha cirugía suele ser próxima a la finalización de la RT. Por ello se precisa de un enfoque multidisciplinar de esta compleja entidad, que tenga muy en cuenta a todos los especialistas implicados.
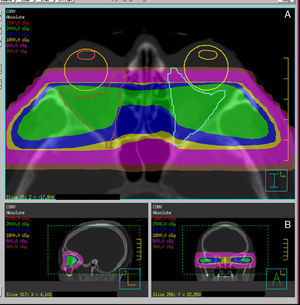
Técnica de la radioterapiaLa técnica habitual de irradiación se realiza normalmente con fotones de alta energía (4-6MV). Se inmoviliza al paciente mediante una máscara termoplástica, procediendo a marcar los puntos de referencia de los láseres en la máscara para permitir la reproducción de la colocación durante las sesiones de tratamiento.
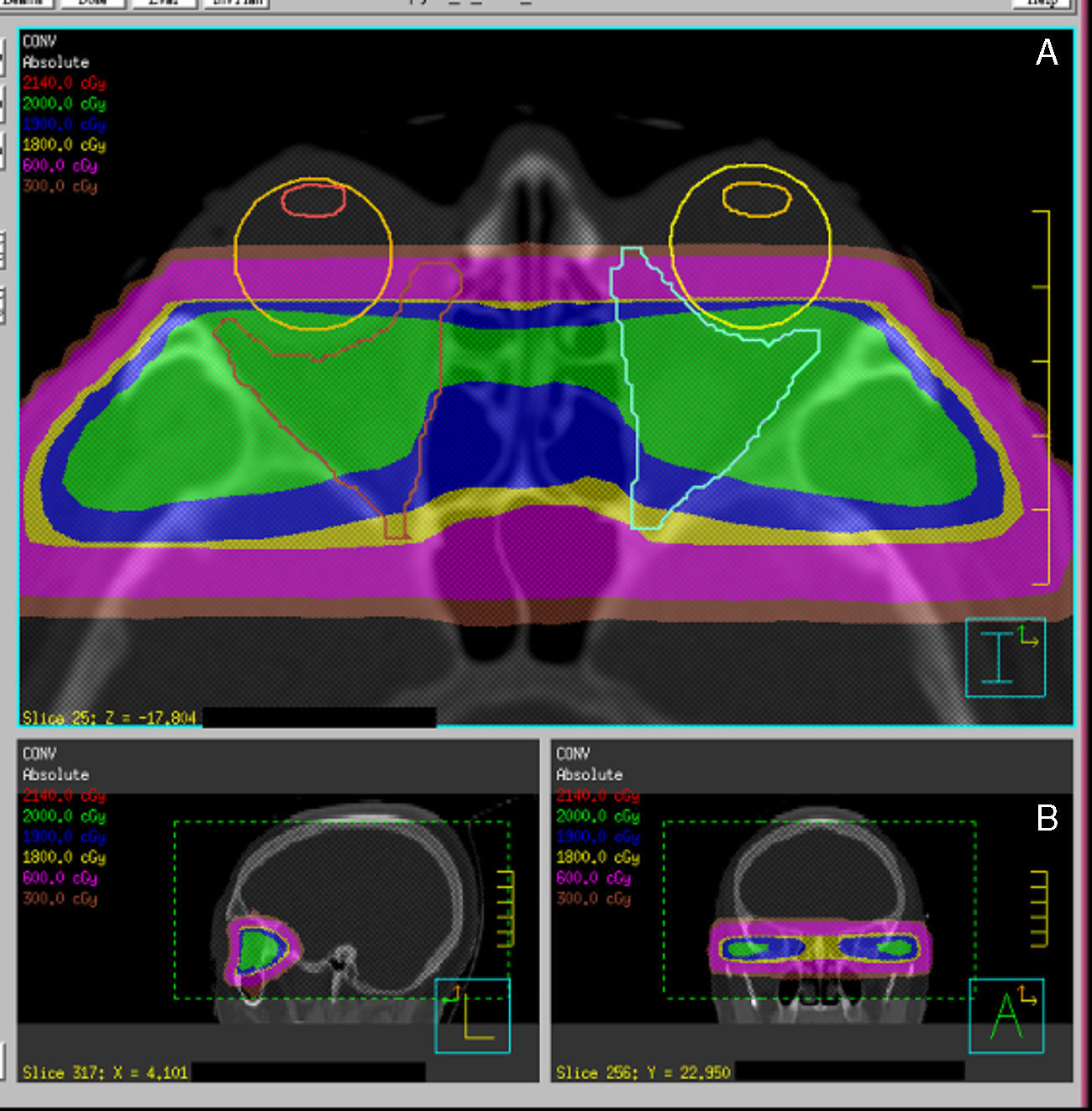
Hoy en día también disponemos de técnicas de localización y administración de la radiación más precisas y conformadas. Existen diferentes sistemas de RT, desde RT estereotáxica fraccionada a radioterapia guiada por la imagen, pasando por la RT de intensidad modulada y una evolución de esta última, el tratamiento volumétrico de arco modulado). Son sistemas tanto de localización y administración como de cálculo de dosis, que permiten la mejora de la conformación del volumen diana, preservando los órganos de riesgo, en este caso los párpados, el cristalino, la retina y la hipófisis (fig. 4)
En conclusión, la RT, con o sin glucocorticoides, produce una mejora significativa en la OT de moderada a severa, en cuanto al grado de diplopía, agudeza visual, neuropatía óptica, engrosamiento palpebral y motilidad ocular, aunque su eficacia es mayor con el uso conjunto de corticoides. Por otro lado, no ha mostrado ventajas frente a otras alternativas terapéuticas en cuanto a costes, disminución de la presión intraocular o calidad de vida55–58. Nivel evidencia i, grado recomendación B.
DiscusiónConsiderando los resultados contradictorios de las diferentes publicaciones en relación con la eficacia de los distintos tratamientos utilizados, cabría discutir si las muestras estudiadas son representativas de los pacientes con la actividad requerida para que las medidas inmunosupresoras resultaran efectivas. Se debe señalar que tanto la corticoterapia como la RT y los nuevos enfoques terapéuticos basan su actuación en una acción inmunomoduladora. Además, el uso conjunto de corticoides y RT muestra una ventaja añadida, ya que los corticoides controlan la inflamación propia de la enfermedad y también el edema radioinducido por la RT normofraccionada11,65. De todas maneras, si se utilizaran dosis bajas de radiación (≤1Gy/sesión) de manera reiterada podría evitarse la corticoterapia conjunta. Se ha observado que dichas dosis son suficientes para aliviar-controlar los síntomas inflamatorios al inhibir la vía del óxido nítrico presente en dichos procesos. Esta vía resultaría activada por las fracciones habituales de 2Gy/sesión, y sería la causa del edema radioinducido60,70. En diversas instituciones se han utilizado esquemas con menores dosis por sesión y una prolongación del tiempo total de tratamiento, con gran eficacia en el control clínico y menor toxicidad respecto al normofraccionamiento66,71,72.
Teniendo en cuenta todo lo expuesto podemos resumir que los pacientes con orbitopatía en fase activa (moderada o severa) y de corta evolución son los sujetos que pueden beneficiarse realmente de la irradiación55,60,64. La RT puede ser utilizada tanto en primera línea asociada o no a corticoides como tras fallo, rechazo o intolerancia de la corticoterapia endovenosa. Disponemos de suficiente evidencia para su utilización frente a otras alternativas, con similares o menores costes e igual calidad de vida. Los efectos secundarios derivados de la radioterapia son locales y de intensidad leve a moderada, sin eventos fatales relacionados con su uso. Los tumores radioinducidos descritos son excepcionales, y los pocos casos reportados de desarrollo de retinopatía o neuropatía óptica suelen estar relacionados con una diabetes previa mal controlada, o con fenómenos compresivos secundarios al aumento de la presión intraorbitaria. Aun así, es necesario un control estrecho y prolongado de estos pacientes.
Por otro lado, no existe un método fiable para medir la actividad de la enfermedad y todos los intentos de cuantificación parecen aportar más confusión, sobre todo si se tienen en cuenta las diferencias interobservador. Es por ello que el uso de nuevos marcadores moleculares o de inflamación, y de la resonancia magnética podrían representar un progreso en este aspecto.
Otra cuestión es el momento adecuado para practicar el tratamiento, ya que en pacientes con una larga evolución, sin actividad inflamatoria y con fenómenos fibróticos instaurados no se conseguirán resultados satisfactorios. Ante la complejidad de esta enfermedad es altamente recomendable un enfoque multidisciplinar de todos los especialistas implicados, que asegurará una mejor calidad asistencial.
Por último, las expectativas del paciente y del profesional pueden diferir. Es por eso que la valoración de la calidad de vida debe constituir una herramienta cotidiana en el manejo clínico de estos pacientes. De este modo obtendremos realmente información objetiva respecto a la eficacia de nuestros tratamientos sobre los síntomas de la enfermedad, y no solamente sobre sus signos. Falta por tanto describir unos parámetros más objetivos, verdaderamente fiables de la actividad de la orbitopatía, que permitan indicar correctamente cualquier tratamiento inmunosupresor, incluida la RT. Solo entonces podremos decidir si el tratamiento es efectivo y, considerando globalmente todos los aspectos, si está justificado practicarlo.
ConclusionesLas conclusiones que se pueden extraer sobre el manejo de esta enfermedad tras la revisión efectuada son las siguientes:
- •
Son necesarias nuevas pruebas diagnósticas consensuadas, que realmente reflejen la actividad de la enfermedad.
- •
En las etapas precoces y leves de la enfermedad solo están indicadas las medidas sintomáticas y suplementos de selenio.
- •
El abandono del hábito tabáquico es fundamental en el control de la orbitopatía.
- •
El control de la función tiroidea es otro aspecto de gran importancia en el que coinciden la mayoría de especialistas.
- •
La corticoterapia y la radioterapia están indicadas, asociadas o no, cuando existe actividad moderada a severa.
- •
La descompresión quirúrgica estaría indicada ante una neuropatía óptica resistente a la córtico-RT, o ante la ausencia de actividad, para la descompresión orbitaria.
- •
La cirugía reparadora puede además ser necesaria para la resolución del estrabismo y afectaciones palpebrales incapacitantes. Además puede estar indicada para actuaciones estéticas.
- •
Dado lo complejo de esta enfermedad, es altamente recomendable el abordaje multidisciplinar.
- •
La valoración de la calidad de vida debería ser incluida como una herramienta habitual, tanto en los ensayos como en el manejo clínico de la orbitopatía tiroidea.
Declaramos no presentar ningún conflicto de intereses.
A María Ángeles Torres Berruezo por la inestimable ayuda en la confección de las figuras ilustrativas del proceso inmunológico.