Evaluar si los niveles de ALT, como marcador de esteatosis hepática no alcohólica, pueden determinar la respuesta hipoglucemiante al tratamiento con agonistas del receptor GLP-1 (AR-GLP1).
Pacientes y métodosEstudio analítico longitudinal retrospectivo. Se incluyeron pacientes con diabetes tipo2 (DM2) tratados sin interrupción con AR-GLP1 (85% liraglutida) durante un año. Se clasificó a los pacientes en 2 grupos según niveles iniciales de ALT, con punto de corte en la mediana (24U/l). La variable dependiente fue el cambio (final-inicial) de HbA1c.
El valor predictivo de niveles de ALT>24U/l y del cambio en ALT fue analizado con regresión lineal multivariante ajustada para edad, género, evolución de DM2, tipo y dosis de AR-GLP1, niveles iniciales de HbA1c, índice de masa corporal (IMC) y cambio de IMC.
ResultadosSe incluyeron 117 pacientes (48% mujeres) con edad media de 58,6 (DE 9,6) años. El tratamiento estuvo asociado con un cambio en ALT de −4,3U/l (p=0,041) y un cambio en HbA1c de −1,1% (p<0,0001). Tanto el descenso de HbA1c (−1,41% vs −0,76%; p=0,045) como el de ALT (−9,25 vs 0,46U/l; p=0,002) fueron significativamente más marcados en pacientes con ALT por encima de la mediana. En análisis multivariante tanto niveles de ALT>24U/l (b=−0,74; IC95%: −1,31 a −0,18; p=0,011) como el cambio en ALT (b=0,028; IC 95%: 0,010 a 0,046; p=0,003) fueron factores predictivos de respuesta.
ConclusionesNiveles elevados de transaminasas y su descenso se asocian a una respuesta hipoglucemiante favorable a AR-GLP1.
This study aimed to assess if ALT levels, as a marker of non-alcoholic fatty liver disease, may predict HbA1c response to treatment with GLP-1 receptor agonists (GLP-1 RAs).
Patients and methodsA retrospective, longitudinal, analytical study was conducted including patients with type2 diabetes mellitus continuously treated with GLP-1 agonists (85% with liraglutide) for one year. Patients were divided into two groups according to baseline ALT levels, with 24U/L (the median of the distribution) as the cut-off point. The dependent variable was HbA1c change (one-year follow-up minus baseline).
The predictive value of ALT levels above 24 U/L and ALT change was analyzed using multivariate linear regression adjusted to age, gender, diabetes duration, type and dose of GLP-1 RA, baseline HbA1c, baseline body mass index (BMI), and change in BMI.
ResultsA total of 117 patients (48% females) aged 58.6 (SD 9.6) years were enrolled into the study. Treatment was associated with a change in ALT of −4.3U/L (p=0.041) and a change in HbA1c of −1.1% (p<0.0001). Decreases in HbA1c (−1.41% vs −0.76%; p=0.045) and ALT (−9.25 vs 0.46U/L; p=0.002) were significantly higher in patients with ALT levels above the median. In the multivariate analysis, both ALT>24U/L (b=−0.74; 95%CI: −1.31 to −0.18; p=0.011) and ALT change (b=0.028; 95%CI: 0.010 to 0.046; p=0.003), were significant response predictors.
ConclusionsElevated baseline transaminase values and decreased transaminase levels during follow-up are associated to a favorable glycemic response to GLP-1 RAs.
Dado que la prioridad en el tratamiento de la diabetes mellitus (DM) tipo2 (DM2) es la consecución de un buen control metabólico, lo más pronto posible y de la forma más segura posible, es necesario avanzar en el conocimiento de factores que sean capaces de predecir la respuesta del paciente individual a los fármacos actualmente disponibles1. Aunque el estudio de las interacciones farmacogenéticas puede ser una vía futura que ayude a un tratamiento personalizado2, en el momento actual tenemos que descansar en criterios clínicos para seleccionar el tratamiento concreto.
Los agonistas del receptor de GLP-1 (AR-GLP1) son ampliamente utilizados en la DM2 debido a sus múltiples efectos beneficiosos: estímulo de la secreción de insulina e inhibición de la secreción de glucagón glucosa-dependientes, enlentecimiento del vaciamiento gástrico e incremento de la saciedad3. Esto se traduce en descenso de la glucemia sin riesgo de hipoglucemia, reducción de peso corporal y mejora de los factores de riesgo cardiovascular; debido a ello, su uso es recomendado en combinación con otros antidiabéticos orales y/o insulina en las guías internacionales4.
Los metaanálisis han demostrado descensos de HbA1c de aproximadamente el 1% mediante tratamiento con AR-GLP1, aunque este es un efecto promedio sometido a una amplia variabilidad5. Por ello sería útil poder identificar parámetros que se asociasen a una respuesta favorable de los pacientes a este grupo terapéutico.
Dado que es conocido que los AR-GLP1 pueden mejorar la resistencia insulínica hepática6, nuestra hipótesis fue que la eficacia de los mismos podría estar aumentada en presencia de una esteatosis hepática no alcohólica (EHNA). Un marcador de EHNA es la alanina aminotransferasa (ALT); de hecho, incluso cifras elevadas dentro del rango de la normalidad se han asociado con el contenido de grasa intrahepática7.
Los objetivos de nuestro trabajo, mediante el estudio de una base de datos de pacientes con DM2 tratados con AR-GLP1, fueron:
- 1.
Seleccionar un modelo clínico predictivo de respuesta favorable al tratamiento con AR-GLP1.
- 2.
Evaluar si los niveles iniciales de ALT, como un marcador de EHNA, eran capaces de predecir la respuesta al tratamiento.
Estudio analítico de cohortes retrospectivo.
PacientesEn el año 2013, como parte de un proyecto liderado por la Sociedad Aragonesa de Endocrinología y Nutrición (SADEN), se inició la recogida de datos de los pacientes con DM2 a los que se indicaba desde atención especializada el inicio de un tratamiento con AR-GLP1. Este estudio garantiza el anonimato de los pacientes y es de naturaleza retrospectiva, siendo los pacientes tratados según criterio del médico responsable. En el momento actual la base cuenta con 356 pacientes. Los hospitales que han contribuido hasta el momento actual son: Hospital Miguel Servet (Zaragoza), HCU Lozano Blesa (Zaragoza), Hospital General de la Defensa (Zaragoza), Hospital comarcal de Barbastro (Huesca) y Hospital General San Jorge (Huesca).
Para el presente análisis se seleccionaron pacientes que cumplían los siguientes criterios de inclusión:
- -
Haber completado un año de tratamiento continuado con cualquier AR-GLP1.
- -
Presentar datos válidos sobre evolución de HbA1c, peso corporal y ALT.
Se excluyeron pacientes con niveles iniciales de ALT superiores a 3 veces el límite superior de la normalidad y aquellos con enfermedad hepática conocida.
Punto final clínicoEl principal punto final clínico fue el cambio de HbA1c (HbA1c final tras un año de tratamiento − HbA1c inicial).
Variables recogidasDentro de la base de datos se recogen características de los pacientes:
- -
Clínicas: edad, género, tiempo de evolución de la DM, peso y talla con cálculo del índice de masa corporal (IMC), presión arterial y presencia de complicaciones crónicas.
- -
Analíticas: HbA1c, perfil lipídico, creatinina (con cálculo del filtrado glomerular [FG] mediante la fórmula de CKD-EPI) y ALT. Los pacientes se clasificaron en 2 grupos según sus valores iniciales de ALT, con punto de corte en la mediana de la distribución (24U/l).
- -
Tratamientos para la DM (incluidas dosis de insulina y cálculo de la dosis/kg de peso para los pacientes insulinizados), para la hipertensión arterial y para la dislipidemia. El tratamiento con AR-GLP1 se dividió según su potencia prevista en 2 grupos:
- ∘
Menor potencia: exenatida, lixisenatida y liraglutida 0,6mg
- ∘
Mayor potencia: liraglutida ≥1,2mg y exenatida LAR.
- ∘
Las variables bioquímicas se analizaron mediante los procedimientos rutinarios de cada hospital.
Métodos estadísticosLas variables cuantitativas se describen por su media y desviación estándar (DE), y las cualitativas, con su distribución de frecuencias. La comparación de los pacientes según sus valores iniciales de ALT se realiza con U de Mann-Whitney (variables cuantitativas) o con Chi cuadrado (variables cualitativas). El cambio de las variables HbA1c, IMC y ALT a lo largo del tiempo se evaluó con el test de Friedman.
El grado de asociación lineal entre variables cuantitativas se determina mediante coeficiente de correlación de Spearman.
Se definió como cambio en una variable la diferencia entre los valores finales (un año de seguimiento) e iniciales. La influencia ajustada de las variables independientes sobre el cambio de la HbA1c se analiza mediante regresión lineal multivariante. En este caso el coeficiente b se interpreta como el cambio de HbA1c (expresado en unidades de NGSP de %) por cada unidad de incremento en la variable independiente evaluada.
Las principales variables predictivas del cambio de HbA1c consideradas en nuestra hipótesis de trabajo fueron la ALT inicial (cuantitativa), la presencia inicial de ALT>24U/l (cualitativa) y el cambio de ALT (cuantitativa). La importancia pronóstica de cada una de ellas por separado se evaluó mediante ajuste progresivo en 5 modelos:
Modelo 1: univariante.
Modelo 2: ajuste para edad, género, evolución DM, HbA1c inicial, IMC inicial, FG inicial.
Modelo 3: ajuste de modelo 2+tipo y potencia de AR-GLP1 y tratamiento con glitazonas.
Modelo 4: ajuste de modelo 3+cambio IMC.
Modelo 5: Utilización de procedimiento de exclusión secuencial para obtener el mejor modelo a partir del modelo 4.
Finalmente, mediante procedimiento de exclusión secuencial se seleccionaron 2 modelos predictivos del cambio de HbA1c durante el seguimiento a partir de las siguientes variables:
Modelo basal (inclusión solo de variables obtenidas en el momento de inicio del tratamiento): edad, género, evolución DM, HbA1c, IMC, FG, tipo y potencia de AR-GLP1 y ALT inicial>24U/l.
Modelo completo: edad, género, evolución DM, HbA1c, IMC, FG, tipo y potencia de AR-GLP1, ALT inicial>24 U/l y cambio durante el seguimiento de IMC y de ALT.
Se consideraron significativos los valores de p<0,05. Se utilizó el programa estadístico SPSS 22.0.
ResultadosSe excluyeron 239 (67,1%) de los 356 pacientes. Las principales razones de exclusión fueron no haber completado todavía un año de seguimiento (209 [58,7%] pacientes) y/o tener valores perdidos de ALT (67 [18,8%] pacientes) y/o tener una hepatopatía conocida previamente (6 [1,7%] pacientes). Los pacientes excluidos se caracterizaban por tener mayor prevalencia de tratamiento combinado con insulina (51,7 vs 40,2%; p=0,04), siendo comparables para el resto de las variables analizadas.
Los 117 pacientes incluidos (47,9% mujeres) tenían una edad de 58,6 (DE9,6) años, un tiempo de evolución de la DM de 9,6 (DE7,1) años y un IMC de 39,3 (DE4,7) kg/m2. El AR-GLP1 más utilizado fue liraglutida (85%) y el 87% de los pacientes fueron tratados con liraglutida ≥1,2mg/día o exenatida LAR.
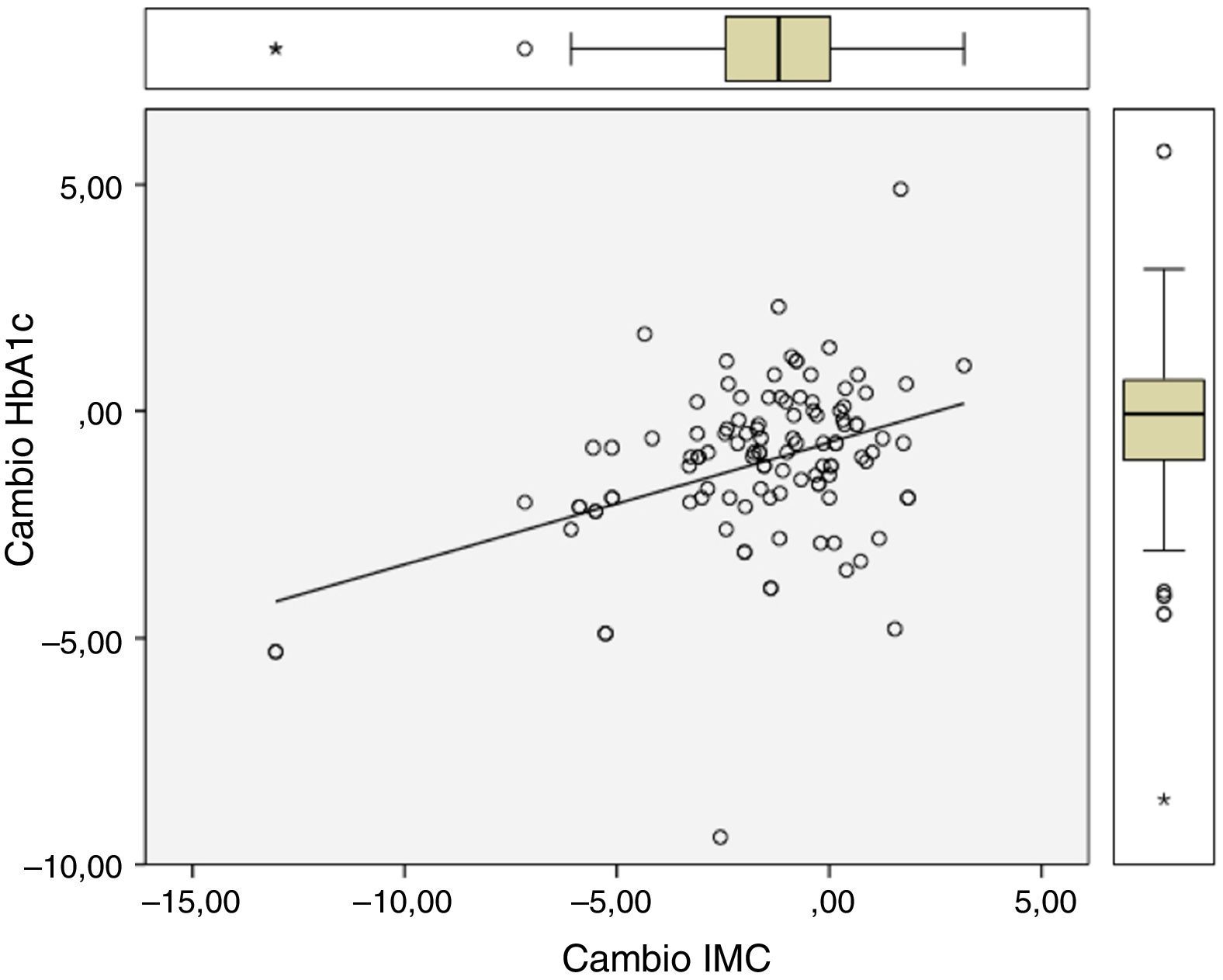
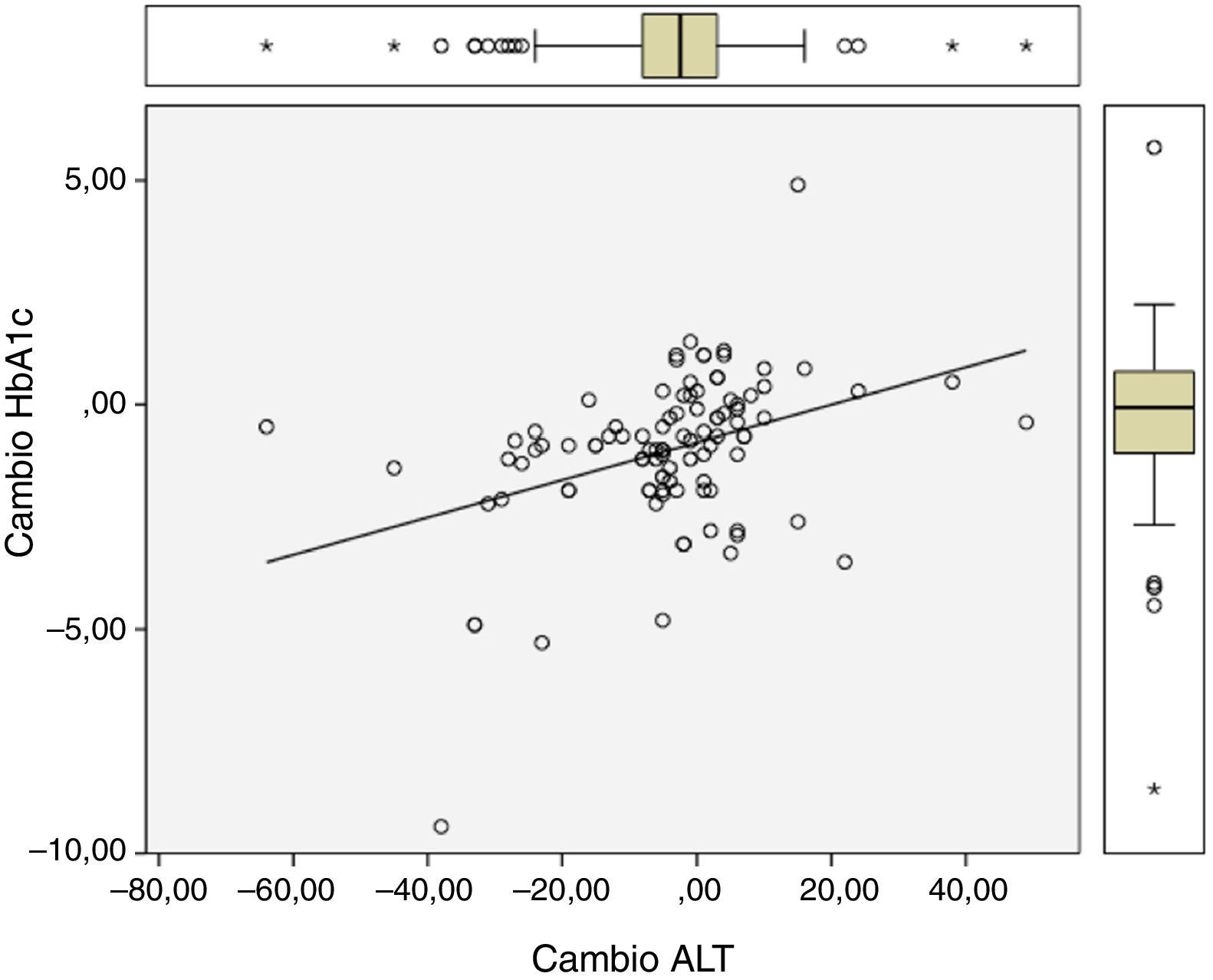
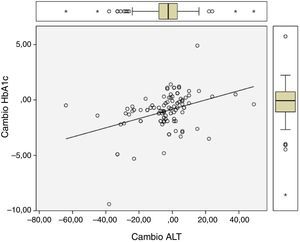
Hubo una diferencia significativa entre los valores al año de seguimiento y los valores iniciales de HbA1c (7,34 vs 8,42%; p<0,0001), IMC (37,7 vs 39,3kg/m2; p<0,0001) y ALT (27,9 vs 32,2 U/l; p=0,041). Los cambios de HbA1c (−1,08 (DE 1,75)%), IMC (−1,6 (DE2,6) kg/m2) y ALT (−4,3 (DE15,6) U/l) mostraron entre sí correlaciones estadísticamente significativas, como queda reflejado en la tabla 1 y en las figuras 1 y 2.
Las características de los pacientes, clasificados en dependencia de sus valores iniciales de ALT, con punto de corte en 24U/l, se muestran en la tabla 2. Los pacientes con valores de ALT por encima de la mediana se distinguían por tener menor tiempo de evolución de la DM, menor IMC y ser con mayor frecuencia varones. En los pacientes con ALT>24U/l hubo mayores reducciones de HbA1c (−1,41 vs −0,76%; p=0,045) y de ALT (−9,25 vs 0,46; p=0,002), pero similares descensos de IMC (−1,62 vs −1,63; p=0,99) que en los pacientes con ALT≤24U/l.
Características de los pacientes totales de la base de datos y de los pacientes seleccionados
| Grupo total (n=356) | Grupo seleccionado (n=117) | ALT ≤24 (n=60) | ALT>24 (n=57) | p | |
|---|---|---|---|---|---|
| ALT inicial (U/l) | 34,7 (30,2) | 32,2 (20,5) | 17,7 (3,9) | 46,4 (20,4) | <0,0001 |
| Edad (años) | 58,1 (9,7) | 58,6 (9,6) | 59,9 (9,3) | 57,2 (9,8) | ns |
| Sexo (% mujeres) | 48,6 | 48 | 68,3 | 26,3 | <0,0001 |
| Agonista GLP-1 (% liraglutida) | 84 | 85,5 | 86,7 | 84,2 | ns |
| Tratamiento pioglitazona (%) | 8,5 | 9,6 | 10,3 | 8,8 | ns |
| Tratamiento metformina (%) | 80,1 | 88 | 90 | 86 | ns |
| Tratamiento estatinas (%) | 64,6 | 70,4 | 70,7 | 70,2 | ns |
| Tratamiento asociado con insulina (%) | 47,9 | 40,2 | 43,3 | 36,8 | ns |
| Dosis insulina inicial (dosis/kg) | 0,66 (0,35) | 0,67 (0,37) | 0,67 (0,40) | 0,67 (0,35) | ns |
| Dosis insulina final (dosis/kg) | – | 0,64 (0,34) | 0,63 (0,38) | 0,65 (0,31) | ns |
| Duración diabetes (años) | 9,6 (7,3) | 9,6 (7,1) | 10,8 (7,1) | 8,3 (7,1) | 0,026 |
| Peso inicial (kg) | 104 (18,3) | 105,7 (14,2) | 104 (14,6) | 107,6(13,6) | ns |
| IMC inicial (kg/m2) | 38,6 (5,9) | 39,3 (4,7) | 40,2 (4,7) | 38,4 (4,6) | 0,022 |
| Glucosa en ayunas inicial (mmol/l) | 9,7 (3,1) | 10 (3,1) | 9,9 (2,8) | 10,2 (3,6) | ns |
| HbA1c inicial (%) | 8,4 (1,7) | 8,4 (1,6) | 8,5 (1,5) | 8,4 (1,7) | ns |
| Triglicéridos iniciales (mmol/l) | 2,16 (1,6) | 2,1 (1,6) | 1,94 (0,88) | 2,26 (2,1) | ns |
| Colesterol no HDL inicial (mmol/l) | 3,67 (1,35) | 3,75 (1,79) | 3,70 (1,83) | 3,78 (1,73) | ns |
| Filtrado glomerular inicial (ml/min/1,73m2) | 89,7 (17,7) | 88,8 (17,6) | 86,1(18,6) | 91,4(16,4) | ns |
Los pacientes seleccionados se estratifican y comparan entre sí en dependencia de los valores iniciales de ALT, con punto de corte en la mediana de la distribución.
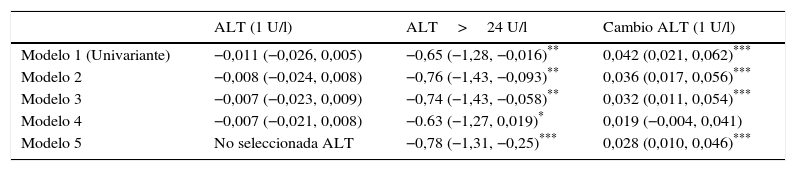
La influencia de los valores iniciales de ALT, de presentar una ALT inicial>24U/l y del cambio en ALT durante el seguimiento, sobre el cambio en HbA1c, con ajuste progresivo para potenciales factores de confusión, queda reflejado en la tabla 3. La diferencia adicional ajustada en el descenso de HbA1c de los pacientes con ALT>24U/l respecto a la de aquellos con ALT≤24U/l fue de −0,78 (IC95%: −1,31 a −0,25%; p=0,004). Cada unidad de descenso en los valores de ALT se asoció a un descenso adicional de HbA1c de 0,028 (IC95%: 0,010 a 0,046%; p=0,003).
Cambio en HbA1c (HbA1c final − HbA1c inicial) expresado en % inducido por ALT inicial, ALT>24U/l y cambio en ALT (ALT final − ALT inicial)
| ALT (1 U/l) | ALT>24 U/l | Cambio ALT (1 U/l) | |
|---|---|---|---|
| Modelo 1 (Univariante) | −0,011 (−0,026, 0,005) | −0,65 (−1,28, −0,016)** | 0,042 (0,021, 0,062)*** |
| Modelo 2 | −0,008 (−0,024, 0,008) | −0,76 (−1,43, −0,093)** | 0,036 (0,017, 0,056)*** |
| Modelo 3 | −0,007 (−0,023, 0,009) | −0,74 (−1,43, −0,058)** | 0,032 (0,011, 0,054)*** |
| Modelo 4 | −0,007 (−0,021, 0,008) | −0.63 (−1,27, 0,019)* | 0,019 (−0,004, 0,041) |
| Modelo 5 | No seleccionada ALT | −0,78 (−1,31, −0,25)*** | 0,028 (0,010, 0,046)*** |
Modelo 1: univariante.
Modelo 2: ajuste para edad, género, evolución DM, HbA1c inicial, IMC inicial, FG inicial.
Modelo 3: ajuste de modelo 2+tipo y potencia de agonista GLP-1 y tratamiento con glitazonas.
Modelo 4: ajuste de modelo 3+cambio IMC (IMC final − IMC inicial).
Modelo 5: Utilización de procedimiento de exclusión secuencial para obtener el mejor modelo a partir del modelo 4.
El mejor modelo predictivo del cambio en HbA1c, obtenido a partir de variables determinadas en el momento del inicio del tratamiento con AR-GLP1, fue el compuesto (R2=0,358) por HbA1c (b=−0,65; IC95%: −0,83 a −0,47; p<0,0001) y ALT>24 U/l (b=−0,74; IC95%: −1,31 a −0,18; p=0,011). El mejor modelo predictivo, tras incluir la información del cambio durante el seguimiento en IMC y ALT, fue el compuesto (R2=0,62) por HbA1c inicial (b=−0,71; IC95%: −0,87 a −0,54; p<0,0001), tratamiento con agonistas de mayor potencia (b=−0,73; IC95%: −1,43 a −0,02; p=0,043), cambio en IMC (b=0,19; IC95%: 0,08 a 0,31; p=0,001) y cambio en ALT (b=0,028; IC95%: 0,010 a 0,046; p=0,003).
DiscusiónEn el presente estudio hemos comprobado que, en un modelo ajustado para tipo y potencia de AR-GLP1, los principales factores capaces de predecir el descenso de HbA1c inducido por el tratamiento fueron la HbA1c inicial y los descensos de IMC y ALT. Si solo se considera la información disponible al comienzo del tratamiento, los determinantes de respuesta fueron la HbA1c inicial y los valores iniciales de ALT.
Los AR-GLP1 mimetizan la acción de la hormona gastrointestinal GLP-1, la cual es secretada de forma fisiológica en respuesta a la ingesta. Esta hormona regula los niveles de glucosa plasmática al estimular la secreción de insulina e inhibir la liberación de glucagón de una forma dependiente de los niveles de glucemia8. Las reducciones promedio de HbA1c obtenidas en los metaanálisis con AR-GLP1 frente a placebo son de aproximadamente 0,6-1,2%5,8,9, en dependencia del tipo y dosis de análogo administrado. No se han identificado con claridad características iniciales de los pacientes que pudiesen predecir una respuesta más favorable al tratamiento: la eficacia se ha revelado independiente de la edad, el género, el tiempo de evolución de la DM y el IMC inicial10. No obstante, recientemente se ha descrito que puede haber diferencias étnicas, ya que la respuesta es superior (diferencia de −0,32%; IC95% −0,64 a −0,01) en pacientes de origen asiático11. En nuestros pacientes la reducción de HbA1c tampoco estuvo significativamente asociada ni a la edad, ni al género, ni al tiempo de evolución, ni al IMC inicial.
Dentro de los parámetros moduladores del efecto cuantitativo de la administración del fármaco sobre el descenso de HbA1c, es ampliamente conocido que cualquier fármaco hipoglucemiante, incluido el grupo terapéutico de los AR-GLP1, es tanto más eficaz cuanto mayor es la cifra de HbA1c de partida; no obstante, la proporción de pacientes que alcanzan los objetivos de HbA1c<7% será menor cuanto mayor es la HbA1c inicial12. También se ha descrito una mayor eficacia hipoglucemiante en aquellos pacientes con mayor reducción del peso corporal, con un coeficiente de correlación de 0,158 entre cambio de peso y cambio de HbA1c13. En nuestros pacientes tanto la HbA1c inicial como el cambio de IMC fueron predictores independientes de respuesta, y la correlación obtenida con el cambio de IMC (r=0,28) fue más elevada que en el estudio anterior13.
Un potencial factor modulador de respuesta que no ha sido considerado en la literatura revisada es la presencia de esteatosis hepática no alcohólica. En la fisiopatología de la DM2, el balance calórico positivo y la hiperinsulinemia portal concomitante favorecen la lipogénesis hepática; los triglicéridos formados son exportados en las VLDL o quedan acumulados en el hígado, con aparición de EHNA, la cual se asocia a un incremento de la resistencia insulínica hepática14. El contenido de grasa en el hígado puede determinarse con una fiabilidad cercana al 100% mediante espectroscopia con resonancia magnética15, pero debido a su elevado coste un marcador útil es la ALT, con una sensibilidad del 45% y una especificidad del 85%7. Un incremento en la sensibilidad diagnóstica de la ALT podría conseguirse reduciendo sus niveles de normalidad, ya que fueron obtenidos en poblaciones sin exclusión de infección por virus de hepatitisC o EHNA16. El papel de la ecografía es discutible debido a su baja sensibilidad17.
Los AR-GLP1 son capaces de mejorar la EHNA. En un metaanálisis de los estudios LEAD liraglutida redujo los niveles de ALT en 8,20U/l en pacientes con niveles iniciales superiores a 30U/l en varones y 19U/l en mujeres, aunque el efecto fue dependiente en parte de la reducción de peso18. Aunque el descenso de peso indudablemente contribuye a la mejora de la EHNA7, los AR-GLP1 también pueden tener efectos directos en el hígado, disminuyendo la lipogénesis de novo y favoreciendo la oxidación de ácidos grasos; mecanismos moleculares envueltos son la estimulación de receptores PPARα y la activación de la proteincinasa activada por AMP6,19. Dado que recientemente se ha descrito que hay correlación significativa (r=0,27) entre cifra de HbA1c y contenido de grasa hepática medido por resonancia magnética20, es biológicamente plausible que la resolución de la EHNA pueda ir asociada a una mejora del control metabólico.
En nuestro estudio comprobamos que hubo un descenso de ALT de 9,2U/l en los pacientes con valores iniciales por encima de la mediana y que existió una relación significativa entre reducción de niveles de ALT y reducción de la HbA1c, y este efecto fue independiente de la pérdida de peso. A su vez, el descenso del IMC también contribuyó de modo independiente a la mejora del control metabólico. Aún más interesante fue el hallazgo de que los niveles iniciales de ALT>24U/l se asociaban a una mejor respuesta metabólica, clínicamente relevante y estadísticamente significativa, con una reducción adicional de HbA1c cercana al 0,8%. Estos hechos podrían indicar un mayor beneficio clínico de la utilización de los AR-GLP1 en pacientes con DM2 y EHNA asociada.
Las limitaciones del presente trabajo deben ser consideradas. El número de pacientes fue insuficiente para realizar un análisis separado por género o por AR-GLP1, interesante ya que no todos los AR-GLP1 pueden tener la misma eficacia sobre receptores hepáticos21; los hallazgos obtenidos deben considerarse más como generadores de hipótesis que como confirmatorios. No dispusimos de pruebas morfológicas que cuantificasen el contenido de grasa intrahepática, por lo que tuvimos que basarnos en los niveles de ALT; no obstante, el establecimiento del punto de corte en 24U/l (mediana de la distribución) coincide con el límite superior de la normalidad descrito en pacientes con DM en los que se excluyó EHNA por resonancia magnética20. Finalmente, no dispusimos de datos acerca de la ingesta exacta de alcohol de los pacientes, aunque excluimos aquellos con hepatopatía conocida.
Como conclusión, consideramos que la eficacia hipoglucemiante de los AR-GLP1 podría relacionarse con la reducción de las cifras de transaminasas (un marcador de grasa intrahepática). Su eficacia hipoglucemiante es mayor en los pacientes con valores iniciales más elevados de la enzima. El papel predictivo de la presencia de EHNA sobre la respuesta metabólica al tratamiento con AR-GLP1 debería ser evaluado en mayor profundidad.
AutoríaTodos los autores han contribuido: a) al diseño del estudio o recogida y análisis de datos; b) en el borrador del manuscrito, y c) en la aprobación definitiva de la versión que se presenta.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
| Javier | Acha Pérez |
| Esperanza | Aguillo Gutiérrez |
| Bárbara | Alastruey Ribas |
| Ramón | Albero Gamboa |
| orosia | Bandrés Nivela |
| Agustín | Barra Morato |
| Amaya | Barragán Angulo |
| Rafael | Barril Vicente |
| yolanda | Blasco lamarca |
| Vicente | Blay Cortes |
| Mª Pilar | Bocos Terraz |
| Fernando | Calvo Gracia |
| Alejandro | Cámara Balda |
| Jose Antonio | Chena Alejandro |
| Santiago | Chóliz Polo |
| Luis | Ciprés Casasnovas |
| Paloma | de Castro Hernández |
| Vicente | Estopiñán Garcia |
| Eduardo | Faure Nogueras |
| Blanca | Garcia Garcia |
| Jose Antonio | Gimeno Orna |
| Paola | Gracia Gimeno |
| Maria Luisa | Gracia Ruiz |
| Jose Ignacio | labarta Aizpún |
| Francisca | Lázaro Puente |
| Andrés | López Gómez |
| carmen | Marcuello melendo |
| esteban | Mayayo Dehesa |
| Marta | Monreal Villanueva |
| Carmen | Morera Fernández-Sanguino |
| Angel L | Navarro Izquierdo |
| Julia | Ocón Bretón |
| pablo | Ortiz Remacha |
| Joaquín | palacios Latasa |
| Mª Jose | Pamplona Civera |
| Angeles | Pie Juste |
| Jesús | Playan Usón |
| Antonio | Portolés Suso |
| Jose Joaquín | resa Bienzobas |
| Mercedes | Rodriguez Rigual |
| mª Antonia | sancho Serrano |
| Alejandro | Sanz parís |
| Amalia | Sobrino vesperinas |
| pablo | Trincado Aznar |
| Concha | Vidal Peracho |
| Diego | Alvarez Ballano |
| Diana | Boj Carceller |
| Guayente | Verdes Sanz |
| Mª Eugenia | López valverde |
| Conchita | Zapata |
| patricia | de Diego |
| Ana | Ilundain Gonzalez |
| Irene Mª | Burgasé Estallo |
| Jara | Altemir Trallero |
| Ana Belen | Mañas martinez |
| Ana Lidia | Medrano serrano |
| Francisco | Los Fablos Callao |
| Laura | borau Maorad |
| Julia | Campos Fernandez |
| alicia | Justel Enriquez |
| carmen | Cabrejas Gomez |
| Isabel | Melchor |
| Beatriz | Lardies Sanchez |
| Leticia | Perez Fernandez |
| Luis | Irigoyen Cucalon |
| Ana | Agudo Tabuenca |