La obesidad se asocia a un desorden inflamatorio de bajo grado. Se ha propuesto una asociación causal entre inflamación y arteriosclerosis. El objetivo de este trabajo fue valorar el perfil inflamatorio en pacientes obesos mórbidos determinando las concentraciones de proteína C reactiva (PCR) y de moléculas solubles de adhesión intercelular tipo 1 (sICAM-1) antes y después de la pérdida de peso por cirugía bariátrica.
MétodoSe realizó un estudio prospectivo en el que se midieron las concentraciones séricas de PCR y de sICAM-1 en 50 pacientes con obesidad mórbida (19 hombres y 31 mujeres) antes y a los 3, 6 y 12 meses de la realización de un by-pass gástrico.
ResultadosSe observó una disminución significativa de índice de masa corporal (IMC), PCR y sICAM-1. Se encontró correlación entre IMC y PCR, pero no entre IMC y sICAM-1.
ConclusiónLa mejora del perfil de riesgo vascular en pacientes obesos tras la pérdida de peso podría atribuirse, en parte, a la mejora del estado inflamatorio.
Obesity is associated with a state of chronic low-grade inflammation. A causal association between inflammatory processes and atherogenesis has been proposed. The aim of this study was to evaluate changes in the proinflammatory profile of morbidly obese patients who underwent bariatric surgery. Serum C-reactive protein (CRP) and soluble intercellular adhesion molecule-1 (sICAM-1) concentrations were measured before and after massive weight loss due to gastric bypass.
MethodsIn this prospective study we measured CRP and sICAM-1 concentrations in 50 morbidly obese patients (19 men and 31women) at baseline and 3, 6 and 12 months after gastric bypass.
ResultsBody mass index (BMI), CRP, and sICAM-1 decreased significantly. BMI correlated with CRP but not with sICAM-1.
ConclusionsThe improvement in vascular risk profile after weight loss in morbidly obese patients could be partially explained by changes in inflammatory status.
La obesidad es la enfermedad metabólica más frecuente de los países desarrollados y se considera un factor de riesgo independiente de enfermedad cardiovascular1. Diversos estudios indican que existe una relación entre respuesta inflamatoria crónica, obesidad y disfunción endotelial2–4.
En los últimos años se han identificado diferentes marcadores inflamatorios como predictores de riesgo vascular en la población general. La proteína C reactiva (PCR) es un marcador inflamatorio que tiene un conocido valor predictivo independiente de episodios vasculares5,6. Su aumento en la obesidad se debe a la producción directa por el tejido adiposo y al aumento de la síntesis hepática inducida por la interleucina-66.
Las moléculas solubles de adherencia intercelular tipo 1 (sICAM-1) son marcadores de disfunción endotelial con un papel crítico en muchos procesos inflamatorios7 que están emergiendo como predictores independientes de episodios cardiovasculares8,9. Se ha descrito elevación de sICAM-1 en pacientes obesos que podría deberse, en parte, a un aumento de la expresión de esta proteína en los adipocitos10.
La enfermedad cardiovascular en los pacientes obesos se relaciona con el aumento del índice de masa corporal (IMC) y es más frecuente en los casos de obesidad mórbida11. La cirugía bariátrica es el tratamiento que ha demostrado conseguir mayores pérdidas de peso sostenidas a largo plazo en estos pacientes12.
El objetivo de este trabajo fue valorar el perfil inflamatorio en pacientes obesos mórbidos sin enfermedad cardiovascular conocida, midiendo las concentraciones de PCR y de sICAM-1 antes y a los 3, 6 y 12 meses de una importante pérdida de peso tras un by-pass gástrico.
Pacientes y métodosSe llevó a cabo un estudio observacional, descriptivo y prospectivo con un seguimiento total de 12 meses. Se seleccionaron 50 pacientes (19 hombres y 31 mujeres) con obesidad mórbida de la consulta de obesidad del Hospital Universitario Morales Meseguer de Murcia. En todos los casos se realizó un by-pass gástrico según el método descrito por Capella13. Se excluyó a pacientes con un episodio cardiovascular previo o que presentaran cualquier enfermedad inflamatoria, infecciosa o neoplásica aguda o crónica intercurrente. Los pacientes se evaluaron antes y a los 3, 6 y 12 meses de la cirugía. Todos los participantes firmaron el consentimiento informado para su inclusión en el estudio, que el Comité Ético de nuestro hospital aprobó de acuerdo a las normas de la declaración de Helsinki.
Medidas antropométricasSe midieron el peso, la talla, el perímetro de la cintura y de la cadera y la masa grasa. Se calculó el IMC y el índice cintura/cadera. Para valorar la composición corporal se usó un impedanciómetro modelo TANITA TBF-300 (Tokio, Japón).
Medidas analíticasLas muestras de sangre venosa se extrajeron en ayunas entre las 8 y las 9 de la mañana. El suero se congeló a −80°C para su análisis posterior.
La PCR se determinó mediante enzimoinmunoanálisis (ELISA; DRG diagnostics, Marburg, Alemania). La sensibilidad del ensayo fue menor de 1mg/l y las variabilidades intraanalítica e interanalítica fueron del 5,12 y del 11,6%, respectivamente. Las concentraciones séricas de sICAM-1 se determinaron mediante enzimoinmunoanálisis (ELISA; R&D System, Minneapolis, Estados Unidos). La sensibilidad del ensayo fue de 0,35ng/ml y las variabilidades intraanalítica e interanalítica fueron del 4,8 y del 10,1%, respectivamente.
Método estadísticoLas variables cuantitativas se expresan como media±desviación estándar y las variables cualitativas se expresan como porcentajes. Para la comparación de medias de variables cuantitativas se utilizó la prueba de Friedman para más de 2 muestras relacionadas. Los análisis de las correlaciones se realizaron con el coeficiente de correlación rho de Spearman. Todas las comparaciones se realizaron bilateralmente y se consideró valor significativo si p<0,05.
Los datos se analizaron por el paquete estadístico SPSS/PC, versión 15.0 para Windows.
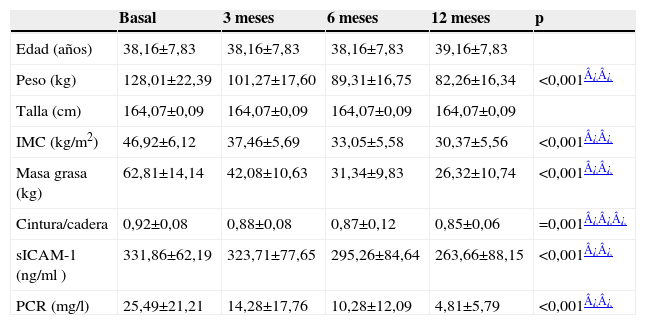
ResultadosDe los 50 pacientes obesos que participaron en el estudio, 31 (62%) eran mujeres y 19 (38%) eran varones, con una edad media de 38,1±7,8 años. El IMC inicial fue de 46,9±6,1kg/m2, el índice cintura/cadera fue de 0,92±0,08 y la masa grasa fue de 62,8±14,4kg. La concentración plasmática inicial de PCR fue de 25,4±21,2mg/l y la de sICAM-1 fue de 331,8±62,1ng/ml. A los 3, a los 6 y a los 12 meses de la cirugía se observó una disminución significativa del IMC inicial, del índice cintura/cadera y de la masa grasa, así como una mejora del perfil inflamatorio, con una disminución significativa de PCR y de sICAM-1. Los resultados se muestran en la tabla 1.
Variables antropométricas y analíticas antes y después (3, 6 y 12 meses) del by-pass gástrico (media±desviación estándar y nivel de significación)
| Basal | 3 meses | 6 meses | 12 meses | p | |
| Edad (años) | 38,16±7,83 | 38,16±7,83 | 38,16±7,83 | 39,16±7,83 | |
| Peso (kg) | 128,01±22,39 | 101,27±17,60 | 89,31±16,75 | 82,26±16,34 | <0,001¿¿ |
| Talla (cm) | 164,07±0,09 | 164,07±0,09 | 164,07±0,09 | 164,07±0,09 | |
| IMC (kg/m2) | 46,92±6,12 | 37,46±5,69 | 33,05±5,58 | 30,37±5,56 | <0,001¿¿ |
| Masa grasa (kg) | 62,81±14,14 | 42,08±10,63 | 31,34±9,83 | 26,32±10,74 | <0,001¿¿ |
| Cintura/cadera | 0,92±0,08 | 0,88±0,08 | 0,87±0,12 | 0,85±0,06 | =0,001¿¿¿ |
| sICAM-1 (ng/ml ) | 331,86±62,19 | 323,71±77,65 | 295,26±84,64 | 263,66±88,15 | <0,001¿¿ |
| PCR (mg/l) | 25,49±21,21 | 14,28±17,76 | 10,28±12,09 | 4,81±5,79 | <0,001¿¿ |
IMC: índice de masa corporal; PCR: proteína C reactiva; sICAM-1: moléculas solubles de adhesión intercelular tipo 1.*p<0,5.
Los niveles de PCR disminuyeron un 44% a los 3 meses (p<0,001), un 59,6% a los 6 meses (p<0,001) y un 81,2% a los 12 meses (p<0,001). Los niveles de sICAM-1 bajaron un 2,5% a los 3 meses, un 11% a los 6 meses (p<0,001) y un 20,5% a los 12 meses (p<0,001).
Se comprobó que existía correlación entre las concentraciones de PCR y de sICAM-1 al inicio (r=0,340; p=0,011), a los 3 meses (r=0,318; p=0,012) y a los 6 meses de la cirugía (r=0,298; p=0,035), y entre las concentraciones de PCR y de IMC a los 6 meses (r=0,321; p=0,019) y a los 12 meses de la cirugía (r=0,475; p=0,01). No se observó correlación entre el IMC y las concentraciones de sICAM-1. Tampoco se encontró correlación entre las concentraciones de PCR y de sICAM-1 y la masa grasa y el índice cintura/cadera.
DiscusiónLa obesidad se asocia a un estado inflamatorio de bajo grado. En los últimos años se han publicado numerosos estudios que indican que la pérdida de peso se asocia a una mejora del estado inflamatorio. La PCR ha sido el marcador inflamatorio más estudiado. Existe controversia sobre si la PCR es simplemente un marcador de enfermedad o si interviene de forma activa en el proceso arteriosclerótico, promoviendo la activación celular del endotelio y, por tanto, la disfunción endotelial14. Se ha descrito una disminución en las concentraciones de PCR tras la pérdida de peso obtenida por las diferentes intervenciones terapéuticas: dieta, ejercicio, dieta más ejercicio y cirugía bariátrica15. En nuestro trabajo hemos comprobado un descenso significativo de los niveles de PCR tras una importante reducción de peso por un by-pass gástrico: a los 3 meses de la cirugía los pacientes disminuyeron un 20,1% el IMC y las concentraciones de PCR descendieron un 44%, entre los 3 y los 6 meses el IMC disminuyó un 9,3% y la PCR disminuyó un 15,6%, y entre los 6 y los 12 meses el IMC bajó un 5,7% y la PCR bajó un 21,4%. Nuestros resultados reproducen los descritos en otras series de pacientes obesos tratados con cirugía16–19. Destacamos que en el período de menor pérdida de peso, entre los 6 y los 12 meses, en el que el IMC disminuyó un 5,7%, la PCR lo hizo un 21,4%. Una posible explicación a este resultado es que los procesos inflamatorios y reparadores tras un by-pass gástrico pueden persistir más de 3 meses.
Las SICAM-1 son marcadores de disfunción endotelial con un papel crítico en muchos procesos inflamatorios que se relacionan con la PCR y que pueden tener un valor predictivo similar a ésta en prevención primaria9. Las concentraciones aumentadas de estas moléculas implican un aumento de la adherencia leucocitaria al endotelio, paso fisiopatológicamente decisivo en la aterogénesis. La disfunción del endotelio vascular se considera el estadio más temprano en el proceso aterosclerótico. En la obesidad se ha descrito un aumento de las concentraciones de sICAM-110,20. En nuestro estudio hemos comprobado que existe una disminución de las concentraciones de sICAM-1 con la pérdida de peso. Esta disminución es significativa a los 6 y a los 12 meses de la cirugía. Nuestros resultados coinciden con los de otros autores que, como nosotros, han valorado las modificaciones de las concentraciones de sICAM-1 en pacientes obesos tras pérdida de peso a largo plazo21–24. Por otra parte, nuestros datos también reproducen los de otros trabajos4,25 que no encuentran variaciones significativas cuando estudian a los pacientes en un período corto de tiempo, tal y como ocurre en nuestra serie a los 3 meses de la cirugía.
Existe cierta controversia sobre si existe o no relación entre los niveles de sICAM-1 y de IMC21,26–28. En nuestros pacientes, aunque las concentraciones de sICAM-1 disminuyeron tras la pérdida de peso, no hemos comprobado correlación entre sICAM-1 e IMC. Tampoco hemos hallado correlación entre las concentraciones de PCR y el IMC basal y a los 3 meses de la cirugía. Esta falta de relación se puede explicar, por una parte, por las características de los pacientes estudiados. Al tratarse de una serie quirúrgica y necesitar cumplir criterios de indicación de cirugía bariátrica, todos tenían un IMC inicial superior a 40kg/m2 y bastante similar entre ellos y, por otra parte, por la ausencia de un grupo control con normopeso. Hemos encontrado la relación que esperábamos entre las concentraciones de PCR e IMC a los 6 y a los 12 meses de la cirugía, lo que coincide con resultados previamente publicados por otros autores29,30. Las concentraciones de PCR y de sICAM-1 guardan relación al inicio y a los 3 y a los 6 meses, pero no al año de la cirugía, correlación que posiblemente existiría si se aumentara el tamaño de la muestra. Este hallazgo corrobora los datos previamente publicados9 y sirve para apoyar el valor predictivo de las sICAM-1 en prevención primaria como factor de riesgo para el desarrollo de aterosclerosis.
ConclusiónLa mejora del perfil de riesgo vascular que se observa en pacientes obesos tras la pérdida de peso podría atribuirse, en parte, a la mejora del estado inflamatorio, tal y como ocurre en nuestros pacientes, en los que se demuestra una disminución significativa de las concentraciones de PCR y de sICAM-1 tras una importante pérdida de peso por cirugía bariátrica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.