La obesidad es el resultado de un balance positivo entre la cantidad total de energía ingerida y el catabolismo de esta. Aun siendo muchos los factores implicados en la regulación del metabolismo energético será con el descubrimiento de la leptina cuando se investigue más profundamente sobre la homeostasis energética. Desde su descubrimiento, la leptina ha sido considerada importante en el desarrollo de la obesidad, dado su efecto anorexígeno e influencia sobre la ingesta y gasto energético. La leptina interviene en diversos procesos fisiológicos, como el balance energético, el control del apetito y del peso corporal, el metabolismo de grasas y glúcidos, y en la reproducción. Si bien para su funcionamiento esta hormona cuenta con numerosos receptores específicos a nivel central (hipotálamo) y periféricamente en el músculo esquelético, el pulmón y los riñones. El objetivo de este trabajo ha sido revisar los principales aspectos que llevan a la leptina a ser considerada como un factor relacionado con el desarrollo de la obesidad, así como sobre sus potencialidades como agente anorexígeno.
Obesity is the result of a positive balance between total energy intake and its catabolism. Although many factors are involved in the regulation of energy metabolism, the discovery of leptin led to energy homeostasis being investigated in greater depth. Since its identification, leptin has been considered important in the development of obesity, given its anorexigenic effect and influence on food intake and energy expenditure. Leptin is involved in diverse physiological processes such as energy balance, appetite and body weight control, fat and carbohydrate metabolism, and reproduction. However, to be able to function, this hormone has many specific receptors both centrally (hypothalamus) and peripherally in the skeletal muscle, lungs and kidneys. This study aims to review the key aspects relating leptin to the development of obesity and discusses its potential as an anorectic agent.
La regulación del peso y de la composición corporal mantiene una estrecha relación con el balance energético1. El adecuado mantenimiento de este último dependerá de la existencia de un balance energético negativo, circunstancia solo presente cuando la energía ingerida a través de los alimentos es gastada por el organismo a través del metabolismo basal, actividad física y efecto termogénico de los alimentos2. En este sentido, en el niño, al igual que en el adulto, la obesidad nutricional o exógena es el resultado de un desequilibrio mantenido en el tiempo entre la ingesta y el gasto energético de los sujetos3,4. Actualmente se sabe cómo para el mantenimiento del peso corporal a lo largo de la vida es necesario que el balance energético esté controlado por toda una serie de señales, tanto aferentes como eferentes, que se encargarán a su vez de mantener en proporciones estables el volumen energético total de reserva del organismo.
Por su parte y desde un punto de vista genético, estudios en gemelos homocigóticos muestran que hasta un 75% de las variaciones en el índice de masa corporal (kg/m2) se puede atribuir a factores genéticos5–7; es decir, el genotipo es un factor crucial en relación con la magnitud de la reserva de grasa corporal y/o el desarrollo de la obesidad. No obstante, y a pesar de estar sujeta a la ingesta y el gasto energético, la regulación del depósito graso dependerá además de toda una serie de factores, tales como influencias medioambientales, metabólicas, nerviosas, conductuales, endocrinas y genéticas. Estudios a partir de modelos animales con cuadros de obesidad genética han supuesto las bases para posteriormente profundizar en el complejo proceso que representa la regulación del peso corporal u homeostasis energética. Por el momento se carece de evidencia científica sólida respecto de la existencia de pacientes obesos a causa de alteraciones monogénicas, sino que más bien. El origen de esta parece ser debido a la existencia de múltiples alteraciones genéticas, constituyendo así una afectación multigenética8,9.
Mecanismos y factores influyentes en la regulación de los niveles plasmáticos de leptinaAl igual que en ratones, el homólogo del gen ob en humanos se encuentra ubicado a nivel del brazo largo del cromosoma 710. Dicho gen codifica una proteína de 167 aminoácidos con peso molecular de 16kD denominada leptina. Dicha hormona de naturaleza peptídica es secretada a la sangre por diferentes estructuras y órganos, entre los que cabe destacar el tejido adiposo blanco y, en menor medida, por la placenta, el estómago y las células estelares del hígado11,12. Ahora bien, dentro del tejido adiposo existen diferencias en cuanto a la capacidad de secreción de leptina. Esta circunstancia se verá influida por la localización del tejido adiposo. Así, las principales regiones adiposas donde la producción de leptina resulta mayor son a nivel del tejido adiposo subcutáneo, retroperitoneal, omental y en tejidos grasos adyacentes a las vías linfáticas13,14. Respecto de la síntesis y las concentraciones circulantes de leptina, hemos de mencionar cómo ambos factores mantienen una relación directa con el volumen de grasa almacenada, de tal forma que a medida que los depósitos de grasa aumentan, las concentraciones de leptina circulantes se elevarán en tanta proporción como la cantidad de grasa lo haga14. Al igual que otras hormonas, la leptina presenta un ritmo de secreción pulsátil, aunque sujeto a variaciones diurnas, teniendo su mayor secreción durante las primeras horas de la mañana para ir disminuyendo a medida que avanzamos hacia el mediodía15. A pesar de esto, su patrón de secreción resulta similar al de otras hormonas, como la prolactina, la tirotropina, la melatonina o los ácidos grasos libres, mientras que es opuesto al del cortisol o de la hormona adrenocorticotropa. En el caso de la mujer, los pulsos de secreción de leptina son similares a los de la hormona luteinizante (LH) y el estradiol.
En relación con el factor sexo, este representa otro de los factores implicados en el volumen de leptina y sus concentraciones circulantes. Por lo general, las concentraciones de leptina suelen ser mayores en el sexo femenino que entre los varones con independencia de su correlación con los valores en el índice de masa corporal, el porcentaje de grasa corporal, el grosor de los pliegues de la piel o la edad. Esta circunstancia tiene su justificación en varios aspectos, entre los que destacan una producción de leptina por unidad de masa grasa mayor en mujeres (75%) que en los hombres. Esta circunstancia tiene su explicación en una mayor concentración de grasa a nivel subcutáneo, teniendo en cuenta que es el tejido adiposo subcutáneo el principal productor de leptina. Además, la mayor concentración de estrógenos en la mujer inducirá a la expresión de leptina in vivo en humanos e incluso modificar incrementando la sensibilidad de los tejidos a la hormona16. Finalmente, podemos concluir la existencia de una mayor producción de leptina en mujeres que en hombres debido a su mayor composición de grasa subcutánea.
Si bien ante situaciones de ayuno que cursan con restricción calórica, las concentraciones de leptina disminuirán de acuerdo a la reducción de las reservas grasas orgánicas17. Resultado de esta reducción en las concentraciones de leptina tendrá lugar un aumento del apetito acompañado de una disminución considerable del gasto energético. Sin embargo, esta disminución en sus concentraciones resultará ser mayor en mujeres que en hombres, circunstancia que podría explicar la mayor facilidad de las mujeres para la recuperación ponderal tras períodos de restricción calórica con pérdida de peso. Esto parece indicar que la leptina, secretada por los adipocitos, es una señal aferente hacia el hipotálamo, que atraviesa la barrera hematoencefálica y es capaz de modular mediante mecanismos de retroalimentación negativa el tamaño de los depósitos grasos, es decir, de regular el balance energético a corto y a largo plazo18.
Por otra parte, y considerando la influencia de otras hormonas, como la insulina, en la actualidad se sabe cómo esta incrementa la secreción de leptina con independencia de la tolerancia a la glucosa o la edad, existiendo una asociación estrecha entre las concentraciones de leptina plasmáticas y las de insulina basales en condiciones normales19. Con todo esto, además de la adiposidad, el balance energético o las hormonas, existen otros factores (en este caso intrínsecos de los adipocitos) que como ciertas citocinas o factores de la transcripción podrían ejercer un efecto regulador en la síntesis de leptina y sus concentraciones circulantes20. Entre estas moléculas cabría destacar, en primer lugar, el papel del factor de necrosis tumoral y su implicación sobre las concentraciones de leptina21,22. Se ha demostrado cómo este induce la expresión de leptina en modelos animales. Por su parte, la interleucina 1 parece describir efectos similares sobre las concentraciones de leptina.
Leptina y su implicación en diversas funciones fisiológicasLa evidencia científica disponible muestra cómo la leptina interviene en numerosas funciones fisiológicas, las cuales tendrán su ejecución bien a nivel del sistema nervioso central (SNC) o en órganos periféricos. Sobre el SNC, la leptina actúa a nivel de los receptores específicos, provocando una inhibición de la ingesta por pérdida del apetito23. De este modo, la leptina interviene en el mecanismo de control a mediano y a largo plazo del balance energético.
De acuerdo a estudios recientes, la leptina actúa dirigiéndose al SNC y encargándose de modular los procesos neuroendocrinos que intervienen en las diversas respuestas adaptativas y comportamientos24. Así, en ratones ob/ob, la administración sistémica o intracerebroventricular de leptina, así como también por vía intranasal25, provocará una disminución del apetito y de las reservas grasas corporales. En este sentido parece lógico que las concentraciones plasmáticas de leptina en humanos se correlacionen con la masa grasa total. Pues bien, en el caso de sujetos obesos, estos suelen presentar niveles de leptina elevados.
La leptina participa en un sinfín de procesos, entre los que cabe destacar por su importancia la respuesta inflamatoria, en tanto que dicha hormona posee capacidad para estimular e iniciar la proliferación de las células T CD4+, así como de ciertas citocinas26,27. Desde un punto de vista sexual y de desarrollo, la leptina cobra una especial relevancia en el inicio de la pubertad y, con esto, en la reproducción. Esta capacidad para modular el inicio de una edad sexualmente efectiva tiene su origen en la estrecha intercomunicación que dicha hormona posee con el hipotálamo. A través del eje hipotalamohipofisoovárico, la leptina informará a dicho órgano sobre el volumen orgánico total existente de masa grasa para el inicio de la pubertad femenina y la reproducción. La leptina posee además la capacidad de incrementar las concentraciones plasmáticas de LH, hormona folículo estimulante y testosterona. En el caso de mujeres obesas, estas suelen desarrollar una resistencia central a la leptina, originándoles alteraciones gonadales, como cuadros de amenorrea. Pues bien, la administración de leptina en estas pacientes no solo mejora sus cuadros de amenorrea, sino que generalmente los corrige.
Otra de las principales funciones de la leptina es su capacidad para estimular la función angiogénica. Si bien del mismo modo que potencia la creación de nuevos vasos sanguíneos, la leptina posee una gran capacidad para elevar la presión arterial. Dicho incremento en las cifras de la presión arterial suele venir acompañado de una reducción del flujo plasmático renal, aumentando con esto la resistencia renal vascular y la frecuencia cardiaca. Teniendo en consideración tales aspectos, resulta obvio plantear cómo en aquellas personas obesas el exceso de leptina jugará un papel crucial en el desarrollo de los trastornos como la hipertensión28.
Se ha verificado una cierta capacidad para intervenir a nivel ocular y ante enfermedades relacionadas con la diabetes mellitus. Así, se ha comprobado cómo aquellos pacientes que muestran concentraciones más elevadas de leptina en el ojo muestran una mayor probabilidad de padecer retinopatía diabética. Considerando la capacidad de la leptina para inducir la angiogénesis, la terapia con leptina podría ser una opción útil para enlentecer, sino evitar, las alteraciones oculares derivadas de la diabetes mellitus29. La leptina además posee la capacidad de modificar el metabolismo glicídico y de estimular la lipólisis en el adipocito, provocando alteraciones en el reparto lipídico del tejido muscular. Promueve la termogénesis en el tejido adiposo marrón e incrementa la síntesis de los ácidos grasos en el hígado.
Leptina, señales y vías reguladoras del apetitoEl receptor de la leptina fue descrito por primera vez en 1995 por Tartaglia et al, utilizando para esto leptina marcada e identificando su existencia en los plexos coroideos de ratón30,31.
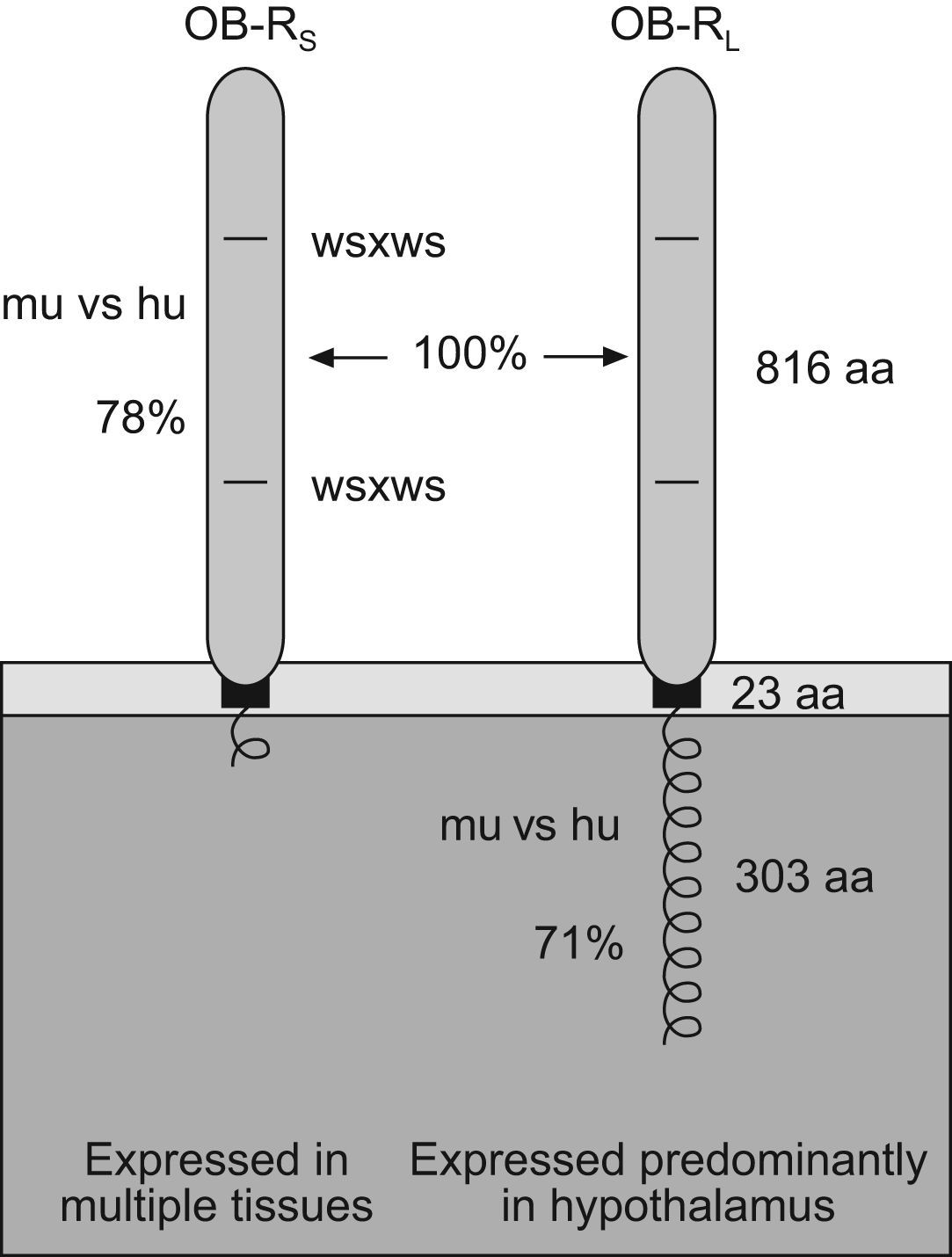
Existe una amplia variedad de formas del receptor en humanos, esto es, formas cortas y largas. Por su estructura y en su forma corta, el receptor se compone de una región externa o receptora compuesta por 816 aminoácidos y de un dominio transmembrana de 34 aminoácidos. En la forma larga se compone de un dominio efector constituido por 303 aminoácidos y responsable de la activación de señales intracelulares32. En la actualidad se sabe cómo las formas largas predominan en el hipotálamo y sus funciones son mediar en las acciones de la leptina a nivel del SNC. Las isoformas cortas se encuentran en los demás tejidos y sus principales funciones son la regulación del sistema inmune y el transporte de la leptina32.
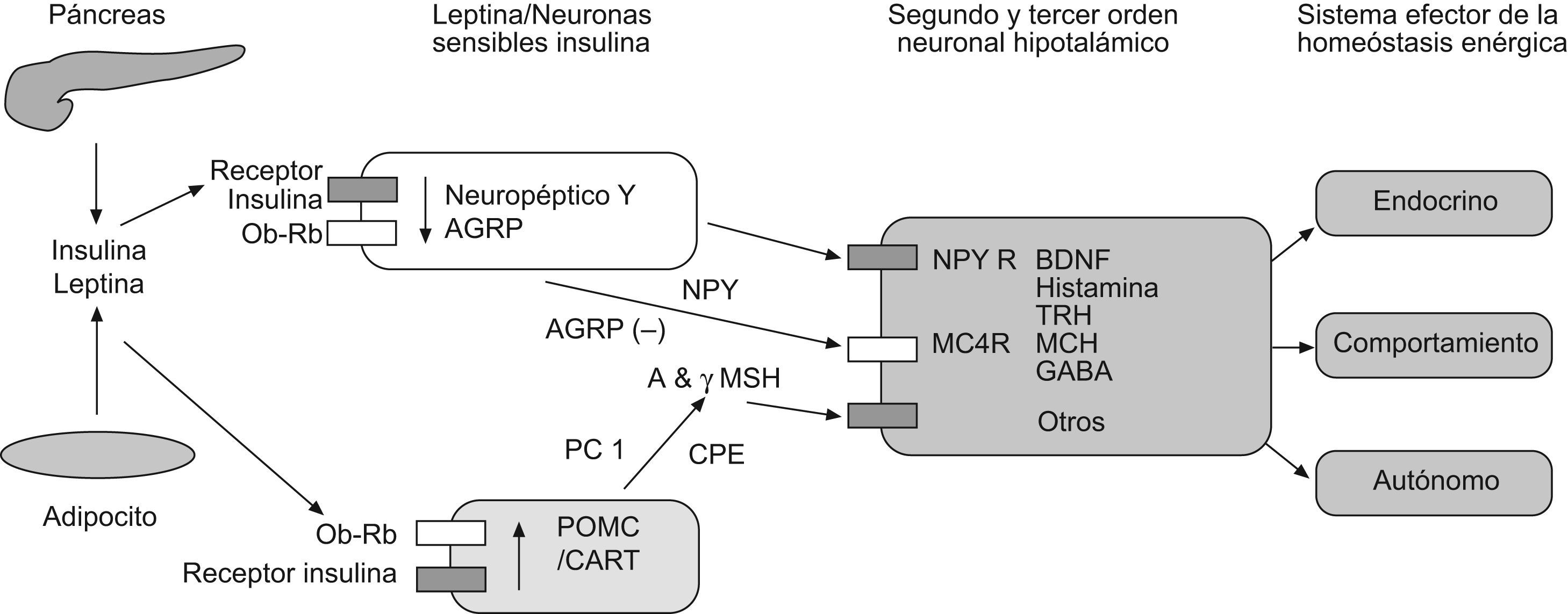
Desde un punto de vista anatómico, los receptores de leptina estarán localizados en los núcleos arcuato, paraventricular y en las áreas hipotalámicas ventromedial, lateral (LH) y dorsomedial. En el caso de las áreas hipotalámicas ventromedial y la LH, ambas tendrán influencias dentro y fuera del hipotálamo, regulando con esto la actividad de los sistemas parasimpático y simpático. Luego, estas regiones hipotalámicas expresarán neuropéptidos (NP) implicados en la regulación de la ingesta alimentaria y del peso corporal33. Por su parte, el NP-Y constituye un agente orexígeno muy potente, cuyas concentraciones están aumentadas en los ratones ob/ob. En un sistema homeostático tan complejo como este también participan otros NP como consecuencia de su activación por la leptina34,35. Es el caso de diversos agentes anorexígenos que, como la colecistoquinina, la bombesina y la insulina, potencian el efecto anoréctico de la leptina. Del mismo modo, se ha comprobado cómo la leptina incrementa los niveles de ARNm de la hormona liberadora de corticotropina, cuya actividad a nivel del núcleo paraventricular se traduce en una disminución de la ingesta y en el aumento del gasto energético. Luego, sobre la base de todo lo anterior, podemos establecer cómo las concentraciones elevadas de leptina serán detectadas por diferentes grupos de neuronas hipotalámicas. Ante situaciones de ayuno prolongado, la leptina disminuirá activándose diferentes mecanismos implicados en la respuesta adaptativa generada ante situaciones de inanición y que se traducirán en distintos procesos a nivel metabólico, hormonal y de comportamiento. Por su parte, la ganancia ponderal de peso subsiguiente a períodos de alimentación generará un incremento en las concentraciones de leptina, activando respuestas metabólicas diversas, todas ellas orientadas a establecer un balance energético negativo36 (fig. 1).
Principales vías efectoras y señalización de la leptina. Adaptado de: Melissa Crocker. 2009 (51). AGRP: Proteína relacionada con agoutí; BDNF: Factor neurotrófico derivado del cerebro; CART: Cocaína-anfetamina relacionadas con la transcripción; CPE: Carboxipeptidasa E; GABA: Ácido gamma amino butírico; MCH: Hormona concentradora de los melanocitos; MC3R: Receptor 3 melanocortina; MC4R: Receptor 4 melanocortina; MSH: Hormona estimulante de los melanocitos; NPY: Neuropéptido Y; PC 1: Prohormona convertasa 1; POMC: Proopiomelanocortina.TRH: Hormona liberadora de tirotropina.
Otros autores, en sus estudios iniciales con ratones obesos y diabéticos, plantearon la existencia en ellos de una leptino–resistencia a nivel hipotalámico37. En el caso de humanos, este modelo de leptino–resistencia ha sido ampliamente aceptado, postulándose como causa probable de defectos a nivel del receptor de esta38 (fig. 2). Del mismo modo, alteraciones a nivel de los receptores del plexo coroideo y la saturación del transporte hematoencefálico podrían ser otras de las causas de obesidad importantes39. Esta condición de resistencia a la leptina en obesos (a pesar de mostrar un exceso de leptina) será la responsable de su apetito exagerado (hiperfagia).
Los sujetos obesos en su mayoría expresan leptina, lo que indica que las mutaciones en el gen ob son poco frecuentes en ellos40,41. Se han descrito alteraciones genéticas entre individuos que poseen delecciones en el gen de la leptina, cursando con amenorrea y obesidad extrema42, lo que pone de manifiesto las primeras descripciones de mutaciones entre genes de leptina o a nivel de sus receptores en sujetos obesos43–45.
Terapia con leptina en el paciente obeso. Una potencial indicaciónEn la actualidad, los beneficios terapeúticos de la leptina aplicada en sujetos obesos, así como su vía de administración, suponen aspectos en continuo debate. Los datos existentes de individuos obesos muestran cómo una inyección diaria de leptina por vía subcutánea no solo es bien tolerada, sino que además causa reducciones significativas en el peso corporal de estos46, siendo más eficaz que por vía intraperitoneal e intranasal. En el caso de la administración intraventricular, hay que decir que es la más efectiva, aunque bien es cierto que sus riesgos resultan mayores. Sin embargo y a pesar de lo positivo en los resultados existentes, conviene recordar que sea cual fuere su vía de administración, por término general la terapia con leptina no estará exenta de complicaciones. Así, la dosis total de leptina por administrar vendrá definida por aspectos como su solubilidad y capacidad de producir reacciones dérmicas locales. De acuerdo a los datos publicados47, la administración intranasal de leptina en animales no solo disminuía considerablemente su peso, sino que además contribuía a reducir significativamente sus ingestas energéticas. Estos datos coinciden con otros ya publicados48,49 desde los que se demostró (utilizando la vía subcutánea para su inoculación) una relación directa entre la dosis total administrada de leptina y la pérdida de peso, es decir, cuanto mayores fueron las dosis administradas de esta hormona, mayor resultó la disminución de la ingesta energética y por ende la pérdida de peso. Otra de las técnicas utilizadas, y aún en experimentación, es la utilización de adenovirus para a partir de estos expresar el gen de la leptina en sujetos obesos.
A pesar de que las últimas investigaciones han sido orientadas al estudio del papel de esta hormona en la regulación del peso corporal y control del gasto energético, se han alcanzado grandes avances en lo que a su implicación y actividad en otros procesos orgánicos se refiere50,51. Así, se sabe cómo la leptina participa en toda una serie de procesos y funciones, como la reproducción y la fertilidad52, la hematopoyesis53,54, la respuesta inmune y el control de la presión arterial55, y ciertos procesos patológicos, como la anorexia56, el cáncer, la diabetes mellitus57 y los trastornos neuroendocrinos, como el síndrome de Cushing y el hipotiroidismo primario58. No obstante y a pesar de lo progresivo en cuanto al conocimiento de sus funciones, aún son necesarias nuevas investigaciones para dilucidar los entresijos y potencialidades de esta hormona, máxime cuando son tantas las expectativas puestas en ella y en su aplicación como terapia en sujetos con obesidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.