Vitamix® es un producto dietético compuesto por un extracto hidroalcohólico de cereales y leguminosas con miel, glicerofosfato de calcio, vitaminas B y D selenio y flúor. El producto base, Ceregumil®, patentado en 1912, ha sido muy popular como reconstituyente, y los usuarios refieren una sensación de salud, resistencia a enfermedades o mayor predisposición para el trabajo o el ejercicio.
Material y métodoEn el presente trabajo se analiza el efecto de Vitamix®, utilizado como suplemento alimenticio en ratas de laboratorio, en diversos parámetros fisiológicos y pruebas físicas. Periódicamente se realizaron hemogramas y se midieron la ingesta y el peso de los animales, así como las concentraciones sanguíneas de glucosa, triglicéridos, colesterol, transaminasas y malondialdehído, un producto de la lipoperoxidación. Se realizaron pruebas de resistencia física y se llevó a cabo un estudio histoquímico del hígado.
ResultadosLos animales que tomaron Vitamix® tenían menor peso e ingesta en edades avanzadas, mostraban mayor capacidad antioxidante, mayor resistencia en la prueba del alambre y menor fatiga en la piscina de Morris. En este último caso, la mejoría era notable en los animales considerados de mal desempeño suplementados con Vitamix®. El resto de los parámetros medidos se mantuvieron estadísticamente similares a los de los controles y no se observaron alteraciones hepáticas de ningún tipo.
ConclusionesEste estudio supone una base científica y experimental para conocer el efecto de dichos complementos en los parámetros fisiológicos.
Vitamix® is a dietary product composed of a hydro-alcoholic extract of cereals and pulses with honey, calcium glycerophosphate, vitamins B and D, selenium and fluoride. The basic product, Ceregumil®, patented in 1912, was highly popular as tonic and consumers reported a feeling of health, resistance to illness, and increased predisposition to work and exercise.
Material and methodIn the present study we analysed the effect of Vitamix® used as dietary supplement, on several physiological parameters in laboratory rats. We periodically performed hemograms and measured intake and weight, as well as blood levels of glucose, triglycerides, cholesterol, transaminases and malondialdehyde, a lipoperoxidation product. Physical probes were performed and a histochemical study was done in the liver.
ResultsRats fed with Vitamix® displayed lower intake and body weight in adult ages, showed and increased antioxidant activity, higher resistance in the wire hang test and lower fatigue in the Morris pool, specially those specimens considered as bad performers supplemented with Vitamix®. The rest of the measured parameters remained similar to control and no hepatic alterations were found.
ConclusionsThis study supports a scientific basis to know the effect of these complements over physiological parameters.
Ceregumil® suplementado con vitaminas (Vitamix®)1 es un producto dietético de los laboratorios Fernández y Canivell S.A. Está compuesto por un extracto hidroalcohólico (etanol a una concentración inferior al 3,5%) de cereales (trigo, cebada, maíz, avena) y leguminosas (judías y lentejas) con miel de abejas, azúcar, glicerofosfato de calcio, vitaminas (B1, B2, B3, B6, B8, B12, B9 –ácido fólico– y D3), selenio y flúor. Los principios inmediatos presentes en el extracto de cereales y leguminosas y la miel de abejas más el calcio y el fósforo se dirigen a servir como complemento alimentario en diferentes segmentos de la población, particularmente en edades tempranas y avanzadas proporcionando energía y un incremento de las defensas. La adición de vitaminas del grupo B, D3, flúor y selenio, unidos al calcio y al fósforo, persigue un efecto positivo en la formación y el mantenimiento de la masa ósea. A la vez, como el selenio es un mineral antioxidante2, se pretende retrasar el envejecimiento celular. Se sabe también que la carencia de selenio tiene efectos perjudiciales en los sistemas inmunitario y cardiovascular y en la incidencia de cáncer3. A pesar de los testimonios favorables de los usuarios, hasta el momento no se habían llevado a cabo estudios científicos, epidemiológicos o experimentales que pudieran contrastar esas opiniones mostrando datos objetivos libres de cualquier carga de subjetividad. Para ello, y al amparo de un contrato Universidad-Empresa, diseñamos el presente trabajo en ratas de laboratorio con el ánimo de estudiar si efectivamente la ingesta de Vitamix® tiene algún efecto fisiológico, mensurable experimentalmente, que pudiera justificar la bondad del producto.
Se establecieron dos grupos experimentales: ratas control alimentadas durante 6 meses con dieta estándar y ratas a las que, además, se suministraba diariamente un suplemento de Vitamix® proporcional al considerado idóneo para el consumo humano. Periódicamente se realizaron hemogramas y se controlaron la ingesta y el peso de los animales, así como las concentraciones sanguíneas de glucosa, triglicéridos, colesterol y transaminasas. Las últimas 2 semanas, se realizaron pruebas de resistencia física. Finalmente, los animales fueron desangrados y se estudió la presencia de radicales libres en el suero. Asimismo se disecaron muestras del hígado para su estudio histoquímico.
MATERIAL Y MÉTODODiseño experimentalEste estudio se realizó sobre ratas macho adultas de la cepa Wistar con un peso inicial de 400-430 g (12-13 semanas de edad). Los animales se dividieron en dos grupos de 30 ejemplares, considerados respectivamente como control y experimental suplementado con Vitamix®, y se mantuvieron en el Centro de Experimentación Animal, perteneciente a los Servicios Centrales de Apoyo a la Investigación de la Universidad de Málaga. Fueron estabulados en jaulas con 3 individuos cada una y recibieron como alimento pienso específico para ratas estándar (pienso de mantenimiento A04, Scientific Animal Food and Engineering, Augy, Francia). El agua y la comida fueron suministrados ad libitum, salvo en determinadas situaciones experimentales (medida de la ingesta). Antes de iniciar la fase experimental, los animales se mantuvieron 2 semanas en el Centro de Experimentación Animal para permitir su aclimatación después de su transporte desde el centro de cría. Los animales experimentales recibieron diariamente, de lunes a viernes, una dosis de Vitamix® equivalente a la establecida para humanos, mientras que a los controles no se les dio nada. Los animales utilizados en el presente estudio fueron manipulados de acuerdo con la normativa nacional vigente (Real Decreto 1201/2005, BOE n.° 252) y la normativa de la Unión Europea (86/609/CEE). El experimento se inició el 1-2-2007 y concluyó el 20-7-2007.
La programación semanal para la administración de Vitamix®, la toma de muestras y la medición de los distintos parámetros fue la siguiente:
- –
Lunes: 1. Suministro de la dosis de Vitamix®. 2. Medición del peso. 3. Retirada de la comida. 4. Procesamiento de los datos.
- –
Martes: 1. Toma de muestra de sangre en ayunas para medir glucosa, colesterol y triglicéridos. 2. Suministro de la dosis de Vitamix®. 3. Procesamiento de los datos.
- –
Miércoles: 1. Suministro de la dosis de Vitamix®. 2. Puesta de la cantidad de comida determinada en el experimento. 3. Procesamiento de los datos.
- –
Jueves: 1. Suministro de la dosis de Vitamix®. 2. Pesaje de la comida sobrante y cálculo de la ingesta. 3. Puesta de la cantidad de comida determinada en el experimento. 4. Procesamiento de los datos.
- –
Viernes: 1. Suministro de la dosis de Vitamix®. 2. Pesaje de la comida sobrante y cálculo de la ingesta. 3. Procesamiento de los datos.
Se suministró Vitamix® a primera hora de la mañana, a razón de 0,5 ml por animal. En humanos la dosis recomendada de Vitamix® es de 30 ml diarios (equivalente a 79 kcal). Esto representa, aproximadamente, un 3% del total de las calorías necesarias para un adulto (suponiendo unas necesidades medias de 2.600 kcal/día). La ingesta calórica diaria en la rata es de aproximadamente 54 kcal4, de modo que un 3% de esta energía está en unos 0,5 ml de Vitamix®. Esta dosis se administró mediante goteo en la boca del animal con el fin de asegurar que cada individuo tomara la dosis completa del producto. Los animales aceptan de buen grado el sabor del producto y no hubo inconveniente alguno en ninguno de los animales a la hora de ingerirlo.
Determinación de los parámetros fisiológicosPeso e ingesta. Una vez a la semana se pesó a los animales y dos veces por semana se pesó la cantidad de comida en cada jaula y la sobrante el día siguiente. Se representa el valor medio por jaula ponderada por el número de animales.
Parámetros sanguíneos. Cada 2 semanas se tomaron 500 μl de sangre mediante una pequeña incisión lateral en la región media de la cola. Para los recuentos celulares se usaron tubos con anticoagulante (EDTAK3) y el suero se obtuvo por centrifugación. Se determinaron los valores de los siguientes parámetros séricos: glucosa, colesterol, triglicéridos y transaminasas (GOT, GPT) y GGT. Estos análisis bioquímicos se realizaron en un multianalizador modelo Pronto Biosed (Izasa). Los hemogramas se realizaron cada 2 meses. Mediante un contador hematológico Coulter MD18, se cuantificaron: hematíes, hemoglobina, volumen corpuscular medio (VCM), hemoglobina corpuscular media (HCM), concentración de hemoglobina corpuscular media (CHCM), leucocitos totales, plaquetas, volumen plaquetario medio y plaquetocrito. Las poblaciones linfocíticas se cuantificaron mediante observación microscópica de frotis sanguíneos de muestras con tinción hematológica rápida. Una vez concluido el muestreo durante los 6 meses de tratamiento con Vitamix®, los animales fueron anestesiados mediante inyección intraperitoneal de tribromoetanol (2'2'2'-tribromoetanol; Fluka, ref. 90710) al 2% en una solución al 0,9% de ClNa y el 8% de etanol (1-2 ml/100 g de peso del animal) y, mediante una punción en el seno retroocular con una cánula de vidrio heparinizada, se les extrajo aproximadamente 5 ml de sangre, que fue recogida en un tubo con anticoagulante (EDTA3K). Con estas muestras de sangre se realizó un análisis hematológico y bioquímico completo y una determinación del estrés oxidativo mediante la prueba de las TBARS5,6. Concentraciones elevadas de malondialdehído (MDA) se correlacionarían con una menor capacidad antioxidante.
Examen histológico de las muestras de tejido hepático. De animales desangrados (5 controles y 5 suplementados con Vitamix®), se extrajeron muestras de tejido hepático que fueron sometidas a: a) congelación rápida en nieve carbónica, almacenamiento a −80 °C, corte en criostato (10 μm) y tinción mediante la técnica Oil red7 para la observación de grasas neutras, y b) fijación por inmersión en fijador de Bouin, inclusión en parafina, corte (10 μm) y tinción con hematoxilina-eosina y tricrómico de Mallory8.
Resistencia al ejercicio físico. Al final de la fase experimental, concretamente las últimas 2 semanas del sexto mes, se sometió a las ratas a dos pruebas para medir su resistencia física: a) prueba del alambre (wire hang grip)9,10: en esta prueba se midió la resistencia muscular colocando las patas delanteras del animal en un alambre de 2 mm de diámetro suspendido entre dos soportes y situado a una altura de 50 cm por encima de la superficie del suelo, para determinar lo que el animal tarda en soltarse, y b) prueba de natación en la piscina de Morris11: para poder determinar la resistencia muscular del animal se registró su conducta durante 5 min, sin plataforma, tras medir los siguientes parámetros: distancia total recorrida, velocidad media y tiempo de inmovilidad, analizados durante los 5 min que duraba la prueba conductual minuto a minuto. Para el análisis de la conducta de los animales se utilizó un sistema de registro/análisis conductual informatizado (SMART 2.0. PANLAB, Barcelona). Igualmente, se examinó el número de veces que el animal hundía la cabeza y el tiempo total que el animal permanecía bajo el agua durante el tiempo total que duró la prueba. La habituación al procedimiento fue diseñada para evitar la aparición de las conductas de inmovilidad y floating.
Tratamiento estadístico de los datosPara el procesamiento estadístico, se han llevado a cabo diferentes pruebas teniendo en cuenta las características de los datos procesados. Así, las comparaciones por pares de grupos se realizaron mediante la prueba de la t de Student. Cuando los datos no cumplieron los supuestos de normalidad y homogeneidad de variancias, se utilizó un análisis no paramétrico, concretamente la prueba de la U de Mann-Whitney. Por otro lado, se realizó un análisis factorial (ANOVA 2 por 2) de la resistencia física de los animales en la piscina circular de Morris. Así, se consideraron dos variables independientes (tratamiento y nivel de rendimiento en diferentes pruebas) con dos niveles cada una, animales control y animales suplementados con Vitamix® (para la variable tratamiento) y buen y mal desempeño (para el rendimiento de los animales). Como variables dependientes, por un lado se registró el número de veces que el animal hundía la cabeza bajo el agua y la distancia total recorrida durante el último minuto de ejecución. Después, para determinar si había diferencias significativas entre las medias de los grupos tras el análisis de la variancia, se usó la prueba de Tukey (Unequal N HSD).
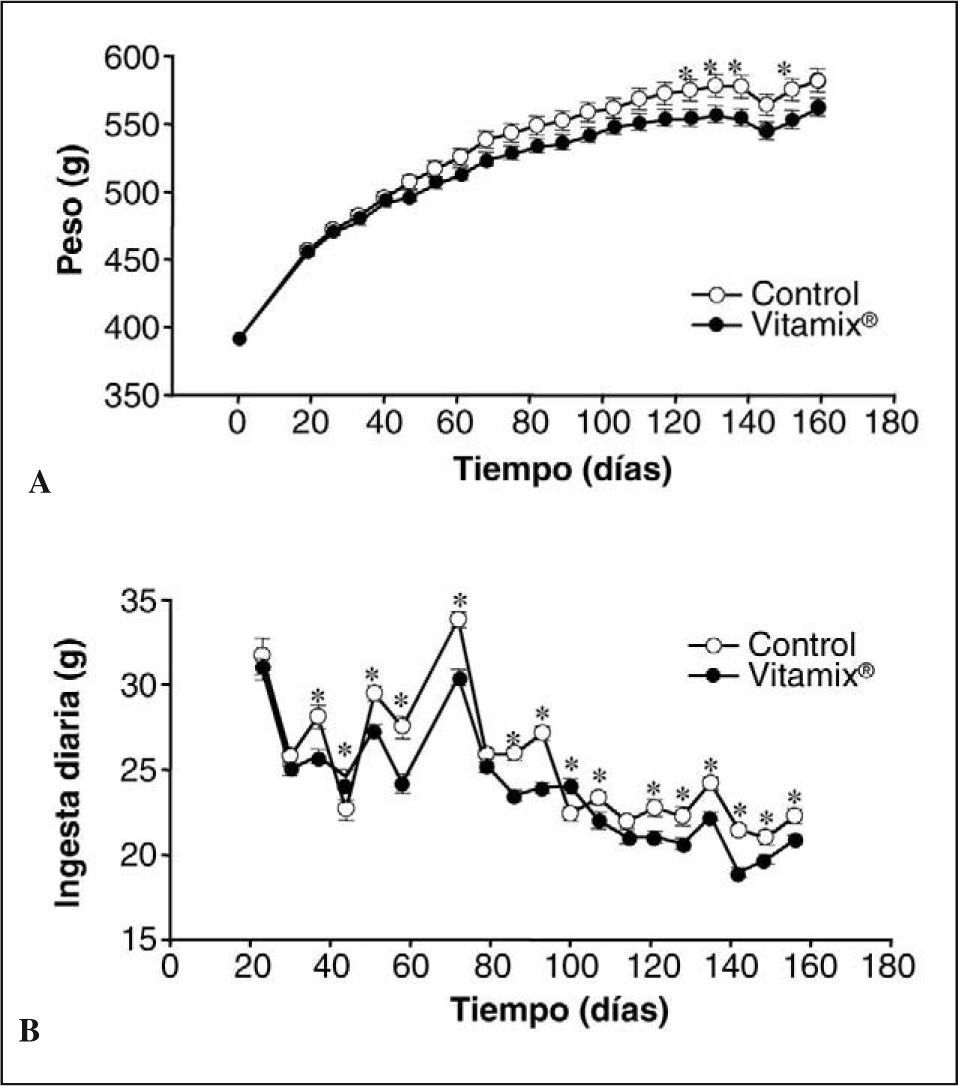
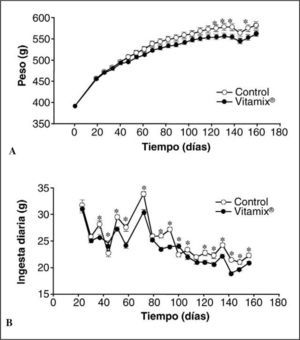
RESULTADOSPesoLas curvas de peso corporal de los animales control y los suplementados con Vitamix® se muestran en la figura 1A. Para ambos grupos, a medida que pasa el tiempo la curva de incremento de peso va disminuyendo su pendiente, hasta que en el último mes se mantiene constante. Hasta los 4 meses no se observan diferencias significativas entre los grupos. A partir de ese momento se constata una separación gradual y significativa de las curvas conforme transcurre el experimento, y el peso del grupo suplementado con Vitamix® es ligeramente inferior.
IngestaLa figura 1B muestra las diferencias en la ingesta entre el grupo con Vitamix® y los controles. Tanto en los controles como en los suplementados hay una disminución en la ingesta con el paso del tiempo. Cuando comparamos los grupos entre sí, los animales suplementados con Vitamix® ingieren menos cantidad de alimento prácticamente desde la primera semana de tratamiento.
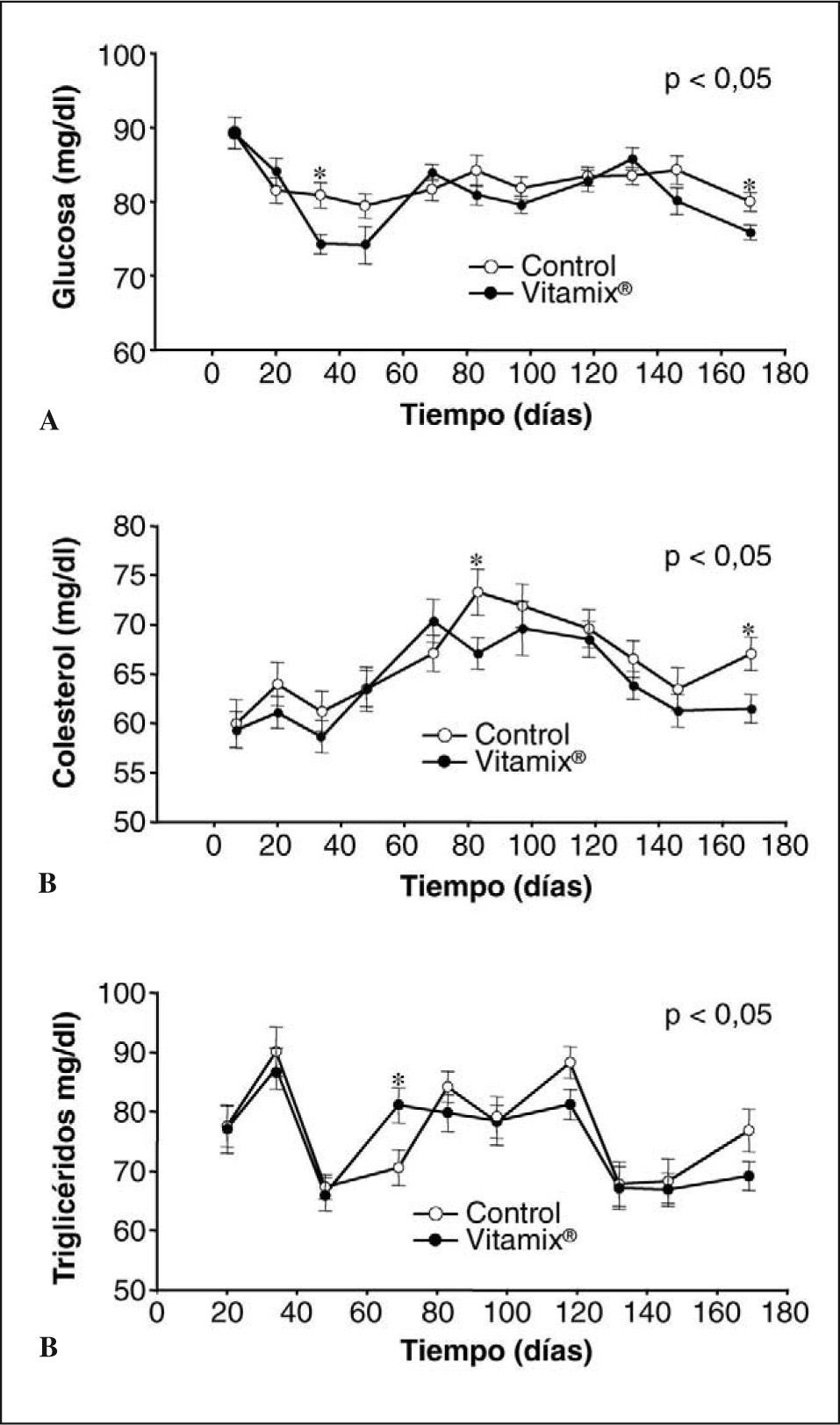
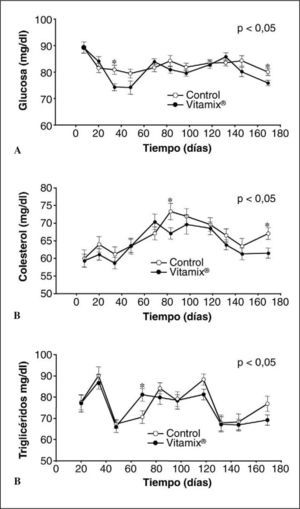
Glucosa basalEn la figura 2A se muestran los resultados relativos a las concentraciones de glucosa en sangre de los controles y los suplementados con Vitamix®. En ningún grupo hay cambio en el tiempo. Cuando comparamos los grupos, tampoco se observan diferencias significativas entre ellos, excepto en un par de determinaciones al principio y al final del experimento, en que las concentraciones son inferiores en el grupo suplementado con Vitamix®.
Colesterol y triglicéridosEn la figura 2B se muestran los resultados obtenidos en las concentraciones de colesterol en sangre. A partir de los 2 meses, el grupo suplementado con Vitamix® presenta concentraciones de colesterol ligeramente más bajas que el grupo control, aunque esta diferencia sólo se confirma estadísticamente en los muestreos de los días 83 y 169.
Según se muestra en la figura 2C, Los valores de triglicéridos del grupo suplementado con Vitamix® siempre son menores que los del grupo control, excepto en uno de los momentos experimentales. Sin embargo, estas diferencias no son estadísticamente significativas.
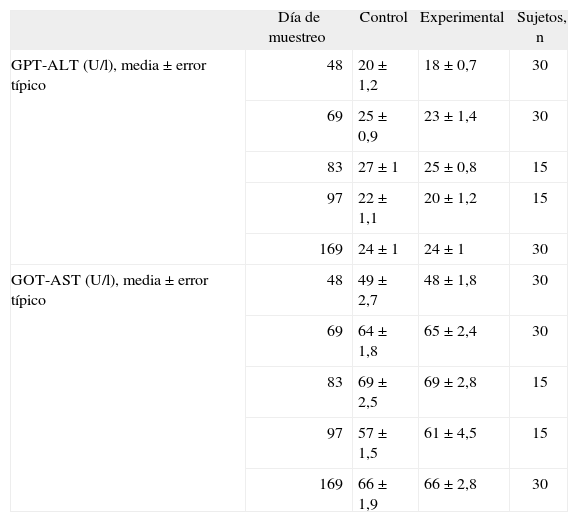
Transaminasas hepáticasSegún muestra la tabla 1, para ninguna de las dos enzimas medidas se observó diferencia alguna entre los animales control y los suplementados con Vitamix® en ninguno de los momentos de muestreo.
Concentraciones séricas de transaminasas en los animales control y los suplementados con Vitamix®
| Día de muestreo | Control | Experimental | Sujetos, n | |
| GPT-ALT (U/l), media ± error típico | 48 | 20 ± 1,2 | 18 ±0,7 | 30 |
| 69 | 25 ± 0,9 | 23 ± 1,4 | 30 | |
| 83 | 27 ± 1 | 25 ± 0,8 | 15 | |
| 97 | 22 ± 1,1 | 20 ± 1,2 | 15 | |
| 169 | 24 ± 1 | 24 ±1 | 30 | |
| GOT-AST (U/l), media ± error típico | 48 | 49 ± 2,7 | 48 ± 1,8 | 30 |
| 69 | 64 ± 1,8 | 65 ± 2,4 | 30 | |
| 83 | 69 ± 2,5 | 69 ± 2,8 | 15 | |
| 97 | 57 ± 1,5 | 61 ± 4,5 | 15 | |
| 169 | 66 ± 1,9 | 66 ± 2,8 | 30 |
ALT: alanina aminotransferasa; AST aspartato aminotransferasa.
No hay diferencias significativas entre los grupos.
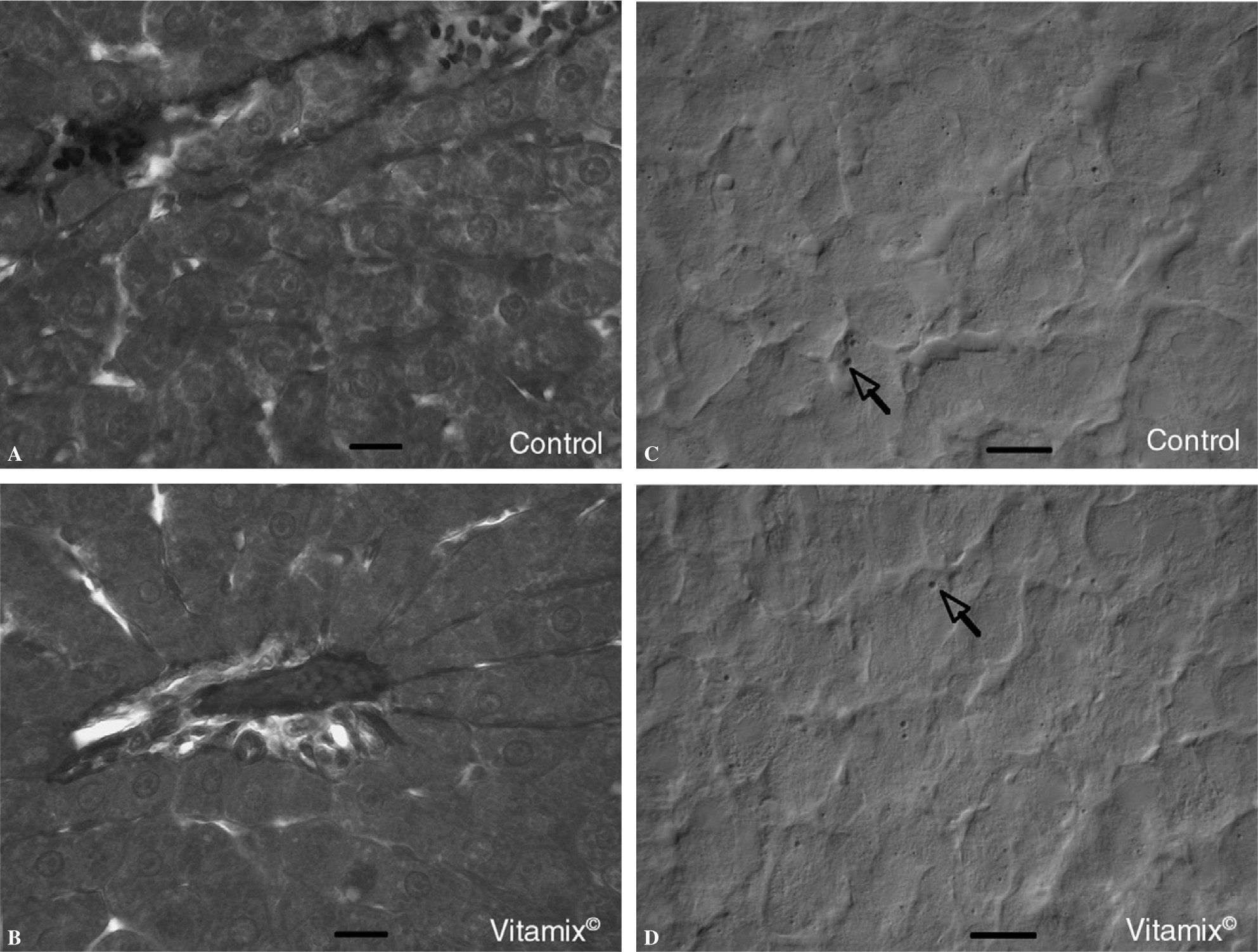
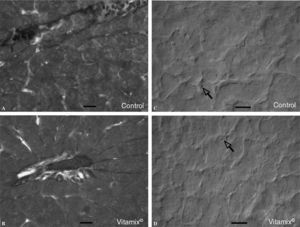
No se observaron diferencias en la organización y la estructura del hígado entre los animales control y los suplementados con Vitamix®. La tinción con hematoxilina-eosina y con el tricrómico de Mallory de cortes histológicos muestra imágenes similares en ambos casos, tanto para hepatocitos como para las fibras de tejido conectivo o los vasos sanguíneos (fig. 3A y B). Por su parte, el estudio de los lípidos, teñidos con la técnica Oil red (fig. 3C y D), no presenta diferencias en la cantidad de gotas lipídicas que aparecen en las secciones del tejido hepático de los animales control y los suplementados con Vitamix®.
A y B: cortes histológicos en parafina de hígado fijado en Bouin y teñido con el método del tricrómico de Mallory en ratas control y suplementadas con Vitamix®. No se observan diferencias en los hepatocitos ni en los espacios extracelulares o los vasos sanguíneos. C y D: cortes histológicos por congelación de hígado de ratas control y suplementadas con Vitamix® teñidos con el método oil red para poner de manifiesto las gotas lipídicas (flechas) presentes en los hepatocitos. No se observan diferencias entre los grupos. Óptica de Nomarsky. Barra: 40 μm.
Los resultados que se muestran en la tabla 2 corresponden a una única determinación del MDA realizada el último día de muestreo de sangre. Se observa una diferencia estadísticamente significativa entre los grupos, con menores concentraciones en los animales suplementados con Vitamix®.
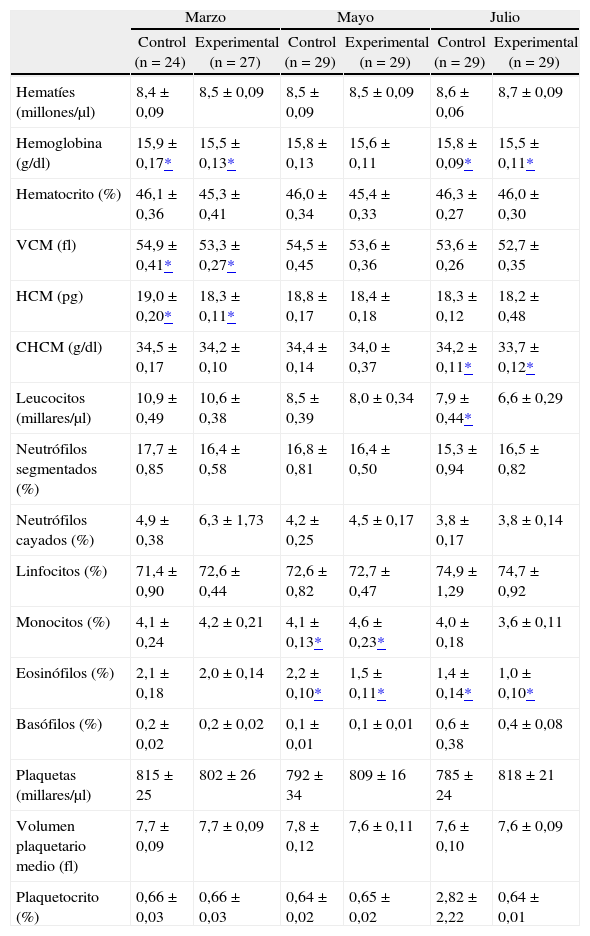
Resultados hematológicosEn muestras de sangre con anticoagulante tomadas en tres momentos del experimento (marzo, mayo y julio), se realizaron recuentos de la serie roja, la serie blanca y la serie plaquetaria. Los resultados obtenidos se muestran en la tabla 3. Ninguna de las diferencias significativas encontradas fue constante, sino que más bien fueron puntuales y en parámetros diversos.
Resultados de los recuentos celulares en muestras de sangre con anticoagulante tomadas en tres momentos del experimento (marzo, mayo y julio)
| Marzo | Mayo | Julio | ||||
| Control (n = 24) | Experimental (n = 27) | Control (n = 29) | Experimental (n = 29) | Control (n = 29) | Experimental (n = 29) | |
| Hematíes (millones/μl) | 8,4 ±0,09 | 8,5 ±0,09 | 8,5 ± 0,09 | 8,5 ± 0,09 | 8,6 ± 0,06 | 8,7 ± 0,09 |
| Hemoglobina (g/dl) | 15,9 ±0,17* | 15,5 ±0,13* | 15,8 ±0,13 | 15,6 ±0,11 | 15,8 ±0,09* | 15,5 ±0,11* |
| Hematocrito (%) | 46,1 ±0,36 | 45,3 ± 0,41 | 46,0 ± 0,34 | 45,4 ± 0,33 | 46,3 ± 0,27 | 46,0 ± 0,30 |
| VCM (fl) | 54,9 ±0,41* | 53,3 ± 0,27* | 54,5 ± 0,45 | 53,6 ± 0,36 | 53,6 ± 0,26 | 52,7 ± 0,35 |
| HCM (pg) | 19,0 ± 0,20* | 18,3 ±0,11* | 18,8 ±0,17 | 18,4 ±0,18 | 18,3 ±0,12 | 18,2 ± 0,48 |
| CHCM (g/dl) | 34,5 ±0,17 | 34,2 ±0,10 | 34,4 ±0,14 | 34,0 ± 0,37 | 34,2 ±0,11* | 33,7 ±0,12* |
| Leucocitos (millares/μl) | 10,9 ± 0,49 | 10,6 ± 0,38 | 8,5 ± 0,39 | 8,0 ± 0,34 | 7,9 ± 0,44* | 6,6 ± 0,29 |
| Neutrófilos segmentados (%) | 17,7 ± 0,85 | 16,4 ± 0,58 | 16,8 ± 0,81 | 16,4 ± 0,50 | 15,3 ±0,94 | 16,5 ± 0,82 |
| Neutrófilos cayados (%) | 4,9 ± 0,38 | 6,3 ± 1,73 | 4,2 ± 0,25 | 4,5 ±0,17 | 3,8 ±0,17 | 3,8 ±0,14 |
| Linfocitos (%) | 71,4 ± 0,90 | 72,6 ± 0,44 | 72,6 ± 0,82 | 72,7 ± 0,47 | 74,9 ±1,29 | 74,7 ± 0,92 |
| Monocitos (%) | 4,1 ±0,24 | 4,2 ± 0,21 | 4,1 ±0,13* | 4,6 ± 0,23* | 4,0 ±0,18 | 3,6 ±0,11 |
| Eosinófilos (%) | 2,1 ±0,18 | 2,0 ±0,14 | 2,2 ±0,10* | 1,5 ±0,11* | 1,4 ±0,14* | 1,0 ±0,10* |
| Basófilos (%) | 0,2 ± 0,02 | 0,2 ± 0,02 | 0,1 ±0,01 | 0,1 ± 0,01 | 0,6 ± 0,38 | 0,4 ± 0,08 |
| Plaquetas (millares/μl) | 815 ± 25 | 802 ± 26 | 792 ±34 | 809 ± 16 | 785 ± 24 | 818 ± 21 |
| Volumen plaquetario medio (fl) | 7,7 ± 0,09 | 7,7 ± 0,09 | 7,8 ±0,12 | 7,6 ±0,11 | 7,6 ±0,10 | 7,6 ± 0,09 |
| Plaquetocrito (%) | 0,66 ± 0,03 | 0,66 ± 0,03 | 0,64 ± 0,02 | 0,65 ± 0,02 | 2,82 ± 2,22 | 0,64 ±0,01 |
CHCM: concentración de hemoglobina corpuscular media; HCM: hemoglobina corpuscular media; VCM: volumen corpuscular medio.
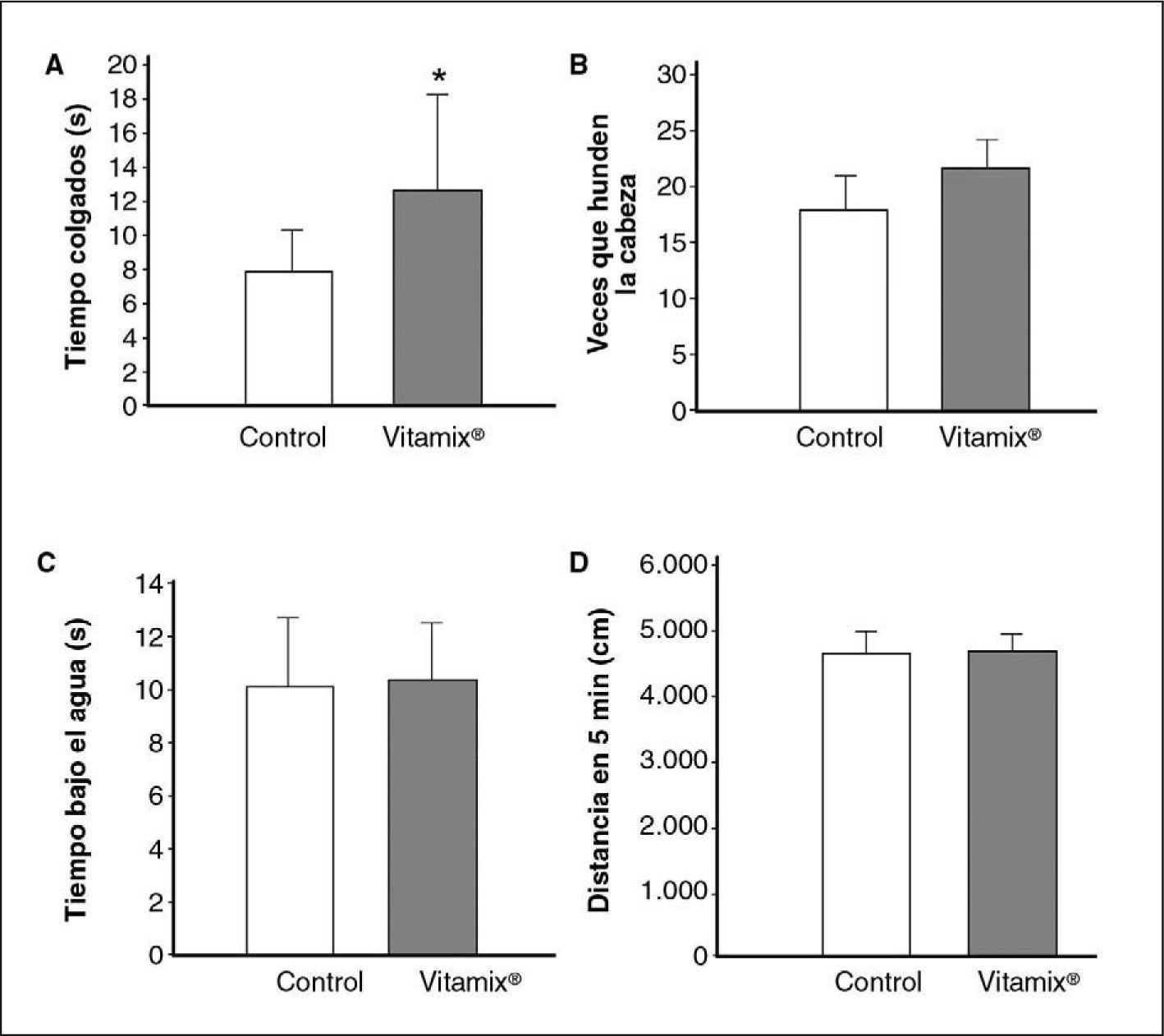
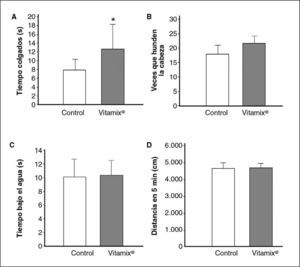
Los resultados de la resistencia muscular medida mediante esta prueba se muestran en la figura 4A. El tiempo que el animal es capaz de mantenerse agarrado al alambre es significativamente mayor, casi el doble, en el grupo suplementado con Vitamix®.
A: resistencia muscular: tiempo de los animales colgados de un alambre (control, n = 24; con Vitamix®, n = 26; prueba de la t de Student, p < 0,05). B: resistencia a la natación, veces que el animal hunde la cabeza bajo el agua (control, n = 26; con Vitamix®, n = 25). C: resistencia a la natación, tiempo total que el animal permanece bajo el agua (control, n = 26; con Vitamix®, n = 25). D: resistencia a la natación, distancia total recorrida en 5 min (control, n = 26; con Vitamix®, n = 30).
En primer lugar se valoró el número de veces que el animal hundía la cabeza como indicador de su flotabilidad y su resistencia natatoria. En la figura 4B no se observan diferencias significativas en este parámetro conductual entre el grupo control y el tratado con Vitamix®. En la figura 4C se representa el tiempo total que el animal permanecía bajo el agua durante los 5 min que duró la prueba, y se pone de manifiesto la ausencia de diferencias entre los animales control y los suplementados con Vitamix®. Según se muestra en la figura 4D, tampoco se encontraron diferencias entre ellos al evaluar la distancia total recorrida durante los 5 min de ejecución en la piscina circular de Morris. Es decir, los tres parámetros con que se evalúa la fatiga y la capacidad de natación no muestran diferencias entre los controles y los suplementados con Vitamix®.
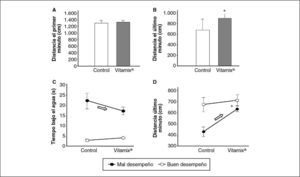
En un análisis más detallado, se estudió el rendimiento de los animales en la piscina circular de Morris minuto a minuto. Según se muestra en la figura 5A, se puso de manifiesto que no hubo diferencias entre los grupos en la distancia recorrida en los minutos iniciales de ejecución. Sin embargo, en el último minuto de evolución (4-5 min), hay una tendencia a que los animales suplementados con Vitamix® recorran una distancia ligeramente mayor que la recorrida por los controles, aunque esta diferencia está en el límite de la significación estadística. La diferencia es significativa cuando se representan las medianas, como se muestra en la figura 5B.
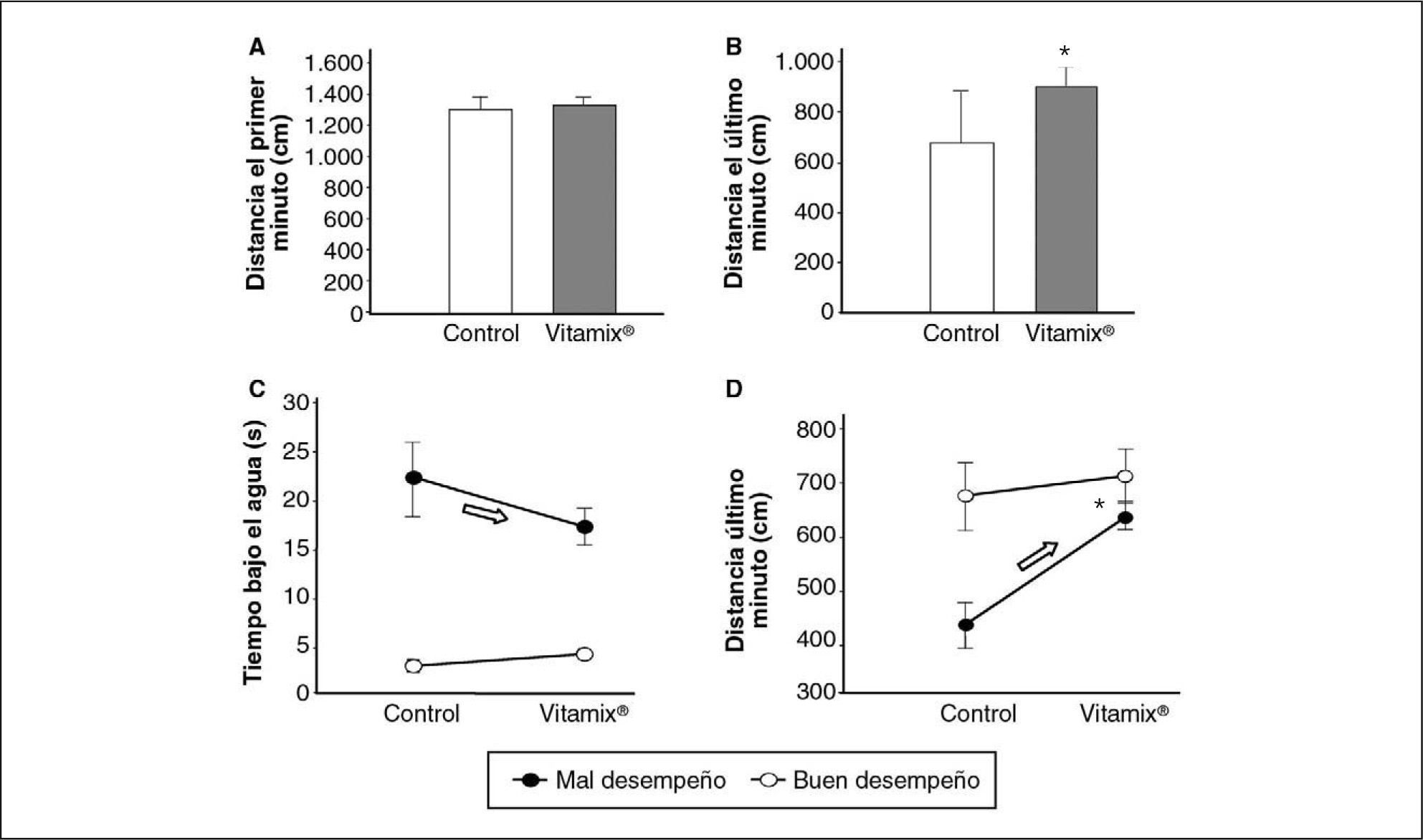
A: resistencia a la natación, distancia total recorrida en el primer minuto (control, n = 26; con Vitamix®, n = 30). B: resistencia a la natación, distancia total recorrida en el último minuto (control, n = 26; con Vitamix®, n = 30); datos representados como mediana ± 25% (*prueba de la U de Mann-Whitney, p = 0,06); el rango intercuartílico Q25-Q75 de los controles fue 402-716 y el de los suplementados con Vitamix®, 593,32-722,6. C: resistencia a la natación en los grupos de buen y mal desempeño, tiempo total que el animal permanece bajo el agua; los de buen desempeño lo tienen siempre y los malos mejoran notablemente tras el tratamiento (flecha) (buen desempeño control, n = 15; buen desempeño con Vitamix®, n = 12; mal desempeño control, n = 9; mal desempeño con Vitamix®, n = 11). Ejecución: F1/49 = 46,47; p < 0,000001 (prueba F con grados de libertad). Puesto que se obtuvieron diferencias significativas en el prueba F de ANOVA, se realizó la comparación a posteriori con la prueba HSD de Tukey para comprobar entre qué condiciones se dan las diferencias significativas (p = 0,05). D: resistencia a la natación en los grupos de buen y mal desempeño, distancia recorrida en el último minuto; los de mal desempeño mejoran notablemente tras el tratamiento (flecha). *p= 0,058 mal desempeño control frente a mal desempeño experimental. Tratamiento: F1/49 = 5,48 (p = 0,023). Ejecución: F1/49 = 9,87 (p = 0,002). Tratamiento/ejecución F1/49 = 2,6 (p = 0,1). Prueba HSD de Tukey, p = 0,05.
Con objeto de recabar más información de los resultados obtenidos en las pruebas de resistencia física en la piscina de Morris, se clasificó a los animales en función de su rendimiento en la ejecución de las pruebas. Así, cada animal fue observado independientemente y designado como de buen o mal desempeño, según una valoración cualitativa de su mejor o peor capacidad en el desarrollo de las pruebas. Con los animales así clasificados, se pudo realizar un análisis factorial (ANOVA 2 por 2) del rendimiento en la piscina de Morris. Como se observa en las figuras 5C y D, en el grupo de mal desempeño sí hay diferencia significativa entre los animales control y los suplementados con Vitamix®, pues éstos permanecieron menos tiempo bajo el agua, lo que indicaría una mayor capacidad de nadar o flotar. Con respecto a la distancia recorrida por los animales en la piscina circular de Morris en el último minuto del experimento, también se observan diferencias significativas en el grupo de mal desempeño entre los animales control y los suplementados con Vitamix®, que recorren una distancia mayor.
DISCUSIÓNPeso corporal, ingesta y glucosaPara ambos grupos, la tasa de incremento de peso (pendiente de la tangente) va disminuyendo con la edad hasta un momento en que el peso se mantiene constante. Este hecho tiene una relación directa con la disminución progresiva de la ingesta (anorexia del envejecimiento) y de la secreción de hormona del crecimiento (somatopausa) con la edad, cuyos mecanismos específicos aún no son conocidos12. Cuando comparamos a los animales control con los suplementados con Vitamix®, los valores de éstos se mantienen algo por debajo, pero siempre en la normalidad. También las concentraciones de glucosa se mantienen en el límite normal para las ratas4 en ambos grupos durante todo el experimento, y en las ratas suplementadas se sitúan en los valores más bajos de la normalidad. Los resultados relativos a la ingesta, el peso corporal y las concentraciones de glucosa en sangre indican que Vitamix® podría influir en el control del apetito produciendo un cierto efecto de saciedad, particularmente en los animales más viejos, lo que se refleja en un peso ligeramente inferior sin que se afecten significativamente las concentraciones sanguíneas de glucosa. Se ha comprobado que las dietas hipocalóricas en ratas y otras especies retrasan el envejecimiento y tienen un efecto antioxidante13,14. En este sentido, como Vitamix® ayuda a mantener un peso ligeramente más reducido, podría ejercer también una acción indirecta en la longevidad y el grado de oxidación a través de su efecto en la ingesta en edades avanzadas, extremo que se debería comprobar en otra serie de experimentos sobre la longevidad en poblaciones control y suplementada con Vitamix®. El efecto antioxidante observado también podría deberse a otros constituyentes de Vitamix® tales como el selenio2,3. Si estos resultados fueran extrapolables a la población humana15, este producto no solamente no engordaría, sino que podría ayudar al mantenimiento de un peso corporal regulado en la edad adulta sin alterar las concentraciones de glucosa sanguínea, que más bien se mantendrían en los valores inferiores del intervalo normal.
Colesterol y triglicéridosDurante todo el experimento se observa una tendencia al incremento de las concentraciones de colesterol con la edad. Este hecho es conocido en mamíferos y se relaciona con una menor capacidad de eliminación del colesterol en sangre16. Con respecto a las diferencias entre los grupos, sólo en dos momentos de muestreo fueron estadísticamente significativas, por lo que podríamos concluir que las concentraciones de colesterol no se ven afectadas por el tratamiento con Vitamix®. Tampoco hay diferencias significativas en los valores de triglicéridos ni con la edad ni entre ambos grupos. Al igual que sucede con el colesterol4, solamente se puede considerar una cierta tendencia a mantener los triglicéridos en su concentración más baja en los individuos suplementados con Vitamix®. Si tenemos en cuenta que con la edad se tiende a la hipercolesterolemia, y si los resultados en ratas fueran extrapolables a humanos, Vitamix® podría ser un producto apropiado para ayudar al mantenimiento de las concentraciones de colesterol en sangre en su límite inferior. En este sentido, podría ser interesante el diseño de nuevos experimentos en ratas con hipercolesterolemia.
Transaminasas hepáticasA pesar de que Vitamix® tiene un muy bajo contenido de alcohol etílico, quisimos analizar la posibilidad de daño hepático en el tratamiento prolongado con el producto, para lo cual se midieron las transaminasas hepáticas y se hizo un estudio histológico del hígado. Las concentraciones de transaminasas en suero son un indicador de daño hepático debido a alcohol17,18. En este experimento se midieron las concentraciones de GOT y GPT. La ausencia de diferencias indica que el tratamiento suministrado no tiene efecto nocivo alguno en el hígado. Los resultados analíticos para las enzimas hepáticas se corroboraron con la observación histológica del hígado, que aparecía normal en los animales suplementados y sin signos de esteatosis. Por lo tanto, se concluye que la cantidad de alcohol presente en Vitamix® (< 3,5%) no parece producir ningún tipo de efecto patológico en el tejido hepático ni señal alguna de esteatosis hepática, uno de los primeros efectos detectados tras intoxicación alcohólica aguda y caracterizada por el incremento de los depósitos lipídicos en los hepatocitos19. Sin embargo, para descartar definitivamente el posible efecto del alcohol, habría sido necesario realizar un experimento suministrando una cantidad de alcohol equivalente a la contenida en la dosis diaria de Vitamix®. Por tratarse de una cantidad tan sumamente reducida, decidimos no incorporar este tipo de control en el experimento.
Estrés oxidativoUno de los resultados más llamativos y consistentes de nuestro experimento es la disminución de MDA en el grupo suplementado con Vitamix®. Ello nos está indicando una mayor capacidad antioxidante o una mayor resistencia al estrés oxidativo en estos animales. De los componentes presentes en Vitamix®, tanto el selenio2,3 como el ácido fólico20 podrían estar implicados en este efecto, ya que se conoce su capacidad para prevenir la oxidación. La participación de otros componentes en este claro efecto no está descartada, como tampoco que pueda relacionarse con un peso corporal más ajustado puesto que, como ya se comentó, las dietas hipocalóricas han resultado eficaces para reducir el grado de oxidación13,14.
HemogramaA pesar de haberse observado diferencias puntuales, en los tres muestreos realizados, en general ningún parámetro ha presentado diferencias constantes, continuas y en el mismo sentido entre los grupos. Además, todos los parámetros han estado en lo considerado normal para esta especie4. Por lo tanto, con estos resultados somos incapaces de determinar de manera fehaciente si el suplemento alimenticio proporcionado tiene o no alguna relación con las diferencias ni en qué sentido se podría interpretarlo. Concluimos que, en nuestro caso, el tratamiento con Vitamix® no produce cambios o alteraciones importantes en la cantidad o en la forma de los eritrocitos ni en la cantidad de hemoglobina. Tampoco se observan diferencias importantes en cuanto a las células de la serie blanca o las plaquetas. Únicamente podemos apuntar que la ausencia de un incremento de eosinófilos en el grupo tratado con Vitamix® refleja la ausencia de respuesta alérgica a este compuesto en los animales21. Es bastante frecuente encontrar variaciones de este tipo en la determinación de los parámetros sanguíneos en ratas de laboratorio. Las razones para ello, en animales estabulados, son múltiples y podrían reflejar enfermedades leves durante los meses que dura el experimento.
Pruebas de resistencia físicaEl resultado derivado de la prueba del alambre muestra un mayor vigor en las ratas suplementadas con Vitamix®, que aguantaron más del doble de tiempo antes de dejarse caer. La justificación de este mayor vigor podría estar relacionada también con el peso corporal y/o podría ser el reflejo de un mejor estado nutricional.
Los resultados en la piscina de Morris muestran menos diferencias, excepto en el último minuto de evolución (4-5 min), en el que hay una tendencia a que los animales tratados recorran una distancia mayor. Este resultado parece indicar que Vitamix® podría favorecer la resistencia muscular o reducir la fatiga, particularmente después de haber estado un tiempo realizando ejercicio físico. Por otra parte, los resultados en el último minuto y la capacidad de aguante sin hundir la cabeza en el agua de los animales de mal desempeño eran significativamente muy diferentes entre los controles y los suplementados con Vitamix®. Estos resultados parecen indicar que el tratamiento con Vitamix® mejora el rendimiento de los animales peor dotados físicamente y no tanto en animales mejor dotados físicamente (con buen desempeño).
Si los resultados obtenidos en ratas fueran extrapolables a la población humana, término no carente de discusión15, Vitamix® podría ser considerado un producto recomendable para mantener más vigor y capacidad antioxidante en edades adultas, así como para ayudar a regular el peso corporal. Dada la complejidad del producto, que tiene añadidos miel y extracto de leguminosas, de momento no es posible determinar cuáles de los componentes presentes en este producto producen los efectos observados. Según Sadosky et al22, en general hay una limitación en la literatura debido a la ausencia de ensayos clínicos y estudios experimentales con este tipo de complementos nutricionales. Como norma general, los médicos deben conocer los suplementos que sus pacientes toman e, idealmente, los efectos que estos productos tengan en el metabolismo. Ello ayudará a los pacientes a tomar las decisiones correctas. Estudios como el presente suponen una base científica y experimental muy útil para conocer de manera fehaciente el efecto de dichos complementos en los parámetros fisiológicos. Sin embargo, se hacen precisos ensayos en poblaciones humanas para poder llegar a conclusiones definitivas respecto a este producto.
Este trabajo ha sido realizado gracias a las aportaciones económicas de la empresa Laboratorios Fernández y Canivell S.A. (Málaga) a través de un contrato-proyecto Empresa-Universidad (8.06/5.02.2595) gestionado por la oficina de transferencia de resultados de investigación (OTRI) de la Universidad de Málaga. Con la excepción de este contrato de investigación, no existe ninguna vinculación mercantil entre laboratorios Fernández-Canivell y la Universidad de Málaga y sus investigadores.