Analizar las características clínicas, metodología diagnóstica, tratamientos empleados y resultados de los casos de insulinoma diagnosticados y tratados entre 1983-2014 en 4 centros hospitalarios españoles.
MétodosSe incluyeron en el estudio todos los pacientes que tenían demostración histológica de tumor secretor de insulina o criterios diagnósticos bioquímicos y morfológicos de insulinoma.
ResultadosSe estudiaron 29 pacientes (23 mujeres [79,3%]; edad media 48,7±17,4 años [intervalo 16-74]). En 26 (89,7%) casos el tumor fue esporádico y en el resto (3 mujeres, 10,3%) se presentó en el contexto de una neoplasia endocrina múltiple tipo 1. Hubo 3 (10,3%) insulinomas múltiples, uno de ellos asociado a neoplasia endocrina múltiple tipo 1, y 2 (6,9%) insulinomas malignos, ambos esporádicos. La mayoría (n=18, 62,1%) mostró hipoglucemia de ayuno, aproximadamente un tercio (31%) hipoglucemia tanto de ayuno como posprandial y el 6,9% solo hipoglucemia posprandial. El tiempo en alcanzar el nadir de glucosa (37,3±6,5mg/dl) en la prueba de ayuno fue 9,0±4,4h, con insulinemia de 25,0±20,3μU/ml. La TAC abdominal localizó el insulinoma en el 75% de los casos. El 93,1% (n=27) de los pacientes fue intervenido quirúrgicamente (enucleación, 18 [66,7%] y pancreatectomía parcial, 9 [33,3%] pacientes; tamaño tumor 1,7±0,7cm). La cirugía consiguió la curación en la mayoría (n=24, 88,9%) de los pacientes.
ConclusiónEl insulinoma en nuestro medio es un tumor benigno, de pequeño tamaño y solitario, que afecta más a mujeres entre 45-50 años y que se localiza generalmente con TAC abdominal. La cirugía mediante enucleación constituye el método terapéutico más habitual consiguiendo unas altas tasas de curación.
To analyze the clinical features, diagnostic procedures, treatment, and clinical outcome of insulinomas diagnosed and treated in the period 1983-2014 in four Spanish hospitals.
MethodsAll patients with either biochemical and morphological criteria of insulinoma and/or histological demonstration of insulin-secreting tumor were included.
ResultsTwenty-nine patients [23 women (79.3%); mean age 48.7±17.4 years (range, 16-74)] were recruited. Twenty-six patients (89.7%) had sporadic tumors, and the rest (3 women, 10.3%) developed in the context of multiple endocrine neoplasia type 1. There were 3 (10.3%) multiple insulinomas, one associated with multiple endocrine neoplasia type 1, and two (6.9%) malignant insulinomas, both sporadic. Most patients (n=18, 62.1%) had fasting hypoglycemia, about a third (31%) both postprandial and fasting hypoglycemia, and 6.9% postprandial hypoglycemia only. Time to glucose nadir (37.3±6.5mg/dL) in the fasting test was 9.0±4.4h, with maximal insulin levels of 25.0±20.3μU/mL. Abdominal CT detected insulinoma in 75% of patients. Twenty-seven (93.1%) patients underwent surgery [enucleation, 18 (66.7%) and subtotal pancreatectomy, 9 (33.3%); tumor size, 1,7±0,7cm]. Surgery achieved cure in the majority (n=24, 88.9%) of patients.
ConclusionIn our setting, insulinoma is usually a benign, small, and solitary tumor, mainly affecting women aged 45-50 years, and usually localized with abdominal CT. The most commonly used surgical technique is enucleation, which achieves a high cure rate.
La hipoglucemia tumoral es una entidad clínica infrecuente que puede aparecer en pacientes con diferentes tipos de neoplasias y ser secundaria a distintos mecanismos patogénicos1. Entre ellos se encuentran la secreción de insulina por tumores de las células beta del islote pancreático (insulinoma) y la secreción ectópica por tumores de otras localizaciones, como carcinoides bronquiales y tumores gastrointestinales.
El insulinoma constituye la causa más frecuente de hipoglucemia tumoral1. A pesar de ello, es un tumor infrecuente, con una incidencia de 4 casos por millón de habitantes/año; sin embargo, constituye el tumor neuroendocrino pancreático (TNEp) funcionante más frecuente2. En los últimos 50 años se han publicado alrededor de un centenar de series de insulinomas que han evaluado en torno a 6.000 pacientes3. Se trata generalmente de un tumor esporádico (90%) secretor de insulina que se manifiesta en forma de hipoglucemia. La cuantificación de los niveles séricos de glucosa, insulina, péptido C y proinsulina ayudan a establecer el diagnóstico de hipoglucemia asociada a hiperinsulinismo endógeno. Diferentes métodos de imagen y pruebas funcionales invasivas y no invasivas permiten la localización pre o intraoperatoria del insulinoma, en la mayoría de los casos ayudando a establecer la estrategia terapéutica. La enucleación del tumor suele ser curativa y las recidivas son excepcionales. El insulinoma benigno no se asocia a mayor mortalidad y el insulinoma maligno puede ir acompañado de largos periodos de supervivencia3.
En nuestro país el insulinoma constituye el 8% de los casos de los tumores neuroendocrinos gastroenteropancreáticos (TNE-GEP) según los datos procedentes del Registro Nacional de TNE-GEP publicado en 20104. Las series de casos de insulinoma publicadas en España son escasas y se han realizado generalmente en un pequeño número de pacientes (<10) procedentes de un solo centro hospitalario5–7. El objetivo de nuestro estudio fue revisar de forma retrospectiva las características clínicas, metodología diagnóstica, tratamientos empleados y resultados de los casos de insulinoma diagnosticados y tratados entre 1983 y 2014 en 4 centros hospitalarios españoles.
Pacientes y métodosPacientesSe realizó un estudio retrospectivo de los insulinomas diagnosticados y tratados entre 1983 y 2014 en los servicios de endocrinología de 4 hospitales españoles: Ramón y Cajal (Madrid), Virgen de la Concha (Zamora), Nuestra Señora de Sonsoles (Ávila) y Hospital General (Segovia). Para ello se analizaron todos los casos registrados de insulinoma en cada uno de los servicios de endocrinología durante el periodo de estudio y se revisaron las historias clínicas de los pacientes.
Los criterios de inclusión en el estudio fueron la demostración histológica del tumor y/o la presencia de criterios bioquímicos y morfológicos compatibles con insulinoma. Como criterios bioquímicos se consideraron la presencia de hipoglucemia sintomática espontánea o tras prueba de ayuno (glucemia <55mg/dl con tríada de Whipple) asociada a hiperinsulinismo endógeno (insulinemia≥3mU/ml y péptido C≥0,2nmol/l), ausencia de antidiabéticos orales en suero y/o en orina durante la hipoglucemia, anticuerpos anti-insulina negativos y ausencia de antecedentes de cirugía gastrointestinal. Como criterio morfológico se consideró la presencia de una o varias imágenes compatibles con insulinoma en el estudio de localización.
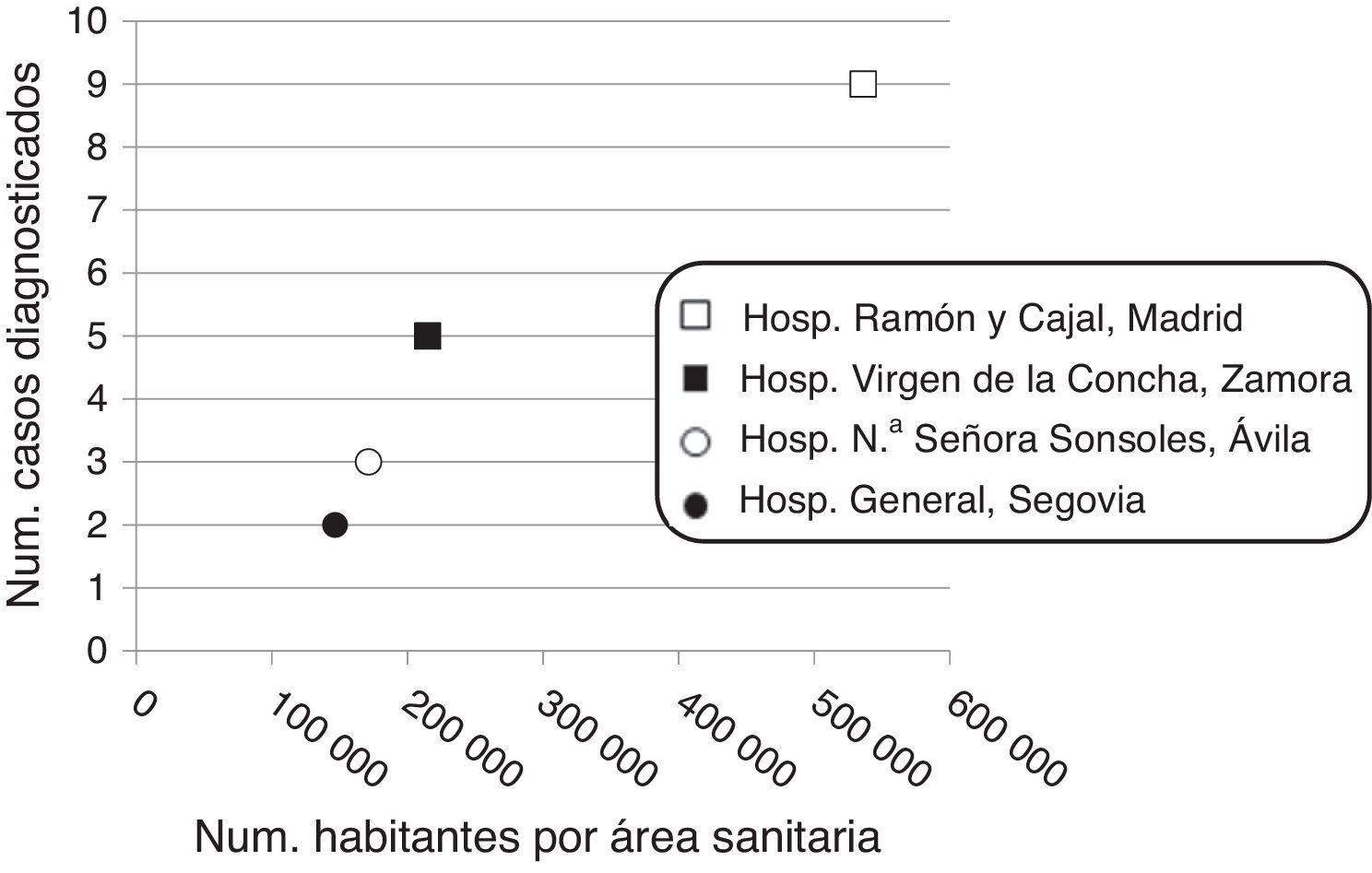
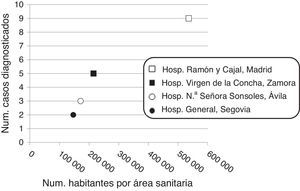
La distribución de los pacientes según los hospitales estudiados fue: hospital Ramón y Cajal, Madrid: n=19 (9 pertenecientes al área sanitaria, población 536.071 habitantes y 10 procedentes de otros centros hospitalarios); hospital Virgen de la Concha, Zamora: n=5 (población 214.768 habitantes); hospital Nuestra Señora de Sonsoles, Ávila: n=3 (población 171.265 habitantes); y Hospital General, Segovia: n=2 (población 146.554 habitantes). Veinticinco (86,2%) pacientes fueron seguidos al menos durante un mes (mediana 53 meses; intervalo 1-378).
MétodosEn cada paciente se registraron los siguientes parámetros clínicos: edad al diagnóstico, antecedentes personales y familiares, fármacos en el momento del diagnóstico, asociación o no a neoplasia endocrina múltiple, motivo de consulta, signos y síntomas de hipoglucemia, tipo de hipoglucemia (ayuno y/o posprandial), glucemia capilar (media de las 3 determinaciones más bajas), número estimado de hipoglucemias/mes, datos de la exploración física (peso, talla y tensión arterial), bioquímica elemental y determinaciones hormonales basales (insulina y péptido C) realizados en los laboratorios de referencia de cada uno de los hospitales con sus respectivos rangos de normalidad.
Como prueba funcional se consideró la prueba de ayuno prolongado (72h) y prueba de glucagón para glucosa tras ayuno (respuesta positiva para insulinoma, incremento de la glucemia ≥25mg/dl en los primeros 20–30min tras la administración de 1mg iv de glucagón). Como estudios de localización consideramos: 1) pruebas no invasivas: ecografía transabdominal, tomografía computarizada (TAC) y resonancia magnética (RM) abdominales, octreoscan y tomografía por emisión de positrones (PET); y 2) pruebas invasivas: eco-endoscopia, arteriografía, inyección intraarterial de calcio y ecografía pancreática intraoperatoria. Las indicaciones de cada una de estas pruebas fueron establecidas en su momento por el médico responsable del paciente en función de criterios clínicos y evidencia científica.
Se registró la fecha de la cirugía, así como el tipo y técnica de intervención y complicaciones quirúrgicas. Se evaluó además el tipo de tratamiento médico empleado en los casos en los que fue necesario. Igualmente se investigaron los hallazgos histopatológicos clasificando los tumores en cuanto a número, tamaño, grado de malignidad (G1: <2 mitosis por 10 campos de gran aumento y/o índice Ki-67≤ 2%; G2: 2-20 mitosis por 10 campos de gran aumento y/o índice Ki-67 3-20; y G3:>20 mitosis por 10 campos de gran aumento y/o índice Ki-67>20) y estadificación TNM8. También se registró el estudio inmunohistoquímico de los insulinomas en los casos en los que se realizó. Finalmente, cada paciente fue evaluado el día de su última revisión analizando los datos analíticos, la necesidad o no de tratamiento médico y la presencia o no de curación —si tras al menos 3 meses después de la cirugía presentaban los siguientes criterios en ausencia de tratamiento para el insulinoma: 1) ausencia de síntomas de hipoglucemia; 2) glucemia plasmática en ayunas >50mg/dl; y 3) insulinemia <6μU/ml—. Asimismo, se consideró la supervivencia libre de recidiva como el tiempo transcurrido tras el tratamiento quirúrgico en el que no hubo recurrencia del tumor, y se analizó la supervivencia global registrando la mortalidad de los pacientes hasta el 31 de diciembre de 2014.
Análisis estadísticoEl análisis estadístico de los datos se realizó con el programa SPSS 15.0. Las variables cuantitativas se expresan como media±DT para datos de distribución normal y como mediana (recorrido intercuartílico) para variables no paramétricas. El ajuste de las variables a una distribución normal se realizó mediante la prueba de Kolmogorov Smirnov. Las variables categóricas se describen como porcentajes. La comparación de proporciones se realizó mediante la prueba de la Chi cuadrado con la prueba exacta de Fisher cuando era necesario. Las correlaciones entre las variables cuantitativas se analizaron usando el análisis de correlación de Pearson. Para la comparación de las variables cuantitativas se utilizó la prueba «t» de Student y prueba de Wilcoxon para las los datos de distribución normal y no normal, respectivamente. Se consideró significación estadística ante valores de p<0,05.
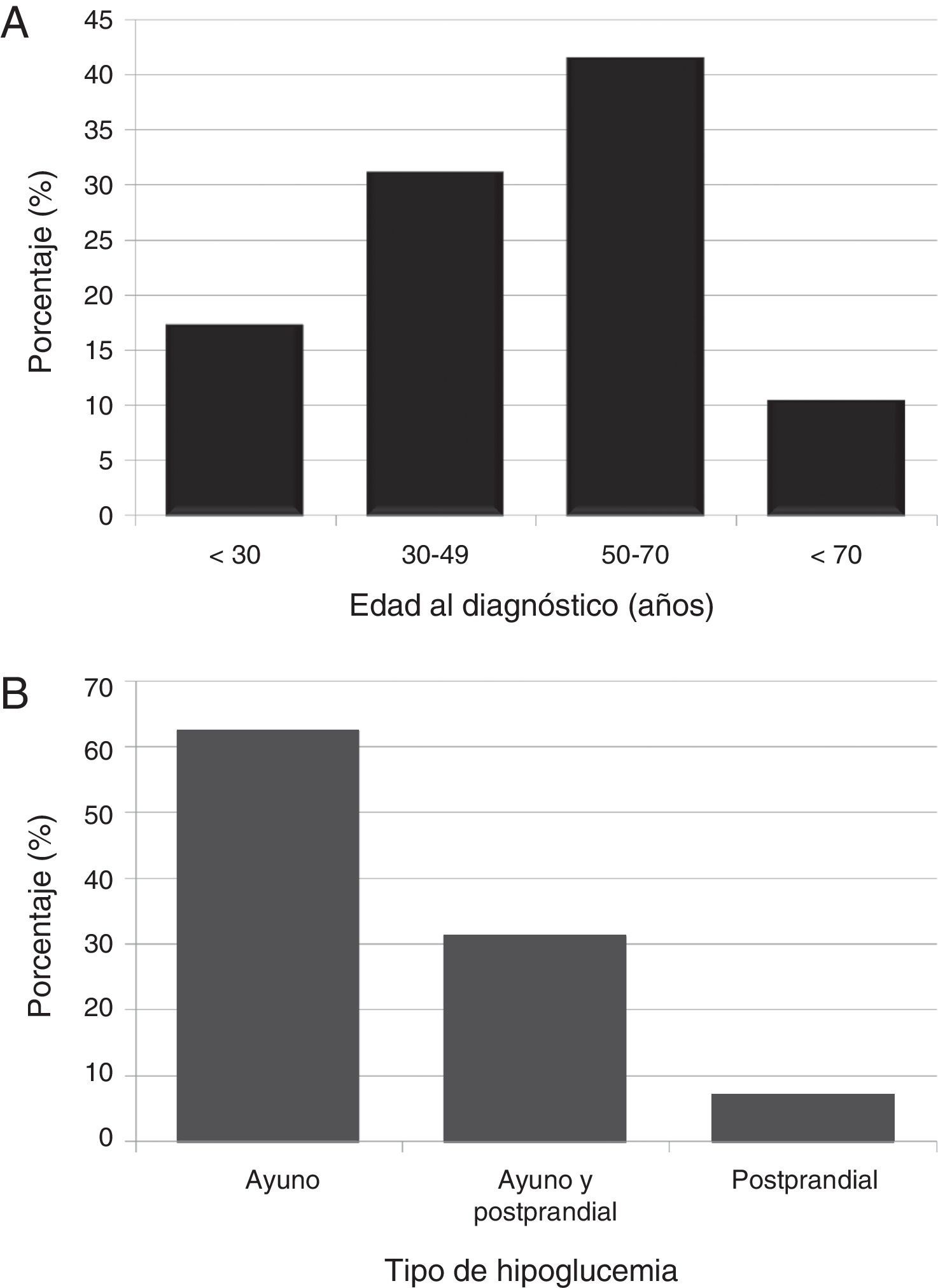
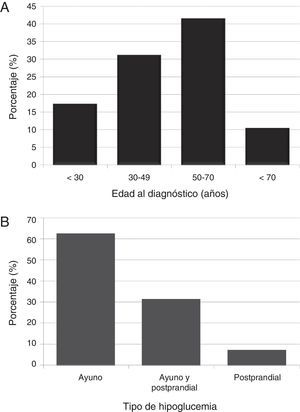
ResultadosCaracterísticas clínicas y demográficasSe estudiaron 29 pacientes (23 mujeres [79,3%]; edad media 48,7±17,4 años [intervalo, 16-74], índice de masa corporal 28,5±5,6kg/m2 [intervalo, 22,9-45,8]). La mayoría (41,4%) de los pacientes fueron diagnosticados en el periodo de edad comprendido entre los 50-70 años (fig. 1A).
En 26 (89,7%) pacientes el tumor fue esporádico y en el resto (3 mujeres, 10,3%) se presentó en el contexto de una neoplasia endocrina múltiple tipo 1 (MEN 1). Las 3 pacientes con insulinoma asociado a MEN 1 tenían un hiperparatiroidismo primario previo al diagnóstico del insulinoma; solo una de ellas presentó además un adenoma hipofisario no funcionante. Hubo 3 pacientes (10,3%, 2 mujeres) con insulinomas múltiples, uno de ellos asociado a MEN 1 y 2 (6,9%) pacientes (2 mujeres de 48 y 65 años, respectivamente) con insulinomas malignos, ambos esporádicos.
Con la finalidad de valorar la tendencia de la incidencia del insulinoma a lo largo del tiempo dividimos el periodo del estudio en 2 partes. Nueve (31%) pacientes fueron diagnosticados en los primeros 15 años del periodo de estudio (1983-1998) y el resto (n=20, 69%) en los últimos 15 años (1999-2014). Se encontró una correlación positiva (r=0,967; p=0,033) entre el número de insulinomas diagnosticados en cada hospital y el número de habitantes correspondientes al área sanitaria de cada centro (fig. 2).
El tiempo de evolución desde el inicio de los síntomas hasta el diagnóstico fue de 7,5 (5-12,5) meses. Los síntomas más frecuentes fueron de carácter neuroglucopénico (confusión [n=20, 69%] y cambios de conducta [n=13, 44,8%]). Aproximadamente la mitad (n=14, 48,3%) de los pacientes consultaron por un único síntoma, mientras que cerca del 20% (n=5, 17,2%) lo hicieron por al menos 5 síntomas.
La mayoría (n=18, 62,1%) de los pacientes mostró hipoglucemia de ayuno, aproximadamente un tercio (31%) hipoglucemia tanto de ayuno como posprandial, y el 6,9% solo hipoglucemia posprandial (fig. 1B). Las hipoglucemias, tanto de ayuno como posprandiales, solo aparecieron en pacientes con insulinomas benignos. El tipo de hipoglucemia no se asoció al sexo, edad, IMC, uni o multifocalidad ni tamaño del insulinoma. Sin embargo, sí se encontró una asociación significativa (p=0,039) con la naturaleza benigna o maligna del tumor, presentando solo los insulinomas benignos ambos tipos de hipoglucemia.
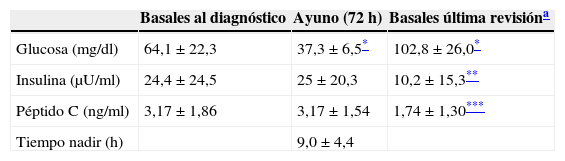
Estudio hormonal y pruebas funcionalesLos valores de glucemia plasmática basal, insulinemia y péptido C se muestran en la tabla 1. No se encontraron diferencias significativas en la glucemia, insulinemia ni en el cociente insulina/glucemia entre mujeres y varones. La insulina se correlacionó positivamente con el péptido C (r=0,757, p<0,01). La proinsulina, determinada en 5 pacientes, fue 102,5±93,5pmol/l (normal<8pmol/l) y la relación porcentual proinsulina/insulina fue 252,6±189,1% (normal<25%).
Valores de glucemia, insulinemia y péptido C en situación basal al diagnóstico, al final de la prueba de ayuno prolongado (72h) y basal en la última revisión
La prueba de ayuno prolongado (72h) se realizó en 24 (82,8%) pacientes. El nadir de glucosa (37,3±6,5mg/dl; intervalo, 24-48) en la prueba de ayuno prolongado se alcanzó a las 9,0±4,4h (intervalo, 0-16). Los valores de insulina y de péptido C al final de la prueba de ayuno se muestran en la tabla 1. Comparados con la situación basal solo la glucemia de fin de ayuno fue significativamente diferente (p<0,001). La cetonemia de fin de ayuno, determinada en 3 pacientes, fue negativa. La prueba de glucagón para glucosa tras ayuno se realizó en 4 pacientes (13,8%). Se observó un incremento de 2,3±0,7 veces (intervalo, 1,2-2,9) en el valor de la glucemia a los 10min con respecto a la glucemia de fin de ayuno (80,2±8,4mg/dl vs 37±7,3mg/dl, p<0,03).
Estudios de localizaciónEn todos los pacientes se realizaron pruebas no invasivas. En orden de frecuencia fueron TAC (n=29, 100%), ecografía transabdominal (n=14, 48,3%), octreoscan (n=14, 48,3%) resonancia magnética (n=11, 37,9%) y PET (n=4, 13,8%). Las pruebas invasivas se efectuaron en 16 (55,2%) pacientes (ecoendoscopia, 7 [24,1%; en 3 de ellos se realizó eco-PAAF con resultado compatible con tumor neuroendocrino], arteriografía, 7 [24,1%]; ecografía intraoperatoria, 5 [17,2%] e inyección intraarterial de calcio, 3 [10,3%]).
El estudio morfológico localizó el insulinoma en todos los pacientes excepto en uno (n=28, 96,5%), portador de insulinoma asociado a MEN 1. La TAC abdominal detectó 21 casos (71,4%; sensibilidad 95,4%). En el resto se descubrió mediante ecoendoscopia (n=3), RM (n=1), PET/TAC con 68Ga-DOTA-exendina-4 (n=1), inyección intraarterial de calcio (n=1) y ecografía intraoperatoria (n=1). La sensibilidad diagnóstica para la eco-endoscopia, ecografía intraoperatoria y la RM abdominal en nuestro estudio fue del 85%, 75% y 40%, respectivamente. La prueba de estímulo de insulina mediante inyección intraarterial de calcio consiguió localizar un insulinoma a nivel de la cabeza pancreática. Por otra parte, el estudio morfológico mediante PET/TAC con 68Ga-DOTA-exendina-4 mostró una captación patológica peripancreática compatible con insulinoma ectópico.
TratamientoLa mayoría de los pacientes (n=27, 93,1%) fueron intervenidos quirúrgicamente (mediana de tiempo desde el diagnóstico hasta la cirugía 4 meses, recorrido intercuartílico 2-7 meses). De los 2 (6,9%) no intervenidos uno era portador de un insulinoma maligno con afectación metastásica hepática y otro rechazó la cirugía por edad avanzada. En la mayoría (n=25, 92,6%) la cirugía fue abierta y en el resto (n=2, 7,4%) laparoscópica. El tipo de cirugía más frecuentemente empleada fue la enucleación del tumor (n=18, 66,7%) y en el resto (n=9, 33,3%) pancreatectomía parcial. Las complicaciones quirúrgicas aparecieron en 9 (33,3%) pacientes, siendo la más frecuente la fístula pancreática (n=4, 14,8%). Diecisiete pacientes (58,6%) fueron tratados con tratamiento médico, principalmente diazóxido (n=16, 55,2%) con la finalidad de controlar las hipoglucemias antes de la cirugía. Un paciente con insulinoma maligno metastásico fue tratado con everolimus. Los 3 pacientes con insulinoma asociado a MEN 1 fueron intervenidos mediante enucleación en un caso de un tumor solitario localizado en cola pancreática, y pancreatectomía parcial en los restantes, uno de ellos con insulinomas múltiples y otro con insulinoma aislado, en ambos casos situados al nivel del cuerpo pancreático. De estos, el primero se curó tras cirugía, mientras que el segundo presentó recidiva por varias lesiones tumorales.
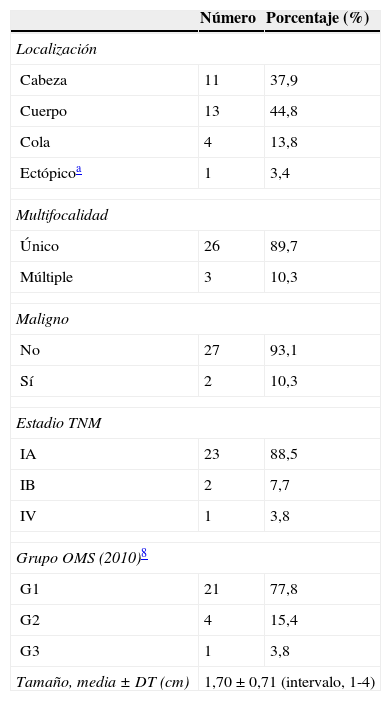
Los datos relacionados con el tumor quedan reflejados en la tabla 2. La mayoría de los pacientes (n=23, 88,5%) presentaron un tumor limitado al páncreas ≤2cm sin afectación ganglionar ni metástasis a distancia (estadio IA; T1N0M0), 2 pacientes (7,7%) mostraron un tumor limitado al páncreas>2cm sin afectación ganglionar ni metástasis a distancia (estadio IB; T1N0M0) y un paciente (3,8%) presentó un tumor pancreático con múltiples metástasis hepáticas (estadio IV; T1N1M1). La mayoría de los insulinomas fueron tumores bien diferenciados, fundamentalmente de bajo grado de malignidad (G1). En este grupo se encontraron 21 pacientes (77,8%). Cuatro pacientes (15,4%) fueron tumores de grado intermedio de malignidad (G2) y, finalmente, solo un paciente (3,8%) presentó un insulinoma de alto grado de malignidad o carcinoma neuroendocrino (G3). El estudio inmunohistoquímico se registró en 23 pacientes (79,3%), siendo positivo para insulina en 19 (82,6%), cromogranina A en 7 (30,4%), sinaptofisina en 7 (30,4%), somatostatina en 6 (26,1%) y enolasa neuronal específica en 5 (21,7%) pacientes.
Datos relacionados con el tumor
Se realizó un seguimiento clínico en 25 pacientes (86,2%) durante 76,7±86,2 meses (mediana 53 meses; intervalo 1-378). La cirugía consiguió la curación en la mayor parte de los pacientes (n=24, 88,9%). En 3 pacientes (11,1%), uno de ellos portador de MEN 1 con insulinomas múltiples, otro con insulinoma maligno y el tercero con insulinoma oculto, probablemente de localización ectópica, todos ellos sometidos a pancreatectomía parcial, persistió el hiperinsulinismo endógeno tras la primera cirugía. La reintervención, que consistió respectivamente en una pancreatectomía subtotal corporocaudal, un trasplante hepático y una laparotomía exploradora sin acto terapéutico, no controló el hiperinsulinismo endógeno. El paciente que recibió trasplante hepático permanecía vivo a los 201 meses (16,7 años) de seguimiento. En cuanto al segundo paciente con insulinoma maligno, no intervenido y controlado con tratamiento médico combinado (diazóxido y análogos de somatostatina) falleció a los 98 meses (8,2 años) de seguimiento por encefalopatía hepática.
El día de la última revisión de los pacientes se objetivó una reducción significativa del peso (69,1±7,6kg frente a 77,1±15,3kg, p=0,041) junto con incremento de la glucemia plasmática basal (p<0,001) y reducción de la insulinemia (p=0,004) y del péptido C (p=0,011) con respecto a los valores obtenidos al diagnóstico (tabla 1).
DiscusiónEl presente estudio pone de manifiesto que el insulinoma en nuestro medio suele ser un tumor benigno (∼95%), de pequeño tamaño (1-2cm) y solitario (∼90%), que afecta más a mujeres (∼80%) entre 45-50 años. La hipoglucemia posprandial aparece en aproximadamente un tercio de los pacientes, aunque solo una minoría la presentan en exclusiva. La cirugía mediante enucleación constituye el método terapéutico de elección consiguiendo unas altas tasas de curación (∼90%).
Nuestro estudio confirma la predilección del insulinoma por el sexo femenino (79,3%), con una relación mujer/varón de 3,8. Esto mismo se ha observado en otras series, aunque con una frecuencia algo más baja (∼60%)3. Otros estudios retrospectivos realizados en nuestro país han mostrado porcentajes por el sexo femenino en torno al 60-92%5,9. La explicación de este hallazgo no se conoce. El estado perimenopáusico pudiera estar relacionado con el desarrollo de insulinomas, ya que la mediana de edad en las mujeres en la mayoría de los estudios, al igual que en el nuestro, se sitúa entre los 40-50 años5,9,10. Sin embargo, la ausencia de diferencias significativas en cuanto a la edad al diagnóstico del insulinoma entre mujeres y varones observada en este y otros estudios aleja esta hipótesis2.
Nuestra serie muestra que la mayoría (∼90%) de los casos de insulinoma son tumores esporádicos, mientras que el resto se presentan en el contexto de un MEN 1. Esta última condición se presentó únicamente en mujeres, se asoció en todos los casos a hiperparatiroidismo primario que precedió al insulinoma, y en un paciente de los 3 diagnosticados se relacionó con insulinomas múltiples. La edad de presentación en estos pacientes fue aproximadamente unos 15 años menor que la de los casos esporádicos. Aunque se han descrito metástasis hasta en el 50% de los insulinomas asociados a MEN 111, en nuestra serie no encontramos ningún caso con estas características. Por otro lado, los 2 únicos casos de insulinomas malignos fueron casos esporádicos, situación que se ha descrito hasta en el 90% de los casos de insulinomas malignos7.
La incidencia estimada del insulinoma en población americana es de 4 casos por millón de personas/año2. En nuestra población esta incidencia parece ser más baja. Si consideramos los 4 hospitales de estudio (área poblacional estimada global ∼106 habitantes) a lo largo de 30 años, el número de pacientes reclutados para la incidencia descrita debería haber sido mucho más elevada (∼120 pacientes). Sin embargo, la incidencia estimada fue inferior a uno (0,63 casos por millón de habitantes/año). Es probable que esta cifra esté infraestimada, ya que algunos pacientes podrían haber sido estudiados en otros servicios clínicos como medicina interna, oncología y cirugía general sin que hubieran sido valorados por endocrinología. Por otro lado, la incidencia de insulinomas se duplicó en los últimos 15 años, hecho que está en consonancia con el aumento de la incidencia de los TNE en general detectado en las últimas décadas12.
Los síntomas neuroglucopénicos fueron los más frecuentemente asociados a la hipoglucemia por insulinoma en nuestra serie de pacientes. Asimismo, nuestros resultados ponen de manifiesto que la hipoglucemia asociada al insulinoma puede aparecer en situación de ayuno (62,1%), posprandial (6,9%) o ambas (31%); porcentajes muy similares a los encontrados en población norteamericana (73%, 6% y 21%, respectivamente)10.
Dado el tamaño relativamente pequeño (<2cm) y naturaleza vascular de los insulinomas, el estudio morfológico mediante TAC en fase pancreática y arterial puede ser de gran utilidad en su localización13,14. La RM pancreática dinámica con secuencia eco de gradiente puede también ayudar en su detección15. Como pruebas invasivas se encuentra la eco-endoscopia pancreática que presenta una sensibilidad del 89,5% y una precisión del 83,7% en la detección de insulinomas no localizados con pruebas no invasivas, siendo fundamentalmente útil aquellos situados al nivel de la cabeza y el cuerpo pancreáticos16. En nuestra serie las pruebas no invasivas, sobre todo la TAC abdominal, presentó una alta rentabilidad diagnóstica localizando prácticamente las 3/4 partes de los tumores. La mayoría de los insulinomas no localizados con pruebas no invasivas se descubrieron con ecoendoscopia pancreática. Dicha prueba instaurada en los últimos años ha demostrado ser fundamental para identificar pequeñas lesiones, y por la posibilidad de establecer un diagnóstico histológico preoperatorio. La disponibilidad de la ecografía intraoperatoria ayuda a confirmar la localización de los insulinomas y descartar la presencia de otras lesiones. Por último, la captación patológica en la PET/TAC con 68Ga-DOTA-exendina-4 al nivel peripancreático en una paciente tras doble intervención quirúrgica fallida apoya la posibilidad de detección de insulinomas ocultos con esta nueva prueba diagnóstica, tal y como ha sido demostrado en estudios recientes17.
A pesar del reciente desarrollo de la cirugía laparoscópica, la cirugía abierta fue la técnica quirúrgica más frecuentemente (92,6%) empleada. La mayor parte (∼90%) de los pacientes tratados mediante técnica de enucleación consiguieron la curación. Como algoritmo diagnóstico-terapéutico en el manejo del insulinoma, a partir de la información obtenida del presente estudio y de las principales series publicadas3, se podría establecer que una vez realizado el diagnóstico de hipoglucemia asociada a hiperinsulismo endógeno, y tras descartar la toma de fármacos hipoglucemiantes orales insulinosecretores, se debería iniciar el estudio de localización mediante pruebas no invasivas, preferentemente TAC abdominal, seguida de RM abdominal. En caso de seguir siendo negativo se realizarían pruebas de localización invasivas, preferentemente eco-endoscopia, seguido de la prueba de inyección intraarterial de calcio y, en caso de seguir siendo negativo se debería plantear la realización de una PET/TAC con 68Ga-DOTA-exendina-4 a nivel peripancreático. En el caso de localizar un tumor único se podría plantear la enucleación mediante cirugía abierta (tumores de localización profunda) o laparoscópica (tumores localizados superficialmente). Si se trata de tumores profundos y no palpables la ecografía intraoperatoria puede ser de gran utilidad. Finalmente, los tumores múltiples podrían necesitar una pancreatectomía subtotal o total3.
La fístula pancreática fue la principal complicación posquirúrgica (∼14%), resultados similares a los obtenidos en otras series3. Aunque se ha descrito una tasa de recidiva de hasta el 7,2%3, en nuestra serie de pacientes no hubo ningún caso durante el período de seguimiento, pero sí de persistencia (11,1%) tras la primera cirugía. Dicha persistencia se asoció a insulinomas múltiples asociados a MEN 1, a malignidad y a ausencia de imagen (insulinoma oculto) en las pruebas de localización prequirúrgicas.
La experiencia del trasplante hepático ortotópico tras hepatectomía en pacientes con insulinoma maligno metastásico es relativamente escasa. Sin embargo, puede considerarse una opción terapéutica en casos seleccionados como pacientes relativamente jóvenes (<55 años), con hipoglucemia intratable tras fallo de tratamiento médico y quirúrgico, tumores bien diferenciados con índices de proliferación celular bajos (Ki 67<10%), baja carga tumoral hepática (<50%), enfermedad estable durante al menos 6 meses antes del trasplante y ausencia de diseminación metastásica sistémica18-20. De las 2 pacientes con insulinoma maligno metastásico a nivel hepático una no fue candidata a trasplante hepático por la edad (65 años) y comorbilidad neoplásica (cáncer de mama) asociada, mientras que la otra fue sometida a trasplante hepático a los 51 años de edad, obteniéndose control sintomático de la enfermedad hasta 14 años después del trasplante, a pesar de haber presentado recidiva metastásica hepática y retroperitoneal.
La tasa de mortalidad postoperatoria del insulinoma se sitúa en torno al 3-4% y generalmente se asocia a enfermedad maligna metastásica, o a complicaciones posquirúrgicas relacionadas con la cirugía abierta (peritonitis y sepsis secundarias a fístula pancreática, hemorragia intraabdominal, pancreatitis y absceso infrahepático)3. En nuestro estudio la tasa de mortalidad fue del 3,5%, lo que correspondió a la muerte por encefalopatía hepática de un paciente con insulinoma maligno metastásico con afectación hepática y segunda neoplasia, que tuvo lugar tras un largo período de seguimiento (8 años). No hubo casos de mortalidad posquirúrgica debido a complicaciones derivadas de la cirugía abierta.
Entre las fortalezas de nuestro estudio se encuentran el número amplio de pacientes evaluados con respecto a otras series españolas y el prolongado periodo de observación analizado. Las principales limitaciones son las derivadas del tipo de estudio retrospectivo y multicéntrico que implica la falta de uniformidad de criterios diagnósticos, recursos de pruebas de imagen y oferta de tratamiento (cirugía abierta, laparoscopia) entre los distintos centros, así como la falta de criterios de reclutamiento que puede afectar el cálculo de la incidencia estimada.
A pesar de que el insulinoma es un tumor generalmente único, benigno y de aparición esporádica, que se cura con la enucleación del tumor, en ocasiones se asocia a dificultades diagnósticas que prolongan el tiempo de su localización y, por tanto, retrasan la cirugía curativa definitiva. Por ello, es necesario instaurar, desarrollar y potenciar técnicas de localización del insulinoma tanto no invasivas, como la PET/TAC con 68Ga-DOTA-exendina-4, con alta rentabilidad diagnóstica, como invasivas como la eco-endoscopia, que además permite el estudio citológico. Por otro lado, en los casos de insulinoma asociado a MEN 1 o insulinomas malignos es fundamental proporcionar un manejo individualizado a través del desarrollo de equipos multidisciplinares como los comités de tumores endocrinos, compuestos por diferentes especialistas que comparten una especial dedicación, experiencia y competencia en el diagnóstico, tratamiento, seguimiento y prevención de estos tumores21.
En conclusión, en nuestro medio el insulinoma es un tumor funcionante pancreático de baja incidencia, generalmente único, de pequeño tamaño y benigno, que aparece habitualmente en mujeres en la quinta década de la vida, con un excelente pronóstico tras la cirugía una vez ha sido previamente localizado mediante TAC y/o RM pancreáticas. Las pruebas invasivas como la eco-endoscopia pancreática ayudan a descubrir los tumores inicialmente no localizados con las pruebas no invasivas. La expectativa de vida parece ser normal en los pacientes intervenidos y curados tras la cirugía. La tasa de mortalidad, aunque baja, no es nula y se asocia a insulinoma maligno metastásico; sin embargo, a pesar de ello, la enfermedad maligna permite un largo periodo de supervivencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.