Las tioureas son las moléculas de elección en el tratamiento farmacológico del hipertiroidismo. Tanto los imidazoles (grupo al que pertenecen el metimazol y el carbimazol) como los tiouracilos (al que pertenece el propiltiouracilo) reducen la síntesis de tiroxina mediante la inhibición de la organificación del yodo y del acoplamiento de yodotirosinas en la glándula tiroides (el propiltiouracilo inhibe, además, la conversión de tiroxina [T4] a triyodotironina [T3] en los tejidos periféricos).
Hasta el 13% de los pacientes tratados con este tipo de fármacos sufre efectos secundarios leves (siendo los más habituales las manifestaciones cutáneas, articulares, gastrointestinales y la fiebre). Un 2% de los pacientes presenta, sin embargo, manifestaciones graves: agranulocitosis, vasculitis o hepatotoxicidad1–3. Describimos dos casos de hepatitis aguda grave por metimazol.
Mujer de 71 años sin antecedentes de interés que consultó por palpitaciones y adelgazamiento, y fue diagnosticada de hipertiroidismo por enfermedad de Graves-Basedow.
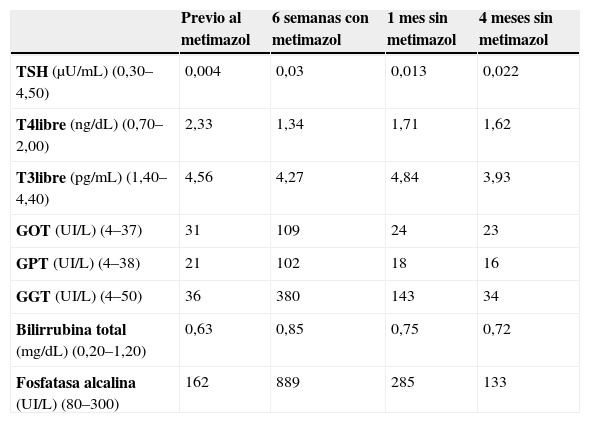
La paciente tenía un bocio palpable pero no visible con el cuello en posición normal (grado 1 de la clasificación de la Organización Mundial de la Salud). Presentaba ausencia de manifestaciones oculares. La frecuencia cardíaca era de 110 latidos por minuto y la tensión arterial era de 140/90mmHg. En el momento del diagnóstico, los hallazgos bioquímicos fueron los siguientes: concentración plasmática de tirotropina (TSH) de 0,004μU/ml; tiroxina no unida a proteínas (T4 libre) de 2,33ng/dl; triyodotironina no unida a proteínas (T3 libre) de 4,56pg/ml; anticuerpos antitiroglobulina de 5.935UI/ml; antiperoxidasa de 4.015UI/ml, y antirreceptor de TSH de 21,28UI/l. El resto de las determinaciones bioquímicas fueron normales (tabla 1).
Evolución de la bioquímica de la paciente 1. En la primera columna, entre paréntesis, las unidades de medida y la concentración de referencia de cada molécula.
| Previo al metimazol | 6 semanas con metimazol | 1 mes sin metimazol | 4 meses sin metimazol | |
| TSH (μU/mL) (0,30–4,50) | 0,004 | 0,03 | 0,013 | 0,022 |
| T4libre (ng/dL) (0,70–2,00) | 2,33 | 1,34 | 1,71 | 1,62 |
| T3libre (pg/mL) (1,40–4,40) | 4,56 | 4,27 | 4,84 | 3,93 |
| GOT (UI/L) (4–37) | 31 | 109 | 24 | 23 |
| GPT (UI/L) (4–38) | 21 | 102 | 18 | 16 |
| GGT (UI/L) (4–50) | 36 | 380 | 143 | 34 |
| Bilirrubina total (mg/dL) (0,20–1,20) | 0,63 | 0,85 | 0,75 | 0,72 |
| Fosfatasa alcalina (UI/L) (80–300) | 162 | 889 | 285 | 133 |
Se instauró un tratamiento con metimazol (Tirodril®) en dosis de 15mg/día y con propranolol (Sumial®) en dosis de 20mg/8h. Seis semanas más tarde, con la paciente asintomática, la concentración plasmática de TSH era de 0,03μU/ml. Las concentraciones de T4 libre (1,34ng/dl) y de T3 libre (4,27pg/ml) se habían normalizado. Sin embargo, las pruebas bioquímicas de la función hepática mostraban aspartato aminotransferasa (GOT) de 109UI/ml, alanina aminotransferasa (GPT) de 102UI/ml, gamma glutamil transpeptidasa (GGT) de 380UI/l y fosfatasa alcalina de 889UI/l. La concentración plasmática de bilirrubina total (0,85mg/dl) era normal (tabla 1).
Se suspendió el tratamiento con metimazol y se propuso a la paciente la realización de una tiroidectomía (opción que rechazó) o una ablación tiroidea con yodo 131 (también descartada por la paciente). Explicándole el riesgo de hepatopatía que el nuevo fármaco también presentaba, se sustituyó el tratamiento con metimazol por propiltiouracilo (50mg/8h).
Un mes más tarde, la concentración plasmática de GOT, GPT, GGT y fosfatasa alcalina había mejorado notablemente. A los cuatro meses del cambio de tratamiento la concentración de todos estos parámetros era normal (tabla 1).
Las serologías para los virus de la hepatitis B y C fueron negativas, la ecografía abdominal, los anticuerpos antimicrosomales del riñón y del hígado antimúsculo liso y antinucleares, el perfil férrico, la cupremia, las concentraciones de ceruloplasmina y albúmina estuvieron dentro de los límites de lo normal en todo momento.
Mujer de 52 años con hipercolesterolemia poligénica que consultó a su médico de cabecera por palpitaciones y ansiedad de varios meses de evolución. Presentaba una frecuencia cardíaca de 125latidos por minuto, temblor de acción de 10 ciclos/s en ambas manos y bocio palpable y visible con el cuello en posición normal (grado 2 de la clasificación de la Organización Mundial de la Salud).
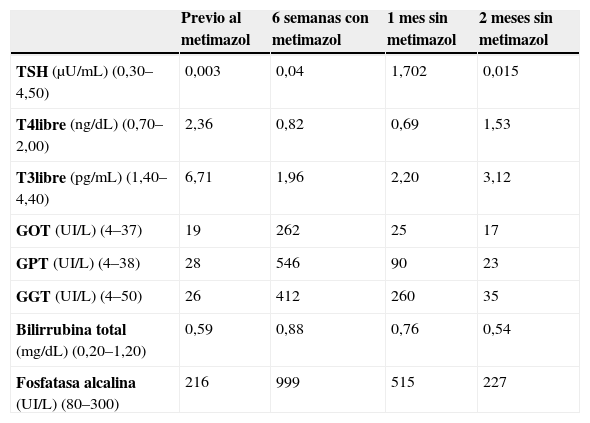
Un análisis de sangre mostró los siguientes resultados: TSH de 0,003μU/ml; T4 libre de 2,36ng/dl; T3 libre de 6,71pg/ml; anticuerpos antitiroglobulina de 463UI/ml; anticuerpos antiperoxidasa de 837UI/ml, y anticuerpos antirreceptor TSH de 18,15UI/l (tabla 2).
Evolución de la bioquímica de la paciente 2. En la primera columna, entre paréntesis, las unidades de medida y la concentración de referencia de cada molécula.
| Previo al metimazol | 6 semanas con metimazol | 1 mes sin metimazol | 2 meses sin metimazol | |
| TSH (μU/mL) (0,30–4,50) | 0,003 | 0,04 | 1,702 | 0,015 |
| T4libre (ng/dL) (0,70–2,00) | 2,36 | 0,82 | 0,69 | 1,53 |
| T3libre (pg/mL) (1,40–4,40) | 6,71 | 1,96 | 2,20 | 3,12 |
| GOT (UI/L) (4–37) | 19 | 262 | 25 | 17 |
| GPT (UI/L) (4–38) | 28 | 546 | 90 | 23 |
| GGT (UI/L) (4–50) | 26 | 412 | 260 | 35 |
| Bilirrubina total (mg/dL) (0,20–1,20) | 0,59 | 0,88 | 0,76 | 0,54 |
| Fosfatasa alcalina (UI/L) (80–300) | 216 | 999 | 515 | 227 |
Con el diagnóstico de hipertiroidismo franco por enfermedad de Graves-Basedow se instauró un tratamiento con metimazol (Tirodril®) en dosis de 20mg/día y de propranolol (Sumial®) en dosis de 10mg/8h. Seis semanas más tarde, con la paciente asintomática, la concentración plasmática de TSH era de 0,04μU/ml, pero la concentración de T4 libre y de T3 libre se había normalizado. Sin embargo, en ese momento presentó alteración de las enzimas hepáticas: la concentración de GOT era de 262UI/l; la de GPT era de 546UI/l; la de GGT era de 412UI/l y la de fosfatasa alcalina era de 999UI/l. La concentración plasmática de bilirrubina era normal (0,88mg/dl) (tabla 2). El resto de la bioquímica no mostraba alteraciones, excepto una dislipemia (colesterol total de 292mg/dl y colesterol unido a lipoproteínas de baja densidad de 206mg/dl) ya conocida.
Se programó la realización de una tiroidectomía y se suspendió el tratamiento con metimazol. Un mes más tarde, la concentración plasmática de TSH era de 1,702μU/ml, la de T4 libre era de 0,69ng/dl, la de T3 libre era de 2,4pg/ml, la de GOT era de 25UI/l, la de GPT era de 90UI/l, la de GGT era de 260UI/l, la de bilirrubina total era de 0,76 y la de fosfatasa alcalina era de 515UI/l (tabla 2). El mismo análisis mostró negatividad en la serología para el virus de la hepatitis B y C; los anticuerpos antimúsculo liso y antinucleares fueron también negativos. El perfil férrico, la ceruloplasmina, la cupremia y la albuminemia fueron normales. Una ecografía abdominal no mostró alteración anatómica alguna en el hígado.
Dos meses después de la supresión del tratamiento con metimazol la concentración plasmática de TSH era de 0,015μU/ml, la de T4 libre era de 1,53ng/dl, la de T3 libre era de 3,12pg/ml y la concentración plasmática de todos los marcadores hepáticos se había normalizado (tabla 2).
La afectación hepática grave por tioureas es un proceso extraordinariamente infrecuente con solo 49 casos documentados de forma fehaciente4,5, siendo mayor el riesgo en el caso del propiltiouracilo.
Los dos casos descritos sufrieron, sin embargo, una hepatopatía por metimazol. En una de ellas, además, la sustitución del metimazol por propiltiouracilo produjo una rápida solución del cuadro.
Se sospecha que la hepatopatía por tioureas se debe a una reacción idiosincrásica, tiene una mortalidad próxima al 20%6, y suele manifestarse como un síndrome colestásico4. Su alteración bioquímica más prevalente es la elevación de la concentración plasmática de bilirrubina y de fosfatasa alcalina, con un aumento menor de las transaminasas.
Ninguna de las pacientes que aquí describimos tuvo, sin embargo, clínica colestásica y la concentración plasmática de bilirrubina fue en todo momento normal en ambas. Por el contrario, la elevación de la concentración de transaminasas y fosfatasa alcalina fue notable.
Se han descrito casos con necrosis hepática focal7 y otros con necrosis extensa8. Existen dos patrones anatomopatológicos de hepatopatía por tioureas: hepatocelular y hepatocanalicular. El primero de ellos es más frecuente en el caso de propiltiouracilo, y el segundo en el caso de metimazol y carbimazol. La ausencia de síndrome colestásico y el patrón bioquímico sugieren que la hepatopatía de las dos pacientes descritas haya sido del tipo hepatocelular.
La supresión del fármaco produce, excepto en los casos fulminantes, una pronta recuperación de las alteraciones clínicas y bioquímicas. En las dos pacientes descritas, la mejoría bioquímica fue notable un mes tras la suspensión del tratamiento con metimazol, y su recuperación completa se produjo en un plazo de 2 meses en una de ellas y en 4 meses en la otra.
Dado que la prevalencia de hepatopatía por tioureas es escasa y su clínica suele ser evidente en forma de un síndrome colestásico, se ha sugerido que es innecesario evaluar la concentración plasmática de transaminasas tras la instauración de un tratamiento con dichos fármacos. Sin embargo, las dos pacientes descritas permanecieron asintomáticas en todo momento y fue la evaluación de la concentración de las transaminasas lo que permitió hacer el diagnóstico. La determinación de GOT, GPT y GGT en pacientes tratados con tioureas ayudaría a diagnosticar casos como los descritos. Por su especial interés, los autores recomiendan la lectura del artículo de Cooper y Rivkees8.